PROCESSO INFIAMMATORIO
ACUTO
CRONICO
PROCESSO INFIAMMATORIO
ACUTO
CRONICO
Intervento farmacologico
Processo Infiammatorio
Acuto
FANS
CORTISONICI
Processo Infiammatorio
Cronico
FANS
ANTIINFIAMMATO
RI AD AZIONE
LENTA
Aspirina
L'aspirina o acido acetilsalicilico o ASA;
(nome IUPAC: acido 2-acetossibenzoico)
Erodoto nelle "Storie" narrava che esisteva un popolo stranamente più resistente di altri alle
comuni malattie; tale popolo usava mangiare le foglie di salice. Ippocrate, considerato il padre della
medicina, descrisse nel V secolo a.C. una polvere amara estratta dalla corteccia del salice che era
utile per alleviare il dolore ed abbassare la febbre. Un rimedio simile è citato anche dai sumeri,
dagli antichi egiziani e dagli assiri. Anche i nativi lo conoscevano e lo usavano per curare mal di
testa, febbre, muscoli doloranti, reumatismi e brividi.
La sostanza attiva dell'estratto di corteccia del salice bianco (Salix alba), chiamato salicina, fu
isolato in cristalli nel 1828 da Henry Leroux, un farmacista francese, e da Raffaele Piria, un
chimico italiano. La salicina è abbastanza acida quando viene sciolta in acqua (una sua soluzione
satura ha pH 2,4), per questo venne ribattezzata acido salicilico. Il composto fu isolato anche dai
fiori di olmaria (Spiraea ulmaria) da alcuni ricercatori tedeschi nel 1839.
Nel 1897Felix Hoffmann, dopo l'idea del suo superiore Arthur Eichengrün, chimici impiegati
presso la Fiedrich Bayer & Co. derivò il gruppo ossidrile (-OH) dell'acido salicilico con un gruppo
acetile, formando l'acido acetil-salicilico. Tale composto presentava gli stessi effetti terapeutici
dell'acido salicilico, ma con minori effetti collaterali. Nacque così il primo farmaco sintetico - una
molecola nuova, non una copia di una molecola già esistente in natura - e la moderna industria
farmaceutica.
Aspirina
Il nome "aspirina" fu brevettato dalla Bayer il 6 marzo 1899,
componendo il prefisso "a-" (per il gruppo acetile) con "-spir-" (dal fiore
Spiraea, da cui si ricava l'acido spireico, ovvero l’acido salicilico) e col
suffisso "-ina" (generalmente usato per i farmaci all'epoca).
La Bayer perse tuttavia il diritto ad usare il proprio marchio in molte
nazioni, dopo che gli Alleati occuparono e rivendettero le sue proprietà
dopo la prima guerra mondiale. Il diritto ad usare il marchio "Aspirina"
negli Stati Uniti fu acquistato nel 1918 dalla Sterling Drug Inc.. Già nel
1917, prima ancora che il brevetto scadesse, la Bayer non riuscì ad
impedire che il nome e la formula del farmaco fossero impiegati da altri.
Sul mercato apparvero quindi "Aspirine" prodotte da numerose diverse
case farmaceutiche finché nel 1921 una sentenza della corte federale degli
Stati Uniti fece di "aspirina" un nome generico non più soggetto a
brevetto.
In altre nazioni, tra cui l‘Italia ed il Canada, il nome "Aspirina" è invece
ancora un marchio registrato.
Aspirina
Il meccanismo di azione dell'aspirina fu
conosciuto in dettaglio solamente nel 1970. In
una ricerca che gli valse il premio Nobel, il
londinese John Vane dimostrò che l'aspirina
nell'organismo umano blocca la produzione
delle prostaglandine e dei trombossani. Questo
avviene perché l'enzima cicloossigenasi coinvolto nella loro sintesi - viene inibito
irreversibilmente quando l'aspirina lo acetila.
Cicloossigenasi
1990s
due isoforme
COX I
COX II
Vane J.R. et al. Annu Rev Pharmacol Toxicol 1998
Differenze fra le due isoforme
COX I
COX II
Gene
22 Kb, cromosoma 9
mRNA 2.8 Kb
8 Kb, cromosoma 1
mRNA 4.3 Kb
Enzima
70 Kd
proteina di membrana
70 Kd
proteina di membrana
Sito catalitico 434 e 523 Isoleucina
Valina
Azoto terminale
Carbonio terminale
17 animoacidi
-------
------18 aminoacidi
Substrato
Acido arachidonico
Acido arachidonico
Altri acidi grassi simili
Differenze biologiche fra le due
isoforme
COX I
Espressione
Costitutiva
Funzioni
Controllo delle
funzioni cellulari
Piastrine
Stomaco
Rene
Endotelio
Inibizione
Aspirina, FANS
Costitutiva
COX II
Inducibile
Inducibile
e Costitutiva
Processi infiammatori
Macrofagi
Leucociti
Fibroblasti
Endotelio
Apoptosi in cellule
tumorali
Aspirina, FANS
glucocorticoidi
Espressione della COX II
• LPS
(CIS)
• IL-1
• IL-2
• TNF
• NO
• IL-4
COX
II
• IL-10
• IL-3
Interazione tra NOS e COX II
Processo infiammatorio
Macrofagi
Fibroblasti
COX II
iNOS
NO
aumento PGs
Salvemini D. et al, J Clin Invest 1996
“We suggest that renal
prostaglandin production in the
normal kidney is driven by the
activity of costitutive COX-I
while at site of inflammation,
such as hydronephrotic kidney,
there is induction of COX-2
that can be blocked selectively
by
anti-inflammatory
glucocorticoids or selective
COX-2 inhibitors”
Seibert K. et al, Br J Pharmacol
1996
Ricerca Farmacologica
1 . revisione completa di tutti i FANS
fino ad ora utilizzati nella pratica
clinica per testarne l’attività sulla
COX-I e sulla COX-II
2 . ricerca di inibitori altamente
selettivi nei confronti della COX-II
Selettività d’azione di diversi FANS
nei confronti della COX-I e COX-II
Engelhardt G. Br J Rheum, 1996
Selettività d’azione di diversi FANS nei
confronti della COX-I e COX-II
Frolich J.C. TiPS 1997
Selettività d’azione di diversi FANS nei
confronti della COX-I e COX-II
Frolich J.C. TiPS 1997
Selettività d’azione di diversi FANS nei
confronti della COX-I e COX-II
Spangier RS. - Semin in Arthr and Rheum 1996
L’uso di questi farmaci
determina l’insorgenza di
patologie iatrogene
EFFETTI INDESIDERATI DEI FANS
•
•
•
•
•
•
Nausea, vomito
Danno gastrico (con rischio di emorragia)
Reazioni cutanee
Insufficienza renale (reversibile)
Nefropatia (FANS non acidi)
Malattie epatiche (Rare)
Effetti collaterali da FANS
Furst D.E. - Semin in Arthr and Rheum 1997
PGE2 a livello gastrico dopo
somministrazione di FANS
Engelhardt G. Br J Rheum, 1996
Nefropatia da FANS
• Insufficienza renale acuta (da cause
emodinamiche)
• Necrosi papillare
• Nefrite interstiziale acuta con
sindrome nefrosica
Nefropatia da FANS
Meccanismi proposti:
• danno cellulare diretto
• riduzione del flusso sanguigno midollare
• formazione di radicali liberi
• meccanismi immunologici
• inibizione
della sintesi di
prostaglandine
La tossicità da FANS
sarà
effettivamente
ridotta dagli inibitori
altamente selettivi della
COX II?
COX II
Inducibile
Costitutiva
“The intrarenal distribution of COX II and its
increased expression in response to sodium restriction
suggest that in addition to its proposed role in
inflammatory and growth responses, this enzyme may
play an important role in the regulation of salt,
volume, and blood pressure homeostasis”
J Clin Invest 1994
Espressione costitutiva della COX II
Fig. l. Northern analysis.
Total
mRNA from kidneys of rats staged
from newborn [postnatal day 0 (PO)]
to adult. Probe for cyclooxygenase2
(COX-2)
MRNA
hybridizing
to
distinct
band
at
4.3
kb
(top)
demonstrates upregulation by day Pl
and strong expression by P3 and P7.
Zhang MZ et al, Am J Physiol 1997
“Mice lacking COX II have
normal inflammatory response to
treatments with tetradecanoyl
phorbol acetate or with
arachidonic acid. However, they
develop severe nephropathy and
are susceptible to peritonitis”
“Here we present an animal model of COX II
deficiency that was generated by gene targeting.
Defect in null mice correlating with reduced viability
included renal alteration, characteristic of renal
dysplasia......”
Nature, 1996
Fig.3. Relative distribution of COX2 mRNA in
tissues harvested from average of 3 separate
rabbits.
Kidney
and
bladder
COX2
mRNA
expressions were significantly greater (**)
than lung, brain, stomach, and uterus, which
in turn were significantly greater (1) than
liver or spleen expression. Densitometry was
used to quantitate COX.2 mRNA expression as
determined by nuclease protection.
Youfei G et al, Am J Physiol 1997
COXIB
Nimesulide, Meloxicam, Celecoxib, Rofecoxib, Valdecoxib e Parecoxib
“The role of COX II within the CNS, the kidney, and
the reproductive tract has not been fully defined.
Highly COX II-specific agents may occur
reproductive, renal, or CNS liabilities not
characteristic of currently marketed NSAIDs. Such
liabilities may restric their use much as gastric toxicity
currently limits the use of COX I-specific agents”
USO DEI COXIB
• L’uso dei COXIB altamente selettivi non è
raccomandato di routine nella Artrite Reumatoide e
nell’Osteoartrosi in sostituzione degli altri FANS,
ma solo in pazienti ad alto rischio di serie
complicazioni gastro-intestinali:
– pazienti >65 anni,
– in terapia concomitanti con farmaci con documentata
azione gastro-lesiva
– che richiedono trattamenti prolungati ad alti dosaggi, o
con serie co-morbilità.
• A rischio particolarmente alto sono i pazienti con
storia di ulcera, perforazione o sanguinamento
gastrointestinale, in essi l’uso dei FANS e anche dei
COXIB deve essere particolarmente prudente
ANTINFIAMMATORI NON ACIDI
•
•
•
•
Paracetamolo
Propacetamolo
Metimizolo
Ketorolac
Processo Infiammatorio
LEUCOCITI
PEROSSIDI
Paracetamolo
X
COX-1 COX-2
PGE1
PGE 2
5-HT
BRADICHININE
DOLORE
ATTIVITA’ ANTIDOLORIFICA
SALICILATI
COOH
OCOCH3
Acido acetil salicilico
(ASPIRINA®)
COOH
COOH
F
OCOCH3
F
OH
F
Flufenisal
Diflunisal
Salicilati: Proprietà farmacologiche
1.
2.
3.
4.
Azione analgesica: Agiscono su dolori di lieve entità che
originano dalle strutture tegumentarie piuttosto che dai
visceri cavi ( Cefalea, mialgia e artralgia)
Azione antipiretica: Riducono la temperatura corporea in
modo rapido, tuttavia le dosi che producono questo effetto
aumentano anche il consumo di ossigeno e il metabolismo
basale
Effetti neurologici: Ad alte dosi possono dare eccessiva
stimolazione del SNC, seguita da depressione
(confusione, vertigine, tinnito, psicosi, stupore e coma).
Possono dare anche nausea e vomito per accesso alla zona
chemocettrice attraverso il liquor
Respirazione: Incrementano il consumo di O2 e la
produzione di CO2, causando un aumento della
ventilazione per lo stato di acidosi. Stimolano
direttamente il centro della respirazione midollare, mentre
dosi tossiche possono dare paralisi respiratoria
Salicilati proprietà farmacologiche
• Alterazioni dell’equilibrio acido base: alcalosi
respiratoria, che comporta aumento dell’escrezione renale
di bicarbonati, che si associa quindi ad escrezione di Na e
K
• Effetti cardiovascolari: dosi terapeutiche non hanno alcun
effetto, dosi tossiche invece determinano un
vasodilatazione periferica per effetto diretto sulla
muscolatura liscia vasale
• Effetti
gastrointestinali:
sanguinamento
gastrico
asintomatico che può portare ad anemia , 4-5 g di aspirina
determinano una perdita di 3-8 ml di sangue rispetto ai
controlli.
• Effetti renali ed epatici:hanno una epatotossicità
prevalentemente dose dipendente di solito asintomatica.
E’ assolutamente controindicato l’uso di salicilati in
bambini o adolescenti con infezione da virus della
varicella o virus influenzale.
Salicilati: proprietà farmacologiche
• Effetti uricosurici: Basse dosi, possono ridurre
l’escrezione di a.urico, dosi intermedie non alteramo tali
processi, alte dosi invece aumentano l’uricosuria e riducono
l’uricemia
• Effetti sul sangue:Allungamento del tempo di emorragia in
soggetti sani. La terapia con aspirina dovrebbe essere
sospesa almeno una settimana prima di interventi
chirurgici.
• Può causare emolisi in soggetti con deficit G6PDH
.
Salicilati: assorbimento e distribuzione
• Dopo somministrazione orale sono ben assorbiti nello
stomaco, ma soprattutto nel tenue
• L’assorbimento per via rettale è più lento di quello per via
orale
• Rapidamente assorbito attraverso la cute quando applicato
sottoforma di ungenti oleosi
• Una volta assorbiti si distribuiscono rapidamente ai tessuti
grazie a fenomeni pH dipendenti
• 80- 90 % si lega alle albumine per cui compete con altri
farmaci come la penicillina, la tiroxina, la fenitoina.
Salicilati: biotrasformazione ed escrezione
• La biotrasformazione si verifica in molti tessuti
in particolare nel reticolo endoplasmico e nei
mitocondri del fegato
• Sono escreti nelle urine sottoforma di salicilato
libero, ma tale eliminazione dipende dal pH
urinario, a pH basico viene eliminato circa il
30% di salicilato, a pH acido circa il 2%
• Emivita plasmatica dell’aspirina è di circa 15
min
ANTINFIAMMATORI NON ACIDI
NHCOCH3
OH
Paracetamolo
(TACHIPIRINA®
EFFERALGAN®)
Paracetamolo: Farmacocinetica
• Rapidamente assorbito per via orale, ragiunde la concentrazione
massima nel plasma dopo 30-60 min, e ha un’emivita di 2 ore .
• Il legame del farmaco alle proteine plasmatiche è variabile da 20 al
50%
• Subisce un processo di glicuronoconiugazione a livello epatico,
oppure viene legato ad a.solforico o a cisteina
• Una parte del paracetamolo subisce invece un processo di Nidrossilazione mediata dal citocromo P450, producendo un
metabolita che interagisce con il glutatione, ma se si formano
quantità elevate si ha deplezione del glutatione e si ha interazione
con i gruppi sulfidrilici delle proteine epatiche, aumentando la
possibilità di necrosi epatica
• Escrezione avviene per via renale.
Paracetamolo. Effetti tossici
• Di solito ben tollerato
• Occasionalmente esantema cutaneo o altre reazioni
allergiche
• Neutropenia, trombocitopenia, o pancitopenia.
• Necrosi epatica dose dipendente (nausea, vomito, dolore
addominale,dopo alcuni giorni aumento delle transaminasi
e della bilirubina;se non si inteyerviene rapidamente può
sopravvenire la morte. L’unico antidoto è rappresentato
dalla somministrazione di composti sulfidrilici che
agiscono ripristinando le riserve di glutatione)
• Necrosi tubulare renale e coma ipoglicemico
Con il termine steroide si identifica qualsiasi lipide con quattro
anelli di carbonio fusi [policicloalifatici,A,B,C,D] per un totale di
17 atomi di carbonio ciclici collegati spesso a una coda alchilica;
sono steroidi il colesterolo, gli ormoni sessuali (es. testosterone,
diidrotestosterone, estradiolo, progesterone) e gli ormoni
corticosurrenali (es. cortisolo, androsterone). Gli steroidi sono
biosintetizzati attraverso la via metabolica dell’acido mevalonico.
Ciclopentanoperidrofenantrene
I diversi steroidi si differenziano per la presenza o l’assenza degli atomi
di carbonio identificati dai numeri da 18 in su e per i gruppi funzionali
presenti sul resto della struttura.
Sono noti centinaia di steroidi diversi, isolati da specie animali e
vegetali. Il loro ruolo più importante nei sistemi viventi è quello di
fungere da ormoni.
Corticosteroide
Corticosteroidi sono un gruppo di ormoni, prodotti dalla corteccia delle
ghiandole surrenali, appartenenti alla classe degli steroidi . Si possono far
derivare tutti da successive degradazioni della catena laterale del
colesterolo.
I corticosteroidi sono coinvolti in una varietà di meccanismi fisiologici,
inclusi quelli che regolano l'infiammazione, il sistema immunitario, il
metabolismo dei carboidrati, delle proteine, il livello di elettroliti nel
sangue.
Si dividono in:
Glucocorticoidi come il cortisolo che controlla il metabolismo di carboidrati,
grassi e proteine.
Mineralcorticoidi come l‘aldosterone che controlla i livelli di elettroliti e la
quantità di acqua presenti nel sangue.
Androgeni responsabili dei caratteri sessuali seondari.
Glucocorticoide
I glucocorticoidi sono una classe di ormoni steroidei che, nell‘uomo, sono
prodotti in particolare nella zona fascicolata della corticale del surrene. Il
più importante glucorticoide umano è il cortisolo.
Regolazione della sintesi e secrezione dei
corticosteroidei surrenali.
Il circuito a feedback negativo lungo è più
importante di quello corto (linea tratteggiata).
L’ormone ACTH provoca soltanto un effetto
minimo sulla produzione di mineralcorticoidi
(indicato dalla linea tratteggiata). (ACTH =
ormone adrenocorticotropo (corticotropina);
ADH = ormone antidiuretico (vasopressina);
CRF = fattore di rilascio delle corticotropine).
Gli steroidi di sintesi utilizzati in farmacologia sono glucocorticoidi
Effetti biologici
flogosi
sistema immunitario
tessuto connettivo
risposta immunitaria
Fibroblasti: flogosi - risposta immunitaria
L'infiammazione è la risposta ad un insulto che può
essere indotto:
•da agenti fisici,
•da agenti chimici,
•dalla presenza di agenti patogeni,
•da fenomeni ischemia,
•da eccessivo (ipersensibilità) o inadeguato (autoimmunità)
funzionamento del sistema immunitario.
L'infiammazione
eventi
vascolari
cellulari
L’infiammazione facilita la risposta immunitaria
l’insulto è riconosciuto
meccanismi per localizzare e rimuovere le
sostanze estranee e i tessuti danneggiati
Inoltre la risposta infiammatoria è amplificata
dall'attivazione di cellule infiammatorie e della
produzione di mediatori chimici come:
prostaglandine (PG),
trombossani,
leucotrieni,
amine vasoattive,
chemochine
molecole d’adesione
enzimi proinfiammatori
citochine etc..
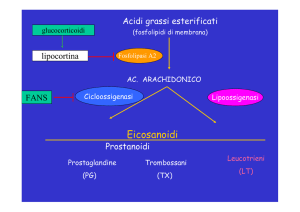
L’attivazione della fosfolipasi A2, dopo gli insulti dei tessuti,
altera i fosfolipidi di membrana delle cellule con la liberazione
dell’acido arachidonico. Ciò costituisce il substrato per
ulteriori reazioni con l’intervento della via della cicloossigenasi e della lipossigenasi
Altri percorsi, come ad esempio la via del citocromo P450, sono
coinvolti nella produzione di lipidi biologicamente attivi che
agiscono come subsrato della via della ciclo-ossigenasi e della
lipossigenasi .
I principali prodotti della via ciclo-ossigenasi (CO) sono le prostaglandine (PG)
Prodotti della via della lipossigenasi
I principali prodotti della via della lipossigenasi sono i leucotrieni (LT), come
il LT B4 e peptidoleucotriene.
Il Leucotriene B4 causa:
•aggregazione delle cellule dei polimorfonucleati (PMN),
•chemiotassi in vivo dei PMN,
•chemokinesisi dei PMN,
•essudazione di plasma,
•traslocazione di calcio,
•la stimolazione della fosfolipasi A2.
I cortisonici sono composti di sintesi dotati
di spiccata attività antinfiammatoria ed
immunosoppressiva.
A differenza dei corticosteroidi naturali
(idrocortisone,
cortisone)
presentano
maggior potenza di azione relativa e minore
azione sulla ritenzione idrica.
Principali cortisonici:
Beclometasone
Betametasone
Deflazacort
Desametasone
Metilprednisolone
Prednisolone
Prednisone
AZIONE ANTINFIAMMATORIA
•
•
•
•
Diminuiscono arrossamento, gonfiore ed edema
Inibiscono la migrazione dei monociti
Riducono i linfociti circolanti
Tramite la lipocortina bloccano la tappa iniziale di
liberazione dell’acido arachidonico
• Tramite l’inibizione della fosfolipasi A bloccano la
tappa iniziale di liberazione dell’acido
arachidonico
• Inibiscono la produzione di COX II
AZIONI DEI CORTISONICI
•Metabolismo
glucidico:
Aumentano
la
gluconeogenesi a partire dagli aminoacidi, ciò causa
iperglicemia, glicosuria e aumento del glicogeno
muscolare
•Metabolismo proteico: Aumentano il catabolismo
proteico tranne nel cuore e nel SNC, ciò causa atrofia
muscolare, fragilità capillare, ritardo crescita e
cicatrizzazione delle ferite molto più lenta
•Ricambio idro-salino: Determinano ritenzione di
sodio (aldosterone), aumentano l’escrezione di Ca e
riducono l’assorbimento dall’intestino in quanto
antagonizzano il trasporto mediato dalla vit D
(osteoporosi)
AZIONI DEI CORTISONICI
•Metabolismo lipidico: Aumentano il catabolismo dei
lipidi, per cui aumentano gli acidi grassi liberi e i
corpi chetonici, aumentano la mobilizzazione e
ridistribuzione dei lipidi (addome, e facies a luna
piena)
•SNC: Possono dare fenomeni psicotici per elevazione
del tono dell’umore, insonnia mattutina, e alla
sospensione, possono verificarsi gravi sintomi
depressivi (suicidio)
•Crasi ematica: policitemia, aumento dei globuli rossi
ed Hb, aumentano i neutrofili, eosinofili e monociti, e
riducono
il
numero
dei
linfociti
(azione
antilinfoblastica)
I glucocorticoidi penetrano nella cellula e si legano al loro recettore citoplasmatico
(GR), che rilascia un gruppo molecolare tra cu le heat shock proteins HSP70 e HSP90
e altre proteine con attività kinasica. Queste complesso macromolecolare determina
una serie di effetti rapidi non-trascrizionali, ovvero non correlati all’interazione con il
genoma, il cui ruolo non è stato ancora completamente definito. Il complesso
glucocorticoide-GR penetra nel nucleo e interagisce con il DNA attivando o inibendo
la trascrizione genica, responsabile dei principali effetti farmacologici dei
glucocorticoidi.
Il complesso glucocorticoide-GR, inoltre, è in grado di bloccare la via del
NF-kB: probabilmente, la maggior parte delle azioni anti-infiammatorie
sono identificabili a questo livello.. Il NF-kB è normalmente presente nel
citoplasma in forma inattiva, in quanto legato ad un inibitore (IkB). Diversi
stimoli pro-infiammatori inducono attivazione di enzimi (IkB kinasi) che
fosforilano IkB liberando NF-kB.
NF-kB trasloca nel nucleo e induce la trascrizione di proteine
legate alle risposte infiammatorie e immunitarie, tra cui:
Citochine: IL-1b, TNF-alfa, IL-2, IL-6, GM-CSF, IL-12 , IL-4, IL-5, IFN-gamma
Chemochine: IL-8, RANTES, MIP-1a, MCP-1, eotassina, IP-10
Molecole d’adesione: ICAM-1, VCAM-1, E-selettina
Enzimi proinfiammatori: iNOS, Cox-2, fosfolipasi A2, 5-lipoossigenasi
Meccanismo d’azione
GLUCOCORTICOIDI
RECETTORI NUCLEARI
DNA
MODIFICAZIONE DELLA TRASCRIZIONE GENICA
Meccanismo d’azione
Glucocorticoidi/recettore
DNA
INDUCE
REPRIME
Inizia la trascrizione Previene la trascrizione
di geni
di geni
Meccanismo d’azione
Glucocorticoidi/recettore
X
Fattori proteici attivatori della trascrizione
AP-1
NFKb
X
INDUZIONE DI GENI
IL-2
COX-2
Lipossigenasi
Collagenasi
X
Meccanismo d’azione antinfiammatorio
Glucocorticoidi/recettore
DNA
Previene la trascrizione
di geni
X
COX-2
Meccanismo d’azione antinfiammatorio
Glucocorticoidi/recettore
DNA
Previene la trascrizione
di geni
X
FOSFOLIPASI A2
X
PGS
Meccanismo d’azione antinfiammatorio
Glucocorticoidi/recettore
DNA
INDUZIONE DI GENI
LIPOCORTINA 1
X
FOSFOLIPASI A2
X
PGS
Altri meccanismi d’azione dei glucocorticoidi
- Azione stabilizzante sulla membrana cellulare e lisosomiale
- Depressione della reazione antigene-anticorpo
- Inibizione della sintesi dell’istamina
- Inibizione della permeabilità e della dilatazione capillare
- Attivazione adrenergica per stimolazione della feniletanolaminaN-metiltransferasi
- Sensibilizzazione Beta-recettori alle catecolamine
- Inibizione biosintesi mucopolisaccaridi
- Azione antijaluronidasica diretta
Farmacocinetica dei glucocorticoidi
• Somministrazione: orale, topica e
parenterale
• Nel sangue sono legate alle globuline
• Entrano nelle cellule per diffusione
• Sono metabolizzati nel fegato
USI CLINICI DEI CORTISONICI
• Terapia sostitutiva nell’insufficienza
corticosurrenalica
• Artrite reumatoide
• Sindrome nefrosica
• Sarcoidosi, asma bronchiale, allergia
• Dermatologia e oftalmologia
• Shock settico
• Immunosoppressori
Effetti di eccesso prolungato
di glucocorticoidi: sindrome
di Cushing iatrogena.
Meccanismo
Glucocorticoidi/recettore
DNA
Previene la trascrizione
di geni
X
Collagenasi
DMARDS
Disease modifying antireumatoid drugs
•
•
•
•
•
•
•
Composti dell’oro
Penicillamina
Sulfasalazina
Clorchina o idrossiclorchina
Immunosoppressori
Metotressato
Antifiammatori biologici
Composti dell’oro
• Introdotti in terapia
nel 1929
• Sperimentazione
clinica nel 1960
• Sodio aurotiomalato
• Auranofin
Composti dell’oro
Meccanismo d’azione da studi sperimentali:
- Inibiscono la proliferazione dei linfociti
indotta dai mitogeni
- Riducono sia la liberazione sia l’attività
degli enzimi lisosomiali
- Diminuiscono la produzione di metaboliti
tossici dell’ossigeno da parte dei fagociti
- Inibiscono la chemiotassi dei neutrofili
Composti dell’oro
Farmacocinetica
SODIO AUROTIOMALATO: somministrato per via
intramuscolare
AURANOFIN: somministrato per via orale
Le concentrazioni plasmatiche si raggiungono dopo 2-6
ore.
La maggior parte del farmaco è legato alle proteine
plasmatiche.
I farmaci si concentrano nei tessuti dove permangono a
lungo anche dopo l’interruzione della terapia.
L’escrezione è prevalentemente renale.
Composti dell’oro
EFFETTI INDESIDERATI (più del 70% dei pazienti trattati)
Frequenti
• Irritazione cutanea (grave)
• Ulcerazioni della bocca
• Proteinuria
• Discrasia ematica
Rari
• Encefalopatia
• Neuropatia periferica
• Epatite
PENICILLAMINA
La penicillamina o D-dimetilcisteina è un prodotto dell’idrolisi della penicillina
MECCANISMO D’AZIONE SPERIMENTALE
• Riduce la funzionalità dei macrofagi
• Diminuisce la liberazione di IL-1
• Accelera la maturazione del collagene
FARMACOCINETICA
•Somministrazione orale
•Picco plasmatico dopo circa 1-2 ore
•Legata alle proteine plasmatiche (80%)
•Eliminazione per via renale
PENICILLAMINA
EFFETTI INDESIDERATI
(+ del 40% dei pazienti trattati)
•
•
•
•
•
•
Anoressia,nausea, vomito, disturbi del gusto
Proteinuria
Irritazioni cutanee e stomatiti
Trombocitopenia
Malattie midollo osseo (leucopenia, anemia aplastica)
Patologie autoimmuni (tiroidite, miastenia gravis)
SULFASALAZINA
Utilizzata principalmente per le malattie infiammatorie intestinali
Meccanismo d’azione sperimentale:
Favorisce l’eliminazione dei metaboliti tossici dell’ossigeno prodotti
dai neutrofili
Somministrazione per via orale con capsule gastroprotette
(assorbimento incostante e scarso)
Effetti indesiderati modesti: disturbi gastrointestinali, mal di testa
(è una sulfonamide
discrasia ematica, reazioni anafilattiche)
Clorchina o idrossiclorchina
Farmaco 4-aminochinolinico
Malaria
Lupus eritemaso sistemico (LES)
Lupus eritemaso discoide (LED)
Clorchina
Artrite reumatoide
Non ritarda la progressione del danno osseo
Clorchina
MECCANISMO D’AZIONE SPERIMENTALE
A
• Inibisce la proliferazione dei linfociti indotta da mitogeni;
• Diminuisce la chemotassi leucocitaria;
• Diminuisce il rilascio degli enzimi lisosomiali;
• Diminuisce la generazione dei metaboliti tossici dell’ossigeno;
• Riduce la generazione di IL-1.
Azione lisosomotropica, si concentra nei lisosomi e provoca un
aumento del pH interferendo con l’attività delle idrolasi acide
Clorchina
B
Inibizione della Fosfolipasi A2
Ridotta formazione di ecosanoidi
C
Inserimento nella molecola del DNA
Inibire la sintesi del DNA e del RNA
Clorchina
Farmacocinetica
Si somministra per via orale (assorbimento completo),
[nella terapia della malaria si può somministrare
per via IM o EV lenta];
Si distribuisce ampiamente nei tessuti (e viene concentrata
nei globuli rossi);
L’eliminazione avviene per via renale (70% forma attiva);
Emivita plasmatica di circa 50 ore.
Clorchina
Effetti collaterali
Nausea, vomito;
Capogiri;
Annebbiamento della vista;
Cefalea;
Prurito;
Retinopatie (solo con dosaggi maggiori)
Ipotensione (solo per endovena ad alte dosi);
Aritmie (solo per endovena ad alte dosi).
Immunosoppressori
Possono essere divisi:
• Inibitori della produzione o dell’attività della IL-2
come la ciclosporina, il tracolimus o la rapamicina
• Farmaci che agiscono attraverso meccanismi
citotossici come la ciclofosfamide e il clorambucil;
• Inibitori della sintesi delle purine o delle pirimidine
come l’azatioprina, il micofenolato ed il mofetil;
• Bloccanti delle molecole di superficie delle cellule T
implicate nel segnale come le immunoglobuline e gli
anticorpi mono e policlonali;
• Inibitori dell’espressione genica come i cortisonici.
La ciclosporina
Peptide ciclico composto da 11 aminoacidi, prodotto dal
metabolismo fungino (Borel-1976)
Non attivo nella fase acuta dell’infiammazione
La ciclosporina
Meccanismo d’azione (sperimentale)
• Diminuita
proliferazione
clonale
delle
cellule
T,
principalmente attraverso l’inibizione del rilascio dell’IL-2 e,
probabilmente, anche attraverso la diminuita espressione dei
recettori dell’IL-2;
• Ridotta induzione della proliferazione clonale delle cellule T
citotossiche da precursori T CD8+;
• Ridotta funzionalità delle cellule T effettrici che mediano le
risposte cellule-mediate;
• Riduzione delle risposte delle cellule B dipendenti dalle cellule
T.
La ciclosporina
L’effetto inibitorio sulla produzione di IL-2 è dovuta ad una azione
relativamente selettiva sulla trascrizione del gene IL-2
Gene
recettore delle cellule Th
Aumento intracellulare di calcio
ciclosporina
FOSFATASI (Calcineurina)
Fattori di trascrizione
Trascrizione di IL-2
Proteina citosoloica
(ciclofillina)
La ciclosporina
Farmacocinetica
Somministrazione orale (o per EV);
Emivita plasmatica circa 24 h;
Livello plasmatico determinato con dosaggio radioimmunologico;
Metabolismo epatico ed eliminazione attraverso la bile;
Si accumula nei tessuti (3-4 volte superiore ai livelli plasmatici);
[il ketoconazolo aumenta i livelli ematici]
La ciclosporina
EFFETTI COLLATERALI
Nefrotossicità
Ipertensione
Epatotossicità
Meno rilevanti: tremori, anoressia, irsutismo, parestesia, ipertrofia delle
gengive e disturbi gastrointestinali.
Tracolimo (FK506)
Meccanismo d’azione
L’effetto inibitorio sulla produzione di IL-2 è dovuta ad una azione
relativamente selettiva sulla trascrizione del gene IL-2
Gene
recettore delle cellule Th
Aumento intracellulare di calcio
Tracolimo
FOSFATASI (Calcineurina)
Fattori di trascrizione
Trascrizione di IL-2
Proteina citosoloica
(FKBP)
Tracolimo (FK506)
Farmacocinetica
Somministrazione orale (o per EV);
Emivita plasmatica circa 7 h;
Metabolismo epatico ed eliminazione attraverso la bile;
Tracolimo (FK506)
EFFETTI COLLATERALI
Nefrotossicità
Ipertensione
Neurotossicità
Disturbi gastrointestinali.
Disturbi metabolici
Raramente: trombocitopenia, iperlipidemia
Ciclofosfamide
Mostarda azotata
La ciclofosfamide è un profarmaco ed resa attiva da una
ossidasi epatica a funzione mista che forma 4idrociclofosfamide che forma in maniera reversibile
aldofosfamide (isomeri strutturali)
Gruppo aziridinico
DNA
Ciclofosfamide
Meccanismo citotossico
Riduzione dei Linfociti
Ciclofosfamide
EFFETTI COLLATERALI
Nausea, vomito;
Depressione midollare;
Cistite emorragica
Cistite emorragica causata dal metabolita acroleina
Idratare il paziente e somministrare N-acetilcisteina o mesna
Azatioprina
Agente citotossico
Azatioprina Citocromo P450
Mercaptopurina
Analogo della purina che inibisce la sintesi del DNA
Azatioprina
EFFETTI COLLATERALI
Depressione midollare
Nausea, vomito
Eruzioni cutanee
Lieve tossicità epatica
Metotressato
Meccanismo d’azione
Antagonista dell’acido folico
EFFETTO ANTIREUMATOIDE MOLTO POTENTE
DMARD di prima scelta in UK e USA
Effetto collaterale
Fibrosi polmonare
Trattamento per più di cinque anni continuato
da più del 50% dei pazienti
Immunoglobuline
Anticorpi contro i linfociti umani
Vengono prodotte in cavalli o conigli attraverso immunizzazione
Stimolano una risposta immunitaria
Umanizzate
Tecnica degli ibridomi nel topo
Viene associato il sito legante l’antigene (Fab) di un anticorpo
monoclonale di topo ad una immunoglobulina umana
Anticorpi policlonali
Le immunoglobuline antilinfociti e le immunoglobuline
antitimociti sono ottenute mediante immunizzazione di cavalli
con linfociti umani o con tessuto di timo fetale rispettivamente
Le immunoglobuline “riconoscono” e legano proteine sulla
superficie del linfocita, causando l’esposizione del sito legante
il complemento sulla porzione Fc dell’immunoglubolina
questo attiva il sistema complemento determinando la lisi del
linfocita
Anticorpi policlonali
EFFETTI COLLATERALI
Reazioni anafilattiche (proteine estranee con produzione di
anticorpi contro l’immunoglobulina estranea)
Alterazioni glomerulari ( precipitano complessi tra la
proteina estranea e gli anticorpi umani)
farmaci biologici
Vanno a colpire una singola struttura (recettore,
proteina, sequenza di DNA) in modo preciso,
riducendo così gli effetti collaterali e aumentando
l'efficacia della terapia
L'infliximab è un anticorpo monoclonale ad azione specifica
nei confronti di una citochina, il TNF-alfa
Anticorpi monoclonali
I farmaci biotecnologici antagonisti del TNF sono:
Infliximab;
Adalimumab;
Golimumab;
Certolizumab.
Anticorpi monoclonali: infliximab
L’infliximab è un anticorpo monoclonale.
Un anticorpo monoclonale è un anticorpo (un tipo di
proteina) sviluppato per riconoscere e legarsi ad una
struttura
specifica
(detta
antigene)
presente
nell'organismo.
Infliximab è stato sviluppato per legarsi a un
messaggero
chimico
presente
nell'organismo
denominato fattore di necrosi tumorale alfa (TNF-alfa).
Questo
messaggero
contribuisce
a
causare
l'infiammazione e si riscontra in elevate quantità nei
pazienti affetti da tale malattia: bloccando il TNF-alfa,
l’infliximab allevia l'infiammazione e gli altri sintomi
delle malattie.
Somministrazione
La dose di Infliximab per l'artrite reumatoide è
solitamente di 3-5 mg per chilogrammo di peso
corporeo, sebbene tale dose possa essere aumentata
in caso di necessità.
L’Infliximab
viene
somministrato
mediante
un'infusione della durata di una-due ore. Tutti i
pazienti vengono controllati per eventuali reazioni
durante l'infusione e per almeno una-due ore dopo.
Prima o durante il trattamento con Infliximab ai
pazienti possono essere somministrati altri
medicinali al fine di ridurre il rischio di reazioni
legate all'infusione.
Non può essere somministrato per via orale, perché
il sistema digestivo è capace di idrolizzare le
proteine.
Frequenza del trattamento
A seconda della specifica indicazione e delle condizioni del paziente sono
possibili tre diverse modalità di cura con l'infliximab:
-una singola somministrazione, eventualmente seguita da terapia a lungo
termine con farmaci immunosoppressori (azatioprina, 6-mercaptopurina,
metotrexate);
-tre somministrazioni (orientativamente, la seconda 15 giorni dopo la
prima e la terza dopo altre quattro settimane), pure eventualmente
seguite da terapia a lungo termine con farmaci immunosoppressori;
-la somministrazione periodica di un’infusione ogni 6-8 settimane, in
genere sempre in associazione con altri farmaci immunosoppressori.
La durata massima per cui è possibile proseguire con queste infusioni
non è ancora stata stabilita, ma nei centri con maggiore esperienza vi
sono pazienti ormai in cura da 4-5 anni in questo modo
L’assunzione contemporanea di immnusoppressori viene
raccomandata anche nei casi in cui questi farmaci in
precedenza si fossero dimostrati poco efficaci, in quanto si è
visto che sono in grado di ridurre sia il rischio di effetti
collaterali, sia il rischio che l'efficacia dell'infliximab possa
col tempo ridursi.
EFFETTI COLLATERALI (a)
Durante l'infusione possono comparire effetti collaterali quali cefalea, nausea,
dolori muscolari o dolore al petto febbre, brividi, tosse Questi sintomi, detti
"reazioni da infusione" compaiono in circa il 15-20% dei pazienti e in genere
scompaiono rallentando o sospendendo temporaneamente l'infusione e
somministrando antistaminici o cortisonici. Solo in circa il 10% dei pazienti
che hanno queste reazioni (cioè nel 2% della totalità dei pazienti trattati) si
rende necessaria la sospensione definitiva dell'infusione. Vere reazioni
allergiche (orticaria, edema alla faccia etc) sono possibili ma molto rare e in
genere si risolvono rapidamente con somministrazione di farmaci antiistamici
o cortisonici.
In una piccola percentuale di pazienti in cui veniva eseguita un’infusione a
più di sei mesi di distanza dalla precedente è stata segnalata una particolare
reazione allergica ritardata ("malattia da siero") caratterizzata da sintomi
quali febbre, macchie sulla pelle, dolore ai muscoli e alle articolazioni che
compaiono alcuni giorni (da tre a 10-12) dopo l'infusione. Si tratta di sintomi
fastidiosi ma non pericolosi, che scompaiono con un breve ciclo di terapia
cortisonica. Per questo motivo in genere si evita di distanziare le infusioni di
più di 2-3 mesi l'una dall'altra; se è necessario distanziarle maggiormente in
genere i medici prescrivono, prima dell'infusione, un breve ciclo di terapia
cortisonica per scongiurare questo rischio.
EFFETTI COLLATERALI (b)
Come tutti i farmaci che interferiscono con le reazioni
immunologiche l'infliximab può determinare una maggiore
suscettibilità alle infezioni.
Nei pazienti trattati con infliximab sono abbastanza comuni lievi
infezioni delle alte vie respiratorie (bronchiti, faringiti etc) che non
sono più gravi di quelle che possono comunemente insorgere in
chiunque e guariscono rapidamente con gli antibiotici.
Infezioni più gravi (polmoniti, infezioni urinarie, ascessi, setticemie)
sono possibili ma rare.
Recentemente è stato segnalato che l'infliximab può favorire la
riattivazione della tubercolosi nei soggetti che sono già venuti a
contatto con in germe che la causa. Per questo in genere viene
consigliato di eseguire una radiografia del torace ed
un’intradermoreazione alla tubercolina a tutti i pazienti prima di
prendere in considerazione l'inizio di questa terapia
Specifiche controindicazioni all'utilizzo di infliximab:
1) riduce le difese contro le infezioni quindi è controindicato nei pazienti
con malattie infettive in atto.
Inoltre, in un paziente che ha avuto la tubercolosi o in cui la radiografia
del torace e/o l’intradermoreazione suggeriscono una precedente
tubercolosi è necessario attuare una terapia antitubercolare profilattica
prima e durante il trattamento con infliximab
2) sempre in considerazione della riduzione delle difese immunologiche è
suggerita cautela per pazienti che hanno in precedenza avuto un tumore
maligno;
3) una specifica controindicazione esiste nei pazienti con morbo di Crohn
con restringimenti dell'intestino ("stenosi") sintomatici, perché
l'infliximab può peggiorare questi restringimenti, rischiando di causare
un’occlusione intestinale
4) infine è stato visto che l'infliximab può peggiorare i sintomi di pazienti
con gravi cardiopatie, per cui è controindicato in questi casi.
FARMACI BIOLOGICI: Etanercept
L'etanercept è un farmaco per il trattamento di malattie a
carattere autoimmunitario che agisce interferendo con
l'attività del TNF-alfa.
L’etanercept è una proteina di fusione, ottenuta tramite
tecniche del DNA ricombinante, ottenuta dall'unione del
recettore umano p75 per il fattore TNF-alfa con la frazione Fc
dell’immunoglobulina umana IgG1. La proteina funziona da
recettore solubile per il TNF-alfa e possiede un’affinità di
legame per il TNF-alfa più alta di quella degli altri recettori
solubili.
È una molecola complessa, dall'alto peso molecolare, circa 150
KDa, che si lega al TNFα andando ad inibire la sua attività nel
processo evolutivo dell'infiammazione, sia nell'uomo sia negli
animali.
Etanercept: somministrazione
Etanercept
sottocutanea.
viene
somministrato
per
iniezione
Nell'adulto, la dose abitualmente raccomandata è di 25
mg due volte a settimana o 50 mg una volta a settimana.
Etanercept: effetti indesiderati
Gli effetti indesiderati più comuni associati a etanercept
(osservati in più di 1 paziente su 10) sono:
-reazioni nel punto di iniezione (inclusi sanguinamento,
ematomi, arrossamento, prurito, dolore e rigonfiamento);
-infezioni (inclusi raffreddore, infezione ai polmoni, alla
vescica e infezioni cutanee).
I pazienti che sviluppano gravi infezioni
interrompere il trattamento con etanercept.
devono
Anakinra
Il
principio
attivo
immunosoppressivo.
anakinra
è
un
farmaco
Blocca i recettori dell’ interleuchina-1.
Questa citochina viene prodotta ad alte concentrazioni nei
pazienti con artrite reumatoide provocando infiammazione
delle articolazioni e danni articolari.
Legandosi ai recettori a cui normalmente si legherebbe
l'interleuchina-1,
l'anakinra
blocca
l'attività
dell'interleuchina-1, contribuendo ad alleviare i sintomi
della malattia.
Anakinra
La dose raccomandata di Anakinra è di 100 mg una volta al
giorno, somministrata per iniezione sotto la cute ogni 24 h.
Alternare a ogni dose il punto in cui viene praticata
l'iniezione per evitare fastidi nella sede della puntura.
Anakinra : Avvertenze e precauzioni per l'uso
Reazioni allergiche
Le reazioni allergiche associate alla somministrazione di Anakinra sono
rare. La maggioranza di queste reazioni sono eruzioni cutanee
maculopapulose o orticarioidi
Infezioni gravi
Anakinra è stato associato con un’aumentata incidenza di infezioni gravi
(1,8%) rispetto al placebo (0,7%). Per un piccolo numero di pazienti con
asma, l’incidenza di infezioni gravi è stata più elevata nei soggetti trattati
con Anakinra (4,5%) rispetto a quelli che avevano ricevuto il placebo (0%).
Neutropenia
La somministrazione di Anakinra è associata a neutropenia nel 2,4% dei
pazienti rispetto allo 0,4% dei pazienti trattati con placebo.
Trattamento concomitante con Kineret e antagonisti del TNF
La somministrazione contemporanea di Anakinra ed Etanercept è stata
associata a un aumento del rischio di infezioni gravi e neutropenia rispetto
a etanercept da solo. Il trattamento in associazione non ha dimostrato un
incremento del beneficio clinico.
Farmaci utilizzati nella gotta
La gotta è una malattia metabolica determinata
geneticamente e caratterizzata da una eccessiva produzione
di purine
Attacchi intermittenti di artrite acuta per la deposizione di
cristalli di urato sodico (prodotto del metabolismo delle
purine) nel liquido sinoviale delle articolazioni
Plasmina
LTB4
Risposta infiammatoria
Chinine
Accumulo di
Sistema del complemento Granulociti neutrofili
Farmaci utilizzati nella gotta
Meccanismi d’azione
Inibizione della sintesi di acido urico
(allopurinolo)
Aumento della secrezione di acido urico
(probenecid, sulfinpirazone, diuretici uricosurici)
Inibizione della migrazione dei leucociti nell’articolazione
(colchina)
Azione generale antiinfiammatoria
(FANS)
Allopurinolo
Inibizione della sintesi di acido urico
Allopurinolo
Xantina ossidasi
Alloxantina
Inibitore della Xantina ossidasi
Diminuzione degli urati insolubili
Diminuzione dell’ac. urico nei tessuti,
nel plasma e nelle urine
Allopurinolo
L’allopurinolo è il farmaco di prima scelta nel
trattamento a lungo termine della gotta, ma è
inefficace per il trattamento dell’attacco acuto, anzi lo
peggiora
FANS per la fase acuta
Allopurinolo
Farmacocinetica
Somministrazione per OS
Emivita 2-3h
Metabolita: alloxantina (emivita circa 18-30 h)
Escreto per via renale
Allopurinolo
EFFETTI COLLATERALI
Disturbi gastrointestinali
Attacchi acuti di gotta (fase iniziale della terapia)
INTERAZIONE
Aumento attività anticoagulanti orali
(interazione metabolica)
Aumento della secrezione di acido urico
(probenecid, sulfinpirazone, diuretici uricosurici)
Meccanismo d’azione
Aumentano la secrezione di acido urico a livello renale,
mediante un’azione diretta sui tubuli renali
Colchina
Meccanismo d’azione
Inibizione della migrazione dei leucociti nell’articolazione
Farmacocinetica
Somministrazione per via orale
Escrezione: nelle urine e nel tratto gastrointestinale (solo in parte)
Colchina
Effetti Collaterali
Nausea, vomito, dolori addominali
Diarrea
Dosaggi più alti
Emorragia gastrointestinale
Nefropatia
Raramente
Irritazioni cutanee
Neuropatia periferica