Il Sistema
Immunitario
Patogeno è qualsiasi organismo dotato del potenziale di provocare una malattia.
Divisi in 4 categorie:
batteri, funghi, virus, parassiti
Patogeno opportunista: colonizza l’organismo senza provocare una malattia.
Può divenire patogeno se le difese sono indebolite.
Parassiti nei globuli rossi
Batteri
SARS virus
Fungi
L’organismo reagisce all’invasione di un patogeno con due
tipi di risposta:
-Risposta immunitaria innata
-Risposta immunitaria acquisita
>umorale (cellule B , anticorpi)
>cellulo-mediata (cellule Tc e Th)
Il Sistema immunitario deve essere in grado di
disitinguere il self dal non-self (tolleranza verso il self)
IMMUNITA’
innata
acquisita
• aspecifica
• riconosce strutture
comuni
• sempre operativa
• sempre uguale
• specifica
• previene l’infezione
• richiede l’infezione
• riconosce strutture
specifiche
• consegue al contatto
• potenziata da contatti
ripetuti
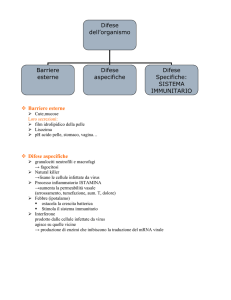
IMMUNITA’ INNATA
• Comprende 4 tipi di barriere:
– Anatomica
• Cute
• Superficie delle mucose
– Fisiologica
• Temperatura
• pH
• Fattori solubili
– Endocitica/fagocitica
• fagocitosi
– Infiammatoria
• Complesso Risposta infiammatoria
Cute:
-barriera meccanica ritarda l’ingresso dei microbi
- l’ambiente acido(pH 3-5) ne ritarda la crescita
Mucose:
- la flora normale compete con i microbi per i siti di
attacco e i nutrienti
-il muco intrappola i microrganismi interi
- Le ciglia spingono i microrgansimi fuori dal corpo
Temperatura: -la normale t inibisce la crescita di alcuni patogeni
-la febbre inibisce la crescita di alcuni patogeni
pH:
- l’acidità gastrica uccide la maggior parte dei patogeni
ingeriti
Mediatori chimici: -lisozima scinde la parete batterica
-interferone induce uno stato antivirale nelle
cellule infettate
- Il sistema del complemento lisa i mocrorganismi e
facilita la fagocitosi
•
•
•
•
•
1-2 adesione del batterio a lunghe evaginazioni della membrana
(pseudopodi)
3- ingestione del batterio con formazione del fagosoma che si muove
verso il lisosoma
4- fusione del fagosoma e lisosoma con rilascio di enzimi lisosomiali nel
fagosoma
5- digestione del materila ingerito
6- rilascio di prodotti di digestione della cellula
Fagocitosi
• I fagociti che riconoscono le comuni componenti delle pareti
batteriche innescano l’immunità innata e inducono l’infiammazione
• I fagociti sono di due tipi:
– Macrofagi
– Neutrofili
• I macrofagi sono presenti nei tessuti
• I neutrofili circolano nel sangue e penetrano solo in quelli infetti
• Essi espongono recettori di superficie che si legano ai comuni
carboidrati della parete batterica, componenti che non sono presenti
nella cellula umana
• In risposta alla presenza dei batteri i macrofagi secernono proteine
solubili, dette citochine, che reclutano altre cellule del sistema
immunitario.
• I neutrofili sono cellule specializzate nella fagocitosi e nell’uccisione
dei patogeni. Iniziano ad agire subito dopo l’infezione. Sono capaci
di agire anche in condizioni di anaerobiosi. Muoiono nel sito di
infezione formado pus. Producono l’infiammazione.
INFIAMMAZIONE
Il danno tissutale provoca il rilascio di vari fattori vasoattivi e chemiotattici.
Questi fattori inducono aumento del flusso sanguigno nell’area, aumento della permeabilità capillare
e afflusso dei globuli bianchi, tra cui fagociti e linfociti.
Le proteine seriche contenute nell’essudato hanno proprietà antibatteriche e i fagociti incominciano
a fagocitare i batteri
Tra i principali mediatori chimici ci sono: proteine della fase acuta
istamina
chinine
• Compito del sistema immunitario innato è anzitutto quello di
riconoscere e quindi distinguere cellule che fanno parte del self,
ovvero cellule proprie dell’individuo, da quelle esterne di origine
batterica.
• Ciò è possibile in quanto tutte le cellule batteriche hanno una
caratteristica comune, ovvero quella di concludere l’estremità Nterminale di ogni peptide una formil-metionina al posto di una
metionina. Inoltre il sistema immunitario innato è in grado di
riconoscere anche la struttura lipopolisaccaridica della parete
esterna dei batteri e anche il tipo di acido nucleico presente in essi.
• La specificità di queste varie capacità di riconoscimento è affidata a
particolari recettori detti “toll-like receptors”,proteine la cui origine ,
si è visto, è molto antica nella scala dell’evoluzione degli organismi
viventi.
La famiglia Toll-like receptor (TLR) appartenenti al
Pattern di Recettori di Ricognizione
Peptidoglycan (G+)
Lipoprotein
Lipoarabinomannans
Zymosan (Yeast)
GPI protein
LPS(G-)
RSV F
CD14 MD-2 TLR-4
TLR-6
TLR-2
TLR-1
dsRNA
TLR-3
Flagellin
TLR-5
Bacterial
CpG DNA
TLR-9
CELLULE E
ORGANI DEL
SISTEMA
IMMUNITARIO
Il Sistema immunitario:
meccanismi di base
Componenti del sistema immunitario: organi linfatici e leucociti.
Organi linfatici: i leucociti si sviluppano fino alla maturità negli organi linfatici PRIMARI (il
midollo osseo e nel caso dei linfociti T, il timo). Gli organi linfatici periferici mostrano
un’architettura reticolare che intrappola materiale estraneo presente nel sangue (milza), nella
linfa (linfonodi), nell’aria (tonsille e adenoidi) e in cibo e acqua (appendice vermiforme e
placche di Peyer nell’intestino).
Leucociti: si dividono in neutrofili, monociti e macrofagi (dai monociti), cellule fagocitarie
che “inglobano e distruggono” agenti estranei e detriti; gli eosinofili ed i basofili proteggono
invece dai grandi parassiti e sono coinvolti nelle reazioni allergiche.
Linfociti: si dividono in B (cellule B) e T (cellule T), specifici rispetto agli agenti esterni. I
linfociti non B e non T sono “natural killer (NK)” antivirali.
Organi del Sistema immunitario
Tonsille e adenoidi
Linfonodi
Vasi linfatici
Timo
Linfonodi
Milza
Placche di Peyer
Appendicite
Linfo nodi
Midollo osseo
Vasi linfatici
• Gli organi linfatici primari forniscono la sede in cui i linfociti
differenziano e vengono commissionati per l’antigene.
• I linfociti T maturano nel timo
• I linfociti B maturano nel midollo osseo (borsa di Fabrizio negli
uccelli)
• In entrambi i casi un processo selelttivo elimina i linfociti immaturi
che riconoscono molecole self oppure riconoscono il MHC autologo
• Gli organi linfatici secondari catturano l’antigene e forniscono la
sede in cui i linfociti possono interagire con esso, andando incontro
alla proliferazione e alla differenziazione in cellule effettrici
• Il tessuto linfatico drena i tessuti e li intereconnette gli uni agli altri
• I linfonodi sono specializzati nel catturare gli Ag presenti nei tessuti
• La milza riceve gli Ag direttamente dal sangue
• Il tessuto meno organizato si trove nelle membrane delle mucose
(follicoli linfatici dispersi nella lamina dell’intestino e nelle placche di
Peyer, site nella parete intestinale)
• Si possono individuare anche tessuti linfatici terziari: tessuti linfatici
associati alla cute
NEI TESSUTI SECONDARI AVVIENE L’INCONTRO
DEI LINFOCITI CIRCOLANTI CON I PATOGENI
E I LORO PRODOTTI METABOLICI TRASPORTATI
DA UN SITO DI INFEZIONE
CELLULE
• Emopoiesi è il processo che porta alla formazione di cellule del
sangue mature.
•
Le sedi dell’emopoiesi sono diverse nel feto, rispetto all’adulto.
•
Nel feto sono organi emopoietici:
il sacco vitellino, il fegato, la milza, il timo, il midollo osseo.
Nell’adulto il principale organo emopoietico è
il midollo osseo delle ossa piatte e delle estremità delle ossa
lunghe che produce tutti gli elementi figurati del sangue.
•
•
Tutti derivano da una cellula capostipite denominata
emocitoblasto, capace di differenziarsi poi nelle differenti linee.
•
Emocateresi è il processo che porta alla distruzione della
cellule del sangue. Principali organi che svolgono questo ruolo
sono il fegato e la milza
Cellule della linea linfatica
• Linfociti sono il 20-40% dei globuli bianchi e
99% delle cellule presenti nella linfa
• Nel corpo umano ci sono circa 1011 linfociti
• Circolano nel sangue e nella linfa e possono
migrare nei diversi tessuti e organI linfatici
• Si dividono in
– Linfociti B
– Linfociti T
– Linfociti null (cellule natural Killer)
• I linfociti B e T quiescenti sono piccoli, mobili, indistinguibili
morfologicamente
• Quelle che non hanno incontrato l’Ag sono vergini (naive) e sono
quiescenti nella fase Go del ciclo cellulare (diametro 6 mm, piccoli
linfociti)
– Citoplasma scarso, cromatina molto addensata, pochi mitocondri
RE e Golgi poco sviluppati
• I linfociti che incontrano l’Ag diventano attivati ed entrano nella fase
G1, S, G2 e M del ciclo cellulare.
– Aumentano di volume (diametro 15 mm cellule blastiche o
linfoblasti) e si sviluppano gli altri organuli cellulari
I linfociti proliferano e differenziano in cellule effettrici e cellule
della memoria
Linfociti B
• Maturano nel midollo osseo
• Esprimono sulla superficie un recettore (Ab) specifico per un
antigene (Ab=antibody anticorpo)
• Dopo l’incontro con l’Ag maturano e si differenziano in Linfociti B
della memoria e linfociti effettori (plasmacellule)
• Linfociti B della memoria esprimono lo stesso Ab delle cellule
progenitrici
• Una plasmacellula sercerne più di 2.000 Ab al secondo
• Le plasmacellule muoiono in 1-2 settimane
Altre molecole di membrana dei
linfociti B
• B220 marcatore della linea linfocitaria B e dei suoi precursori
• Molecole MHC di classe II permette al linfocita B di
comportarsi come cellule presentante l’Ag
• CR1 e C2 recettori per alcuni prodotti del complemento
• Fcg/RII recettore per IgG
• B7-1 e B7-2 interagiscono con CD28 e CTLA-4, importanti
molecole presenti sui linfociti T
• CD40
interagisce con il CD40-ligando sulla superficie del linfocita TH
Cellule T
• Nascono nel midollo osseo e maturano nel timo
• Durante la maturazione esprimono sulla membrana uno
specifico recettore per l’Ag: recettore del linfocita T
(T cell receptor TCR)
• TCR riconosce Ag solo se è legato a proteine MHC,
glicoproteine polimorfiche, presentate da altre cellule
• Ci sono 2 sottopopolazioni di linfociti T:
– T helper (TH)
– Th1 e Th2
– T citotossiche (Tc) o killer
VH
VH
V
CH1 CH1
VL
CH2
CH2
Ig/Ig CH3
CH3
g e
VL
CL
CL
V
e d
C C
z z
Ig/Ig
fyn
lck
Zap 70
Blk, Fyn or Lyn
RECETTORE CELLULE B
RECETTORE CELLULE T
Cellule null
• Non esprimono le molecole caratteristiche dei linfociti T e
B
• Sono prive degli attributi fondamentali dell’immunità: la
specificità e la memoria
• Comprendono i linfociti natural killer (NK)
• Sono di aspetto granulare e rappresentanto il 5-10% dei
linfociti del sangue
• Svolgono un ruolo importante nei confronti delle cellule
tumorali e infettate da virus
Cellule dendritiche
• Le cellule dendritiche sono globuli bianchi che attivano il sistema
immunitario catturando gli antigeni ed esponendoli all’azione delle
cellule 'killer', i linfociti T.
• Queste cellule risiedono principalmente a livello di quei tessuti che
fungono da barriera con l'ambiente esterno e quindi sono più
facilmente raggiungibili da agenti patogeni (mucosa nasale,
polmonare, intestinale, gastrica e cute), dove ricoprono il ruolo di
vere e proprie 'sentinelle'.
• Quando vengono a contatto con agenti estranei
migrano a livello di quei tessuti che
servono da basi al sistema immunitario
(linfonodi), dove allertano le altre cellule
di questa complicata macchina che ci difende
dall'insorgenza di nuove malattie.
ANTIGENI
• Antigeni sono sostanze in grado di indurre una risposta immunitaria
• Ci sono differenze fondamentali nel modo in cui i linfociti B e T
riconoscno l’Ag
• Immunogenicità e antigenicità sono due propietà
immunologiche correlate, ma distinte
• Un antigene è un immunogeno e l’antigenicità è la sua capacità di
reagire in maniera specifica con i prodotti finali delle risposte
immuni
•"TUTTI GLI IMMUNOGENI SONO
ANTIGENI, MA NON TUTTI GLI
ANTIGENI SONO IMMUNOGENI".
APTENE: molecola solitamente di piccole
dimensioni che hanno la proprietà di essere
antigeniche, ma che di per sé non è in grado
di evocare una risposta immunitaria (sono
prive di immunogenicità).
Può diventare anche immunogenica se si
lega a una molecola carrier.Può reagire con i
prodotti di una risposta immune specifica.
Proprietà dell’immunogeno
•
Estraneità: tanto maggiore è la distanza filogenetica fra due specie, tanto
maggiore è la lo diversità genetica
•
Peso molecolare: macromolecole > 10 kDa
•
Composizione ed eterogenità chimica:
– omopolimeri scarsa immunogencicità
– Copolimeri EKEKEKEKEK…..richiede un PM di 30.000 per essere immunogeno, se
si aggiunge anche Y EKYEKYEKYEKY…….il PM si riduce a 20.000
•
Capacità di essere processato: le macromolecole devono essere
processate dalle cellule che presentano l’Ag. Più alta è quasta capacità
maggiore è l’immunogenicità
Ruolo del sistema biologico
nell’immunogencità
• Lo sviluppo di una risposta immunitaria dipende da alcune
caratteristiche del sistema biologico con cui l’agente entra in
contatto:
• Genoma ospite
• Dose e via di somministrazione: gli immunogeni sperimentali
sono somministrati per via parentale
• Associazione di altre sostanze (adiuvanti): sostanze che unite a
un Ag e iniettate con esse, ne aumentano l’immunogenicità. Uno dei
più usati è l’adiuvante di Freund che contienen l’Ag in una soluzione
acquosa, olio minerale ed agente emulsionante (monooleato di
mannite) che disperde l’olio in piccole gocce intorno all’Ag. Si ottine
un lento rilascio dell’Ag dal sito di inoculazione
EPITOPO O DETERMINANTE ANTIGENICO:
PARTE DI UN ANTIGENE CHE ENTRA IN CONTATTO
CON IL SITO DI LEGAME DI UN ANTICORPO O COL
RECETTORE PER L’Ag DELLE CELLULE T o B. (GLI
EPITOPI SONO PRATICAMENTE LE PORZIONI PIÙ
IMPORTANTI DELL’ANTIGENE, CAPACI DI EVOCARE
LA RISPOSTA IMMUNITARIA).
Quando i farmaci diventano immunogeni
•
I farmaci sono piccole molecole incapaci di scatenare la risposta
immunitaria se non sono associate a una molecola più grande
•
La penicillina in alcuni individui può reagire con alcune proteine
dell’organismo per formare un derivato penicilloil-proteina (aptene-vettore),
in cui il derivato penicillinico, il gruppo penicilloil, ha la funzione di epitopo
aptenico
•
Questo epitopo è riconosciuto dal sistema immunitario che produce Ab
(IgE) contro di esso. Le IgE vengono trasportate in tutto l’organismo dove
vengono riconosciute dai recettori per le IgE posti sui basofili (mast-cellule)
e rimanere per molto tempo. Se a una persona che ha anticorpi IgE contro
la penicillina viene somministrata penicillina, andrà incotro a reazione
allergica
•
1-5% della popolazione ha questo problema
SISTEMA
IMMUNITARIO
ACQUISITO
Sistema immunitario specifico
Origine
Linfociti:
1.Linfociti T
2.Linfociti B
•
•
La selezione clonale dei linfociti B e linfociti T è alla base della risposta innata
Sia i linfociti B che T esprimono recettori dotati di una singola specificità
– Linfociti B esprimono immunogobuline (Anticorpi, Ab)
– Linfociti T esprimono recettori
VH
VL
VH
CH1 CH1
CL
CH2
Ig/Ig
CH3
V V
VL
zz
CL
ge
CH2
CH3Ig/Ig
C C
fyn
ed
lck
Zap 70
Blk, Fyn or Lyn
•
Ciascun linfocita da origine a un unico tipo di molecola
•
Ciascun linfocita, stimolato dal patogeno da origine a una popolazione di cellule che
esprimono tutte immunoglobuline o recettori delle cellule T identici (SELEZIONE
CLONALE)
Esempio: SELEZIONE CLONALE nei linfociti B
Ogni linfocita B esprime
sulla membrana 150.000
Anticorpi (recettori) identici per lo
stesso Ag
Gli strumenti del sistema immunitario
acquisito
• Immunoglobuline o Anticorpi
• Recettore delle cellule T
• Complesso maggiore di istocompatibilità e
proteine MHC su APC
• Cellule che presentano l’antigene (APC)
Immunoglobuline:
struttuta e
funzione
Antibody Molecule Structure
Ag binding
region
VH
N terminal
end
VL
CH1
disulfide
bonds
Heavy Chain
CH3
CHO
CH2
h
C terminal
end
Ag
CL
=
globular
domains
Y
•
•
•
•
•
•
•
•
•
•
•
2 catene leggere identiche (L, light, 220 aminoacidi)
2 catene pesanti identiche (H, heavy, 440 aminoacidi)
A forma di Y rovesciata
Ponti S-S fra le catene
2 siti di legame per Ag (bivalenti)
Zona di riconoscimento per Ag o Fab (Fragment Antigen
Binding) con sequenza di aminoacidi relativamente variabile
Zona costante o Fc (Fragment cristallizzabile) con sequenza
di aminoacidi relativamente costante
REGIONI IPER VARIABILI
La variabilità della sequenza di aminoacidi è confinata in 3
regioni ipervariabili (5-7 aminoacidi per L, 6-17 aminoacidi
per H)
Il sito antigenico è composto dalle regioni ipervariabili della
catena L e dalle regione ipervariabili della catena H
Alta costante di affinità Ig-Ag (104-1011 l/mole)
Papain Cleavage
Papain Cleavage
2 Fab
Fc
Pepsin Cleavage
Pepsin Cleavage
F(ab’)2
Enzymatic degradation
of Fc fragment.
Funzione effettrice
Legame a C4b
C fissazione
(legame a C1q )
Si lega a FcR
(Mac, Mono)
Si lega a FcR
(neutrofili; NK cells)
Come agiscono gli anticorpi
• Gli Ab eliminano gli Ag e uccidono i patogeni
utilizzando 3 funzioni effettrici principali:
– Opsonizzazione (fagocitosi dell’Ag da parte dei macrofagi e
neutrofili)
– Attivazione del complemento (IgM e sottoclassi di IgG)
– Interazione con i recettori Fc delle cellule NK
Classi di anticorpi
Esistono 2 tipi di catene leggere
– K (uomo 60%)
l (uomo 40%)
Esistono 5 classi di catene pesanti:
m, g, , d, e
Ognuna di queste diverse catene pesanti è chiamata
ISOTIPO
Ogni Ab è formato da 2 catene pesanti e 2 catene leggere
identiche H2L2, oppure è un multimero di questa struttura
base a 4 catene (H2L2)n
5 Classi di anticorpi nell’uomo
• Classe
catena
pesante
sottoclassi
catena
leggera
formula
molecolare
IgG
g
g1g2g3g4
K, l
g2K2, g2 l2
IgM
m
nessuna
K, l
(m2K2)n
(m2l2)n n=1 o 5
IgA
1, 2
K, l
(2K2)n
(2l2)n n=1,2,3,4
IgE
e
nessuna
K, l
(e2K2) (e2l2)
IgD
d
nessuna
K, l
(d2K2) (d2l2)
Immunoglobuline: struttura
IgG, IgD, IgE, and IgA
IgA
IgM
Funzione degli anticorpi
•
•
•
•
IgG:
Coinvolte nella risposta umorale
70% delle Ig sieriche
Azioni:
–
–
–
–
•
•
•
•
•
Opsonizzazione
Neutralizzazione di microbi e tossine
Attivazione del complemento per via classica
Attraversare la placenta
IgM:
Primi a comparire nel sangue in risposta ad antigeni
Potere agglutinante a causa dei molteplici siti disponibili
Attivatori del Complemento
Non attraversano la placenta
•
•
•
•
IgA:
Ig dimeriche
Sintetizzate da linfociti B dei tessuti linfoidi associati alle mucose
Presenti nelle secrezioni, latte, saliva, lacrime, etc.
– Impediscono l’aderenza di microrganismi.
– Scarsa attività opsonizzante
– Attivazione del complemento per via alternativa
• IgE:
• Reazioni di ipersensibilità di Tipo I (asma, febbre da fieno)
provocando il rilascio di citochine e mediatori infiammatori.
• Attivi nelle infezioni da parassiti favorendo l’attività citotossica degli
eosinofili.
• IgD:
• Ig di membrana espresse sulla superficie dei linfociti.
• Ruolo non chiarito, ma sono importanti drante la differenziazione dei
linfociti B.
Ruolo delle IgE nella secrezione di istamina
Recettore Fc
per IgE
mastocita
IgE
Ag
Vescicole di
istamina
Istamina
Vasodilatazione, reazioni
allergiche
Rilascio di
istamina
Il sistema del Complemento
Sistema di Proteine attivate enzimaticamente dal legame di
un anticorpo ad un antigene che portano alla formazione di
un complesso terminale capace di attaccare e dissolvere la
parete batterica o la membrana di cellule tissutali.
Vie di Attivazione:
•Classica - In cui sono presenti tutti i componenti
attivata dal complesso antigene-anticorpo
•Alternativa – Innescata da membrane microbiche e
molecole non anticorpali. Assenza di alcuni componenti.
•Lectinica – Attivata da lectine plasmatiche che si
legano ai microrganismi.
Funzioni:
• Interazione con i recettori della superficie
cellulare per indurre la fagocitosi
– Molecole recettrici su polimorfonucleati, macrofagi e
frammento Fc degli anticorpi
• Produzione di componenti biologicamente attivi.
– Tramite proteolisi il complemento si attiva liberando
un frammento b che prende parte ad ulteriori reazioni
ed un frammento a che si comporta come mediatore
flogistico.
• Danno della membrana tramite il complesso
d’attacco
Complement
C2
C3
C3a
C5a
C1
C7
C6
C8
C5b
IgG
C5b
Antigen
C4
Enzyme
C3b
C5
C9
Complesso di attacco alla
membrana
C5a
C5
70-100 Å
C8
C9C9
C9
C9
C9
C9
C9
C9 C9
C9C9
C6 C5b C7
• Natura especifica
• Richiede regolazione per evitare danni ai tessuti sani
• Sistemi di regolazione attivi e passivi
– Passivi: estrema labilità di molti componenti che si inattivano
subito
– Attivi: vari regolaotri che inattivano i prodotti del compelmento
• Deficit a carico del C3 sono clinicamente più importanti; aumentano
la suscettibilità alle infezioni batteriche
•
La via lectinica è innescata dalla proteina legante il mannosio, che ha siti di
legame per i carboidrati tipici della superficie batterica.
•
Una volta legata al batterio scatena una serie di reazioni enzimatiche che attivano il
COMPLEMENTO
• Gli anticorpi vengono prodotti da tre distinte famiglie
geniche localizzate su cromosomi diversi:
per le catene leggere K
per le catene leggere l
per le catene pesanti
• Ogni famiglia genica contiene numerosi segmenti genici:
• Regione variabile V e J nella catena leggera
• Regione variabile V, D, J nella catena pesante
• Regione costante
Segmenti genici separati codificanti parti diverse delle
regioni variabili delle catene leggere e delle catene pesanti
vengono unite mediante fenomeni di ricombinazione nel
corso del differenziamento della cellule B
V1
V2
V3
Vn
C
J1 J2 J3 J4
DNA della linea germinale
Regioni di DNA da unire
V= circa 300
J=4
V1
DNA della cellula B
RICOMBINAZIONE SOMATICA
CATENA LEGGERA
V2
V3 J3 J4
C
trascrizione
splicing
Sintesi delle catena leggera K
nel topo:riarrangiamento V-J della
catena leggera
V3 J3 C
traduzione
NH2
V3J3 C
COOH
Segmenti genici della catena pesante nel topo
V1
V2
Vn
D1 D2
Dn J1 J4 Cm Cd
Cg Ce C
Esistono almeno 100-1000 segmenti genici V
12 segmenti D
4 segmenti J
gruppo ordinato di segmenti C codificante una
classe diversa di catene pesanti
• I riarrangiamenti avvengono in ordine
sequenziale: prima quelli della catena pesante
poi quelli della catena leggera
• Sono finemente regolati, in modo tale che il DNA
di un solo cromosoma parentale venga
riarrangiato a formare un gene funzionale per la
catena leggera o pesante.
• Questa esclusione allelica assicura che Ab
maturo abbia la specificità antigenica singola
Diversificazione combinatoria
Uno dei circa 300 V si può unire a uno dei 4 J
300 x 4 = 1200 diverse regioni V (catena leggera)
Uno dei 100-1000 V si può unire a uno dei 20 D e dei 4 J:
1000 x 20 x 4 = 80.000 diverse regioni V
Una ulteriore diversità deriva dal fatto che gli eventi di giunzione
sono imprecisi. Si può avere perdita di basi e cambiamneto di Frame
Regione V, D, J nella catena Pesante e Leggera k e l
Segmenti
Genici
catena pesante
V
51
D
27
J
6
Possibili
Combinazioni 51x27x6=8262
C.leggera l
40
0
5
40x5=200
C.leggera k
30
0
4
30x4=120
Associazione
Combinatoriale leggera-pesante
8262 x (200+120)= 2,64 x 106
DIVERSITA’ GIUNZIONALE
Una ulteriore diversità deriva dal fatto che gli eventi di giunzione
sono imprecisi. Si può avere perdita di basi e cambiamneto di Frame
V
GAG GAT CCT CCC ACA….
TAC CAC TGT GGT GGA CGT TA…
J
GAG GAT CCG GTG GAC GTT A…
GAG GAT CCG TGG ACG TT A
GAG GAT CCT GGA CGT TA….
Cambia il
Codice di
lettura
• Nucleotidi P: aggiunta di nucletidi ad opera degli enzimi di
riparazione
• Nucelotidi N: aggiunta di di nucleotidi durante i processi di
giunzione D-J e V-D-J mediante l’enzima terminal-trafesrasi
• Ipermutazione somatica:
sostituzione di singoli nucleotidi nelle unità
V-J e V-D-J
Switch isotipico tra i geni delle
catene pesanti
• Il DNA della catena pesante può andare incontro a ulteriore
riarrangiamneto in cui una unità V-D-J può combinarsi con uno dei
segmenti C
• Esempio:
– V2-D4-J3 può combinarsi con Cd oppure con Cg...
L1
VH1
Ln
VHn
DH(1-12)
JH
Cm
Cd
Cg3
Cg1
n=250-1000
Cg2b
Cg2a
Ce
C
Linfociti T e
recettore
(TCR)
Cellule T
• Nascono nel midollo osseo e maturano nel timo
• Durante la maturazione esprimono sulla membrana uno
specifico recettore per l’Ag: recettore del linfocita T
(T cell receptor TCR)
• TCR riconosce Ag solo se è legato a proteine MHC,
glicoproteine polimorfiche
• Ci sono 2 sottopopolazioni di linfociti T:
– T helper (TH)
– T citotossiche (Tc)
• Il TCR riconosce solo Ag processati e associati a una
molecola MHC espressa da una cellula APC o da una
cellula bersaglio
• Il DNA del TCR è organizzato in domini variabili codificati
da diverse regioni geniche e costanti (come Ig)
• Meccanismi di ricombinazione simili a quelli delle Ig
• Cellule T presentano altre molecole accessorie di
interazione con le APC (cellule che presentano
l’antigene)
– CD40, CD2, CD28, CTLA-4
• Il TCR è associato al CD3, un complesso molecolare
Interazione APC e Linfocita T
CTLA-4
B7 (CD80/86)
B7 (CD80/86)
CD28
APC
CD58 (LFA-3)
Attivazione
CD154
(CD40L)
Attivazione
Riconoscimento
TCR
MHC II
Attivazione
CD2
CD4+
Adesione T Cell
CD40
2HN
T
Variabile
costante
NH2
T
V
V
Ogni catena è lunga 280 aa.
Omologia strutturale e di
Sequenza con gli Ab
Circa 100 geni V
50 geni J
Circa 30 geni V
Circa 12 geni J
C
C
membrana
COOH
COOH
Recettore cellue T
Memoria immunologica
• Le risposte immunitarie acquisite danno luogo alla memoria
immunologica di lunga durata e a una immunità protettiva
• La risposta immunitaria primaria è sviluppata da un numero limitato
di linfociti
• L’intervallo necessario per la ooro espansione numerica fornisce al
patogeno l’opportunità di avviare un processo infettivo fino alla
comparsa della malattia
• Il cloni della risposta primaria comprendono anche le cellule della
memoria di lunga durata, che rendono la risposta più veloce e più
intensa a una successiva esposizione allo stesso patogeno
• L’intesità delle risposte secondarie può essere sufficiente a
respingere la malattia
Complesso
maggiore di
istocompatibilità
(MHC)
• Tutte le specie di mammiferi possiedono un gruppo di
geni strettamente associati, il complesso maggiore di
Istocompatibilità (MHC), i cui prodotti proteici sono
coinvolti nel riconoscimento cellulare e nelle discriminazione
self e non-self.
Svolge un ruolo fondamentale nel determinare se un tessuto
trapiantato può essere accettato come self (istocompatibile) o
rigettato (istoincompatibile)
• MHC è fondamentale nello sviluppo delle risposte sia umorali che di
tipo cellulare
• I linfociti T riconoscono gli antigeni solo se associati a molecole MHC
• MHC è un gruppo di geni localizzato su un
ampio tratto del Cromosoma 6 (uomo) e
cromosoma 17 (topo)
• Viene denominato HLA (human leukocytes
antigen nell’uomo)
• I geni sono localizzati in regioni che
codificano 3 classi di proteine:
geni MHC di classe I codificate nelle regioni A, B, C
geni MHC di classe II codificati nelle regioni DP, DQ, DR
geni MHC di classe III
Le molecole MHC espresse da un individuo non si modificano
nel tempo e possono differire da quelle espresse da un altro
individuo della stessa specie
POLIMORFISMO
MHC è uno dei complessi genetici più polimorfici dei
vertebrati più evoluti e possiede un numero straordinariamente
elevato di alleli diversi per ciascun locus
Gli alleli differiscono del 5%-10% nella sequenza del DNA da un
individuo all’altro
Proteine MHC sulle cellule che
Presentano l’antigene
Antigen presenting cells (APC)
•
Le molecole MHC di classe I e classe II legano il peptide derivante dal
processamento dell’Ag
•
Gli Ag di classe I si associano a molecole derivanti da antigeni endogeni
•
Gli Ag di classe II legano molecole derivate da antigeni esogeni
•
MHC di classe I sono su tutte le cellule (non specializzate)
•
MHC di classe II solo su cellule specializzate:
– Linfociti B
– Cellule dendritiche
– Macrofagi
– Fibroblasti, cellule gliali (cervello), cellule endoteliali, epiteliali, ecc.
LE MOLECOLE DI CLASSE I e II appartengono alla
superfamiglia delle immunoglobuline
Entrambe presentano l’antigene ai linfociti T
Le molecole di classe I sono espresse in tutte le
cellule nucleate che presentano gli antigeni endogeni
processati ai linfociti CD8+
Le molecole di classe II sono espresse solo in numero
limitato di cellule presentanti l’antigene (macrofagi,
cellule dendritiche, linfociti B) che presentano gli
Antigeni esogeni processati dai linfociti CD4+
Restrizione immunitaria per le molecole MHC:
I linfociti T citotossici CD8 sono ristretti alla classe MHC I
I linfociti TH CD4 alle molecole di classe MHC II
A seconda della provenienza dell’antigene, intracellulare (endogeno)
o extracellulare (esogeno), il sistema immunitario viene attivato
in modo diverso
Antigeni esogeni: ciclo endocitico
Antigeni endogeni: ciclo citosolico
Trasportatore associato alla processazione dell’Ag
ubiquitina7ATP
Ag esogeni
complesso
proteasoma
peptidi
Via citosoilica
Ag esogeni
Via endocitica
TAP
RE
esopeptidasi
Endocitosi/
fagocitosi
compartimenti
endocitari
peptidi
Complesso
MHCI/peptide
Aminoacidi
semplici
complesso
MHCII/peptide
• MHC lega piccoli peptidi, 8-10 amminoacidi
• Ligandi Classe I circa 9 aa.
• Ligandi Class2 II tra 12 e 25 aa.
• Un core di 9 amminoacidi è fondamentale per il
legame tra peptide/MHC.
Human Tissue Typing for Transplants
HLA
Chromosome 6
D
B
C
A
Leukocyte
MHC protein
• Ogni cellula del corpo è coperta di markers MHC-self, e ogni persona
porta un set unico di questi markers. Se un linfocita T riconosce un
struttura MHC non-self essa reagisce rapidamente per distruggerla.
•
• Per un trapianto di successo di un organo o di cellule staminali è
necessari paragonare il set MHC del donatore e del ricevente.
• Devono essere il più possibile simili.
• Per trovare un buon “match” è necessario fare la tipizzazione
tissutale dei linfociti. In questo caso i marker MHC-self sono
chiamati HLA (human leukocytes antigens). Ogni cellula ha un
doppio set di sei principali markers HLA, HLA-A, B e C e tre tipi di
HLA-D.
Tipizzazione dell’HLA
Gruppo di Alleli polimorfici
trasmessiinsieme è definito
APLOTIPO
SCHEMA GENERICO
Complesso
APC/MHC-pep/CellulaT
recettore
Cellula T
recettore
Peptide estraneo
Complesso peptide
estraneo/recettore/
MHC
MHC (I o II)
Cellula che presenta Ag
CD4/8
MHC
Peptide estraneo
Come viene
innescato
l’intero sistema
Linfociti T helper: secernono citochine che favoriscono la risposta umorale e
cellulo-mediata. Si attivano a contatto con uno specifico antigene presentato da una
molecola MHC di classe II (sulla membrana di un macrofago o su un linfocita B). Allo
stesso tempo si generano linfociti T di memoria a lunga vita. Le risposte combinate
dei linfociti T helper, dei linfociti T citotossici e dei linfociti B controllano la specifica
rimozione di antigeni dannosi e forniscono l’immunità permanente verso di essi.
La risposta immunitaria cellulo-mediata si verifica quando i linfociti T citotossici
riconoscono uno specifico antigene presentato da una molecola del complesso
maggiore di istocompatibilità MHC di classe I sulla membrana di una cellula
infettata da un virus o su una cellula tumorale. Si differenziano quindi in cellule
(killer) assassine. I linfociti T citotossici rilasciano perforine ( formano dei pori nella
membrana della cellula colpita) e frammentine (entrano nella cellula e determinano
la sua morte, apoptosi).
La risposta immunitaria umorale deriva dall’attivazione dei linfociti B. In seguito
al contatto con specifici antigeni sulla membrana del batterio, i linfociti B proliferano
e si differenziano in linfociti B di memoria a lunga vita e plasma-cellule a vita breve.
Mentre i linfociti B di memoria sono responsabili dell’immunità permanente ad un
antigene, le plasma-cellule secernono anticorpi che si uniscono ad un antigene
bersaglio e quindi reclutano atri fattori di difesa (per esempio cellule fagocitarie) per
distruggerlo.
Attivazione delle cellule T
• L’attivazione di una cellula T citotossica o helper a
proliferare e differenziarsi in cellula effettrice avviene per
interazione con la cellula che presenta l’antigene, la
quale deve trasmette alcuni segnali:
– 1° segnale: peptide estraneo legato alla proteina MHC.
– 2° segnale: proteine stimolatrici, come le proteine B7 (CD80 e
CD86) che sono riconosciute dal corecettore CD28 sulle
superficie della cellula T. Se le cellule T helper ricevono entrambi
i segnali, si attivano, proliferano e secernono una citochina,
chiamata interluchina-2.
– 3° segnale: secrezione di interleuchine diverse
Le cellule T helper assumono il comando della risposta immunitaria
attivano tutte le altre cellule a proliferare
Attivazione di Cellule T da APC attivato
IL-1
IL-6
IL-12
IL-12 Recettore
CD28
“segnale 3”
B7
“Segnale 2”
CD4+
T cell
CD4
Recettore
Linf. T
LPS
TLR4
“Segnale 1”
Peptide
MHC II
Signal 1: Specificità
Signal 2: Attivazione
Signal 3: Differenziamento
Antigen Presenting Cell (APC)
Cellule TH1 e TH2
•
•
Esistono due tipi di cellule T helper: TH1 e TH2.
Questa distinzione è fatta sulla base delle citochine che secernono:
•
le cellule TH1 secernono
•
le cellule TH2 secernono
– l’interferone g (IFN-g)
– il fattore di necrosi tumorale (TNF-)
– aiutano essenzialmente i macrofagi, le cellule T citotossiche e -in parte- le cellule
B;
– le interleuchine 4, 5, 10 e 13 (Il-4, Il-5, IL-10 e IL-13)
– stimolano le cellule B (solo quelle che presentano lo stesso antigene)
a produrre anticorpi.
La differenziazione delle cellule T in TH1 e TH2 influenza quindi il tipo di risposta
immune che deve essere organizzata contro il patogeno.
Una volta che TH1 o TH2 si sono sviluppate avviene una inibizione reciproca, cioè
se si formano le TH1, la produzione di (IFN-g) inibisce lo sviluppo di TH2,
mentre la produzione di IL-4 e IL-10 prodotte da TH2 inibisce lo sviluppo di TH1.
Attivazione da parte delle cellule Th1
•
Attivazione dei macrofagi. Le cellule TH1 utilizzano due segnali
per attivare i macrofagi:
1) la IFN-g
2) il ligando della proteina CD40 si lega alla proteina CD40
presente sulla superficie del macrofago. A questo punto i macrofagi
attivati possono uccidere i patogeni contenuti nel fagosoma
attraverso processi idrolitici, la formazione di radicali e ossido
nitrico.
• Attivazione delle cellule T citotossiche. Le cellule TH1 attivano le
cellule T citotossiche negli organi linfoidi periferici stimolando le
cellule dendritiche a produrre proteine costimolatrici. Inoltre, la
secrezione di IFN-g aumenta l’efficienza con cui le cellule bersaglio
processano gli antigeni virali per presentarli alle cellule T
citotossiche.
• Attivazione delle cellule B. Le cellule TH1 possono aiutare le
cellule B a proliferare e differenziarsi sia in cellule secernenti
anticorpi che cellule memoria. Inoltre stimolano anche il
cambiamento di classe degli anticorpi.
Meccanismo di attivazione da parte
delle cellule Th2
• Il primo segnale è rappresentato dall’antigene che si
lega al recettore-anticorpo legato alla membrana della
cellula B. Processi di fosforilazione
• Il secondo segnale è costituito dal ligando della
proteina CD40, che è espressa sulla superficie delle
celluleT attivate, ma non su quelle a riposo. L’interazione
tra il ligando del CD40 e il CD40 è necessaria perché le
cellule T attivino le cellule B a proliferare e a maturare in
cellule della memoria e in cellule che secernono gli
anticorpi. Nello stesso tempo viene prodotta
interleuchina 4 (Il-4), che stimola la proliferazione e la
maturazione delle cellule B
Attivazione dei macrofagi.
IFN-g
• I meccanismi con cui le cellule T citotossiche
uccidono le cellule bersaglio infettate sono due:
– 1- rilascio di una proteina, la perforina, in grado di formare pori
sulla membrana della cellula infettata. Questa proteina,
dapprima conservata in vescicole secretorie, viene rilasciata per
esocitosi locale nel punto di contatto con la cellula bersaglio. Da
queste vescicole sono rilasciate anche alcune proteasi, in
particolare la granzyme B, che attiva alcune caspasi, innescando
il processo apoptotico della cellula
– 2- Una proteina trimerica sulla superficie delle cellula T
citotossica , si lega e attiva la proteina Fas sulla superficie della
cellula bersaglio. La coda citosolica della Fas contiene un
dominio che, quando è attivato, si lega a una proteina
adattatrice e recluta la procaspasi-8. La successiva attivazione
della caspasi 8 da inizio alla cascata proteolitica che porta al
processo apoptotico.
Schema della risposta immunitaria
Ingesione patogeni (Macrofagi)
Digestione Patogeni
Frammenti di antigeni proteici del Patogeno vengolo legati al
MHC aulla membrana dei Macrofagi
I Macrofagi presentano l’antigene ai Linfociti T
Cellule T con recettori per l’antigene vengono sensibilizzate
Cellule T sensibilizzate si dividono
Cellule T helper
Stimolano le cellule
T esprimenti lo
stesso recettore
Cellule T Suppressor
Cellule T citotossiche
Distruggono
l’antigene
Inibiscono le Cellule B
con lo stesso recettore
antigenico
Cellule T helper
Cellule T suppressor
Stimolano le cellule
T esprimenti lo
stesso recettore
Inibiscono le Cellule B
aventi lo stesso recettore
Termine della
risposta
immunitaria
Divisione Cellule B
Plasmacellule
Cellule B di Memoria
Cellule B producono Ab
Anticorpi legano l’antigene
Attivano il Complemento
Aiutano I Fagociti a trovare gli antigeni
Distruggono l’antigene