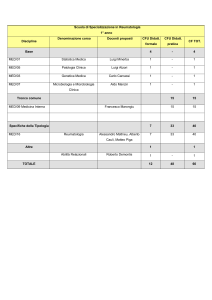
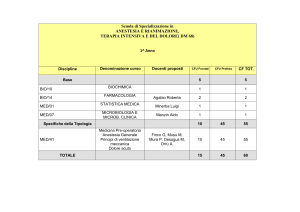
La prescrizione di farmaci e
l’appropriatezza in medicina
specialistica
Catanzaro 9 marzo 2011
Cattedra di Nefrologia
U.O. di Nefrologia–Dialisi-Trapianto
A.O. Policlinico Mater Domini - Catanzaro
Alfredo Caglioti
Urologo
Chirurgo
vascolare
Internista
Geriatra
NEFROLOGO
Cardiologo
Diabetologo
Medico di base
PERCORSI DEL PAZIENTE NEFROPATICO
RICOVERO EXTRA NEFRO
MMG
AMB NEFROLOGIA GENERALE
PRONTO SOCCORSO
AMB IPERTENSIONE
AMB CALCOLOSI
FOLlOW UP BIOPSIATI
RICOVERO
NEFROLOGIA
AMBULATORIO PREDIALISI
EMODIALISI
DIALISI PERITONEALE
TRAPIANTO
L’appropriatezza
L’appropriatezza è:
“ la cosa giusta, al soggetto giusto, nel
momento giusto, da parte dell’operatore
giusto, nella struttura giusta ”
L’appropriatezza in
Medicina
(Accordo Collettivo Nazionale)
…. d. “ Operare secondo i principi di efficacia
ed appropriatezza degli interventi in base ai
quali le risorse devono essere indirizzate verso
le prestazioni la cui efficacia è riconosciuta
secondo le evidenze scientifiche e verso i
soggetti che maggiormente ne possono trarre
beneficio”.
L’appropriatezza nella prescrizione
Correttezza della diagnosi
Indicazione terapeutica
Dose
Via di somministrazione
Durata del trattamento
Revisione periodica del trattamento
Controindicazioni
Interazioni
Fattori da tenere in considerazione nella
prescrizione nel paziente con IRC
Assorbimento e biodisponibilità
Volume di distribuzione
Legame farmaco-proteico
Biotrasformazione
Eliminazione
Inquadramento iniziale dettagliato:
- Farmaci precedentemente/attualmente assunti
- allergie
- esame obiettivo
- parametri di funzionalità renale
- altri parametri di laboratorio
Hassan Y et al, Drug Use and Dosing in Chronic Kidney Disease - Ann Acad Med
Singapore 2009;38:1095-103
Valutare il grado di funzionalità renale:
- determinare lo stadio dell’IRC attraverso la
formula MDRD
- calcolare la cl. creatinina per adeguare al filtrato
la dose di farmaco
N.B. – la maggior parte dei farmaci non richiede
adattamento della posologia se GFR > 50 mL/min
(tranne
vancomicina,
aminoglicosidi,
digossina,
procainamide)
Hassan Y et al, Drug Use and Dosing in Chronic Kidney Disease - Ann Acad Med
Singapore 2009;38:1095-103
Creatinina
…ma …basta solo usare la Creatininemia?
1 mg/dl
40 Kg
52
ml/min
30 anni
(140-30 anni) x 90
Kg
72
!!
Formula di Cocroft = (140- Età) x Peso corporeo
72 x Creatininemia
nelle donne moltiplicare x 0.85
formula MDRD : Creatinina, età, sesso ed etnia
(bianca o negra)
137
ml/min
Abboud H et al, N Engl J Med 2010;362:56-65.
Stadiazione della malattia renale cronica
Filtrato Glomerulare (ml/min)
150
stadio 1: FG nor. o ↑
danno renale (alb.-sedimento-imaging)
120
stadio 2: IR lieve (FG 9060 ml/min) +μAlb e/ o
90
sedimento imaginig
stadio 3: IR moderata (FG 60-30 ml/min)
60
stadio 4: IR severa
(FG 30-15 ml/min)
30
15
0
tempo
stadio 5: fase
terminale (FG <15
ml/min)
Piano d’azione per rallentare la progressione dell’IRC
Filtrato Glomerulare (ml/min)
150
stadio 1:diagnosi della malattia renale, trattamento
delle comorbidità, terapia per ↓ progressione
120
90
60
30
15
0
stadio 2 : terapia- stima velocità di progressione
stadio 3: valutazione e trattamento delle complicazioni
(anemia-iperparatiroid. etc)
stadio 4: preparazione allastadio
dialisi/trapianto
5:sostituzione
funzione renale
tempo
Principali cause di insufficienza renale cronica
Abboud H et al, N Engl J Med 2010;362:56-65.
Ricontrollare la lista di farmaci in terapia:
- assicurarsi che tutti abbiano specifiche
indicazioni
- valutare le possibili interazioni/effetti avversi
- rivalutare la frazione di farmaco eliminata dal
rene come immodificata/metaboliti attivi escreti
dal rene
N.B. – le terapie andrebbero rivisitate per assicurarsi che
i dosaggi siano sempre adeguati alla funzione renale del
momento.
Hassan Y et al, Drug Use and Dosing in Chronic Kidney Disease - Ann Acad Med
Singapore 2009;38:1095-103
Faull R et al, Prescribing in renal disease - Aust Prescr 2007;30:17–20
Olyaei, Steffl: A Quantitative Approach to Drug Dosing in Chronic Kidney Disease - Blood Purif 2011;31:138–145
Scegliere il farmaco con la minore
nefrotossicità:
Se non si può evitare l’uso di un farmaco
nefrotossico, lo stretto monitoraggio della
funzione renale e degli effetti del farmaco
diventa indispensabile.
Hassan Y et al, Drug Use and Dosing in Chronic Kidney Disease - Ann Acad Med
Singapore 2009;38:1095-103
Hassan Y et al, - Ann Acad Med Singapore 2009;38:1095-103
Dose di carico:
Solitamente la stessa del paziente avente
normale funzione renale;
Regime di mantenimento:
Se necessario, in funzione della clearance
della creatinina
-ridurre il dosaggio;
- prolungare l’intervallo fra le dosi;
Hassan Y et al, Drug Use and Dosing in Chronic Kidney Disease - Ann Acad Med
Singapore 2009;38:1095-103
Monitorare i livelli del farmaco:
Indispensabile per determinati farmaci (es.
aminoglicosidi, digossina)
La dose somministrata di determinati
farmaci dovrebbe essere adeguata in base
alla risposta farmacodinamica.
Hassan Y et al, Drug Use and Dosing in Chronic Kidney Disease - Ann Acad Med
Singapore 2009;38:1095-103
Olyaei, Steffl: Blood Purif 2011;31:138–145
VALUTAZIONE E RALLENTAMENTO DELLA PROGRESSIONE
TRATTAMENTO DEI FATTORI DI RISCHIO
A) CONTROLLO IPERTENSIONE
B) CONTROLLO GLICEMICO (diabetico)
C) PATOLOGIE CARDIOVASCOLARI
D) EVITARE SOSTANZE NEFROTOSSICHE
E) CONSULENZA DIETETICA E OBESITA’
Conventional treatment for
SHPT
• Dietary phosphate restriction
• Oral phosphate-binding agents
• Calcium supplementation
• Active Vitamin D sterols
• Calcimimetics
• Parathyroidectomy
Iperfosforemia in corso di uremia:
le possibili opzioni dei chelanti
A base
di METALLI
- Alluminio
- Magnesio
- Lantano
- Ferro 3+
DB 2006
A base
di CALCIO
- Calcio carbonato
- Calcio acetato
Privi di Calcio
e Alluminio
- Sevelamer
- Lantano
- Ferro 3+
Efficacia ++
Ipercalcemia 15%-25%
Calcium carbonate
Sevelamer/Lantano
Calcium Acetate
Efficacia +
Ipercalcemia 23%-92%
Efficacia ~CaCO3
Ipercalcemia 2%-5%
Aluminium Hydroxide
Efficacia +++
Ipercalcemia 0-10%
Assorbimento 0,02% Osteomalacia
Anemia
Encefalopatia
Sopravvivenza CV cumulativa
Livelli plasmatici di iPTH e
sopravvivenza
ad
eventi
CV
1,0
iPTH 114–476 pg/ml
[iPTH 12–50 pmoli/l]
0,9
iPTH < 114 pg/ml
[iPTH < 12 pmoli/l]
0,8
iPTH > 476 pg/ml
[iPTH > 50 pmoli/l]
0,7
n = 143
P = 0,02
(> 476 verso 114–476 pg/ml)
[> 50 verso 12–50 pmoli/l]
0,6
0,0
0
1
2
3
4
5
6
Tempo (anni)
Riprodotto per concessione da Marco MP et al. Kidney Int 2003;63(Suppl 85):S111–4
Studio prospettico della durata di 6 anni
28
Minimum dose of Vit. D
Calcitriolo
e.v. 0.5
Alfacalcidolo e.v. 1
Paracalcitolo e.v. 2
Calcitriolo
os 0.25
Alfacalcidolo os 0.25
g TIW
g TIW
g TIW
g TIW
g TIW
iPTH
Ca
P
Ca x P
Mean (SE) Change from Baseline (%)
20
10
2%
1%
5%
4%
0
-10
5%
7%
- 20
- 30
- 40
- 50
46%
- 60
Conventional Care n = 184
Cinacalcet n = 368
12%
Mean (SE)
iPTH
over time
Cinacalcet
Conventional Care
500
target
400
300
----- = KDOQUI
Mean (SE) iPTH ( pg / ml )
600
200
0
B
1
3
5
7
9
11
13
15
17
19
21
23
Conventional Care n = 184
n = 146
Cinacalcet n = 368
n = 285
Mean Ca x P
over time
Cinacalcet
Conventional Care
target
50
----- = KDOQUI
Mean (SE) Ca x P (mg 2/ dl 2 )
55
45
0
B
1
3
5
7
9
11
13
15
17
19
21
23
Conventional Care n = 182
n = 148
Cinacalcet n = 360
n = 282
TRATTAMENTO dei FATTORI di RISCHIO
A) CONTROLLO IPERTENSIONE
mantenere PA <130/80 mmHg
ACE inibitori e/o inibitori AT1
B) CONTROLLO GLICEMICO
•
HbA1c, microalbuminuria
C) PATOLOGIE CARDIOVASCOLARI
D) EVITARE SOSTANZE NEFROTOSSICHE
E) CONSULENZA DIETETICA E OBESITA’
TRATTAMENTO dei FATTORI di RISCHIO
A) CONTROLLO IPERTENSIONE
mantenere PA <130/80 mmHg
ACE inibitori e/o inibitori AT1
B) CONTROLLO GLICEMICO
•
HbA1c, microalbuminuria
C) PATOLOGIE CARDIOVASCOLARI
D) EVITARE SOSTANZE NEFROTOSSICHE
E) CONSULENZA DIETETICA E OBESITA’
EFFETTI dell’IPERGLICEMIA sulla
PROGRESSIONE dell’INSUFFICIENZA RENALE
Iperglicemia
Normoglicemia
TGF- mRNA
Ipertensione
Cellule
mesangiali
Restrizione Proteica
Antipertensivi
Produzione
Collagene
(tipo IV,V)
Anticorpi anti-TGF-
Restrizione Proteica
Antipertensivi
GLOMERULO
- SCLEROSI
Ricerca Microalbuminuria
POSITIVA?
SI
Presenti
fattori
confondenti?
NO
FATTORI CONFONDENTI:
- sforzo fisico intenso
- ortostasi prolungata
Ripetere
entro 1 anno
- stati febbrili
- ipertensione arteriosa pronunciata
- scompenso cardiaco
- infezioni delle vie urinarie
Ricerca Microalbuminuria
POSITIVA?
SI
Presenti
fattori
confondenti?
NO
SI
NO
NO
Ripetere
entro 1 anno
Trattare e/o attendere finchè non
risolti.
Ripetere il test.
SI
POSITIVO?
NO
Ripetere il test altre
due volte nell’arco
di 3-6 mesi
2 tests su 3 positivi?
SI
AVVIARE TRATTAMENTO
Diabetes Care (2004)
Aliskiren Combined with Losartan
in Type 2 Diabetes and Nephropaty
301 pz
+ Aliskiren 300 mg /die
+ Aliskiren 150 mg /die
Losartan 300 mg/die
Arruolati
599 pz
Losartan 300 mg/die
Losartan 300 mg/die
+ Placebo
Run - in
-12
298 pz
0
2
4
6
8
10
12
14
16
18
20
22
24
Week
H. H. Parving et Al. N .Engl J Med 358; 23. 2008
Aliskiren Combined with Losartan
10
Albumin-to-Creatinine Ratio (%)
Geometric Mean Change in Urinary
in Type 2 Diabetes and Nephropaty
Placebo
0
-10
Aliskiren
-20
-30
-2
0
2
4
6
8
10
12
14
16
18
20
22
24
Week
H. H. Parving et Al. N .Engl J Med 358; 23. 2008
Aliskiren Combined with Losartan
10
Placebo
Albumin Excretion Rate (%)
Geometric Mean Change in Urinary
in Type 2 Diabetes and Nephropaty
0
-10
Aliskiren
-20
-30
-2
0
2
4
6
8
10
12
14
16
18
20
22
24
Week
H. H. Parving et Al. N .Engl J Med 358; 23. 2008
TRATTAMENTO dei FATTORI di RISCHIO
A) CONTROLLO IPERTENSIONE
mantenere PA <130/80 mmHg
ACE inibitori e/o inibitori AT1
B) CONTROLLO GLICEMICO
•
HbA1c, microalbuminuria
C) PATOLOGIE CARDIOVASCOLARI
D) EVITARE SOSTANZE NEFROTOSSICHE
E) CONSULENZA DIETETICA E OBESITA’
STADI MALATTIA RENALE e
CARDIOVASCOLARE
Insuff. Renale
cronica terminale
Insuff. Renale
Stadio Scompenso cardiaco
finale
Progressione
Cronica (FG)
Albuminuria
Proteinuria
Anziano, obesità
Diabete Mellito,
Press. Arter.
Malattia Renale Cronica
Eventi malattia
cardiovascolare
(MCV)
MC
Inizio
Insuff. Ventricolare sx
“A rischio”
Anziano, obesità
Diabete Mellito,
Press. Arter.
Malattia Cardiovascolare
Sarnak MJ & Levey AS, Am J Kidney Dis, 2000
Il rischio della malattia renale cronica va ben al di là del rene
Rischio Relativo
3.4
4
2.8
3
2
2
1.4
1
0
No
lieve/moderata moderata/severa severa
insufficienza renale
avanzata
Why Do CKD Patients Need Special Care?
CKD “Death Before Dialysis” is Prominent
Early recognition of CKD risk and early intervention for CKD can prevent early death before
dialysis
CKD patients in a large HMO were more likely to die than reach Renal Replacement Therapy
Lost to
Follow Up
CKD Patients In Large Health Plan
100 %
73.5%
0%
11.2%
Stable
CKD
Stable
CKD
64.2%
17.6%
Death
Death
27.8%
Dialysis
45.7%
24.3%
55
Stage 2
Stage 3
Stage 4
Emoglobina e GFR
Astor BC et al, Arch Intern Med 162:1401-1408, 2002
Differentiation and morphologic
maturation of erythroid cells
Erytroid Burst
Erytroid Colony
Forming Unit (BFUe)
Forming Unit (CFUe)
Normoblasts
Red Cell
Reticulocyte
Pluripotent
Stem cell
Proerythroblast
Hemoglobin
mRNA
Neutrophils
Monocytes
Megakaryocytes
Lymphocytes
Erythropoietin
Accumulation
Responsivene
s
Globin mRNA
Accumulation
21 giorni
3-4 giorni
1-2 giorni
Palmer SC et al, Ann Intern Med. 2010;153:23-33.
Palmer SC et al, Ann Intern Med. 2010;153:23-33.
Palmer SC et al, Ann Intern Med. 2010;153:23-33.
Palmer SC et al, Ann Intern Med. 2010;153:23-33.
Conclusioni
“… le prescrizioni e i trattamenti
devono essere ispirati ad
aggiornate e sperimentate
acquisizioni scientifiche, tenuto
conto dell’uso appropriato delle
risorse, sempre perseguendo il
beneficio del paziente secondo
criteri di equità …”
Codice di Deontologia Medica, Cap. IV, Art. 13
Cos‘è un Biosimilare o Follow-on
Biologic?
Un farmaco biosimilare è il successore di un
farmaco biologico che non ha più una
copertura brevettuale
È prodotto secondo la tecnologia del DNA
ricombinante (inclusione di un gene in una
cellula ospite al fine di produrre una
determinata proteina)
È confrontabile con il farmaco biologico di
riferimento o farmaco generatore in termini
di qualità, sicurezza ed efficacia
Non un semplice generico per la sua complessità: dimensione,
struttura molecolare e produzione
Il termine Biosimilare è un termine regolatorio deciso da EMA che descrive un
farmaco biologico approvato attraverso un processo predeterminato in grado
di dimostrare la confrontabilità.
Biosimilari e generici: quale è la
differenza?
Generici
Massa
Molecolare
Produzione
Non-clinica
Approx. fino a 5 kDa
Sintesi Chimica
Fermentazione
microbiologica semplice
Standard analitici
n/a
Studi di Bioequivalenza
Clinica
relativi all’assorbimento
Biosimilari
Tra 5kDa e 500 kDa
Linee cellulari geneticamente
modificate
Processo di fermentazione
complesso, purificazione, procedure
analitiche complesse
Studi in vitro e in vivo
Studi di tossicità
Studi di tollerabilità locale
Studi di Bioequivalenza per
assorbimento ed eliminazione
Studi di Fase III
Studi di Fase IIIb / IV
Studi di sorveglianza post-marketing
a lungo termine nei registri
Piano di Gestione del Richio (Risk
management plan)
Lo sviluppo di un Biosimilare è più simile a
quello di un originatore che non a quello di
un generico
Generics*
US$ 2 – 3m
Biosimilars*
US$ 100 - 150m
Originators*
US$ 800m
Development
Investment
2 – 3 yrs
7 – 8 yrs
8 – 10 yrs
Time to market
20 – 50 pts
# of patients for
approval
*Industry average
~ 500 pts
800 – 1000 pts
L’EMA ha sviluppato un attento processo regolatorio per
la registrazione dei farmaci Biosimilari
L’Europa possiede una solida struttura regolatoria e dettagliate Linee Guida
per quanto concerne i farmaci Biosimilari
Pharma
Review
2001
Directive 2003/63/EC
“Annex I” published:
recognition of ‘biosimilars’
Directive 2004/27/EC
as amended
published
Directive
2004/27/EC
takes effect
Legal
progress
2001
2002
2003
2004
EMEA’s biosimilar ‘quality issues’
and ‘non-clinical and clinical
issues’ draft guidelines published
EMEA’s
revised
‘comparability’
guidelines
published
EMEA
releases
biosimilar
‘concept
papers’
2005
2006
EMEA ’s productspecific draft
guidelines released
for hGH, insulin,
EPO and G- CSF.
First
biosimilar
approved
EMEA
workshop
Regulatory
progress
2001
2002
2003
2004
2005
2006
INJ-9: equivalenza terapeutica di
Binocrit® ed Eprex® dimostrata
I livelli medi di Hb erano stabili durante il periodo di trattamento in entrambi i gruppi. Il range del
valore di Hb era 11.6–11.9 g/dl nel gruppo Binocrit e 11.7–12.1 g/dl nel gruppo Eprex
Time course of Hb levels (mean ± SD)
(PP population)
14
12
10
8
Hb (g/dL)
6
4
Binocrit® (n=207)
Eprex® (n=118)
2
0
2
4
6
8
10
12
14
16
18
20
22
24
26
28
Main study period – duration (weeks)
Haag-Weber M et al. Clin Nephrol 2009; 72: 380–90
BIOSIMILARI IN COMMERCIO IN ITALIA
AL 31-05-2009
PRONTUARIO TERAPEUTICO REGIONALE
INDICAZIONE AI BIOSIMILARI
“Considerato che il potenziale immunogenico dei prodotti biosimilari di tutti
i farmaci biotecnologici di nuova immissione in commercio, non è
identico tra prodotto originatore e il prodotto biosimilare, si
raccomanda che:
1.
Sia esclusiva responsabilità del medico la scelta del farmaco biologico
da utilizzare (originatore e biosimilare), così come lo switching per i
pazienti già in trattamento con uno specifico biologico verso un
biosimilare;
2.
Sia garantita la tracciabilità post-marketing evitando la sostituibilità
automatica della prescrizione ai fini della farmaco-vigilanza;
Sia sotto la diretta responsabilità del medico prescrittore, il
monitoraggio intensivo sia per quanto riguarda l’efficacia clinica che la
3.
PRONTUARIO OSPEDALE–TERRITORIO (PHT)
Principio attivo
Denominazione
Confezione
Prezzo attuale
Prezzo dal 3/11
Epoetina alfa
EPREX
6.000 UI/0.6
mL
52,80 €
42,96 €
Epoetina beta
NEORECORMO
N
4.000 UI/0.3
mL
32,10 €
26,80 €
Darboepoetina
alfa
ARANESP
40 mcg/0.4 mL
78,80 €
67,20 €
MPEG-epoetina
beta
MIRCERA
200 mcg/0.3
mL
372,00 €
338,00 €
Epoetina alfa
ABSEAMED
6.000 UI/0.6
mL
21,60 €
Epoetina alfa
BINOCRIT
6.000 UI/0.6
mL
22,80 €
Un accordo quadro tra Regione Calabria ed Aziende Farmaceutiche prevede dal 3
novembre la distribuzione direttamente nelle Farmacie private convenzionate ai prezzi
sopra indicati.