Il cloro è un gas giallo
verdognolo composto da due
atomi di Cl, legati insieme quindi
Cl2.
Il cloro si trova nella parte destra della tavola periodica
nel gruppo degli alogeni , che alcuni chiamano il
settimo altri il diciasettesimo . In pratica significa che il
Cloro desidera un altro elettrone per raggiungere la
configurazione di gas nobile.
CENNI STORICI DEL CLORO
1774
Carl Wilhelm
Scheele
1810
Humphry Davy
Il cloro reagisce con l’acqua
producendo un
acido, HCl, acido
cloridrico.
MINERALI COMUNI DI CLORO
Halite
(cloruro
di sodio)
Silvite
(cloruro
di
potassio)
Carnallite
(cloruro
esaidrato
di potassio
e
magnesio)
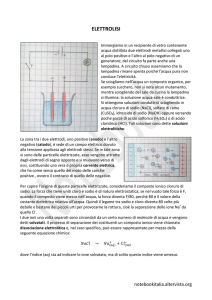
Industrialmente, il cloro elementare è prodotto solitamente per
elettrolisi di cloruro di sodio sciolto in acqua. Insieme al cloro, il
processo genera anche idrogeno e idrossido di sodio, secondo
l'equazione chimica
2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOH
IL CLORO REAGISCE CON TUTTI I TIPI DI METALLO
Sodio
metallico
Alluminio
Sale
Cloruro di
sodio
Cloruro di
Alluminio
Ferro
Cloruro
ferrico
UTILIZZI DEL CLORO
• Nella depurazione dell’acqua
• Nei disinfettanti, come sbiancante
• Nella fabbricazione di molti oggetti di uso quotidiano, come carta,
antisettici, tinture, alimenti, insetticidi, vernici, prodotti petroliferi,
plastica, medicinali, tessuti, solventi.
• Si usa come battericida (acido ipocloroso HClO, ipoclorito di sodio
NaClO, clorito di sodio NaClO2) nell'acqua potabile e nelle piscine.
• Il cloro può assumere gli stati di ossidazione −1, +1,
+3, +5, o +7 corrispondenti agli anioni Cl− (cloruro),
ClO− (ipoclorito), ClO2− (clorito), ClO3− (clorato), o
ClO4− (perclorato).
numero di ossidazione −1
+1
+3
+5
+7
anione
cloruro ipoclorito clorito clorato perclorato
formula
Cl−
struttura
ClO−
ClO2−
ClO3−
ClO4−
COMPOSTI UTILIZZATI DEL CLORO
Campo inorganico
•
•
•
•
cloruri
ipocloriti
clorati
perclorati
Campo organico
• cloramine
• alogenuri
organici
EFFETTI SULLA SALUTE
Irrita il sistema
respiratorio ,
soprattutto in bambini
e anziani
Stato gassoso
Stato liquido
Provoca
ustioni
cutanee
IN AMBIENTE
DOMESTICO
Si sviluppa con l’ipoclorito di sodio
(candeggina) + acido muriatico
Per contatto tra candeggina ed urina(urea),
ammoniaca o altri prodotti sbiancanti possono
svilupparsi vapori tossici contenenti gas cloro o
tricloruro di azoto.
Irrita le
mucose
DISASTRO DI SEVESO
avvenuto il 10 luglio 1976 nell'azienda ICMESA di Meda, che provocò la
fuoriuscita di una nube di diossina del tipo TCDD (tetraclorodibenzo-pdiossina) , una tra le sostanze tossiche più pericolose.
Non vi furono morti, ma circa 240 persone vennero colpite da
cloracne, una dermatosi provocata dall'esposizione al cloro e ai suoi
derivati, che crea lesioni e cisti sebacee.
Un composto
eterociclico è
una molecola
ciclica nella
quale uno o più
atomi dell'anello
sono eteroatomi,
cioè atomi diversi
dal carbonio.
LA DIOSSINA
composto organico eterociclico la cui struttura
consta di un anello con quattro atomi di carbonio,
insaturi, e due di ossigeno di formula bruta
C4H4O2.
corrisponde in realtà ad oltre 200 sostanze
diverse, 17 delle quali altamente tossiche per
l'uomo. La più pericolosa è il
tetraclorodibenzo-p-diossina (Tcdd), la
cosiddetta diossina Seveso.
La diossina è contenuta in moltissimi prodotti di uso comune:
• oli isolanti
• additivi antimuffa
• vernici e impregnanti per il
legno
Effetti della diossina:
•
•
•
•
•
lesioni della pelle
calo della fertilità
tumori
ritardo della crescita
capacità di indurre malformazioni genetiche
fetali