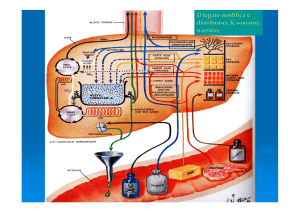
28/04/15 Nelle lezioni che seguono esamineremo l’azione degli ormoni secreti dal
pancreas e dalla ghiandole surrenali perché svolgono i ruoli principali nella
regolazione dei combustibili nei diversi tessuti dei mammiferi. Esamineremo i
recettori e le vie tramite i quali gli ormoni esercitano i loro effetti sulle cellule.
L’integrazione del metabolismo energetico è controllata principalmente dall’azione di tre
ormoni insulina e glucagone e adrenalina.
I livelli circolanti di questi ormoni permettono all’organismo di accumulare energia quando
l’apporto alimentare è abbondante per adoperarla nei momenti critici per la sopravvivenza :
scarsa alimentazione o situazioni “combatti o fuggi”
Il pancreas risponde agli aumenti di
concentrazione di glucosio nel sangue
secernendo un ormone
Segnale di abbondanza di
carburante metabolico
Le cellule β del pancreas sono sensibili a
concentrazioni di glucosio da 5,5 a 6 mM
(variazione glucosio nel sangue 3,6 – 5,8
mM). Il segnale di secrezione dell’insulina è
generato dal metabolismo del glucosio da
parte delle cellule β
1 28/04/15 Quando la concentrazione del glucosio nel
sangue aumenta il trasportatore GLUT2 lo
convoglia all’interno della cellula β del
pancreas dove viene convertito a glucosio 6fosfato dalla glucochinasi per entrare nel
processo glicolitico.
La via catabolica del glucosio, lineare e
unica, connette direttamente la velocità di
fosforilazione ossidativa delle cellule alla
quantità di glucosio disponibile
1. Le cellule β sono i sensori del glucosio più
importanti dell’organismo (glucochinasi)
2. Gli amminoacidi (soprattutto un alto livello
plasmatico plasmatico di arginina)
3. Ormoni gastrointestinali (SECRETINA)
determinano un aumento anticipato del
livello di insulina
4. Inibizione della secrezione d’insulina nei
periodi di stress (febbre o infezione) è
mediata dall’adrenalina secreta dalla
midollare del surrene
2 28/04/15 L’insulina è sintetizzata come
PREPROINSULINA diventa PROINSULINA con
la perdita di un fattore segnale ed infine
INSULINA con la perdita del peptide C.
L’insulina è conservata in granuli citoplasmatici
che si liberano per esocitosi in seguito ad uno
stimolo appropriato
L’insulina è degradata nel fegato dall’enzima
INSULINASI
E inibisce la produzione di glucosio da parte del FEGATO. L’insulina stimola inoltre la crescita e il
differenziamento cellulare aumentando la sintesi del glicogeno, proteine e triacilgliceroli.
Le cellule muscolari e gli adipociti possiedono un
trasportatore insulino-dipendente il GLUT4.
L’aumento di trasporto da parte della GLUT4 è
determinato dall’aumento dei trasportatori sulla membrana
cellulare.
In assenza di insulina i trasportatori si trovano su vescicole
intracellulari: VESCICOLE DI STOCCAGGIO DELLA
GLUT4. l’insulina favorisce la fusione delle vescicole con
la membrana citoplasmatica tramite un processo mediato
dalla proteina SNARE.
3 28/04/15 Quando l’apporto di insulina si interrompe,
i trasportatori sono sequestrati tramite
endocitosi.
Il cervello che usa quasi esclusivamente
glucosio come fonte di energia, non è
sottoposto alle variazioni di concentrazione di
glucosio nel sangue (GLUT1: Km 0,1 mM).
Anche il fegato è privo di GLUT4 e non
risponde all’insulina, la velocità di
assorbimento del glucosio aumenta
all’aumentare del substrato
EFFETTI ORMONALI SUL METABOLISMO ENERGETICO
Il glucosio nel muscolo viene usato per sintetizzare glicogeno
Negli adipociti è usato per sintetizzare i triacilgliceroli ( glicerolo e acetil-CoA per gli acidi grassi da
esterificare)
Negli adipociti l’insulina inibisce la lipolisi, inibendo la lipasi ormone dipendente.
Nel fegato l’insulina inattiva la fosforilasi chinasi inattivando la glicogenolisi
Nello stesso tempo attiva la glicogeno sintasi attivando la sintesi di glicogeno
L’insulina inibisce la trascrizione di geni che codificano per : fosfoenolpiruvato carbossichinasi, la fruttosio
1,6-bisfosfatasi e la glucosio 6 fosfatasi mentre stimola la trascrizione di geni che codificano per gli enzimi
glicolitici glucochinasi e piruvato chinasi
4 28/04/15 EFFETTI ORMONALI SUL METABOLISMO ENERGETICO
Muscolo
Tessuto adiposo
Fegato
assorbimento di glucosio
sintesi del glicogeno
assorbimento di glucosio
lipogenesi
lipolisi
sintesi di glicogeno
lipogenesi
gluconeogenesi
attivato
attivato
attivato
attivato
inibito
attivato
attivato
inibito
Ormone peptidico secreto
dalle cellule α dell’isole di
Langerhans
Unica catena polipeptidica costituita da 29 amminoacidi
sintetizzato come precursore più grande e poi diminuito
attraverso proteolisi selettive
La stimolazione del glucagone avviene per:
1. Basso livello ematico di glucosio
2. Amminoacidi di un pasto ricco in proteine stimolano la
secrezione
3. L’adrenalina stimola la secrezione
5 28/04/15 Glicogenolisi nel fegato per rendere disponibile glucosio ad altri
tessuti quando la concentrazione di glucosio scende rapidamente.
Mobilizzazione degli acidi grassi dal tessuto adiposo, attivando la
lipasi ormone sensibile.
Le catecolammine (adrenalina e noradrenalina) determinano risposte simili a quelle del glucagone ma
sono rilasciate dal SURRENE in condizioni di stress.
Questi ormoni si legano a recettori differenti: β ed α-adrenergici, il primo collegato al sistema adenilato
ciclasi, il secondo all’inositolo 1,4,5-trifosfato che causa un aumento della concentrazione intracellulare
di calcio.
L’adrenalina favorisce il rilascio di glucagone dal pancreas.
Nel FEGATO si lega l’adrenalina ma anche il glucagone determinando la glicogenolisi e il glucagone la
gluconeogenesi. Abbiamo inoltre l’aumento di concentrazione di calcio che rafforza la risposta al
cAMP.
6 28/04/15 Nel muscolo l’adrenalina lega il recettore β-adrenergico favorendo la glicogenolisi.
Nel tessuto adiposo l’adrenalina si lega a i due diversi recettori determinando l’attivazione della lipasi
ormone sensibile.
L’adrenalina stimola inoltre il rilassamento della muscolatura liscia dei bronchi e dei vasi sanguigni che
riforniscono il muscolo scheletrico e la costrizione di vasi sanguigni di altri organi periferici.
Mobilizzazione delle riserve energetiche e loro trasporto nelle sedi in cui sono maggiormente richieste
per preparare il corpo ad entrare velocemente in azione.
7 28/04/15 I complessi meccanismi che regolano il metabolismo delle sostanze combustibili nei mammiferi
permettono al corpo di rispondere adeguatamente alle necessità di cambiamento energetico
mantenendo una equilibrata omeostasi metabolica.
Tutte le vie metaboliche sono legate alle necessità di ATP cellulare e rispondono al rapporto
AMP/ATP. Alcuni enzimi sono attivati o inibiti dall’AMP altri sono fosforilati dalla proteina chinasi
AMP-dipendente (AMPK).
Proteina eterotrimerica costituita dalle subunità α,β e γ. La subunità α contiene il dominio
chinasico mentre la γ contiene i siti di attivazione allosterica: AMP per l’attivazione, ATP per
l’inibizione.
L’AMPK attiva le vie cataboliche inibendo contemporaneamente le vie anaboliche.
La AMPK attiva la glicolisi nel muscolo
cardiaco ischemico attraverso
l’attivazione (fosforilazione) dell’isoforma
inducibile del enzima bifunzionale
PFK-2/FBPasi-2 che controlla la
concentrazione di F-2-P.
La fosforilazione dell’enzima
Attiva la PFK-2 attivando la glicolisi.
Inibisce la lipogenesi e la gluconeogenesi nel fegato attraverso l’inibizione di alcuni enzimi quali l’
acetil CoA carbossilasi, la glicogenosintasi e idrossimetilglutaril-CoA reduttasi (sintesi dl colesterolo)
Nel muscolo scheletrico promuove l’ossidazione degli acidi grassi attraverso l’inibizione dell’acetil CoA
carbossilasi che provoca una diminuzione di malonil-CoA e quindi una de-inibizione del trasporto
dell’acil-CoA nei mitocondri.
8 28/04/15 Negli adipociti fosforila la triacilglicerolo lipasi
ormone sensibile impedendo la demolizione ad
acidi grassi. Effetto paradossale che si pensa
possa servire per impedire la produzione di alti
livelli intracellulari tossici per la cellula.
Sembra inoltre che l’enzima stimoli nell’ipotalamo
i centri della fame.
E nel pancreas un aumento di secrezione di
insulina
L’AMPK è il "sensore energetico" della cellula: legge i livelli di AMP presenti nella cellula e, quando
sono bassi, lancia l'allarme per ripristinarli.
Il tessuto adiposo è anche un importante organo endocrino che produce ormoni peptidici, noti
come ADIPOCHINE che possono avere azione autocrina, paracrina ed endocrina.
Provocano modificazioni del nel metabolismo energetico e nel comportamento alimentare per
ristabilire un adeguata riserva energetica e mantenere il costante peso corporeo.
9 28/04/15 L’ADIPONECTINA secreta esclusivamente dagli
adipociti partecipa alla regolazione dell’omeostasi
energetica e del metabolismo del glucosio e dei lipidi
controllando l’AMPK.
I recettori dell’adiponectina presenti soprattutto su i
miociti e gli epatociti incrementano la fosforilazione e
l’attività dell’AMPK.
Vengono attivati tutte quelle vie cataboliche che fanno
capo all’insulina.
Paradossalmente
la concentrazione sanguina di adiponectina diminuisce quando il
tessuto adiposo aumenta. L’aumento del il tessuto adiposo è
associato ad un fattore “fattore di necrosi tumorale α” che pare faccia
diminuire l’espressione e la secrezione di adiponectina.
Un altro ormone sintetizzato e rilasciato dalle cellule adipose è la
LEPTINA.
È stata scoperta studiando topi omozigoti per difetti nel gene obese
(ob/ob) sono caratterizzati da un peso superiore rispetto a quelli
normali( gene OB/OB) e che si nutrono in eccesso quando viene
fornito loro cibo a volontà.
Il gene OB/OB
codifica per la
LEPTINA.
Quando si inietta la leptina nei topi ob/ob ,
mangiano meno e perdono peso.
La leptina è considerata il segnale della
sazietà”
10 28/04/15 Poiché gli animali non mangiano continuamente la disponibilità dei carburanti energetici e la
mobilizzazione delle riserve cambia in modo drastico nelle poche ore che trascorrono tra un
pasto e l’altro. L’animale superiore può comunque resistere a digiuni prolungati cambiando e
regolando il suo metabolismo energetico.
I carburanti introdotti con la dieta sono distribuiti immediatamente a tutto l’organismo.
Amminoacidi e zuccheri attraverso la vena porta vanno direttamente al fegato, grassi attraverso
i chilomicroni più tardi.
FASE DI ASSORBIMENTO due quattro ore successive ad
un pasto
a. Aumento glucosio ematico, a.a. Ed trigliceridi
b. Aumento secrezione insulina diminuzione glucagone
c. Aumento sintesi del glicogeno, proteine e trigliceridi
d. Tutti i tessuti utilizzano glucosio come fonte energetica.
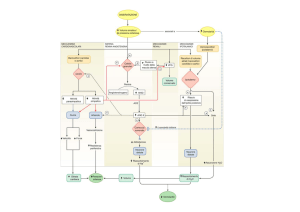
IL FLUSSO DELLE VIE METABOLICHE E’ CONTROLLATO:
a. Disponibilità di substrati
b. Attivazione o inibizione allostrerica di enzimi
c. Modificazioni covalenti di enzimi
d. Induzione o repressione della sintesi di enzimi
Ciascun meccanismo opera secondo una scala temporale
diversa
11 28/04/15 METABOLISMO DEI CARBOIDRATI ( il 60% dello zucchero presente nel sistema portale è
utilizzato dal fegato)
1. Aumento della fosforilazione del glucosio
2. Aumento della sintesi del glicogeno
3. Aumento dell’attività dell’esoso monofosfato (utilizzazione NADPH per la sintesi di
colesterolo e acidi grassi) (il 5-10% del glucosio)
4. Aumento della glicolisi stimolata dall’insulina ( formazione di acetil-CoA soprattutto per le
sintesi dei grassi)
5. Diminuzione della gluconeogenesi
METABOLISMO DEI GRASSI
1. Aumento della sintesi degli acidi grassi
favorita dalla disponibilità di substrati
(NADPH, Acetil-CoA, ATP) e dall’attivazione
dell’acetil carbossilasi
2. Aumento della sintesi dei triacilgliceroli e
formazione di VLDL per l’esportazione ai
tessuti extraepatici
METABOLISMO DEGLI AMMINOACIDI
1. Aumento della degradazione degli amminoacidi. Quando la quantità di proteine ingerite è
maggiore di quella necessaria per le proteine di nuova sintesi , gli a.a. eccedenti sono
trasformati in acetil-CoA o intermedi del ciclo di Krebs per la catalisi.
2. Aumento della sintesi proteica. Aumento transitorio proteine di nuova sintesi vanno a
sostituire quelle degradate nel periodo precedente.
12 28/04/15 METABOLISMO DEI CARBOIDRATI
1. Aumento del trasporto del glucosio determinato da un aumento della
presenza ematica di insulina
2. Aumento della velocità della glicolisi (fornisce glicerolo per la sintesi
dei trigliceridi)
3. Aumento dell’attività della via dell’esoso monofosfato (HMP). NADPH
per la sintesi dei trigliceridi anche se nel tessuto adiposo non è una
fonte di primaria importanza.
METABOLISMO DEI GRASSI
1. Aumento della sintesi degli acidi grassi molto limitata al contrario la
maggior parte degli acidi grassi deriva dalla dieta (chilomicroni) e in
quantità più piccola dalle VLDL dal fegato
2. Aumento della sintesi dei triacilgliceroli da acidi grassi: vedi sopra per
il glicerolo, poiché gli adipociti non contengono glicerolo chinasi, deriva
dal metabolismo del glucosio.
3.Diminuzione della degradazione dei triacilgliceroli. L’insulina determina la defosforilazione della lipasi
ormone sensibile inattivandola.
Gli effetti antagonisti di insulina e glucagone, che rispondono entrambi alla variazione di
concentrazione di glucosio nel sangue, assicurano che la quantità di glucosio disponibile per i
tessuti rimanga relativamente costante
Poiché la quantità di glicogeno conservato è quasi sufficiente per 24 ore, passato questo periodo
la diminuzione di insulina e l’aumento di glucagone determinano:
1. la mobilizzazione di acidi grassi dal tessuto adiposo.
2. Inibizione dell’assunzione di glucosio da parte del tessuto muscolare
13 28/04/15 METABOLISMO DEI CARBOIDRATI
Aumenta la velocità della gluconeogenesi. La gluconeogenesi comincia da quattro a sei ore dopo
un pasto e raggiunge la massima attività quando le scorte di glicogeno sono esaurite. Importante sia
nel digiuno notturno che nel digiuno prolungato.
Dopo 40 ore di digiuno la gluconeogenesi produce il 96% del glucosio epatico.
Il glucosio deriva dal glicerolo prodotto dalla demolizione dei trigliceridi, in misura maggiore dalla
degradazione delle proteine che provengono soprattutto dal muscolo
METABOLISMO DEI LIPIDI
Il primo evento durante il digiuno è l’aumento dell’ossidazione degli acidi grassi che diventa la fonte
principale di energia per il fegato
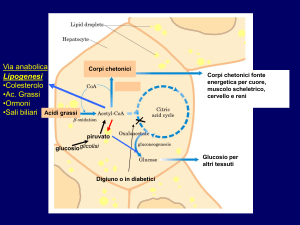
Dopo alcuni giorni di digiuno il fegato invia la produzione di acetil-CoA verso la sintesi dei corpi
chetonici. Dopo 3 giorni di digiuno solo 1/3 dell’energie metaboliche del cervello sono soddisfatte dai
corpi chetonici, ma dopo 40 giorni questa percentuale sale fino al 70%.
Durante il digiuno prolungato la velocità di degradazione del tessuto muscolare diminuisce fino al
25% del valore che aveva dopo alcuni giorni di digiuno.
14 28/04/15 Tessuto adiposo durante il digiuno
METABOLISMO DEI CARBOIDRATI
Il trasporto di glucosio nelle cellule e il conseguente
catabolismo è depresso a causa del basso livello di
insulina ematica.
METABOLISMO DEI GRASSI
1. Aumento della degradazione dei triacilgliceroli, dovuta all’attività dell’adrenalina ma soprattutto della
noradreanalina liberate dalle terminazioni simpatiche.
2. Aumento della liberazione degli acidi grassi che sono rilasciati e trasportati grazie all’albumina
3. Diminuzione dell’assunzione degli acidi grassi
15 28/04/15 Il muscolo scheletrico a riposo durante il digiuno
METABOLISMO DEI CARBOIDRATI
Il trasporto e il metabolismo dello zucchero sono
depressi
METABOLISMO DEI LIPIDI
Durante le prime due settimane il muscolo utilizza lipidi
e corpi chetonici come combustibile. Dopo tre settimane
diminuisce l’utilizzo di corpi chetonici a favore dei grassi.
METABOLISMO DELLE PROTEINE
Durante i primi giorni di digiuno abbiamo una rapida demolizione delle proteine per fornisce al fegato a.a.
da utilizzare per formare glucosio. Dopo varie settimane la demolizione si riduce per una minore necessità
di glucosio, da parte del fegato, perché l’encefalo comincia ad adoperare i corpi chetonici
16 28/04/15 Nella malattia DIABETE MELLITO l’insulina non è secreta in quantità sufficienti o non stimola
in modo sufficiente le sue cellule bersaglio.
Le cellule del fegato non ricevendo informazioni
dall’insulina si comportano come se il glucosio
ematico fosse diminuito, come nel digiuno, e
producono e riversano glucosio nel sangue.
Sebbene nel sangue ci siano alti livelli di
glucosio le cellule “muoiono di fame” perché
l’ingresso di glucosio nelle cellule indotto
dall’insulina è alterato.
Il glucosio viene riversato nelle urine.
Aumentano i corpi chetonici nel sangue, CHETOSI, e poiché sono acidi la loro elevata concentrazione
tende a consumare il sistema tampone del sangue e nei reni, che controllano il pH con l’escrezione di
H+ in eccesso.
Esistono due principali forme di diabete mellito:
1. Diabete mellito insulino dipendente (giovani)
2. Il diabete mellito insulino indipendente (anziani)
Il primo è causato da carenza di cellule β del pancreas
L’iperglicemia indotta dal diabete può causare cecità per glicosilazione
delle proteine del cristallino che causa la cataratta
Il secondo può essere causato da una carenza di recettori per
l’insulina o da disfunzioni nella trasduzione del segnale indotte
dall’insulina.
17