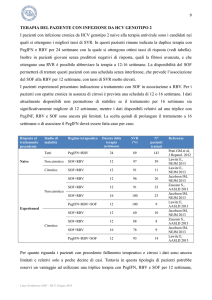
22 EFFETTI COLLATERALI IN CORSO DI TERAPIA ANTIVIRALE
Nel corso di terapia con PegIFN+RBV+PI (TVR o BOC) gli effetti collaterali più comunemente
segnalati sono prurito, rush, anemia, disturbi dell’apparato gastrointestinale (nausea e diarrea) e
disturbi anorettali (prurito/bruciore anale ed emorroidi). Il counseling prima dell’inizio della cura e
la gestione precoce di tali effetti collaterali, riducono la probabilità di interruzione del trattamento
(che in alcune casistiche, specie nei pazienti cirrotici è superiore al 13%).
La probabilità di insorgenza di questi effetti collaterali aumenta nel paziente con cirrosi e/o di età
avanzata. Nel paziente cirrotico, particolare attenzione va posta al rischio infettivologico e a quello
di scompenso funzionale della cirrosi. Pertanto il paziente cirrotico trattato con triplice terapia deve
essere sottoposto a più stretta sorveglianza clinica per il pronto riconoscimento degli effetti
collaterali e la loro tempestiva gestione ed in stretta collaborazione con un Centro Trapianti.
Lo studio CUPIC ha evidenziato come la presenza contemporanea di una conta piastrinica
<100000/mm3 e un valore plasmatico di albumina <3.5 gr/l nei pazienti con cirrosi trattati con
triplice terapia (PegIFN+RBV+BOC o TVR) si associ ad una elevatissima probabilità di sviluppo di
eventi avversi gravi (ed una riduzione di efficacia), tali da sconsigliare questa tipologia di
trattamento.
Nei pazienti sottoposti a trapianto epatico, la prevalenza di leuco e piastrinopenia è nettamente
superiore rispetto a quanto riscontrato nei pazienti immuno-competenti e rappresenta la causa
principale di riduzione del dosaggio dei farmaci o della loro interruzione. Un ulteriore effetto
collaterale della triplice terapia in questa tipologia di pazienti è rappresentato dalla profonda
interazione sia di BOC che di TVR con gli inibitori della calcineurina utilizzati nella terapia
immunosoppressiva post trapianto quali ciclosporina e tacrolimus. In particolare, il TVR è in grado
di aumentare le concentrazioni plasmatiche rispettivamente della ciclosporina e del tacrolimus di 4
e 30 volte mentre il BOC le aumenta rispettivamente di 2 e 8 volte.
Le manifestazioni cutanee (tipiche ma non esclusive della terapia con TVR), descritte anche nei
pazienti trattati con duplice terapia (PegIFN+RBV) mostrano una frequenza (50%) ed una gravità
maggiore. Nei casi di eruzioni cutanee progressive o gravi (<3%), si raccomanda l'interruzione del
TVR, che una volta sospeso non può più essere re-introdotto. E' importante inoltre riconoscere e
fare diagnosi precoce di DRESS e di sindrome di Stevens‐Johnson, in quanto in tali condizioni tutti
i trattamenti devono essere tempestivamente sospesi. Per la gestione di questo effetto collaterale, si
rimanda alle Indicazioni dell’Associazione Italiana per lo Studio del Fegato (AISF) sull’uso
della triplice terapia (2013).
L’anemia nei pazienti trattati con PegINF + RBV è un effetto collaterale abbastanza frequente che
però aumenta in maniera significativa nei pazienti trattati con triplice terapia (PegIFN+RBV+TVR
Linee di indirizzo AISF – HCV, Giugno 2014
23 o BOC). Nel paziente cirrotico un calo emoglobinico significativo si osserva in una percentuale
molto alta di soggetti (>50%) e può essere repentino. Durante il trattamento è necessario pertanto,
in tutti i pazienti, un attento e ravvicinato monitoraggio dell’emocromo in ragione dell’aumentato
rischio di anemia severa. Per la gestione di questo effetto collaterale, si rimanda alle Indicazioni
dell’Associazione Italiana per lo Studio del Fegato (AISF) sull’uso della triplice terapia (2013).
Contrariamente a quanto si osserva nel corso delle terapia con gli agenti ad azione antivirale diretta
di I generazione, la terapia con Sofosbuvir ha dimostrato, oltre a importanti tassi di efficacia,
un profilo di sicurezza e tollerabilità molto elevati, specie negli schemi di terapia IFN-free,
dove gli effetti collaterali segnalati sono risultati non significativi in termini di frequenza e di
severità. Questo aspetto deve pertanto essere tenuto in considerazione oggi nella discussione con il
paziente nella scelta terapeutica (terapia o deferral); l’elevato profilo di sicurezza potrà di certo
rappresentare un criterio di scelta determinante nel tipo di terapia quando il farmaco sarà
disponibile. La terapia con SOF, infatti è risultata ben tollerata negli studi clinici. Gli eventi avversi
osservati sono risultati di grado lieve e il numero di interruzioni della terapia imputabili ad essi è
stato esiguo. Gli eventi avversi accusati con maggior frequenza da almeno il 20% dei pazienti
trattati con SOF in combinazione con PegIFN e RBV sono: spossatezza, cefalea, nausea, insonnia e
anemia, effetti verosimilmente legati all’assunzione di PegIFN e RBV più che all’uso di SOF. Il
trattamento è stato generalmente sicuro e ben tollerato negli studi che prevedevano l’associazione
con solo SOF e RBV. Gli effetti collaterali sono stati generalmente lievi; sono stati segnalati con
maggiore frequenza affaticamento e sintomi gastrointestinali, cefalea, prurito e anemia. Nessun
paziente ha sviluppato anemia grave e nessun effetto collaterale ha portato alla sospensione della
terapia.
La terapia con Simeprevir, interferone e ribavirina è risultata generalmente sicura e ben tollerata.
Gli effetti collaterali più comuni riportati nei principali studi clinici con Simeprevir in associazione
con Peginterferone alfa e Ribavirina sono stati rash cutaneo (fino al 14%), prurito (20%) e
fotosensibilità (rara), oltre ad affaticamento (41%), cefalea (27%) e nausea (26%), tipici della
terapia con PegIFN e RBV. Poco più del 10% dei pazienti ha sviluppato anemia, il 5% neutropenia,
e meno del 2% dei pazienti hanno mostrato aumenti della bilirubina, per lo più lievi o moderati, che
non si sono associati a un innalzamento degli enzimi epatici. La frequenza degli eventi avversi gravi
è stata del 4,7%. A causa delle reazioni di fotosensibilità riportate, sarebbe consigliabile nei pazienti
trattati con SMV, limitare l'esposizione al sole e utilizzare protezioni solari durante il trattamento.
Linee di indirizzo AISF – HCV, Giugno 2014