TUTTO QUELLO CHE C’È DA SAPERE DI CARDIOLOGIA IN
POCO PIU’ DI 45 MINUTI
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Indice
Fisiologia e patofisiologia: capire le malattie e il trattamento
Conduzione elettrica e nozioni basilari dell’elettrocardiogramma
Embriologia e circolazione fetale e cambi perinatali
Anatomia
Fisiologia
La circolazione sanguigna nell'essere umano e nei mammiferi è definita doppia e
completa. Sia la parte sinistra che destra funzionano indipendentenmente senza mai
mescolarsi e si tratta di un sistema chiuso. La circolazione sistemica e polmonare sono
collegate in serie mentre il collegamento con gli organi avviene in parallelo.
La capacità del cuore di pompare una quantità adeguata di sangue è legata all’equilibrio
tra le diverse forze in gioco sia cardiache che vascolari. In condizioni fisiologiche la
performance cardiaca è regolata: dalla frequenza cardiaca, dalla capacità inotropica di
contrazione, dalle forze che si oppongono all’azione di pompa del cuore (afterload) e da
quelle che agiscono sul riempimento del cuore durante la fase di quiescenza (preload). In
condizioni patologiche esistono altri fattori da prendere in considerazione: l’ipertrofia e le
perdite nel sistema cardiovascolare.
Il ciclo cardiaco che porta il cuore dallo stato di contrazione allo stato di riposo e quindi
nuovamente a quello di contrazione è detto "rivoluzione cardiaca". Il ciclo cardiaco viene
diviso nelle seguenti fasi: sistole atriale o riempimento ventricolare rapido, contrazione
ventricolare isovolumetrica, espulsione, rilasciamento ventricolare isovolumetrico e
riempimento ventricolare passivo o lento.
Nella sistole atriale le pareti di entrambi gli atri si contraggono sotto l'impulso inviato dal
nodo senoatriale e la contrazione degli atri si completa spingendo il sangue nei rispettivi
ventricoli. In questa fase le valvole atrioventricolari sono aperte, il ventricolo è rilassato e
viene riempito di sangue; al contrario le valvole semilunari sono chiuse in modo tale che
il sangue non refluisca dall'arteria polmonare e dall'aorta nei rispettivi ventricoli. La fase
di contrazione ventricolare isovolumetrica si verifica fra l'inizio della sistole ventricolare
1
e l'apertura delle valvole semilunari. Il volume ventricolare in questa fase rimane costante
o uniforme (isovolumetrico), mentre la pressione intraventricolare cresce rapidamente.
Nella fase di espulsione le valvole semilunari si aprono e, quando la pressione nei
ventricoli supera la pressione nell'aorta e nell'arteria polmonare, il sangue viene sospinto
fuori dal cuore. Il momento dell'espulsione può essere a sua volta distinto in due fasi:
a) rapida espulsione: essa è caratterizzata da un aumento marcato della pressione
ventricolare e aortica e da un violento flusso ematico verso i sistemi arteriosi.
b) espulsione ridotta: questa è caratterizzata, invece, da una diminuzione meno brusca
del volume ventricolare. E' importante notare che una notevole quantità di sangue,
chiamata volume residuo, rimane nei ventricoli anche dopo il periodo dell'espulsione.
Il rilassamento (diastole) ventricolare isovolumetrico è il periodo che intercorre tra la
chiusura delle valvole semilunari e l'apertura delle valvole atrioventricolari. Al termine
dell'espulsione ventricolare le valvole semilunari si chiudono in modo tale che il sangue
non possa rientrare nelle cavità ventricolari dai grandi vasi. Le valvole atrioventricolari
nel frattempo non si aprono fino a quando la pressione delle cavità atriali non supera
quella esistente nei ventricoli rilassati. Il riempimento ventricolare passivo è
caratterizzato dal ritorno del sangue venoso al cuore che aumenta la pressione intratriale
fino a quando le valvole atrioventricolari sono forzate ad aprirsi e il sangue riempie
velocemente i ventricoli rilassati. Dopo un afflusso di sangue molto rapido che determina
un aumento brusco e immediato del volume ventricolare, si assiste ad un periodo di lento
ma continuo riempimento ventricolare, conosciuto come diastasi ventricolare. La diastasi
è caratterizzata da un graduale aumento della pressione e del volume ventricolare.
Bibliografia
Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine. St Louis: Mosby, Inc
1998
2
REVIEW DI CARDIOLOGIA PER IL CHIRURGO – PARTE 1
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Sistema di conduzione cardiaco
La parte di muscolo cardiaco con lo specifico compito di permettere una contrazione
sincrona di atri e ventricoli è il miocardio specifico.
La peculiarità del miocardio specifico consiste nella possibilità di generare
autonomamente gli impulsi elettrici. Il pacemaker principale si trova nel nodo senoatriale (SA) che si depolarizza a una frequenza più elevata rispetto a tutte le altre cellule
cardiache. Si tratta di una piccola e appiattita striscia elissoidale di miocardio specifico
che si trova nella parte superiore laterale dell'atrio destro immediatamente sotto lo sbocco
della vena cava craniale. Le cellule nel nodo seno atriale includono cellule nodali o
cellule P, cellule di transizione o cellule T e cellule del muscolo atriale. La funzione delle
cellule T è di permettere la trasmissione dell’impulso ai tratti internodali.
Una volta che l'impulso si è generato nel nodo seno-atriale, esso passa direttamente alle
fibre atriali investendole in maniera simultanea e attraverso le fibre internodali il
segnale viene trasmesso al nodo atrioventricolare attraverso tre strisce di tessuto di
conduzione. Dalla generazione del segnale sono passati pochi secondi. La presenza di
questi fasci internodali è stata ben dimostrata nei cani: la craniale o anteriore comincia al
nodo SA, piega cranialmente lungo la vena cava per penetrare nel fascio muscolare di
Bachmann (via prefenziale di conduzione dall’atrio destro a quello sinistro) e da qui
lungo il setto atriale nel nodo atrioventricolare. La fascia media scende lungo il setto
interatriale, giusto di fronte alla fossa ovale. La caudale o posteriore raggiunge il nodo
atrioventricolare attraverso il seno coronarico discendendo lungo la cresta terminale e il
setto interatriale.
I tratti internodali caudali e medi convergono a formare il fascio prossimale
atrioventricolare, mentre il tratto internodale craniale si unisce alla parte caudale del
fascio prossimale atrioventricolare per poi formare il nodo atrioventricolare (AV). Esso
è situato nell’atrio destro cranioventrale all’apertura del seno coronario e craniodorsale al
lembo settale della valvola tricuspide. Da qui si muove in avanti e verso il basso
attraverso il tessuto fibroso del cuore. Essendo nella zona fibrosa del cuore, è
elettricamente isolato da altre strutture elettriche cardiache. Il nodo atrioventricolare si
1
collega al fascio di His (fascio atrioventricolare distale). Affinché l'impulso cardiaco non
possa propagarsi dagli atri ai ventricoli in maniera troppo veloce e, quindi, per permettere
ai ventricoli di completare la fase diastolica, l’impulso viene rallentato a questo livello.
La prima struttura che provoca questo ritardo è il nodo atrioventricolare anche se in realtà
il ritardo maggiore è dovuto nel cane al transito dell’impulso attraverso il fascio
prossimale atrioventricolare.
Le fibre del Fascio di His propagano l'impulso alla massa cardiaca ventricolare
dividendosi in due branche a livello del setto membranoso: destra e sinistra. Il passaggio
dell’impulso attraverso le branche è circa tre volte più veloce rispetto al trasporto
miocardico. La branca sinistra possiede due fascicoli, quello anteriore, più spesso, e
quello posteriore, più sottile. Si trova nello strato endocardico del setto di sinistra. La
branca destra scende sotto l’endocardio nella parte destra del setto. Arrivato all’apice,
si sposta verso la parete esterna nel “moderator band”.
Le fibre del Purkinje collegano le branche di sinistra e destra ad una rete di fibre a
livello dell’endocardio. Queste fibre sono a conduzione molto veloce.
Il sistema autonomo e il cuore
Il cuore è, pertanto, in grado di generare autonomamente gli stimoli per la sua
contrazione. Tuttavia esso necessita di particolari controlli esterni (sistema nervoso
simpatico e parasimpatico) per variare gli stimoli contrattili in base alle richieste
metaboliche.
Il cuore ha una duplice innervazione ricevendo fibre dal parasimpatico (attraverso il
nervo vago) e dell'ortosimpatico.
Il sistema parasimpatico è responsabile dell'inibizione della frequenza cardiaca; questo
sistema dispone di uno specifico neurotrasmettitore: l'acetilcolina. Essa determina due
importanti effetti sul cuore: deprime la frequenza di scarica del nodo S-A e diminuisce
l'eccitabilità delle fibre giunzionali poste tra il miocardio atriale ed il nodo A-V. La
stimolazione ortosimpatica provoca effetti opposti a quelli descritti per l'azione vagale,
anche se comunque i due effetti sono sempre compresenti. Il neurotrasmettitore attraverso
il quale il sistema ortosimpatico agisce è la noradrenalina, che viene rilasciata nelle
sinapsi che interessano le terminazioni nervose cardiache e che, come l'acetilcolina,
determina delle variazioni a livello dei condotti nelle cellule miocardiche. La
soppressione dell'attività ortosimpatica determina una diminuzione della frequenza che,
però, è meno rilevante rispetto all'azione del nervo vago.
2
In condizioni di riposo il tono parasimpatetico prevale sul nodo SA. Infatti la
concentrazione di acetilcolina a livello del nodo è molto più alta rispetto al resto
dell’atrio. Il tono simpatetico è invece basso a riposo. Il sistema autonomico è anche
responsabile di controllare quale parte del nodo seno atriale si depolarizza prima. In
condizioni normali la parte media e craniale del nodo si attivano prima e trasmettono alla
via internodale craniale. Con stimolazione vagale si osserva un cambio nelle regioni
caudali del nodo e un’attivazione dei tratti internodali medi e caudali. La stimolazione
può essere così pronunciata da sopprimere completamente l’attività del nodo seno atriale
ed attivare altre zone in prossimità del seno coronario. Questo determina il wandering
pacemaker.
Sia l’ortosimpatico che il parasimpatico di destra e sinistra arrivano a livello del nodo
AV, ma la parte sinistra prevale.
Principi basilari di interpretazione dell’elettrocardiogramma
La valutazione dell’elettrocardiogramma per il chirurgo, ma anche per la valutazione di
pazienti in terapia intensiva, deve essere metodico e deve tenere in considerazione il
processo patologico che è alla base. Sebbene molte di queste nozioni siano basilari, ci
limiteremo a ricordarle in modo tale che un approccio metodico ad ogni caso possa
permettere di identificare velocemente il ritmo e preparare un protocollo terapeutico
adeguato sia nel paziente nel postoperatorio sia per una stabilizzazione preoperatoria. Il
sistema più comune per la valuazione di un elettrocardiogramma deve svilupparsi
attraverso punti successivi:
1. Stabilire la frequenza cardiaca; 2. Valutare la regolarità del ritmo; 3. Stabilire la
morfologia del complesso QRS; 4. Guardare le onde P chiedendosi: c’è una P per ogni
QRS? C’è un QRS per ogni P?; 5. Procedere ad eseguire specifiche misurazioni; 6.
Stabilire la diagnosi più probabile 7. Formulare un protocollo terapeutico
Bibliografia
Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine. St Louis: Mosby, Inc
1998
3
REVIEW DI CARDIOLOGIA PER IL CHIRURGO – PARTE 2
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Embriologia
Il cuore deriva embriologicamente dal mesoderma.
I primi abbozzi compaiono nella regione cefalica prima della delimitazione (ovvero
dell'avvolgimento dell'embrione su se stesso sia in senso latero-laterale che craniocaudale, processo che fa sì che una struttura piana divenga tubolare e chiusa). Si tratta di
cellule mesenchimali vasoformative, inizialmente ammassate irregolarmente che
progressivamente si organizzano a delimitare i tubi endocardici destro e sinistro, e che
confluiscono nell'unico tubo cardiaco. In direzione cranio-caudale si osserva il tronco
arterioso, il bulbus cordis, il ventricolo primitivo e il seno venoso. Il ventricolo primitivo
evolve nel ventricolo sinistro, parte del bulbus cordis nel ventricolo destro e parte nelle
vie di efflusso di entrambi i ventricoli, il truncus arteriosus nell’aorta ascendente e
nell’arteria polmonare principale.
Il tubo cardiaco è immerso nel mesoderma splancnico che si ispessisce fino a formare il
mantello, da cui derivano miocardio ed epicardio: siamo in presenza della prima struttura
in grado di contrarsi. Il gel cardiaco viene incorporato nel miocardio ed epicardio a
formare il cushion.
I setti intracardiaci e i maggiori vasi si formano per effetto passivo (septum secundum,
ventricular septum e septum aorticopolmonare) ed attivo (setto del canale
atrioventricolare, setto spirale, septum troncale). Il setto atriale si completa con due setti:
il septum primum e il septum secundum alla sua destra con la formazione di diverse
aperture nei setti: l’ostium primum, l’ostium secundum e il foramen ovale.
La formazione del setto ventricolare comincia dall’apice e procede in direzione dorsale.
All’interno del truncus arteriosus e del bulbus cordis si sviluppa una elevazione del
cushion endocardico. Da questa struttura si forma il setto del truncus che ha una leggera
spirale. A causa di questa spirale, in condizioni normali l’arteria polmonare si sviluppa
intorno all’aorta ascendente.
Il sistema arteriale è formato da due aorte ventrale e dorsale collegate da sei paia di archi
aortici. La coppia di arterie vitelline collegano l’aorta dorsale con lo yolk sac e il paio di
1
arterie umbilicali con l’allantoide. Esistono tre sistemi venosi: il sistema vitellino, il
sistema venoso umbellicale e il sistema venoso cardinale.
Circolazione fetale e cambi perinatali
Durante la vita fetale lo scambio dei gas sanguinei avviene attraverso la placenta della
madre piuttosto che a carico dei polmoni del feto. E’ quindi facilmente intuibile la
notevole differenza rispetto alla circolazione adulta. In questo primo stadio, per evitare il
circolo polmonare, che essendo collassato, offre alta resistenza vascolare, il sangue
attraversa vie preferenziali fetali, che subiranno un drammatico rimodellamento dopo la
nascita. Esse sono:
1) forame ovale (intracardiaco): stabilisce una comunicazione interatriale e quindi
consente l’arrivo del sangue dall'atrio destro all’atrio sinistro e quindi direttamente al
ventricolo sinistro;
2) dotto venoso di Aranzio: mette in comunicazione la vena ombelicale con la vena cava
caudale permettendo, in tal modo, a quantità variabili di sangue di non interessare il
fegato;
3) dotto arterioso di Botallo: mette in comunicazione l'aorta con l'arteria polmonare
permettendo l’ esclusione della circolazione polmonare; durante la vita intrauterina il
dotto di Botallo rimane aperto sia grazie alla bassa pressione di ossigeno nel sangue fetale
e grazie, in parte, all’ azione delle prostaglandine.
Nella circolazione fetale la vena ombelicale porta il sangue arterioso dalla placenta al feto
attraverso l’ombelico.
Attraverso il dotto venoso, il sangue arriva nella vena cava caudale per confluire nell'atrio
destro. L'atrio destro fetale, in corrispondenza dello sbocco della vena cava caudale,
presenta una formazione chiamata “valvola di Eustachio”. Per mezzo di essa la corrente
sanguigna proveniente dalla vena cava caudale viene avviata verso il setto interatriale nel
quale è presente il foro ovale o di Botallo che mette in comunicazione i due atri. Di
conseguenza il sangue proveniente dalla vena cava caudale passa direttamente dall'atrio
destro all'atrio sinistro. Nell'atrio sinistro giunge anche una piccola quantità di sangue di
ritorno dai polmoni attraverso le vene polmonari. Questo viene convogliato tutto nel
ventricolo sinistro e da qui passa nell'aorta. Dall'aorta il sangue si distribuisce poi a tutto
il corpo.
Dal ventricolo destro, attraverso l'arteria polmonare, una piccola quantità di sangue arriva
ai polmoni del feto. La maggior parte del sangue viene invece deviata verso il dotto
2
arterioso di Botallo che sbocca nell'aorta, dove si unisce al sangue che proviene dal
ventricolo sinistro. Il sangue che è nell'aorta viene convogliato nelle arterie ombelicali,
dove raggiunge la placenta per ossigenarsi a livello dei villi coriali.
Dopo il parto si hanno radicali modificazioni nell'apparato cardiocircolatorio neonatale:
obliterazione del dotto di Botallo, chiusura del dotto venoso di Aranzio, chiusura del
forame ovale.
Anatomia
Il cuore è un organo cavo di natura muscolare, localizzato nella cavità toracica; ha una
forma di cono schiacciato con un asse diretto in avanti e verso il basso. Esternamente
presenta quattro facce, una diaframmatica, una craniale e due laterali.
Lateralmente sono presenti gli ili polmonari, i due nervi frenici e i vasi pericardiofrenici;
medialmente, il cuore è in rapporto con l'esofago, l'aorta discendente, la trachea e i
linfonodi; caudalmente il ventricolo sinistro e’ in contatto con il diaframma. La base
guarda in alto, davanti e a destra, mentre l'apice è rivolto in basso, caudalmente e a
sinistra. È compreso tra la terza e sesta costa e corrisponde posteriormente alla zona tra la
quarta e l'ottava vertebra toracica.
Il cuore è avvolto da una sottile membrana detta pericardio, costituito da due strati
distinti: uno esterno, il pericardio fibroso, e uno interno, il pericardio sieroso che
aderisce all’intera superficie cardiaca. Il pericardio sieroso ha due foglietti che si
riflettono uno nell’altro a livello dell'origine dei grossi vasi. Fra i due foglietti del
pericardio sono presenti normalmente pochi ml di liquido chiaro roseo che permettono il
movimento del cuore minimizzando l'attrito.
Sotto al pericardio si trovano tre tonache una interna all'altra:
- epicardio: (il foglietto viscerale del pericardio sieroso) costituito da tessuto connettivo,
contenente capillari sanguigni, capillari linfatici e fibre nervose.
- miocardio: fibre muscolari cardiache il cui spessore varia fra 5 e 15 mm (maggiore in
corrispondenza dei ventricoli), ordinatamente orientate in modo da permettere la corretta
contrazione.
- endocardio: rivestimento protettivo interno costituito da cellule endoteliali.
La superficie esterna del cuore è segnata da due solchi: a) il solco coronario o
atrioventricolare che taglia l'organo in senso trasversale fra il terzo superiore e i due terzi
inferiori, contiene l’arteria circonflessa sinistra, l’arteria coronaria destra e le vene
coronarie; b) quelli longitudinali o interventricolari che divide il cuore nella parte destra e
3
sinistra a livello di atri e ventricoli. Il solco craniale si origina sotto l’auricola sinistra e
contiene l’arteria e la vena coronaria discendente, mentre il caudale contiene la branca
caudale dell’arteria e vena coronaria circonflessa. I due solchi si incrociano caudalmente
in un punto definito "croce" (crux cordis), il quale è spesso occupato dall’arteria
coronaria.
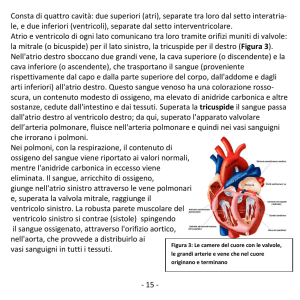
Il cuore è diviso in quattro cavità (o camere): gli atri (destro e sinistro) posti dorsalmente
e i ventricoli (destro e sinistro) posti ventralmente.
L'atrio e il ventricolo destro sono in continuità tra loro formando il cuore destro, così
come comunicano le due cavità sinistre, formando il cuore sinistro.
Dopo la nascita non persiste alcuna comunicazione tra la parte destra e la parte sinistra
del cuore; questa condizione è garantita dai setti interatriali e interventricolare.
Dalla porzione superiore del cuore si dipartono i due vasi arteriosi principali: l'aorta a
sinistra e l'arteria polmonare che si apre nell’ arteria polmonare di destra e sinistra.
Ciascuna di queste è un prolungamento cavo del ventricolo corrispondente. Le basi di
queste arterie sono abbracciate dalle auricole, (così chiamate poiché la loro forma ricorda
le orecchie pendule di un cane) che fanno parte degli atri.
Atrio destro
La muscolatura di entrambi gli atri è formata da muscoli pettinati. Esternamente è
presente la cresta terminale a cui internamente corrisponde il solco terminale, questa zona
e’ presente vicino all’apertura laterale della vena cava craniale. Tra atrio destro e atrio
sinistro si trova il setto interatriale, sul quale si trova la fossetta ovale, che corrisponde al
foro chiuso che nella vita fetale permetteva la comunicazione tra i due atri (il foro di
Botallo). Dal setto interatriale si origina il tubercolo intervenoso che separa l’area di
sbocco della vena cava caudale da quella craniale. Davanti all'orifizio della vena cava
caudale e alla sinistra del lembo settale della valvola tricuspide si trova l'orifizio del seno
coronario, munito anch'esso di una valvola, detta valvola di Tebesio che chiude l'orifizio
quando l'atrio si contrae, impedendo in tal modo che il sangue ritorni all'interno del seno.
La parte superiore della valvola di Tebesio si unisce alla valvola di Eustachio dando
origine al tendine di Todaro.
La valvola tricuspide forma la faccia inferiore dell'atrio. Nell’atrio destro sboccano tre
vene: la vena cava craniale, la vena cava caudale e il seno coronario, che porta il sangue
refluo dalle arterie coronarie.
4
Ventricolo destro
Superiormente si trova la valvola tricuspide, le altre pareti sono costituite da muscolatura
miocardica con trabecole carnee di primo, secondo e terzo ordine. Le trabecole di terzo
ordine sono uguali ai muscoli pettinati; la muscolatura di secondo ordine è costituita
invece da trabecole muscolari a forma di manico di valigia con le estremità collegate alle
pareti e libere nel mezzo; le trabecole di primo ordine sono dette muscoli papillari, esse
con un’ estremità si attaccano alla parete mentre con l'altra, attraverso le corde tendinee,
si inseriscono sulla valvola tricuspide e sono determinanti nella chiusura della valvola
stessa. La presenza di queste molteplici trabecole soprattutto a livello del setto rendono la
superficie interna del ventricolo rugosa.
Nel ventricolo destro appaiono ben distinte la via di afflusso dalla via di efflusso o
infundibulo separate, però, da un anello muscolare costituito da: a) la cresta
sovraventricolare; b) dal fascio settale che continua nel fascio moderatore; questo è una
trabecola di secondo ordine posta trasversalmente per impedire un'eccessiva dilatazione
del ventricolo nella diastole e permettere il trasporto della branca ventricolare di destra
alla parete ventricolare libera. In tal modo la via di efflusso si posiziona anteriormente
alla via di afflusso.
Atrio sinistro
Nella parete posteriore si aprono le vene polmonari che, nel cane, sono in numero
variabile da quattro a sei mentre nel gatto sono in genere quattro, due o tre da destra e due
o tre da sinistra, delimitando il vestibolo dell'atrio sinistro. Il setto interventricolare
presenta la fossetta ovale, residuo del foro di Botallo. La base presenta l'ostio della
valvola bicuspide o mitrale che da accesso del ventricolo sinistro. La parete laterale
presenta l'auricola sinistra, ricca di tessuto muscolare. A differenza dell’atrio destro i
muscoli pettinati sono limitati all’auricola.
Ventricolo sinistro
Nella parete superiore sono posizionate la valvola bicuspide e la valvola aortica,
quest’ultima dà accesso all'aorta ascendente. Qui la via di efflusso è separata dalla via di
afflusso solo dal lembo valvolare anteriore della valvola mitrale. Il sangue nella via di
efflusso, detta anche cuspide aortica, si trova davanti al lembo valvolare anteriore; le due
valvole, infatti, sono affiancate. La parete ventricolare e’ composta dai muscoli di primo,
5
secondo e terzo ordine, ma le sue trabecole carnee sono meno sporgenti del ventricolo
destro.
Valvole
Ogni atrio comunica con il corrispondente ventricolo attraverso l'orifizio atrioventricolare
che è fornito di una valvola cuspidale, essa permette il passaggio del sangue in una
direzione unica; la valvola tricuspide è posizionata tra le cavità di destra, mentre quella
bicuspide o mitrale trova posto tra atrio sinistro e ventricolo sinistro, entrambe si
inseriscono
sull'anello
fibroso
degli
osti
atrio-ventricolari.
La
base
fibrosa
atrioventricolare permette la separazione fisica ed elettrica di atri e ventricoli. La parte
centrale fibrosa è triangolare tra il lembo non coronarico dell’aorta, il lembo settale della
tricuspide, il lembo settale della mitrale e la base del setto interatriale. Il setto
interventricolare si collega a questa parte centrale fibrosa ed e’ dove si inserisce il fascio
di His. Il trigone fibroso di sinistra collega la parete aortica caudale all’anello della
mitrale.
La valvola di destra nelle persone è formata da tre lembi, da cui il nome tricuspide. In
realtà in cani e gatti, la valvola ha due lembi uno settale e uno parietale. Il settale è molto
più piccolo del parietale. L’unione tra i due lembi avviene attraverso le commissure
craniali e caudali. Essa funziona come una vera e propria valvola poichè permette
l'unidirezionalità del flusso ematico: è aperta nella diastole cardiaca mentre nella fase
sistolica è chiusa e non consente al sangue di tornare all'interno dell'atrio. Il movimento
valvolare è permesso dall’apparato valvolare composto da: muscoli papillari in numero
variabile (ma in genere tre grandi e uno piccolo) che si attaccano tutti al lembo parietale e
un numero variabile di corde tendinee di primo e secondo grado che si attaccano alla
parte ventrale dei lembi valvolari. Nella parte settale, le corde tendine si attaccano
direttamente a piccole prominenze muscolari o papille. La valvola di sinistra è chiamata
mitrale per la somiglianza con la mitra episcopale. Si tratta di una valvola bicuspide
quindi avente due lembi, uno settale o anteriore e uno parietale o posteriore. A differenza
della tricuspide, il lembo settale è il prominente, almeno due o tre volte più grande del
parietale. In realtà si possono avere molte dentellature soprattutto nel lembo posteriore. A
fini chirurgici, è opportuno suddividere ulteriormente i lembi valvolari in regioni, tre
nella porzione anteriore (A1, A2, A3) e tre nella porzione posteriore (P1, P2, P3). Il lembo
settale è collegato a una zona fibrosa mentre il lembo parietale si collega a una zona
muscolare piuttosto che ad una zona fibrosa e pertanto risente della maggiore dilatazione
6
in seguito a rigurgitazione mitralica. I due lembi si incontrano in due commissure al di
sotto delle quali è presente un muscolo papillare. I muscoli papillari sono qui più grandi
rispetto alla parte destra e sono nominati muscoli papillari craniale o subauriculare e
caudale o subatriale. Le corde tendinee si originano da questi muscoli, ma anche
direttamente dalle pareti ventricolari. Per motivi chirurgici il miglior sistema di
classificazione delle corde è di raggrupparle in: ordine primario, che si origina dai
muscoli papillari e si inserisce all’estremità dei lembi valvolari; ordine secondario, che si
origina dai muscoli papillari e si inserisce al di sotto dei lembi; ordine terziario, questo si
origina direttamente dalle pareti ventricolari e si inserisce alla base del lembo posteriore.
Di tutte le valvole cardiache, la mitrale ha forse l’anello vascolare più completo anche se
le zone di supporto più stabili sono tra la valvola mitrale e aortica che poi si estende nel
trigone di sinistra e destra. Inoltre bisogna considerare che nel cane, come nelle altre
specie, l’anello fibroso della mitrale è una struttura funzionalmente tridimensionale che
assume la forma di sella per ridurre lo stress meccanico sui lembi. Queste condizioni
vengono alterate nelle varie patologie della valvola.
Gli orifizi che mettono in
comunicazione le cavità cardiache con i vasi efferenti sono anch'essi protetti da valvole
che impediscono il reflusso: valvola semilunare polmonare nel ventricolo destro per
l'arteria polmonare e valvola semilunare aortica nel ventricolo sinistro per l'aorta. La
valvola polmonare ha un anello su cui si attaccano tre lembi chiamati craniale, di destra e
di sinistra. La valvola aortica è strutturalmente simile ma i lembi sono più spessi. Nei seni
di Valsalva si individuano gli osti dell’arteria coronaria di sinitra e destra. I lembi
valvolari prendono il nome delle arterie coronarie che hanno origine dai rispettivi seni, il
lembo senza coronaria viene poi chiamato non-coronarico. Sia nel caso delle polmonare
che dell’aorta, quando la valvola è chiusa, le linee di apposizione dei lembi chiamate
linea alba, formano una struttura radiale che assomiglia al simbolo della Mercedez Benz.
Coronarie
Sulla superficie del cuore si possono osservare le arterie coronarie destra e sinistra che si
dipartono dagli osti coronarici di sinistra e destra. Le coronarie si diramano irrorando
tutto il cuore fino all'apice.
La coronaria sinistra comincia con una breve porzione principale da cui poi si dipartono
l'arteria discendente anteriore, l'arteria circonflessa e la più piccola arteria marginale, la
coronaria destra si sfiocca, poi, in una miriade di vasi minori.
7
Le arterie coronarie costituiscono un sistema in grado di assicurare un apporto costante di
ossigeno e di elementi nutrienti per il muscolo cardiaco. Il ritorno venoso attraverso le
vene coronarie, trasporta il sangue nell’atrio destro attraverso il seno venoso.
Bibliografia
Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine. St Louis: Mosby, Inc
1998
Savage EB, Bolling SF. Atlas of mitral valve repair. Philadelphia: Lippincott Williams
and Wilkins, 2006
8
OPZIONI TERAPEUTICHE IN CORSO DI CARDIOPATIE
CONGENITE
Bussadori R. DVM [email protected]
Carnabuci C. DVM
Le cardiopatie congenite sono malformazioni presenti alla nascita spesso diagnosticabili
entro i primi mesi di vita. Alcune di esse non sono compatibili con il raggiungimento
dell’età adulta, altre invece si manifestano con segni di insufficienza cardiaca o
provocano morte improvvisa solo in età avanzata. E’ quindi necessaria una pronta
diagnosi e un appropriato intervento terapeutico. Secondo la nostra esperienza il 34%
delle cardiopatie congenite è rappresentato dalla stenosi polmonare (SP), il 31% dalla
stenosi subaortica (SSA), il 19% dal dotto arterioso pervio (PDA), il 6% da difetti
associati quali SP e SSA, il 5% da difetti interventricolari (DIV), il restante 5% da
cardiopatie congenite quali difetti interatriali (DIA), Tetralogia di Fallot (TdF), cor
triatriatum e cor triatriatum dexter, ventricolo destro a doppia camera (DCRV).
Le opzioni terapeutiche prevedono oltre alla terapia medica di supporto, l’applicazione di
tecniche chirurgiche tradizionali e tecniche mini-invasive.
Stenosi Polmonare
La SP è caratterizzata dall’ostruzione del tratto di efflusso destro. Le razze predisposte
sono il Boxer, Bulldog, Bulldog francese, Terranova, Rottweiler, Pitbull. E’ possibile
distinguere due tipi di stenosi polmonare, quella di tipo A con diametro dell’anulus
normale, lembi fusi ed ispessiti e dilatazione post stenotica e quella di tipo B con anulus
ipoplasico, valvola displasica e lembi rudimentali1. La gravità della stenosi è determinata
dal gradiente pressorio. Soggetti con stenosi lievi e moderate non necessitano di
trattamento, quelli con stenosi grave (> 80 mmHg) presentano invece un elevato rischio
di morte improvvisa. Le tecniche chirurgiche tradizionali per la riduzione della stenosi
prevedono la dilatazione valvolare transventricolare con tecnica modificata da Brock
tramite toracotomia sinistra a livello del quarto spazio intercostale o valvuloplastica con
patch-graft che necessita invece il blocco del flusso cavale e lieve ipotermia e prevede
l’innesto di un lembo autogeno (pericardio) o eterogeno nel tratto di efflusso destro.
L’alternativa offerta dalla cardiologia interventistica è la valvuloplastica percutanea con
pallone2 che è attualmente la prima opzione terapeutica per la gestione di questo difetto3.
In corso di coronaria anomala, l’unca opzione terapeutica possibile è il patch graft con
bypass coronarico.
Stenosi subaortica
La stenosi aortica è anatomicamente classificata come valvolare, sopravalvolare e
sottovalvolare. La forma più comune è quella sottovalvolare, tipica di cani di razza
Boxer, Terranova, Dogue de Bordeaux, Pastore Tedesco, Bull terrier e Retrivers. Nel
95% dei casi la lesione è costituita da un anello di tessuto fibroso localizzato al di sotto
delle valvole semilunari che attraversa il setto interventricolare e si piega all’interno del
lembo anteriore della mitrale. La SSA è una patologia diagnosticabile ecograficamente
sin dai primi mesi di vita, nelle forme più lievi il soggetto rimane asintomatico per tutta la
vita, nelle forme moderate o gravi l’andamento è caratterizzato da insufficienza cardiaca
sinistra o da morte improvvisa dovuta ad ischemia miocardica ed aritmie ventricolari. Il
rischio di morte improvvisa può essere ridotto con una terapia a base di β-bloccanti
(propanolo e atenololo) ed in caso di insufficienza cardiaca congestizia è indicato
l’utilizzo di diuretici. È possibile intervenire chirurgicamente eseguendo la resezione
della stenosi a cuore aperto dopo realizzazione di un bypass cardiopolmonare anche se i
risultati fin’ora ottenuti non sono incoraggianti4. Da uno studio condotto su cani affetti da
grave SSA e trattati con valvuloplastica con pallone Meurs et al, non hanno riportato
benefici a lungo termini rispetto a un gruppo di cani trattati con β-bloccanti5.
Patent ductus arteriosus
Il dotto arterioso pervio è la terza patologia congenita più frequente nel cane, con
maggior predisposizione nel Pastore tedesco, Terranova, Doberman, Barbone, Maltese,
Yorkshire e con maggior frequenza nelle femmine. È una normale struttura vascolare
presente durante la vita fetale che si estende dalla biforcazione dell’arteria polmonare all’
aorta discendente, giusto dopo l’origine dell’arteria succlavia. La sua funzione è quella di
portare il sangue dall’ arteria polmonare all’aorta, bypassando i polmoni, che sono
collassati, e non funzionali. La chiusura fisiologica di questa struttura avviene da alcuni
minuti fino a poche ore dopo la nascita. La mancata chiusura del dotto determina uno
shunt sinistro destro che nei casi più gravi è invertito (reversed PDA). Il flusso
proveniente dall’aorta produce turbolenza nell’arteria polmonare principale rilevabile
come un soffio continuo nella zona ascellare di sinistra che si irradia anche a destra.
L’interruzione del flusso attraverso la chirurgia tradizionale prevede la legatura del PDA.
Le tecniche descritte sono la tecnica con filo ad ansa, la tecnica del nodo e la tecnica con
pinza De Backey. La legatura chirurgica si realizza per mezzo di una toracotomia a
livello del quarto spazio intercostale sinistro; una volta retratto caudalmente il lobo
polmonare craniale, si visualizza l’ aorta, l’arteria polmonare e il nervo vago che deve
essere isolato e spostato caudalmente. Con una pinza da dissezione, si procede alla
dissezione smussa della parte caudale del dotto, al fine di poterne raggiungere con un filo
di seta o di Nylon la porzione craniale. Dopo aver completamente legato il dotto si
ricolloca il lobo polmonare craniale e si procede alla chiusura della parete toracica. Le
complicanze dell’intervento sono dovute alla possibile rottura del dotto durante le
legatura, questo rischio aumenta quando il soggetto viene sottoposto a terapia diuretica
prima dell’intervento poiché questo determina disidratazione dei tessuti. L’opzione
terapeutica alternativa alla chirurgia è la tecnica interventistica per via percutanea
attraverso diversi dispositivi occludenti quali coils, ADO, plug vascolari ed ACDO che
sembra essere il più appropriato per l’occlusione di dotti canini6. L’utilizzo dell’ACDO è
inappropriato in caso di dotti tubulari. Le possibili complicanze sono dovute all’utilizzo
di dispositivi di inappropriate dimensioni e ad aritmie..
Difetto interventricolare
Il difetto interventricolare è caratterizzato da un orificio nel setto interventricolare che
permette il passaggio di un flusso da un ventricolo all’altro. E’ la patologia congenita
cardiaca più comune nei bambini, mentre nel cane e nel gatto la prevalenza è molto più
bassa. Nella forma più comune il difetto riguarda il setto membranoso sotto la cuspide
aortica non coronarica. I difetti più ampi e più bassi sono rari e di solito associati ad altre
anomalie in corso di difetti congeniti complessi. Si crea solitamente uno shunt da sinistra
a destra. Secondo la classificazione anatomica possiamo distinguere DIV di tipo
perimembranoso, muscolare e sottoarterioso. I primi due tipi possono essere
ulteriormente suddivisi in base alla localizzazione in anteriore, posteriore e trabecolato.
In base alle dimensioni del difetto e alla quota di shunt possiamo distinguere difetti
piccoli, medi e grandi. I difetti medi ed ampi determinano entro i due anni ipertrofia
eccentrica e scompenso cardiaco dovuto al sovraccarico volumetrico sinistro, oltre i due
anni nei DIV ampi si può verificare vasculopatia polmonare ostruttiva e l’inversione dello
shunt (Eisenmenger complex). E’ possibile la chiusura spontanea solo dei DIV muscolari
e perimembranosi di piccole dimensioni. E’ consigliabile la chiusura dei DIV ampi che
può effettuarsi attraverso la chirurgia tradizionale o con tecnica interventistica per via
percutanea. Le tecniche mini-invasive prevedono l’utilizzo di diversi dispositivi7,8,9,10:
coil a rilascio controllato11, dispositivo di Rashkind double umbrella, Amplatzer VSD
occluder. Quest’ultimo permette la chiusura di difetti muscolari e perimembranosi, non è
possibile utilizzare il dispositivo nei difetti sottoarteriosi in quanto può causare
insufficienza aortica7. E’ possibile che con il DIV coesista un altro difetto quale SP o
PDA che devono essere corretti prima della chiusura del DIV. La chirurgia tradizionale
prevede il cerchiaggio dell’AP il cui scopo è quello di aumentare la pressione sistolica
all’interno del ventricolo dx, creando una resistenza allo shunt, oppure l’inserimento di
un lembo protesico attuando un bypass cardiopolmonare (patch-graft closure).
Difetto interatriale
Nell’uomo l’anomala comunicazione tra i due atri costituisce la cardiopatia congenita di
più frequente riscontro negli adulti. E’ un difetto relativamente raro nel cane e nel gatto.
Generalmente produce uno shunt sinistro destro, solo nei casi in cui coesista
un’alterazione del cuore destro che produce un sovraccarico pressorio-volumetrico lo
shunt può invertirsi. Secondo la sede e l’origine embriologica possiamo distinguere
quattro tipi di difetti interatriali. Tipo ostium primum, tipo ostium secundum, tipo seno
venoso e tipo seno coronarico. Il DIA tipo Ostium Secundum è il tipo più frequente,
rappresenta circa i 2/3 dei DIA. Generalmente unico, sono rare le fenestrazioni. Limitato
alla regione della fossa ovale nell’area circoscritta dal limbus. E’ caratterizzato dalla
mancanza di tessuto miocardico settale. Può essere il risultato sia dell’eccessivo
riassorbimento del Septum Primum, sia dall’insufficiente sviluppo del Septum
Secundum. Da non confondersi con il foramen ovale pervio che invece è caratterizzato
dalla mancata fusione del flap del septum primum con quello del septum secundum. DIA
tipo ostium primum rappresenta circa il 15-20% dei DIA. E’ localizzato nella parte più
bassa del setto interatriale appena al di sopra della valvola mitrale e tricuspide. E’ una
variante del difetto dei cuscinetti endocardici. La forma estrema è costituita dal canale
atrio ventricolare. La fossa ovale non è coinvolta. Quasi sempre il lembo anteriore della
valvola tricuspide è fissurato, meno frequentemente lo è il lembo settale. Meno frequenti
sono il tipo seno venoso che compare secondariamente all’anormale inserzione della vena
polmonare destra ad una delle due vene cave, ed il DIA tipo seno coronarico, il più raro,
che è caratterizzato dall’assenza della radice del seno coronarico situato nel pavimento
dell’atrio sinistro. Non è necessario alcun trattamento per difetti di piccole dimensioni,
mentre difetti più ampi possono determinare scompenso cardiaco e sincopi. E’ possible
chiudere DIA tipo ostium secundum e il FOP attraverso l’impianto di un dispositivo
Amplatzer muscular ASD occluder per via percutanea. Non sono trattabili con questa
tecnica il tipo seno venoso ed il tipo ostium primum (trattabili chirurgicamente). La
chirurgia tradizionale prevede la chiusura del difetto tramite patch-graft dopo atriotomia
destra, durante bypass cardiopolmonare12.
Tetralogia di Fallot
La Tetralogia di Fallot è un difetto cardiaco congenito non comune in cani e gatti, la cui
ereditabilità è stata studiata nel keehshond. È caratterizzata da stenosi polmonare difetto
interventricolare ampio, aorta a cavaliere ed ipertrofia concentrica del ventricolo destro.
Le conseguenze fisiologiche della tetralogia di Fallot dipendono dal grado di SP e dalla
resistenza vascolare sistemica. Attraverso il DIV ampio passa uno shunt destro-sinistro
perché la resistenza al flusso opposta dalla presenza della stenosi polmonare supera
quella offerta dal difetto interventricolare e dalla resistenza sistemica. Il sangue non
ossigenato si miscela quindi a quello ossigenato determinando ipossiemia, cianosi,
policitemia. Non necessitano della chirurgia i soggetti non cianotici. Sono candidati
invece quei soggetti che presentano a riposo un’ossigenazione del sangue arterioso
inferiore al 70%. Oltre alla terapia medica, e all’attenuazione della stenosi polmonare
(rischio di over-correction, quindi shunt sinistro-destro), sono state proposte alcune
tecniche per la creazione di shunt tra il circolo sistemico e quello polmonare: Blalock-
Taussig13 che prevede l’anastomosi tra succlavia e arteria polmonare, Blalock-Taussig
modificata e l’ anastomosi di Potts tra aorta e arteria polmonare.
Cor Triatriatum
In medicina umana con il termine cor triatriatum si definisce l’anomala inserzione della
vena polmonare comune nell’atrio sinistro che ne determina la divisione in due camere,
una
prossimale e una distale. La camera prossimale generalmente riceve le vene
polmonari. In medicina veterinaria è un difetto che si presenta raramente nei gatti14.
Cor Triatriatum Dexter
È caratterizzato da un diaframma o setto che può essere più o meno perforato, che divide
l’atrio destro in due camere, una craniale e una caudale. In quella craniale si trovano
solitamente il seno coronarico e la valvola atrioventricolare, in quella caudale la vena
cava caudale e la fossa ovale. Nell’uomo sono previste diverse varianti anatomiche, nel
cane invece soltanto due. In molti casi la partizione anomala è dovuta alla persistenza
delle valvole di Eustachio (valvola della vena cava caudale) e di Tebesio (valvola del
seno coronarico) che formano un setto a livello della parte bassa dell’atrio15. Solitamente
non è associato ad altri difetti cardiaci. E’ possibile correggere il difetto tramite tecnica
interventistica utilizzando un catetere con pallone per aprire la membrana che separa
l’atrio16. Il successo di questo intervento dipende dalla anatomia del tessuto13. Il cor
triatriatum dexter può essere risolto con l’utilizzo di un valvulotomo17, oppure attuando
l’interruzione del flusso cavale ed atriotomia destra, e recisione ed asportazione della
membrana18. E’ inoltre possibile utilizzare la circolazione extracorporea per eseguire la
resezione della membrana19.
Ventricolo Destro a Doppia Camera
Il ventricolo destro a doppia camera è una cardiopatia congenita rara, nella quale il
ventricolo destro è diviso in due sezioni da un fascio muscolare anomalo. La lesione
tipica è solitamente rappresentata da una banda muscolare anomala che parte dalla cresta
sopraventricolare e attraversa il ventricolo destro fino alla parete libera.
La camera prossimale del ventricolo è caratterizzata da alta pressione mentre quella
distale da bassa pressione. Normalmente è associato ad altre patologie quali SP e DIV.
La correzione chirurgica può avvenire con un valvulotomo pediatrico, senza l‘utilizzo di
bypass cardiopolmonare o di blocco del flusso cavale20. L’escissione chirurgica del
tessuto muscolare anomalo richiede il bypass cardiopolmonare21,22. I tentavi di correzione
del DCRV con catetere da valuloplastica con pallone hanno riportato scarsi risultati 22,23.
Bibliografia:
1. Bussadori C, Amberger A., Le Bobinnec G., C.W. Lombard. Guidelines for the
echocardiographic studies of suspected subaortic and pulmonic stenosis. Journal of Vet.
Cardiology, Vol.2, N°2, December 2000 17-24.
2. Bussadori C, etal. Balloon valvuloplasty in 30 dogs with pulmonic stenosis: effect of
valve morphology and annular size on initial and 1-year outcome. J Vet Intern Med.
2001;15(6):553-8.
3. C. Locatelli, O. Domenech, F. Armada, S. Vannini, R. Toschi Corneliani, PG.
Brambilla, C. Bussadori. Pulmonary ballon valvuloplasty in 95 dogs: effect of valve
morphology on immediate and late outcome. Poster research communications of the 18th
ecvim-ca congress Ghent, Belgium, 4th to 6th September 2008
4. Orton EC et al. Influence of open surgical correction on intermediate-term outcome in
dogs with subvalvular aortic stenosis: 44 cases. J Am Vet Med Assoc 216:364, 2000.
5. Meurs KM, Lehmkuhl LB, Bonagura JD. Survival times in dogs with severe
subvalvular valvuloplasty or atenolol. J Am Vet Med Assoc 227: 420, 2005.
6. Thaibinh P Nguyenba, Anthony H Tobias. The Amplatz((R)) canine duct occluder: A
novel device for patent ductus arteriosus occlusion. J Vet Cardiol. 2007 Nov 26; :
18054306 (P,S,E,B,D)
7. Arora R, Trehan V, Kumar A, et al. Transcatheter closure of congenital ventricular
septal defects: experience with various devices. J Interv Cardiol 2003;16:83–91.
8. Lock JE, Block PC, McKay RG, et al. Transcatheter closure of ventricular septal
defects. Circulation 1988;78:361–368.
9. Amin Z, Gu X, Berry JM, et al. New device for closure of muscular ventricular septal
defects in a canine model. Circulation 1999;100:320–328.
10. Kalra GS, Verma PK, Dhall A, et al. Transcatheter device closure of ventricular
septal defects: Immediate results and intermediate-term follow up. Am Heart J
1999;138:339–344.
11. Y. Fuji, T. Fukuda, N. Machida, T. Yamane, Y. Wakao. Transcatheter closure of
congenital ventricular septal defects in 3 dogs with a detachable coil. J Vet Intern Med
2004; 18:911-914.
12. Eyster GE, Anderson LK, Krehbell JD et al. Surgical repair of atrial septal defect in a
dog. J Am Vet Med Assoc 169:1081-1084,1976.
13. Blalock A, Taussig HB. The surgical treatment of malformation of the heart in which
there is pulmonary stenosis or pulmonary atresia, JAMA 128:189, 1945
14. Kole H., Sato T., Nakagawa H., & Sakai T. 2000 Cor triatriatum sinister in a cat.
Journal of Small Animal Practice 42, 128-131.
15. Brayley K. A. Lunney j., Ettinger S. J. 1994 Cor triatriatum dexter in a dog. Journal
of the American Animal Hospital Association 30, 153-156.
16. Adin D.B. & Thomas W. P. (1999) Ballon dilatation of cor triatriatum dexter in a
dog. Journal of Veterinary Internal Medicine 13, 617-619.
17. Jevens DJ Johnston SA, Jones CA et al. Cor triatriatum dexter in two dogs. J Am
Anim Hosp Assoc 29:289, 1993.
18. Tobias AH, Thomas WP, Kittleson MD et al. Cor triatriatum dexter in two dogs.
J Am Vet Med Assoc 202:285, 1993.
19. Tanaka R., Hoshi K., Shimizu M., Hirao H., Akiyama M. Kobayashi M., Machida N.,
Maruo K., Yamane Y. Surgical correction of cor triatriatum dexter in a dog under
extracorporeal circulation. Journal of Small Animal Practice 44, 370-373 2003.
20. S. L. Minors, M. R. O’Grady, R. M. Williams, M. L. O’Sullivan. Clinical and
echocardiographic features of primary infundibular stenosis with intact ventricular
septum in dogs. J Vet Med 2006; 20:
21. Willard MD, Eyster GE. Double chambered right ventricle in 2dogs. J. Am Vet Med
Assoc 1981; 178:486-488.
22. Martin JM, Orton C., Boon JA., et al. Surgical correction of double-chambered right
ventricle in dogs. J Am Vet Med Assoc 2002; 220:770-774.
23. MacLean HN, Abbott JA, Pyle RL. Ballon dilation of double chambered right
ventricle in a cat. J Vet Intern Med 2002; 16:478-484.
COSA FACCIO SENZA BYPASS? – PARTE 1
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Specificazioni anestetiche
La ventilazione assistita deve essere impiegata durante gli interventi a torace aperto.
Durante le chirurgie piu’ complesse il monitoraggio deve essere intenso con lettura di:
pressione aortica diretta, differenti temperature centrali e periferiche, pressione venosa
centrale e possibilmente pressione atriale. Poiche’ il nervo vago è coinvolto
frequentemente in molte dissezioni, l'atropina deve essere amministrata durante
l’induzione del paziente per bloccare l’attività parasimpatetica durante le manipolazioni
chirurgiche.
Approccio al torace
Ci sono 4 metodi principali per l’approccio al torace di cui soltanto due sono usati piu’
frequentemente: l'intercostale o toracotomia laterale e la stenotomia mediana.
La maggior parte delle procedure attuate in medicina veterinaria può essere compiuta con
la toracotomia laterale poiché i nostri pazienti tendono ad essere compressi lateralmente.
Per la toracotomia laterale e’ fondamentale che il chirurgo scelga lo spazio intercostale
corretto anche a volte mediante l’uso di radiografia o TAC. Lo svantaggio della
toracotomia laterale è la difficoltà di raggiungere le strutture toraciche situate nella parte
contralaterale. Dal lato sinistro si ha accesso a molte strutture cardiache (dotto, arteria
polmonare, atrio sinistro), nonchè ad alcune strutture extracardiache come l’esofago
caudale; mentre dal lato destro si ha accesso all’ atrio destro, alla trachea e all’esofago
craniale. Per i polmoni l’approccio varia a seconda della zona interessata. In particolare
l’entrata attraverso il quarto spazio permette la visualizzazione di molte delle strutture
sopra menzionate. Il quarto spazio intercostale può essere individuato seguendo
ventralmente il bordo posteriore dello scapola. Gli strati identificati nella toracotomia
laterale sono: pelle, tessuti sottocutanei, il cutaneous trunci, il latissimus dorsi, lo
scalenus craniale all'obliquo addominale esterno, il serratus ventralis seguito da
intercostali esterni ed interni e la pleura.
La modificazione della toracotomia laterale con rimozione di una costa è usata raramente
se l'incisione intercostale è correttamente estesa alla giunzione costocondrale,
permettendo la ritrazione del fascio vascolo-nervoso intercostale.
1
La sternotomia mediana e’ la seconda tecnica usata piu’ comunemente. Questa procedura
permette la visualizzazione completa di entrambi gli emitoracici e può essere combinata
con laparotomia. Uno svantaggio della sternotomia, almeno nel cane, è la percezione che
il periodo postoperatorio sia più doloroso. Le chirurgie più comunemente eseguite
utilizzando una sternotomia mediana sono la riparazione delle ernie diaframmatiche,
pericardiectomia, stenosi aortica e la stenosi polmonare (in alcune situazioni). I tessuti
incontrati nella sternotomia mediana sono la pelle ed i tessuti sottocutanei. L'incisione è
fatta fra i pectorali, e lo sterno è tagliato solitamente per mezzo di una sega sternale
oscillatoria.
Un altro metodo, usato piu’ raramente, e’ la toracotomia laterale bilaterale estesa
attraverso lo sterno. Questa tecnica chirurgica e’ tuttavia usata solo raramente.
A queste tecniche si devono aggiungere gli approcci laterali e mediani usati nella
toracoscopia. Il mediano o paraxifoideo e’ particolarmente utile per alcune procedure
cardiache come la pericardiectomia e per la visualizzazione dell’atrio destro.
Chiusura del torace e postoperatorio
Nella chiusura della cavità toracica si dovrebbe cominciare a considerare analgesia
sistematica con epidurale e blocco intercostale mediante amministrazione di bupivacaina
in chirurgia o somministrazione continua di anestetico locale nell’intercostale durante il
periodo postoperatorio o amministrazione di anestetico locale attraverso il drenaggio
toracico. Il drenaggio toracico è solitamente introdotto nel settimo-nono spazio
intercostale e si fa procedere in avanti attraverso un tunnel sottocutaneo. Il drenaggio
puo’ essere rimosso al termine della chirurgia (come nel caso del dotto pervio) o lasciato
qualche giorno per permettere un’azione intermittente o continua dello stesso.
In animali di taglia grande si possono suturare i muscoli intercostali, ma in cani di piccola
taglia è generalmente sufficiente chiudere con sutura continua il serratus, lo scalenus ed i
tessuti ventrali allo scalenus. La seconda linea di chiusura è a livello del latissimus
seguito dal cutaneus trunci, i tessuti sottocutanei e alla pelle.
La chiusura della sternotomia mediana è simile alla toracotomia laterale con tubo di
drenaggio che spesso viene lasciato. Lo sterno puo’ essere richiuso con suture o filo
metallico. I pettorali sono chiusi con sutura continua e quindi seguiti dai tessuti
sottocutanei e dalla pelle.
La somministrazione postoperatoria include l’uso di narcotici iniettabili per un periodo
variabile. Se necessario il paziente puo’ essere mantenuto con ventilazione assistita fin
2
quando non si constata la capacità di ossigenazione con respirazione volontaria. Alcune
situazioni necessitano della tracheostomia anche se solo temporanea, in alcuni casi,
invece, può essere sufficiente l’amministrazione di ossigeno mediante tubi nasali o
camera d’ ossigeno. Inoltre, in questa fase, si deve anche considerare il supporto
vascolare con cristalloidi, hetastarch, sangue o sostituti dell'emoglobina. Il supporto
cardiaco puo’ essere mantenuto con farmaci inotropici come dopamine e dobutamina.
Strumenti specifici in chirurgia toracica e vascolare
E’ fondamentale considerare l’acquisto di un set di strumenti specifici prima di
pianificare una chirurgia cardiaca. Diverse patologie congenite come il dotto arterioso
pervio e le anomalie degli anelli vascolari possono essere corrette senza toccare la
struttura cardiaca e, spesso, con minima strumentazione specifica. Comunque è
importante ricordare che, anche in questo caso, sono necessari alcuni strumenti chirurgici
prettamente vascolari che rendono la chirurgia piu’ sicura. Il resto degli strumenti
chirurgici
cardiovascolari
con
le
specifiche
caratteristiche
verranno
descritti
dettagliatamente nella presentazione.
Patologie cardiache e trattamenti senza bypass
Il trattamento cardiaco, anche senza l’utilizzo del bypass, può assere curativo come nel
caso del dotto pervio, degli anelli vascolari, o palliativo per guadagnare tempo e
permettere la crescita del paziente prima dell’ intervento definitivo (piu’ comunemente
usato in pazienti umani) o di alleviare i segni clinici al punto da diventare quasi
asintomatico (in pazienti veterinari). In questo caso gli interventi possono essere condotti
con o senza l’utilizzo del bypass cardiopolmonare. Per il difetto settale ventricolare e la
tetralogia di Fallot da anni sono state usate tecniche per alleviare la sintomatologia
clinica. Il trattamento palliativo per eccellenza è la creazione degli shunt polmonarisistemici. La forma piu’ comune di shunt, anche usata come parte di altri interventi (ad
esempio Norwood per l’ipoplasia del cuore sinistro), è lo shunt modificato di Blalock
Taussig. Mediante anastomosi end-to-end alla succlavia, un condotto naturale o sintetico
è collegato all’arteria polmonare (end-to-side). Nel caso della tetralogia di Fallot, una
frazione di sangue viene convogliata nell’arteria polmonare bypassando la stenosi
polmonare.
Per il trattamento delle patologie cardiache in assenza di bypass cardiopolmonare, il
migliore alleato rimane l’ipotermia e l’uso del blocco del ritorno venoso al cuore destro
mediante occlusione delle vene cave. L’utilizzo dell’ipotermia è clinicamente difficile
3
senza bypass cardiopolmonare. L’ipotermia sia locale che sistemica puo’ essere
facilmente raggiunta mediante l’uso di ghiaccio sterile e fluidi intravascolari freddi,
tuttavia il successivo riscaldamento del paziente puo’ essere estremamente complicato
senza avere un sistema come quello offerto dal bypass (come verrà spiegato più avanti).
Pertanto l’ipotermia lieve è sicuramente auspicabile ma, senza bypass anche parziale,
bisogna evitare condizioni di ipotermia moderate-gravi.
Il dotto arterioso pervio e’ stato ampiamente trattato nelle relazioni precedenti.
Difetti di formazione degli anelli aortici
Descrizione: In questo gruppo si includono diverse patologie di formazione dell’arco
aortico con o senza dotto arterioso o legamento arterioso che induce una costrizione della
trachea e dell’ esofago. Vengono classificati in 7 tipi e la frequenza di presentazione e’
variabile a seconda del tipo: 1. Arco aortico di destra persistente con dotto o legamento
arterioso di sinistra; 2. Arco aortico di destra persistente con succlavia anomala; 3. Arco
aortico di destra persistente con dotto o legamento arterioso di sinistra con succlavia
anomala; 4. Doppio arco aortico; 5. Arco aortico di sinistra persistente con dotto o
legamento arterioso di destra; 6. Arco aortico di sinistra persistente con succlavia
anomala; 7. Arco aortico di sinistra persistente con dotto o legamento arterioso di destra
con succlavia anomala. Il tipo 1 è l’alterazione che avviene con maggiore frequenza in
circa il 95 % dei casi.
E’ descritto più comunemente in alcune razze, come il Doberman, pastore tedesco,
danese e il setter irlandese.
Trattamento (tipo 1): Il legamento arterioso e’ localizzato, attraverso una toracocotomia
laterale sinistra nel quarto o quinto spazio intercostale (nel gatto il quinto e’ preferito). La
dissezione e’ in direzione mediale verso il mediastino facendo attenzione al nervo vago e
alla parete dell’ esofago. Un tubo con palloncino puo’ essere gentilmente introdotto
nell’esofago dall’anestesista per meglio visualizzare la zona ostruita. Una volta
individuato, il dotto o legamento va legato con doppia sutura e sezionato nel medio. Fino
al 20 % di questi legamenti puo’ essere ancora pervio. E’ importante rimuovere le
adesioni intorno all’esofago per poter garantire una completa rimozione dell’ostruzione e
passare diverse volte il palloncino nell’esofago e assicurasi che si muova liberamente fino
al cardias. Se e’ presente tessuto eccessivo dell’esofago, non e’ necessario rimuoverlo.
Questa tecnica non arreca nessun vantaggio e puo’ portare a complicazioni non volute nel
postoperatorio (deiscenza e torace settico, restrizioni esofagee).
4
Per il trattamento degli altri tipi e’ importante ricordare che non sempre l’ostruzione puo’
essere raggiunta da un approccio sinistro.
Stenosi polmonare
Descrizione: Il restringimento del deflusso ventricolare destro puo’ essere presente a
livello supravalvolare, valvolare e sottovalvolare o infundibolare. La forma piu’ comune
e’ di ostruzione valvolare o sottovalvolare. Nella forma valvolare puo’ essere dovuto ad
una fusione dei lembi valvolari o a displasia, caratterizzata da vari gradi di ipoplasia
anulare o inspessimento e immobilita’ dei lembi valvolari. E’ riportato nel 18% delle
patologie congenite nei cani e, anche se la genetica non è completamente definita, è più
comunemente visto nel beagle, Keeshond, Chihuahua,
bulldog, mastiff, samoyedo,
miniature schnauzers, american cocker spaniel e nei terriers. Il soffio e’ sistolico e udito
meglio cranialmente a livello della valvola polmonare. L’ostruzione al deflusso del
ventricolo destro porta a progressivo aumento della pressione ventricolare con
inspessimento della parete miocardica. La velocita’ aumentata e la turbulenza sono
responsabili della dilatazione poststenotica.
Trattamento: Il trattamento medico mediante l’uso di beta bloccanti per ridurre la
frequenza cardiaca e il rimodellamento cardiaco possono risultare insufficienti quando il
gradiente pressorio
e’ elevato, le condizioni pressorie nel ventricolo destro sono
eccessive e cominciano a manifestarsi segni di insufficienza cardiaca destra. Questo
normalmente si verifica quando il gradiente pressorio attraverso la stenosi e’ superiore a
80-100 mmHg. In questo caso è raccomandabile diminuire il gradiente pressorio
mediante valvuloplastica o chirurgia. Le tecniche chirurgiche sono molteplici ma
vengono selezionate in base alla localizzazione della lesione a livello valvolare,
sottovalvolare o infundibulare. Si può optare per una valvolectomia mediante
arteriotomia polmonare, l’applicazione di un patch sintetico se si tratta prevalentemente
di una lesione sottovalvolare o infundibolare.
L’ intervento chirurgico deve sempre essere preceduto da uno studio angiografico in cui
si valuta il gradiente pressorio ma soprattutto si stabilisce la localizzazione e la natura
della lesione, nonchè la presenza di una arteria coronaria anomala. In questa sezione ci
limiteremo alle tecniche chirurgiche che si possono effettuare con occlusione venosa di
ritorno escludendo le tecniche intervenzionistiche (già trattate precedentemente) e quelle
fatte mediante bypass cardiopolmonare che verranno trattate in seguito. Il primo caso
descritto in medicina veterinaria risale al 1952 dai Rips e Henderson che usarono un
5
bistoury via un “purse string” nel ventricolo destro per rimuovere la valvola polmonare
stenotica. L’occlusione venosa venne inizialmente descritta nel 1959 in medicina
veterinaria. La tecnica del “valve dilator” puo’ essere usata nello stesso modo. Tuttavia,
queste techniche vengono oggi usate raramente.
Le tecniche piu’ comunemente usate sono la valvulectomia mediante arteriotomia
polmonare e la valvuloplastica usando un “patch graft”.
La valvulectomia viene sempre eseguita con toracotomia laterale attraverso il quarto o
quinto spazio intercostale sinistro. Per la valvuloplastica con patch, a seconda della
conformazione del torace, la procedura può essere eseguita mediante toracotomia laterale
sinistra nel quarto o quinto spazio o via sternotomia mediana. I Rommel tourniquets sono
posizionati intorno alle vene cave craniale e caudale, e nel caso della sternotomia
mediana, anche della vena azygous. In condizioni normotermiche, l’occlusione venosa
non dovrebbe eccedere i due minuti. Tuttavia è possibile ripeterla dopo qualche minuto
(cinque-dieci minuti).
Nel caso di una arteriotomia polmonare, l’arteria è aperta durante occlusione venosa e un
bisturi n. 11 o una metz con una debakey sono introdotti per rimuovere la maggior parte
della valvola.
Nel caso della patch technique o una delle sue modificazioni, un patch di materiale
sintetico è presuturato a livello del ventricolo destro e dell’arteria polmonare e, durante
l’occlusione venosa, il patch è aperto per permettere l’incisione longitudinale sulla
valvola e la rimozione della zona stenotica. Il patch è spesso sintetico (dacron o PTFE).
Difetto del setto ventricolare (VSD)
Descrizione: A seconda delle dimensioni può essere classificato come grave, moderato o
lieve, è uno dei difetti cardiaci in assoluto più frequente (interessa circa il 10% di tutti i
pazienti canini affetti da cardiopatia congenita ed e’ la patologia piu’ frequente nel gatto):
tuttavia nell'85% dei casi si tratta di forme lievi che tendono a produrre overload minimo
nel corso della vita. Più comunemente riscontrato nel keeshond, barboncino e schnauzer.
La forma piu’ comune nel cane e’ dovuta all’incompleta chiusura della parte
membranosa, raramente si puo’ osservare a livello muscolare. La tipica localizzazione e’
mediale al lembo settale della valvola tricuspidale, al di sotto della crista
supraventricularis e nella prossimita’ del tessuto di conduzione.
Il soffio e’ spesso udito nella parte destra anche se si puo’ avere un soffio sistolico
funzionale a livello della polmonare.
6
In condizioni di normale pressione nel ventricolo destro, lo shunt ha direzione sinistradestra e puo’ progressivamente portare ad insufficienza cardiaca, arteriopatia polmonare,
ipertensione polmonare e shunt destra-sinistra. In alcuni casi si puo’ osservare
insufficienza dell’aorta per prolasso della valvola nel difetto.
Trattamento: La maggior parte di VSD in cani ed i gatti non richiedono intervento
chirurgico poichè il difetto è piccolo e la frazione dello shunt polmonare a sistemico
(Qp:Qs) è <1.8: 1. Questi pazienti non hanno bisogno della chirurgia e spesso non hanno
nemmeno bisogno del trattamento medico. Il trattamento medico a controllo della
sintomatologia e a supporto della struttura cardiaca e vascolare include diuretici, inibitori
ACE, e idralazina. Trattamento chirurgico dovrebbe essere considerato se le radiografie
mostrano dilatazione vascolare polmonare, o del ventricolo sinistro, progressiva
insufficienza aortica, shunt flow inferiore a 3.5 m/sec e Qp:Qs > 1.8:1.a La tecnica
chirurgica senza l’uso del bypass e’ la fascia polmonare intorno all’arteria polmonare.
La chirurgia dovrebbe essere eseguita il più tardi possibile per permettere la crescita
completa e quindi operare sulle dimensione definitive della polmonare. La chirurgia
viene eseguita mediante toracotomia laterale sinistra nel quarto spazio intercostale.
Appena l’arteria polmonare viene isolata, una fascio di Teflon o ombelicale viene passato
intorno l’arteria polmonare lontano dalla valvola. La fascia è legata al punto tale da
ridurre il diametro ad un terzo del diametro originale. Per essere assolutamente certi si
può introdurre un ago per la misurazione della pressione a livello del ventricolo destro e
nella parte distale dell’arteria polmonare. L'obiettivo di controllare la pressione è di
raddoppiare la pressione ventricolare o dimezzare la pressione polmonare dell'arteria
distale alla fascia.
Possibili conseguenze: eccessivo restringimento della polmonare puo’ portare a shunt
destro-sinistro e ipossemia. Si puo’ anche osservare un progressivo peggioramento di
rigurgitazione tricuspidale dovuta al restringimento della via di defflusso del ventricolo
destro. Questa condizione puo’ essere resa peggiore dalla crescita dell’ individuo, fibrosi
intorno alla fascia e ipertrofia concentrica del tratto ventricolare destro. La conseguenza
di questa complicazione e’ insufficienza cardiaca destra.
a
Pulmonary-to-systemic flow ratio (Qp:Qs) puo’ essere stimato usando l’analisi Doppler del flusso aortico
e polmonare. Un Qp:Qs 1.8:1 indica un difetto emodinamicamente serio.
7
Tetralogia di Fallot
Descrizione: Morfologicamente e’ caratterizzata da un difetto settale ventricolare spesso
molto largo, stenosi polmonare, aorta a cavallo del setto e ipertrofia ventricolare destra.
La Tetralogia di Fallot è più comunemente diagnosticata nel malamute, barboncino
pastore tedesco, rottweiler, sharpei, keeshound, shar pei e wirehair fox terrier. Il soffio
spesso e’ udibile a livello della base cardiaca. Si presentano spesso con policitemia,
cianosi, intolleranza all’esercizio e sincopi che spesso sono simili ad attacchi epilettici.
La sintomatologia clinica e’ simile in pazienti con setto ventricolare incompleto e stenosi
polmonare (fisiologia da tetralogia). Rappresenta il 4 % delle patologie congenite nel
cane.
Trattamento: Il trattamento medico include flebotomia, uso di idrossiurea, beta bloccanti,
dilatatori arteriolari. In caso di eccessiva intolleranza all’esercizio, policitemia con
ematocrito > 65 % che richiede flebotomie frequenti e ipossemia con saturazione arteriale
dell’ossigeno <70 %, si raccomanda la chirurgia. La riparazione palliativa originale per la
tetralogia di Fallot venne effettuata da Blalock nel 1940. La chirurgia è stato inventata e
perfezionata nel laboratorio di ricerca chirurgica al John Hopkins. La tecnica e’ stata
successivamente modificata per meglio adattarsi alle diverse condizioni anatomiche. I
dettagli sono stati descritti nelle relazioni precedenti.
Pacemaker
Condizioni di blocco di conduzione atrioventricolare, patologie a carico del nodo seno
atriale (atrial standstill, sick sinus syndrome) e atrio-ventricolare, fibrillazione atriale non
controllabile con trattamento medico possono essere trattati mediante impianto di un
pacemaker (nel caso della fibrillazione combinato con una ablazione). Le tecniche di
impianto sono molteplici. Qualsiasi tecnica si scelga, bisogna sempre avere un pacemaker
temporaneo che puo’ essere transvenoso piu’ comunemente, ma anche transesofagico o
transtoracico. Il temporaneo transvenoso e’ normalmente posizionato nella giugulare
sinistra. Il pacemaker transvenoso permanente viene spesso impiantato da un cardiologo
attraverso la giugulare destra. Al chirurgo puo’ essere richiesto di fare il “cut down” alla
vena se il cardiologo non e’ suo agio con la procedure di approccio alla vena. Pertanto e’
importante essere a conoscenza della metodica di impianto del pacemaker transvenoso. Il
chirurgo piu’ comunemente impianta il pacemaker epicardico con un approccio
transdiaframmatico. Una laparotomia mediana craniale permette l’accesso al diaframma e
quindi all’apice del ventricolo sinistro. Il pericardio viene aperto e un elettrodo unipolare
8
con testina “screw-in” viene inserito nel ventricolo sinistro, possibilmente lontano dalle
coronarie. Il generatore puo’ essere posizionato tra l’addominale trasverso e il muscolo
addominale interno obliquo. Questa procedura puo’ essere anche eseguita mediante
toracotomia laterale o toracoscopia.
Bibliografia
Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine. St Louis: Mosby, Inc
1998
Orton EC, McCracken TO. Small Animal Thoracic Surgery. Malvern, PA: Williams and
Wilkins 1995
9
COSA FACCIO SENZA BYPASS? – PARTE 2
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Tumori toracici
Per semplificare, i tumori toracici si possono dividere in due categorie: quelli che
coinvolgono il cuore e quelli che coinvolgono il resto della cavità (tumori del polmone,
primari o metastatici, mesotelioma, timoma etc).
Il mesotelioma verrà considerato in questo review perchè può direttamente interessare la
cavità pericardica e quindi presentarsi con sintomatologia cardiaca. Il trattamento
chirurgico può alleviare parte della sintomatologia, ma difficilmente se ne può ottenere il
controllo completo.
I tumori cardiaci sono descritti in dettaglio nel paragrafo successivo.
Versamento pericardio
I versamenti pericardici rappresentano l’1 % delle malattie cardiovascolari nel cane e
possono distingursi principalmente in quattro gruppi:
1) Trasudato
Nelle forme di trasudato pericardico le forme più comune nel cane sono dovute a
insufficienza cardiaca, ernia, pericardio-diaframmatica, ipoalbuminemia e aumento della
permeabilità vascolare.
2) Infiammatorio
Forme virali sono descritte in pazienti umani e possibilmente possono presentarsi in
alcune forme descritte come idiopatiche.
3) Essudato
Questi processi possono essere dovuti a malattie infettive e non infettive. Nella maggior
parte dei casi, nel cane, si osservano in processi infettivi (esempio, coccidiodiomicosi
nelle zone endemiche) e corpi estranei.
4) Emorragico
I versamenti maligni (da emangiosarcoma, chemodectoma, mesotelioma tra i più
frequenti) possono avere le caratteristiche di essudato ma sono spesso emorragici. Le
forme idiopatiche rappresentano la principale diagnosi differenziale. Trauma, rottura
dell’atrio sinistro e intossicazione con anticoagulanti sono meno frequenti, ma possono
causare sintomatologia simile.
1
Le forme benigne più comuni descritte nel cane sono il mixoma e il coristoma (tumore
ectopico tiroideo). Le masse cardiache maligne comunemente associate con versamenti
pericardici nel cane sono l’ emangiosarcoma e il chemodectoma (dei paragangli). Molti
tumori di tipo maligno riscontrati nel cane sono sovrapponibili a simili tumori descritti
nell’uomo.
I tumori della base del cuore o chemodectoma sono descritti più frequentemente in
cani brachiocefalici, specialmente Boston terrier e Boxer. Il tumore si sviluppa intorno
alla base dell'aorta, fra l'aorta, l'arteria polmonare e l'atrio sinistro. Crescono lentamente e
possono essere diagnosticati fortuitamente dalle radiografie nel caso in cui non si abbia
versamento pericardico. Nel caso di versamento, i segni clinici possono variare a seconda
dei fattori descritti a seguito. Nella radiografia, si può notare un aumento della silhouette
cardiaca se c’è versamento, altrimenti si può osservare una massa alla base del cuore, che
può elevare la trachea nella proiezione laterale e deviarla a destra, in una proiezione
dorsoventrale. La diagnosi è confermata da ecocardiografia. Poichè i sintomi sono legati
al versamento pericardico, una pericardiectomia può alleviare i segni clinici.
L’emangiosarcoma è descritto abitualmente nell’atrio destro, come nell’uomo. Spesso
gli animali si presentano con segni acuti di tamponamento pericardico. Mediante
ecografia è possibile stabilire se il tumore può essere rimosso. Tuttavia, non sembra
esserci evidenza concreta di vantaggi con la chirurgia rispetto al trattamento
chemioterapico da solo.
Anche il rabdomiosarcoma può presentarsi nel cane con la stessa sintomatologia
osservata nell’uomo: aritmia nella forma di aritmie ventricolari progressive. Il
condrosarcoma dell’endocardio è stato descritto a livello della valvola tricuspidale con
segni di insufficienza congestiva. Infiltrazione da parte del linfoma può anche essere
associata con versamento pericardico. Come già detto, il mesotelioma può colpire tutte le
membrane sierose incluso il pericardio producendo versamento pericardico.
La quantità di fluido che viene accumulata nella cavità pericardica può anche essere
variabile. Quando è piccola, è spesso asintomatica e può essere rilevata solo da indagini
ecografiche. Quando il versamento è massivo e non può essere più controllato, i pazienti
vanno incontro a insufficienza destra e possibile morte.
Tuttavia un altro fattore
fondamentale nell’insorgere della sintomatologia clinica è dovuto alla velocità di
accumulo. La compromissione emodinamica del cuore dipende non solo dalla quantità
del fluido, ma, soprattutto, dalla rapidità con cui esso si accumula e dalla distensibilità del
2
pericardio: un accumulo rapido di soli pochi ml in un pericardio rigido è più pericoloso di
un accumulo lento di grandi quantita’ di fluido in un pericardio distensibile.
Poiché lo spazio è chiuso, qualunque aumento di volume intrapericardico determina un
aumento della pressione intrapericardica. In condizioni fisiologiche, la pressione
intrapericardica è uguale alla pressione intrapleurica, leggermente inferiore alla pressione
atmosferica. Quando nella cavità pericardica aumenta il volume del liquido si ha un
aumento di pressione. L’aumento della pressione intrapericardica determina in tempi
variabili il tamponamento cardiaco, quando la pressione del fluido dentro il sacco
pericardico eguaglia quella diastolica dell’atrio destro e del ventricolo destro, con
conseguente riduzione dell’output cardiaco. La compromissione della dinamica cardiaca
che ne consegue può portare ad uno stato di shock e quindi alla morte.
Per evitare una drammatica riduzione della gettata cardiaca, la pressione nell’ atrio destro
aumenta, ma progressivamente si instaura una diminuzione del flusso ematico e del
ritorno venoso polmonare al ventricolo sinistro. Il volume di fine diastole infatti è
diminuito così come il volume di eiezione; il risultato è ipotensione sistemica. La
sequenza di questi eventi scatena una fisiologica risposta compensatoria con una
stimolazione adrenergica.
La prima di queste risposte è la tachicardia che si instaura nel tentativo di aumentare la
gettata cardiaca e quindi la pressione sistemica, infatti il volume d’eiezione e di fine
diastole sono limitati dalla aumentata pressione intracardiaca. Il tamponamento
pericardico è associato a segni clinici spesso ben evidenti come distensione addominale e
della giugulare, ipotensione sistemica, toni cardiaci distanti, polso paradosso. La
conseguenza di queste modificazioni è la riduzione della gettata sistolica ventricolare
sinistra con conseguente ipotensione. Oltre all’ osservazione dei segni e dei sintomi l’
unico esame diagnostico specifico e non invasivo è l’ecocardiogramma che metterà in
evidenza il diminuito volume ventricolare, le variazioni delle dimensioni delle camere
cardiache durante la respirazione, la compressione esterna delle camere cardiache e l’
aumento degli spazi anecogeni tra cuore e pericardio. La radiografia del torace e l’
elettrocardiogramma non evidenziano segni specifici.
L’elettrocardiogramma del paziente con versamento pericardico può mostrare alternanza
elettrica. La diagnosi di versamento viene confermata dall’ecocardiografia.
Gli interventi variano a seconda della causa ma, in generale, si possono distinguere in
pericardiocentesi o l’intervento chirurgico. In caso si voglia monitorare la produzione
3
pericardiaca nei giorni successivi la pericardiocentesi, si può impiantare un catetere nel
pericardio e lasciarlo per alcuni giorni.
La forma meno invasiva di pericardiectomia viene ottenuta con palloncino introdotto
attraverso la parete toracica. Nelle forme più invasive si può procedere chirurgicamente
con diverse forme di approccio: toracoscopia (laterale o paraxifoidea), toracotomia
laterale o sternotomia mediana. La visualizzazione e la capacità di manipolare tutte le
superfici cardiache per una pericardiectomia totale è ottimizzata con una toracoscopia
paraxifoidea e la sternotomia mediana. Tutte le tecniche in mano a un chirurgo esperto
posso permettere una pericardiectomia subtotale. Le rimanenti techniche possono essere
usate senza problemi per creare pericardial window.
Trauma
La letteratura veterinaria non fornisce specifici dettagli con dati scientifici sui traumi
toracici. Il trauma toracico contusivo (incidenti stradali, cadute dall’alto) e i traumi
toracici da penetrazione (armi da fuoco, oggetti penetranti, da morso) possono
rappresentare una sfida sia per medico d’urgenza che per il chirurgo. L’interessamento
delle strutture cardiache è visto fino al 20 % di casi di trauma toracico nelle persone, con
una mortalià’ stimata del 70-80 %. A causa della posizione craniale del ventricolo destro,
questa risulta essere la parte più comunemente interessata dal trauma. Se il ventricolo
sinistro o i grandi vasi sono interessati, si deve considerare che i danni possono essere
molto gravi e può rendersi necessario un intervento immediato. L’ecocardiografia è un
test rapido per valutare il danno subito dalle strutture cardiache; tuttavia, a volte, può dare
falsi negativi e fornire immagini di bassa qualità in caso di pneumotorace. Alterazioni
elettrocardiografiche possono essere presenti anche se sono viste solo sporadicamente in
pazienti umani. Se presenti, esse, prendono la forma di elevazioni del segmento ST,
blocchi della branca di destra, tachicardia ventricolare e dissociazione atrioventricolare.
Versamento pericardico è spesso presente e può avere conseguenze devastanti non solo
per il tamponamento cardiaco che ne deriva (accumulo di fluido in tempi brevi), ma
anche a causa dell’emorragia interna. Esiste sempre il rischio di sepsi nelle ferite
penetranti. Considerato quanto appena detto, ogni ferita toracica in cui esiste il sospetto
di interessamento cardiaco, dovrebbe essere esplorata soprattutto se trattasi di un trauma
penetrante. In questi interventi d’urgenza si dovrebbe sempre avere a disposizione sangue
per
trasfusioni
massive
e
trattamenti
aggressivi
di
supporto
dell’apparato
cardiocircolatorio e respiratorio.
4
Bibliografia
Slatter Textbook of small animal surgery. Vol I and II 3rd edition Saunders 2005
Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine. St Louis: Mosby, Inc
1998
5
IL FUTURO DELLA CHIRURGIA INTRACARDIACA IN
VETERINARIA
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Per lungo tempo il cuore è stato un organo guardato con timore dai chirurghi poiché
considerato troppo delicato e complesso per consentirvi un intervento.
Fu soltanto durante il secondo conflitto mondiale che con l’incremento esponenziale di
ferite al cuore si fece sempre più pressante l’esigenza di sviluppare una tecnica che
consentisse di intervenire sul muscolo cardiaco al fine di salvare la vita di quante più
persone possibile. Purtroppo a quel tempo tentare di rimuovere una scheggia era tanto
pericoloso quanto lasciarla all’interno del miocardio.
Cominciarono specifiche sperimentazioni in animali in Europa e in America per potere
raffinare le tecniche chirurgiche e di perfusione cardiopolmonare. Questi primi tentativi
portarono a risolvere patologie valvolari come le stenosi mitraliche nelle fasi in cui il
bypass cardiopolmonare non era ancora comunemente impiegato. L’intervento consisteva
nell’eseguire un piccolo taglio per poi inserire il dito e dilatare la valvola stenotica a cuore
battente. Tuttavia, i primi risultati furono disastrosi con la maggior parte dei pazienti
deceduti soprattutto per le consistenti emorragie.
Il 2 Settembre del 1952 due chirurghi dell’Università del Minnesota, Walton Lillehei e
John Lewis, operarono una bambina di cinque anni con difetto interatriale. Dopo essere
stata anestetizzata venne raffreddata con delle speciali coperte e portata ad una
temperatura di circa 27 °C. La chirurgia venne eseguita con occlusione del flusso venoso.
Successivamente la paziente venne immersa in una vasca d’acqua calda grazie alla quale
venne progressivamente riportata ad una condizione di normotermia. L’intervento fu un
successo e tale metodica si diffuse rapidamente in molti centri. Tuttavia l’approccio
ipotermico era adatto per la correzione di piccoli patologie come appunto i difetti
interatriali, ma spesso gli operatori si trovavano di fronte a situazioni ben più complesse
che non potevano essere riparate neanche con i dieci minuti garantiti dall’ipotermia
moderata.
Si doveva compiere un ulteriore passo in avanti. L’idea di costruire una macchina che
sostituisse il cuore ed i polmoni circolava già da molti anni. Il primo prototipo, "Model I",
venne messo a punto da un altro illustre pioniere: John Gibbon. Il 6 Maggio 1953 segna
1
una data fondamentale per la nascita della circolazione extracorporea, infatti, John Gibbon
e il suo staff presso il Jefferson Medical College Hospital, eseguirono per la prima volta
un intervento di chiusura di difetto interatriale.
Da questo momento in poi la chirurgia cardiaca in medicina umana subì uno sviluppo
esponenziale che ci porta fino ai nostri giorni.
Nel mondo veterinario la chirurgia cardiaca ebbe uno sviluppo molto più timido. I primi
pionieri - tra cui nomi eminenti Drs Eyster, Buchanan e Breznok - cominciarono ad
operare in cani affetti da patologie cardiache negli ultimi anni 60. Sebbene la chirurgia
cardiaca sia stata utilizzata in medicina veterinaria nel trattamento di molteplici difetti sia
congeniti che acquisiti, a differenza del percorso storico osservato nella chirurgia cardiaca
nell’uomo, la chirurgia a cuore aperto in medicina veterinaria comincia e finisce in un
decennio. Nonostante risultati accettabili, il costo e la difficoltà tecnica hanno precluso
l’uso routinario di questi trattamenti. Le spese correnti connesse con la chirurgia variano
da $5000 a $15.000 e questa stima può aumentare se il paziente richiede un lungo periodo
postoperatorio o se una valvola prostetica è necessaria durante la chirurgia.
In questi ultimi anni si osservano solo episodi sporadici di pochi chirurghi nelle diverse
regioni del mondo. Tra questi sono probabilmente da ricordare per il piu’ alto numero di
casi pubblicati fino ad ora, Dr Orton in Colorado e Dr Kanemoto in Giappone. Negli
ultimi anni, Dr Orton è stato il maggiore esponente sul territorio americano ma il suo
centro non è al momento attivo ed è stato affiancato dal Debakey Institute all’Universita’
del Texas A&M. In Giappone il Dr Kanemoto rimane il solo chirurgo veterinario che al
momento è riuscito con succcesso ad operare pazienti con peso inferiore a 10 kg.
Dove siamo diretti a questo punto???
2
PRINCIPI DI PERFUSIONE CARDIOPOLMONARE
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Lo sviluppo attuale di questa tecnologia ha una storia lunga che comincia nel 1930 con il
Dott. Gibbon, ma dobbiamo aspettare fino al 6 maggio 1953 per avere la prima chirurgia
a cuore aperto compiuto dallo stesso Dott John Gibbon all'Università del Minnesota.
In ambiente ospedaliero e’ un tecnico di fisiopatologia cardiocircolatoria e perfusione
cardiovascolare a far funzionare la macchina.
Il sistema bypass come si evince dal termine stesso, ha la funzione di sostituire il cuore
come pompa e i polmoni per le funzioni di scambio di gas durante un intervento a cuore
aperto.
La macchina per il cardiopulmonary bypass puo’ essere accessoriata con molteplici parti
aggiuntive ma ci sono componenti di base, fondamentali per il suo funzionamento:
1. Pompe
2. Ossigenatori
3. Heater and cooler
4. Serbatoio artero-venoso
5. Tubatura
6. Cannule
Pompe
Esistono due tipi principali di pompe usate in percentuali diverse in America e Europa.
Rotatorie
Possono essere singole, doppie o multiple. La pompa ha all’interno un meccanismo
rotatorio che permette la compressione costante di una parte di tubo del circuito.
L’occlusione continua del tubo permette di generare sia pressione negativa che positiva,
rendendo pertanto possibile la propagazione del sangue in avanti ma anche il suo uso per
l’aspirazione di liquidi dall’area chirurgica. Gli svantaggi di questo sistema sono:
eccessiva o inappropriata occlusione, miscalibration, frattura del tubo, perdita di energia,
tromboembolismo.
Radiali o centrifughe
1
Consiste in un nido di coni lisci di plastica o una ventola localizzati in un contenitore di
plastica. Il principio di funzionamento si basa sulla capacita’ di creare un gradiente
pressorio tra l’entrata e l’uscita della pompa. La pressione differenziale provoca il
movimento di fluido. Questo gradiente e’ creato da un vortice generato dalla rotazione
della pompa ad alti rpm. Il vortice determina un’ area di bassa pressione nel centro e una
zona di alta pressione all’ esterno. E’ in genere associato a un rischio contenuto di
embolismo. I principali svantaggi sono il bisogno di un misuratore di flusso, la
possibilita’ di flusso retrogrado quando la pompa rallenta o si ferma. A causa del suo
principio di funzionamento, la pompa, fortemente dipendente dall’afterload, e’ pertanto
fortemente influenzata da cambi in resistenza sia nel paziente che nel circuito. I maggiori
vantaggi nell’uso di queta pompa risiede nell’essere non-occlusiva e pertanto non indurre
il fenomeno chiamato ”spallation”.
Ossigenatori
Rappresentano la parte del circuito responsabile dello scambio gassoso dando ossigeno e
una percentuale di gas anestetico e rimuovendo anidride carbonica. Gli ossigenatori usati
nelle normali chirurgie cardiache, dovrebbero essere limitate a 6 ore. Ossigenatori usati
per periodi piu’ lunghi sono chiamati extracorporeal life support (ECLS) o extracorporeal
membrane oxygenator (ECMO). Esistono delle differenze fondamentali rispetto al
processo di ossigenazione che avviene a livello polmonare a cui provvede l’ingegneria
nella costruzione di queste componenti.
Ossigenatori a “Bubble”.
L’ossigenatore e’ diviso in due parti. Il sangue privo di ossigeno entra passivamente in
una zona dove viene mescolato. L’ ossigeno viene immesso nel flusso ematico causando
la formazione di piccole bollicine. L’ossigeno si unisce al sangue spiazzando l’anidride
carbonica. A questo punto il sangue entra in una seconda area, un serbatoio arterioso,
dove le bollicine di gas che hanno assunto un aspetto di schiuma gassosa, vengono
rimosse dall’azione di una liquido a base di silicone che destabilizza le bolle facendole
implodere. In questo sistema lo scambio di calore avviene nello stesso momento in cui
avviene lo scambio gassoso.
Ossigenatori “a membrana”.
Rappresentano l’ unica forma attualmente usata di ossigenatori, in cui una barriera
semipermeabile produce una separazione tra il sangue e l’ossigeno. Questi ossigenatori
assomigliano a polmoni veri e propri ed offrono una barriera completa tra l’ ossigeno e le
2
fasi di sangue. Le membrane sono per lo piu’ formate con polivinilcloride (PVC) che
offre le migliori caratteristiche per lo scambio gassoso. Nei sistemi a lungo termine come
ECMO e il ECLS, il silicone e’ invece il materiale preferito. La membrana e’ costruita
con fibre vuote di PVC, precedentemente trattate per creare microcanali. La porosita’ di
questo materiale si perde quando la membrana entra a contatto con le proteine ematiche.
Lo scambio di calore avviene prima ed e’ seguito dallo scambio gassoso.
Heater and cooler
Aggiunge o rimuove calore dal sangue. Lo scambio avviene mediante acqua non - sterile
che circola attraverso un calorifero o unità refrigerante.
Serbatoio venoso
E’ un contenitore rigido, non collassabile dove viene accumulato il sangue di ritorno dalle
cannule venose. Da questo serbatoio si diparte il tubo che va alla pompa per poi ritornare
nell’ossigenatore e venir pompato attraverso la cannula arteriosa. Una prima eliminazione
di bolle di aria avviene a questo livello prima che il sangue venga pompato
nell’ossigenatore. Questo deposito rappresenta il centro di molte attivita’ durante il
bypass. Trasfusioni di sangue, farmaci e campioni di sangue per valutare ossigenazione
etc, avvengono in questo serbatoio.
Tubatura
Il diametro interno dei tubi e’ il fattore piu’ importante per la determinazione del
massimo flusso ematico ottenibile con un particolare circuito. La tubatura deve essere
costruita con materiale biocompatible: atossico, nonimmunogenico, nonallergico,
nonmutageno. Il materiale piu’ usato per i circuiti bypass e’ il silicone o il PVC. Da un
punto di vista meccanico il PVC sembra essere superiore per la sua durata nel tempo ma
da un punto di vista di biocampatibilita’ e resistenza a basse temperature, il silicone e’
superiore. La compressione costante puo’ produrre “fatigue” del materiale con rilascio di
microparticelle, questo processo di usura del materiale e’ chiamato “spallation”.
Cannulazione
Esistono diversi tipi di cannulazione fatti a livello vascolare per permettere un normale
flusso durante il bypass. Per comodita’ si possono dividere in questo modo:
Cannulazione arteriosa
Per questo tipo di cannulazione possono essere scelte diverse combinazioni dipendendo
dalle necessita’ e dal tipo di intervento. La piu’ comune e’ la cannulazione dell’aorta
ascendente. Delle altre forme di cannulazione, l’ arteria femorale e’ considerata come
3
prima scelta in pazienti umani che vanno incontro a interventi ripetuti e in pazienti
veterinari in cui si ha limitato spazio nella cavita’ toracica o se si sospetta che la parete
aortica non riuscirebbe a tollerare la presenza di una cannula.
La cannula viene mantenuta mediante una sutura a “purse string” nel muro aortico.
Attraverso un’ incisione nel vaso, la cannula e’ introdotta e diretta verso l’arco.
Cannulazione venosa
Queste cannule devono garantire il ritorno venoso al bypass. Le dimensioni devono
pertanto rispettare il normale ritorno venoso stimato per un paziente di un determinato
peso. La tipica cannulazione usata in pazienti umani e’ chiamata bicava, perche’ due
cannule sono inserite in ciascuna vena cava. In alcuni casi, la cannulazione singola dell’
atrio viene preferita. Altre forme di cannulazione prevedono l’uso di vene periferiche
come la giugulare e la femorale, raramente usate sia per un fattore estetico ma anche
perche’ necessitano l’uso di un sistema aspirante. In pazienti veterinari, la cannulazione
atriale singola sembra essere la piu’ semplice da un approccio laterale mentre una bicava
e’ probabilmente preferita nel caso di una sternotomia mediana.
Una “purse string” viene usata per fissare la cannula a livello della vena cava o dell’
atrio. La sutura viene poi chiusa intorno alla cannula a mo’ di laccio emostatico per
evitare che una parte del sangue passi intorno alla cannula e raggiunga la parte destra del
cuore.
LV vent
Normalmente la zona di entrata e’ nelle vene polmonari, ma puo’ anche essere inserita a
livello aortico o direttamente nel ventricolo sinistro. Mentre la parte destra del cuore e’
normalmente drenata dalla cannula venosa, la funzione di questa cannula nella parte
sinistra e’ di evitare un’ eccessiva dilatazione del cuore sinistro, un eccessivo aumento di
temperatura dovuto alla presenza di sangue, evitare l’espulsione di bolle d’aria e un
miglioramento della visualizzazione chirurgica. In condizioni normali, una quantita’ di
sangue dalle vene bronchiali e tebesiane e una piccola quantita’ di sangue dal cuore
destro si accumula nel ventricolo destro. Inoltre esistono condizioni patologiche che
possono rendere l’accumulo nel ventricolo sinistro ancora piu’ drammatico, le piu’
importanti sono un dotto arterioso pervio o uno shunt sistemico-arteria polmonare (come
un Blalock Taussig, Potts or Waterston), setti ventricolari o atriali, un drenaggio venoso
anormale nel cuore sinistro, rigurgitazione aortica.
4
Cannula per amministrazione della cardioplegia
La cardioplegia puo’ essere somministrata in maniera anterograda o retrograda con una
cannula nell’aorta ascendente o nel seno coronarico.
Cannula per aspirazione
Il sangue presente nel campo chirurgico e nelle cavita’ cardiache che, viene aspirato
durante la chirurgia, viene reintrodotto nel circuito mediante l’uso di cannule per la
suzione. Ne esistono di diversi modelli, vengono messi in funzione da una pompa che
permette l’aspirazione del sangue e il trasporto nel deposito venoso, dove si unisce al
resto del sangue.
Cardioplegia
L’infusione permette di ridurre al minimo il danno miocardico durante il clampaggio
aortico mediante infusione di una soluzione fredda nel letto vascolare coronarico.
In caso di mancata protezione, il danno miocardico irreversibile puo’ manifestarsi dopo
solo 20 minuti, anche se esiste un certo margine di protezione garantito dal livello di
ipotermia raggiunto. In questo modo i tempi di ischemia possono essere sensibilmente
prolungati al punto che periodi di arresto di tre-quattro ore vengono tranquillamente
tollerati dai tessuti senza che vi sia la minaccia di un danno irreversibile. Diverse
tipologie di soluzioni cardioplegiche sono attualmente usate. Per convenienza è possibile
distinguerle in due principali gruppi:
Cardioplegia cristalloide
Cardioplegia cristalloide-ematica
La cardioplegia cristalloide fredda è stata la prima ad essere sperimentata ed e’
caratterizzata da una componente completamente cristalloide e da una temperatura di
somministrazione di circa 4°C. Nella famiglia delle cristalloidi è possibile distinguere fra
soluzioni intracellulari ed extracellulari. Le soluzioni intracellulari, caratterizzate dalla
bassa concentrazione di sodio e procaina e dall'assenza dello ione calcio, inducono
l'arresto cardiaco riducendo i gradienti ionici transmembrana. L'osmolarità viene
mantenuta con l'aggiunta di mannitolo nella soluzione. Le soluzioni extracellulari
agiscono variando le concentrazioni ioniche extracellulari aumentando nello specifico le
concentrazioni extracellulari di potassio. In tal modo si produce un'iperpolarizzazione di
membrana che arresta il cuore in diastole mantenendo uno stato di quiescenza elettrica.
5
Questa soluzione è stata successivamente modificata a costituire una parte ematica ed una
cristalloide secondo un rapporto che tipicamente e’ di 4:1. La parte ematica è
rappresentata dal sangue autologo proveniente dall'ossigenatore che si combina
direttamente con la composizione cristalloide. Il raffreddamento della soluzione avviene
per passaggio in uno specifico scambiatore di calore, impostato a seconda del protocollo
ad una temperatura tra i 4-12°C. Ciò permette una somministrazione di tipo intermittente.
Attualmente questa soluzione e’ probabilmente la piu’ usata in ambiente clinico. I
vantaggi sono rappresentati dalle seguenti proprieta’ della soluzione:
Sangue: veicolo di ossigeno, sistema tampone, proprietà osmotiche, substrato metabolico;
Cristalloide: composizione elettrolitica e pH fisiologici, presenza di antiossidanti e
stabilizzatori di membrana;
Temperatura: il freddo induce riduzione del metabolismo, riduzione richiesta di O2,
miglioramento della protezione miocardica.
Bibliografia
Gravlee GP, Davis RF, Stammers AH, Ungerleider RM. Cardiopulmonary Bypass.
Principles and practice. 3rd edizione; Philadelphia PA: Lippincott Williams & Wilkins
2008
Orton EC, McCracken TO. Small Animal Thoracic Surgery. Malvern, PA: Williams and
Wilkins 1995
Mavoudis C, Backer CL Pediatric Cardiac Surgery. 3rd edizione Mosby 2003
6
La Terapia Elettrica delle Aritmie:
Pacemaker e Ablazione con Radiofrequenza
Roberto
A.
Santilli
Dr
Med.Vet.
D.E.C.V.I.M.‐C.A.
(Cardiology)
Clinica
Veterinaria
Malpensa
–
Viale
Marconi,
27
–
21017
–
Samarate
–
Varese
–
Italy
e‐mail:
[email protected]
USE
OF
TRANSCUTANEOUS
EXTERNAL
PACING
DURING
PACEMAKER
IMPLANTATION IN DOGS
Santilli R.A., Noomanovà N., Perego M. Use of transcutaneous external pacing during pacemaker
implantation in dogs. Proceedings 17th ECVIM-CA Congress. Budapest 2007;1:235.
Transvenous
pacemaker
implantation
(PMI)
is
commonly
indicated
in
symptomatic
bradyarrhythmias caused by high-grade second (HG2°AVB) and third-degree atrioventricular block
(3°AVB), persistent atrial standstill (PAS) and sinus node dysfunction (SND). Because of high risk
of cardiac arrest during PMI procedures, temporary cardiac pacing is usually set to prevent lifethreatening conditions. There are several reports in dogs on using temporary transvenous pacing
(TTP) but only one on transcutaneous external pacing (TEP) in clinical setting. The aim of this
study was to evaluate retrospectively the clinical utility of TEP during transvenous PMI in dog.
Forty dogs were referred to our clinic for PMI, because of symptomatic bradyarrhythmias: 3°AVB
(72,5%), SND (10%) and HG2°AVB (10%) and PAS (7,5%). Labrador retriever was the breed
most represented, 23/40 were males, 17/40 females. The mean age was 8.3 + 4.1 years, the mean
body weight 25.92 + 13.91 kg. We positioned patch electrodes of TEP device on both sides of the
thorax before induction of general anaesthesia. TEP was initiated after onset of asystole or profound
bradycardia (<20-25 bpm), using synchronous transthoracic pacing with a mean current output of
65 mA to induce ventricular capture with pacing rate 40-60 ppm. TEP was stopped when permanent
pacemaker lead was positioned and pacemaker was programmed.
The use of TEP resulted
necessary in 12/40 dogs: 8/12 dogs with 3°AVB, 2/12 dogs with PAS and 2/12 dogs with SND. We
obtained successful external pacing in all but one dog. TEP induced a polymorphic ventricular
tachycardia in one case where sinus rhythm was successfully restored with biphasic shock. Despite
the use of TEP we assess sensing threshold and slew rate in all but one dog. Both in our sample and
the previous reported study the use of TEP caused few complications and equipment failure. On the
other hand TTP is a more time consuming technique reserved to specialized personnel and it is
associated with higher risk of infections and venous access bleeding. Our results indicate that TEP
could be a valid tool to reduce asystole or low heart rate in at least 1/3 of patients during pacemaker
implantation with few complications and that its use do not counteract with analysis of native
rhythm.
CARDIOSTIMOLAZIONE PERMANENTE ENDOCARDICA
Il pacemaker è un sistema di stimolazione cardiaca permanente, formato da un generatore di impulsi
ed un elettrocatetere che conduce lo stimolo elettrico alle camere cardiache.
Il pacing cardiaco è una tecnica che è stata introdotta circa 50 anni fa nel uomo e circa 11 anni
dopo, nel 1968, è stato eseguito il primo impianto di pacemaker nel cane. Durante questi
cinquant’anni la tecnica ha avuto grossi giovamenti dallo sviluppo tecnologico, informatico ed
elettronico e da un punto di vista delle funzioni, delle dimensioni e della fonti di energia.
Dai primi dispositivi di grosse dimensioni, trapiantabili per via toracotomica, unicamerali asincroni
alimentati con pile a zinco mercurio e con frequenza di uscita fissa, si è passati agli attuali
dispositivi, biventricolari, di dimensioni contenute, alimentati con batterie al litio-iodio sequenziali
multiprogrammabili, dotati di funzione rate-responsive, utili nella bradicardia, nella tachicardia, e
nello scompenso cardiaco. Naturalmente tutto questo ha reso l’utilizzo dei pacemaker più
complesso.
Il pacemaker è costituito da:
Il generatore :é costituito da una batteria e da complessi circuiti elettronici: un circuito di uscita, un
circuito di sensing, un circuito temporizzatore e un sistema di telemetria in grado di trasmettere e
ricevere istruzioni di programmazione e informazioni diagnostiche. I più moderni cardiostimolatori
hanno un circuito per il sensore di adattamento della frequenza.
L’utilizzo del litio-zinco come fonte di energia nelle batterie ha permesso di prolungare molto la
duratura ( 7-10 anni ), e di prevedere in anticipo l’esaurimento della batteria stessa.
Elettrocateteri: sono costituiti dagli elettrodi e da sistemi di isolamento, di conduzione e di
fissaggio e possono essere uni o bipolari. Il sistema unipolare è formato da un unico elettrodo la cui
punta ( in contatto col miocardio ) funge da catodo e l’involucro da anodo. Nel sistema bipolare la
punta funge sempre da catodo ma l’anodo è costituito da un anello localizzato a 1-2 cm dalla prima.
I vantaggi dei cateteri unipolari sono la semplicità e la resistenza ma, tuttavia, hanno un’area di
sensing maggiore, per cui uno stimolo atriale può essere percepito come impulso ventricolare così
come le interferenze ambientali possono essere percepite più facilmente.
I materiali utilizzati per l’isolamento sono il silicone o il poliuretano. I secondi sono più sottili e
resistenti e sono meno trombogenici ed esercitano minor attrito.
A seconda della modalità di stimolazione esistono diversi elettrodi: uno per la modalità VVI e AAI,
uno per la modalità VDD e due per la modalità DDD. Il catetere VDD si distingue dal catetere
tradizionale di tipo ventricolare (VE), per la presenza del floating atrial electrodes FAE,
responsabile del sensing atriale. La distanza tra il (VE) ed il (FAE), può essere 11, 13, 14, e 15 cm
Il meccanismo di fissazione dei cateteri può essere attivo o passivo. Il meccanismo passivo prevede
che alla punta del catetere ci sia un elemento sporgente ad uncino o ad elica che intrappolandosi
nell’endocardio produce una reazione fibrotica. La fissazione attiva è relativamente più moderna e
utilizza meccanismi a vite estraibile e consente un posizionamento preciso in siti diversi dall’apice
del ventricolo dx o dell’auricola, inoltre questo tipo di catetere può essere rimosso più facilmente.
Tecnica di impianto
In anestesia generale viene preparata in modo asettico ed in ambiente adeguato la regione del collo
destra o sinistra. Si applica un pacemaker temporaneo trancutaneo fatto funzionare in modalità VVI
alla frequenza di 70 bpm in caso di profonda bradicardia o ipotensione arteriosa.
A questo punto viene esposta chirurgicamente la vena giugulare e viene introdotto l’elettrodo che
sotto il controllo dell’intensificatore di brillanza, viene posizionato all’apice del ventricolo destro
dove viene ancorato. Il corretto inserimento viene verificato attraverso diverse proiezioni
fluoroscopiche, controllando le soglie di stimolazione ed il potenziale di rilevamento del segnale
endocavitario. In caso di funzionamento DDD viene anche posizionato un secondo elettrodo a J
preformata che viene ancorato all’auricola destra. Il potenziale del ventricolo e dell’atrio vengono
misurati tramite un sistema di rilevazione e pacing temporanei. Fissato il catetere, si sfila il
mandrino per dare a questo maggiore flessibilità, lo si collega al generatore attivando la
stimolazione ad una frequenza di 60 bpm. In caso di elettrodo VDD dopo aver assicurato la
fissazione all’apice del ventricolo destro, si posiziona la (FAE), sicuri che il catetere stia ricevendo
il sensing atriale, con l’obbiettivo di riuscire ad ottenere il sensing della parte medio superiore
dell’atrio destro. Nello stesso tempo è necessario assicurare una minima distanza tra il punto (AV)
ed il punto (FAE), senza che gli impulsi ventricolari possano interferire con quelli atriali. A questo
scopo sono stati utilizzati con successo diversi configurazioni del catetere 1) si crea una loop 2) si fa
protrudere dentro la vena cava caudale 3) estenderlo nel tratto di efflusso del ventricolo dx 4)
formando una “S”.
Nel sottocute del collo, o a livello del torace, dopo una adeguata preparazione, si ottiene una loggia
per il pacemaker; si crea un tunnel tra la zona giugulare e la loggia, per poter far passare il catetere,
particolare attenzione va nel far passare il catetere di tipo VDD rispetto al VVI tradizionale in
quanto il primo è a forma di “Y”; si collega il catetere al pacemaker e, dopo aver verificato il
funzionamento del dispositivo tramite un elettrocardiogramma, si deposita il pacemaker nella loggia
appositamente creata per contenerlo. L’animale viene fasciato in modo da limitare il movimento
del collo per 20 giorni.
Successivamente al posizionamento degli elettrodi vengono registrate le soglie di pacing e di
sensing. Tenendo presente che essi possono essere modificati nel tempo, bisogna mantenere un
certo margine di sicurezza. Nel caso del VDD per riuscire a mantenere un sincronismo AV è
indispensabile distinguere tra l’attività atriale e quella ventricolare, i miopotenziali provenienti
fuori dal cuore, ed segnali elettrici dell’atrio. Al momento dell’impianto è necessario ottenere una
soglia di pacing atriale < 1.5 v e una soglia ventricolare <1v. Nelle 2-4 settimane successive si
raggiunge un picco che si stabilizza dopo 6-8 settimane e dopo 2-3 mesi dall’impianto l’uscita viene
programmata a non meno del doppio della soglia di stimolazione in modo tale da mantenere un
adeguato margine di sicurezza ed una durata più lunga. I modelli più recenti utilizzano algoritmi che
misurano automaticamente la soglia di stimolazione, confermano la cattura e regolano
automaticamente l’ampiezza di stimolazione battito a battito riducendo al minimo il consumo della
batteria.
Il sensing viene misurato in mv come distanza picco-picco o base-picco dell’elettrogramma
intracavitario. La sensibilità ventricolare è generalmente programmata tra 2-3 mv per mantenere un
adeguato margine di sicurezza nella rilevazione della depolarizzazione ventricolare, evitando
fenomeni di oversensing delle onde T o di artefatti. Per l’atrio i valori sono 1-2 mv e a volte, in caso
di fibrillazione striale, bisogna utilizzare dei voltaggi ridotti.
Il sensing ed il pacing del VDD presenta delle caratteristiche diverse rispetto a quelle discusse in
precedenza, in aggiunta ai parametri standard ventricolari del VVI, il VDD necessita di diversi
tempi di intervallo ed una sensibilità atriale programmabile per mantenere la P-R ed un sincronismo
AV.
Classificazione dei Pacemaker in base alla modalità di funzionamento
La North America society of pacing and electrophysiology ( NASPE) e il British pacing and
electrophysiology group (BPEG) hanno stabilito un codice a 5 lettere che descrive la modalità di
funzionamento
1)
indica la camera stimolata: A ( atrio ), V ( ventricolo ), O ( nessuno ), D ( bicamerale
)S ( Monocamerale ) .
2)
Camera rilevata : le lettere sono le stesse.
3)
Risposta al rilevamento: O ( nessuno ) I ( inibisce la stimolazione al rilevamento ) T
( trigger o azionamento della stimolazione ) D ( inibisce e triggera ).
4)
Programmabilità e risposta in frequenza: O (nessuna ), R ( frequenza variabile ) P (
programmazione semplice ) M ( programmazione multipla ) C ( trasmissione dati )
5)
Funzione antitachicardica .
Modalità di stimolazione
Diverse modalità di dispositivi sono stati e sono tuttora in corso di studio, per riuscire a sopperire a
tutte le esigenze nelle varie patologie elettriche del cuore. Il dispositivo VVI era sicuramente il più
usato. Con lo sviluppo dei dispositivi nuovi e l’allargamento dei pazienti cui il pacemaker può
allungare la vita e migliorare la qualità di vita dello stesso, l’utilizzo del VVI è stato abbandonato a
favore di altri dispositivi selezionati in funzione della malattia cardiaca sottostante.
alcuni esempio di pacemaker sono: VVI, AAI, VOO, DDI, VDD, DDD, ecc.
VVI:
Il ventricolo è la camera sentita e stimolata ed un stimolo ventricolare nativo inibisce lo stimolo in
uscita. Il VVI ha la funzione di isteresi: è una funzione programmabile che consiste in un intervallo
di scappamento ventricolare più lungo dopo un battito nativo che dopo un battito stimolato.
Questo tipo di pacemaker è semplice, protegge dalla bradicardia ma non riesce ad ottenere la
sincronizzazione atrioventricolare. Questa situazione può non essere tollerata in molti pazienti. Può
essere invece la scelta più appropriata in caso di fibrillazione atriale.
VDD
In questo caso il dispositivo, stimola il ventricolo, rileva l’attività in entrambe le camere cardiache e
risponde all’attività atriale con una stimolazione ventricolare.
L’attività ventricolare nativa inibisce la stimolazione del pacemaker, ed un evento atriale da inizio
ad un intervallo AV seguito da un stimolo ventricolare. Se non è presente un attività atriale il
pacemaker eroga stimoli ventricolari ad una frequenza minima. Come nella modalità VVI, il VDD
non è indicato nei casi di disfunzione sinusale, mentre è indicato nei casi di un blocco AV con una
normale attività sinusale.
Il pacemaker VDD è formato da un unico catetere provvisto di due elettrodi ventricolari distali uno
per il pacing e l’altro per il sensing. Ed uno atriale per il sensing, prossimale.
Il dispositivo VDD prevede il beneficio fisiologico della sincronizzazione atrioventricolare con un
singolo catetere.
La sincronizzazione atrio-ventricolare ed interventricolare è stata da molto tempo l’oggetto di studio
ipotizzando l’importanza specialmente in determinate patologie cardiache, la
mancanza di
sincronismo atrio ventricolare determina una seria alterazione nell’emodinamica in quanto si perde
il trasporto attivo dell’atrio.
In un studio condotto da Janusz Sielski. Et. al. In due gruppi di persone di 20 soggetti l’uno, è stato
confrontato l’impianto di VVI nel primo gruppo con quello di VDD presente nel secondo, nel
trattare i disturbi di conduzione AV. Il confronto si basava sulla concentrazione nel sangue di ANP
( atrial natriuretic peptide) e la funzionalità dell’atrio sinistro attraverso l’ecocardiografia
transtoracica.
I risultati dello studio dopo 7 e 30 giorni sono stati che mentre a distanza di 7 giorni la differenza di
ANP e la funzionalità dell’atrio sinistro non cambiava nei due gruppi, a distanza di 30 giorni la
differenza della funzionalità dell’atrio sinistro era significativamente aumentata nel gruppo trattato
con VDD, rispetto a quello trattato con VVI.
In un altro studio retrospettivo in 700 pazienti umani effetuato da Maruan C Chabbar et al. Il
dispositivo è stato impiantato in pazienti che nel 66.4% dei casi erano blocco di III grado, nel 6.4%
avevano un aritmia sopraventricolare e solo il 0.3% dei pazienti necessitava l’impianto di DDD. Nel
follow- up il 91.4% dei pazienti erano ancora in pacing di tipo VDD solo nel 8.3% dei pazienti è
stato necessario passare ad un stimolazione di tipo VVI. Secondo questo studio il pacing con un
catetere singolo di tipo VDD sembra dare un ampio margine di sicurezza nelle patologie per cui è
indicato.
La valutazione dei vantaggi nell’utilizzo della
stimolazione VDD rispetto al VVI in campo
veterinario è stato l’obiettivo di Bulmer et. al. nello studio effettuato, valutando 10 cani durante le
12 settimane successive all’impianto di pacemaker VDD.
Nello studio sono stati valutati: il diametro dell’atrio sx indicizzato alla superficie corporea, che si
riduce significativamente, il rapporto atrio sx / aorta, dimensione del ventricolo sx alla fine della
sistole,l’aumento della frazione di accorciamento, velocità del doppler aortico, la portata cardiaca, e
la gittata in comparazione con quella prodotta nel pacing di tipo VVI .Si è cosi evidenziata una
significativa riduzione della frequenza cardiaca nel pacing VDD rispetto a quella del VVI. Inoltre la
sincronizzazione atrio-ventricolare porta anche ad una riduzione della concentrazione di ANP ( Nterminal proatrial natriuretic peptide ), norepinefrina, ed epinefrina, in comparazione con i cani con
un pacing che non porta ad una sincronizzazione atrio-ventricolare. Nonostante l’assenza di
differenze radiografiche, di pressione sistemica e di percezione di miglioramento della qualità di
vita da parte del proprietario degli animali, il pacing di tipo VDD in questo studio ha condotto ad
una sincronizzazione atrio-ventricolre quasi nei 100% dei casi, portando dei benefici emodinamici
e neuro ormonali a lungo termine.
DDD
Stimola e sente sia l’atrio che il ventricolo. E può rispondere all’attività sentita con l’inibizione o
con la stimolazione. E’ una stimolazione di tipo fisiologico perché all’attività atriale sentita o
stimolata segue un’attività ventricolare sentita o programmata con un tempo di conduzione
atrioventricolare programmabile.
Nei Pacemaker VDD e DDD inoltre in aggiunta ad una frequenza minima viene programmata una
frequenza massima oltre la quale gli eventi atriali non vengono più trascinati al ventricolo. In questi
casi il pacemaker stimola il ventricolo con un blocco tipo Wenckebach 2:1.
Un funzione molto importante è la rate responsive o la capacità del pacemaker di aumentare il
limite inferiore di frequenza in risposta a stimoli fisiologici. I VVI ed il AAI non consentono
l’incremento della frequenza durante l’esercizio fisico. Il DDD invece lo consente in maniera
fisiologica come risposta a un accelerazione del ritmo sinusale. In caso di disfunzione del nodo del
seno la frequenza di stimolazione può non incrementare in modo consono alle aumentate esigenze,
In questi casi esistono degli speciali sensori che rilevano diversi processi fisiologici aumentando di
conseguenza la frequenza.
La modalità migliore di pacing deve essere quindi valutata caso per caso. I sensori attualmente
disponibili si dividono in fisiologici e tecnologici. Ad esempio alcuni sensori risentono della
variabilità di catecolamine o dell’attività del sistema nervoso autonomo o dell’intervallo QT, della
ventilazione-minuto, della temperatura venosa e del pH. Altri rilevano cambiamenti esterni come le
vibrazioni o l’accelerazione che si verifica durante l’attività.
La combinazione di due sensori può essere sufficiente per riprodurre una risposta il più simile a
quella del nodo del seno.
Complicanze dei pacemaker
Molte delle complicazioni e malfunzionamenti dei pacemaker sono stati descritti ampiamente sia
nell’uomo che nel cane. Tra le complicanze più comune riscontriamo:
Perforazione cardiaca:
è un complicanza rara ma pericolosa, può avvenire durante la manovra stessa di impianto, o a
distanza di mesi soprattutto utilizzando dei cateteri a fissazione attiva.
Ematoma seroma:
in sede della tasca per il posizionamento del pacemaker, può variare da una banale ecchimosi ad
una tumefazione molto ampia. Poche volte necessitano un svuotamento chirurgico, nella maggior
parte basta la compressione tramite bendaggio.
Infezioni:
L’utilizzo della profilassi antibiotica e la sterilità riduce di molto la possibilità di infezione. I segni
di infezione comprendono un infiammazione localizzata con formazione di ascessi, l’erosione dello
stimolatore e la febbre con un emocoltura positiva. L’ecografia può essere d’aiuto in questi casi per
identificare le vegetazioni sugli elettrodi. In caso di infezione in genere è necessario rimuover tutto
l’impianto.
Dislocazione dei cateteri:
si può verificare nella prima settimana di impianto. I diversi meccanismi di fissazione attiva o
passiva hanno contributo a ridurre questa complicazione. Si verifica più spesso per il catetere atriale
che per quello ventricolare. La dislocazione si manifesta con un aumento della soglia di
stimolazione, deficit di cattura, o di sensing. Può essere diagnosticato radiologica mente.
Frattura del catetere.
La frattura del catetere può verificarsi più facilmente a livello dell’accesso venoso, In seguito, per
esempio ad un danno da schiacciamento.
Erosione cutanea.
la scelta del punto nel quale viene inserito il generatore nella tasca apposita, l’uso di generatori di
grande dimensione, il grasso sotto cutaneo. L’inserimento di generatori di piccola dimensione al
livello del torace, sembra dare maggiore stabilità e meno possibilità di erosione. Questo tipo di
complicazione molto spesso si risolve con la medicazione locale, ed una
terapia antibiotica
adeguata.
Esperienze di impianto di pacemaker in medicina veterinaria
La sopravvivenza media dei cani sottoposti ad impianto di pacemaker permanente è tra 4-42 mesi (
16.9 mesi. Le complicazioni più importanti sono: la dislocazione del catetere, infezioni, ematomi,
stimolazioni dei muscoli scheletrici, aritmia ventricolare, migrazione del generatore eruzioni
cutanee. La dislocazione del catetere è la complicazione maggiore.
Nello studio retrospettivo condotto da Mark A. Oyama, et. al. ,2001 vengono definite le pratiche ed
i risultati del pacing artificiale nel cane, in 7 centri referenza negli USA. Sono state prese in
considerazione le indicazioni tecniche d’impianto, le complicazioni, risultati a lungo termine e la
soddisfazione dei proprietari . Sono stati esaminati 154 cani trattati, da l 1 gennaio del 1991 al 1
gennaio del 1996. I risultati sono stati i seguenti:
Il 59% presentava blocco atrioventricolare di III grado, il 29% disfunzione del nodo del seno; nel
88% dei cani è stata utilizzata la tecnica trans venosa mentre nel 12% quella epicardica; 55% dei
cani hanno avuto complicazioni: il 33% complicazioni maggiori (10% dislocazioni del catetere, 6%
insufficienza del generatore, 6% arresto cardiaco durante l’impianto, 5% infezioni), ed il 31%
complicazioni minori ( 12%, stimolazione muscolare nel 11%, aritmie nel 10%). Il 9% sia
complicazione maggiori che minori .
La sopravvivenza è stata di 1,2 e 3 anni nel 70, 57e 45% rispettivamente. L’età e l’insufficienza
cardiaca congestizia hanno avuto effetti negativi sulla sopravvivenza. Il 60% dei pazienti affetti da
insufficienza cardiaca congestizia è morto entro 1 anno dall’impianto. Più del 80% dei proprietari
dei cani sono rimasti soddisfatti delle procedure.
Nello studio condotto da Gerhard Wess et al. le patologie e le indicazioni erano molto simili rispetto
allo studio citato in precedenza, ma un’importante differenza consisteva nella percentuale di
complicanze, che sono risultate decisamente inferiore. Tale differenza potrebbe essere stata causata
dall’usa di differente procedure, criteri di supervisione ed esperienza degli operatori.
La stessa differenza nelle percentuali di complicazioni è stata riscontrata nello studio retrospettivo
condotto da Oriol Domenech, et al. e di quello di Johnson et al. In questi studi le complicanze sono
risultate decisamente inferiori.
IMPIANTO DI PACEMAKER PERMANENTE ENDOCARDICO NEL CANE: STUDIO
RETROSPETTIVO SU 36 CASI.
Santilli R, Perego M, Voghera S. et al Proceeding SCIVAC forum Rimini 2007;1:
Introduzione: L’impianto di pacemaker permanente endocardico nel cane rappresenta il
trattamento d’elezione in pazienti affetti da bradiaritmie quali blocco atrioventricolare di II° e
III°, disfunzione sinusale e silenzio atriale. Il dispositivo è costituito da una batteria in grado di
generare impulsi elettrici trasmessi al miocardio ventricolare tramite un elettrocatetere. In
letteratura sono riportate complicanze maggiori e minori in percentuale del 13-34% e 11-23%.
Scopo del lavoro: Lo scopo del lavoro è stato quello di descrivere le caratteristiche dei
cardiostimolatori impiantati e valutare il tasso di complicanze occorse durante e dopo l’impianto.
Materiali e metodi: Sono stati analizzati in modo retrospettivo 36 cani sintomatici per bradicardia
sottoposti ad impianto di pacemaker endocardico presso la Clinica Veterinaria Malpensa nel
periodo compreso tra gennaio 2004 e dicembre 2006. Tutti i pazienti sono stati sottoposti a visita
clinica, elettrocardiogramma, Rx torace ed ecocardiografia. Per ogni impianto sono stati raccolti
i seguenti dati: modalità di funzionamento del pacemaker, configurazione e tipo di fissazione
dell’elettrocatetere, frequenza cardiaca di stimolazione, ampiezza e durata degli stimoli atriali e
ventricolare, valori di soglia di stimolazione ed impedenza in acuto, utilizzo di pacemaker
esterno o di defibrillatore bifasico, tempi di fluoroscopia, presenza e tipologia delle complicanze.
Risultati: Il gruppo di studio è costituito da 36 soggetti di cui 20 maschi (55,5%) e 16 femmine
(44,5%) appartenenti alle seguenti razze: labrador (19,4%), bracco tedesco (8,3%), meticcio
(13,8%), altre razze (42%), con un’età media di 8,3 ± 4,1 anni e con un peso medio di 24,9 ±
14,3 kg. I soggetti sono risultati affetti dalle seguenti bradiaritmie: blocco atrioventricolare di III°
permanente (66,7%), blocco atrioventricolare di III° parossistico (5,5%), blocco atrioventricolare
di II° avanzato (11,2%), sindrome del seno malato (8,3%) e silenzio atriale persistente (8,3%). Il
52,7 % dei soggetti presentava sintomatologia sincopale, il 33,3% debolezza periodica ed l’ 11,2
% risultava in terapia per insufficienza cardiaca congestizia. Le tipologie di pacemaker
impiantati sono state le seguenti: V.V.I. (33,4%), V.V.I.R. (52,9%), D.D.D. (8,3%), V.D.D.
(2,7%). Nel 77,7% dei soggetti è stato utilizzato un elettrocatetere a fissazione passiva e nel
22,3% a fissazione attiva configurato in modalità unipolare nel 41,6% e in bipolare nel 58,4%.
La frequenza cardiaca di stimolazione base è stata programmata a 60 bpm nell’83,3% e a
frequenze maggiori (75-90 bpm) nel 16,7%. L’ampiezza dello stimolo ventricolare è stato
programmato a 3,5 V per tutti i soggetti con durata 0,5 ms, i valori di soglia ventricolare acuti
sono stati 2,75 ± 0,11 mV e l’impedenza 1192 ± 641Ohm. L’utilizzo del pacemaker temporaneo
esterno si è reso necessario nel 16,6% dei soggetti (stimolazione 76,6±28 mA), mentre nel 5,5%
dei soggetti è stata effettuata una defibrillazione asincrona bifasica con successo per insorgenza
di torsioni di punta. I tempi di fluoroscopia medi sono 10,62 +/- min. Le complicanze maggiori
sono occorse nel 19,4% dei soggetti (1 decesso intraoperatorio, 3 dislocazioni, 1 reazione a
punti, 1 infezione della tasca) mentre le minori (seroma) nel 5,5%.
Discussione: Nel nostro studio, come già confermato da studi precedenti, l’indicazione più
frequente all’impianto di pacemaker è stata il blocco atrioventricolare di III°. Nel nostro gruppo
di cani la dislocazione dell’elettrodo è occorsa nel l’8,3% dei soggetti similmente ai dati presenti
in letteratura (10%), mentre l’infezione della tasca è intervenuta nel 2,7% dei casi rispetto al 5%
dei dati precedenti. Le complicanze minori si sono evidenziate in una percentuale ridotta di
soggetti (5,5% vs 11-23%).
Conclusioni: L’impianto di pacemaker costituisce l’unico intervento terapeutico attuabile in
soggetti sintomatici affetti da bradiaritmia con elevati tassi di successo in presenza di una bassa
percentuale di complicanze maggiori e minori.
MAPPING AND ABLATION OF CANINE ARRHYTHMIAS
Santilli R.A. Proceedings 16th ECVIM_CA congress. Amsterdam 2006;1:48-50.
Electrophysiological study
Electrophysiological (EP) study is considered the method of choice to recognise cardiac
arrhythmias, to analyse their origin and to evaluate underlining mechanisms. It consists of a
systematic analysis of dysrhythmias by recording and measuring a variety of EP events with the
patient in the basal state and by evaluating the patient’s response to programmed electrical
stimulation.
1
tachycardia.
2-6
Few studies reported the use to this technique in dog with supraventricular
In dog EP investigations are performed in general anesthesia. The animals are
placed in dorsal recumbence. Three multipolar electrode catheters are inserted in the venous system,
with Seldinger technique, using fluoroscopic and intra-cardiac ECG guidance: a decapolar catheter
is inserted through the right external jugular vein into the coronary sinus, two quadripolar catheter
through the right femoral vein, one to record the His bundle potential and one for programmed
electrical stimulation, is placed, alternatively, in high right atrium, and right ventricular apex. All
intra-cardiac electrograms, 12-lead surface ECG are displayed and analyzed on an EP recorder 26
.
Normal conduction intervals (A-H and HV), effective antegrade and retrograde refractory periods
(ERP) and Wenckebach point of the normal AV node are first obtained. Normal values have been
described in 15 adult dogs before and after administration of atropine and propranolol.3 Antegrade
and retrograde ERP of the AV node can be measured using programmed stimulation technique. A
paced train of 8 extrastimulus (S1) are delivered respectively to ventral septal right atrium and
right ventricular apex with a current of 2 mA and duration of 2 ms. S1-S1 interval or drive cycle
length set is slightly minor of native sinus rhythm, after the eighth stimulus a premature
extrastimulus (S2) is introduced with progressively shorter S1-S2 interval (from 300 to 180 ms)
until S2 is not conducted through the AV node. ERP of the AV node is defined as the longest S1S2 interval at which S2 failed to reach the His Bundle (antegrade) or ventral right atrium
(retrograde). Similarly to human being 46 % of dogs present ventriculo-atrial (VA) conduction
during the basal state, and it is enhanced by high sympathetic tone1,3. Antegrade and retrograde AV
node Wenckebach point is obtained with incremental atrial and ventricular pacing. Pacing cycle
length at which type I atrioventricular or VA block occurs is considered the Wenckebach point.3
Response of AV nodal conduction time to progressively premature atrial extrastimulus is also
important to diagnose dual pathways and atrioventricular nodal reciprocating tachycardia
(AVNRT) circuit. At longer coupling interval antegrade conduction proceeds over the fast or beta
pathways. At critical coupling interval a marked jump (> 50 ms) in the A-H interval is observed as
the impulse blocks in the fast pathways and travels over the slow or alpha pathways 1. After the
jump a Wenckebach point of the slow pathway can be achieved, although very often an echo beat
is present, since the impulse return to the atrium through the fast pathway1.
During EP study presence and conduction properties of AV bypass tract can be assessed.
Antegrade conduction is considered present in case of ventricular pre-excitation (either abnormally
short, or negative His to ventricular interval) during normal sinus rhythm or while atrial pacing at
progressively shorter cycle lengths. The presence of retrograde conduction through the accessory
pathways (AP) is demonstrated by the evidence of eccentric VA activation during ventricular
programmed pacing or tachycardia, and retrograde non-decremental conduction by programmed
ventricular stimulation1-6.
Supraventricular tachycardia
Supraventricular tachycardia are classified according to their electrophysiological findings in: A Sinus tachyarrhythmias; B -Atrioventricular nodal reciprocating tachycardia; C - Focal and
nonparoxysmal junctional tachycardia; D - Atrioventricular reciprocating tachycardia (AVRT); E Focal atrial tachycardias (EAT); F- Macro-re-entrant atrial tachycardia.7
During tachyarrhythmias EP study different pacing and mapping techniques can be use to define
the type of tachycardia: programmed stimulation with single or double extrastimulus, rapid
incremental atrial pacing, resetting and entrainment.
Similarly to AV nodal ERP analysis, programmed atrial stimulation, delivered at twice the pacing
threshold, is used to induce tachycardia, and to study its location, type and mechanism.
Tachycardia induction is considered reproducible if initiated with the same S1-S2 interval.
Reentrant tachycardia can be initiated and terminated as soon as S1-S2 interval encounter the
refractory period of one of the two limb of the circuit1-6. EAT due to triggered activity can be
initiated and terminated with rapid atrial pacing and isoproterenol infusion1. EAT cannot be
predictably and reproducibly initiated and terminated with programmed stimulation1. EAT can be
differentiated from reentrant tachycardia by measuring first VA interval after cessation of
overdrive atrial pacing. 6 In latter case it is usually fixed to testify the presence of a predetermined
circuit.
Resetting is the interaction of single extrastimulus with the tachycardia circuit resulting in a less
than a compensatory pause (S1-S2 interval + pause = double of tachycardia cycle length).
Resetting is use to prove that AP is part of supraventricular tachycardia circuit, and to differentiate
AVNRT from orthodromic AVRT with concentric VA conduction. A single ventricular
extrastimulus during tachycardia is given, while His was refractory, looking for preexcitation of
the atrium with identical activation sequence.1-6
The entrainment technique is useful when study anatomical reentry. It is defined as a stable
conduction which derives from the interaction of two rhythms1. The degree of interaction depends
on the distance between the site of stimulation and the circuit, electrophysiological properties of
tissues and presence of excitable gap. Pacing the atrium with a cycle length shorter than
tachycardia cycle length accelerates the tachycardia cycle with the same activation sequence and
different degree of fusion depending from the distance between the site of stimulation and the
circuit. In case the site of stimulation is within the circuit no fusion appears (concealed
entrainment) 1. In case of apparent entrainment first beat post-interruption of pacing could be use
to assess the location of the tachycardia circuit. The length of this interval is proportional to this
distance.
The sequence of atrial and ventricular activation during tachycardia is crucial to define the type
and the location of tachycardia. AVRT and AVNRT present usually fixed ventricolo-atrial
interval, while EAT have VA dissociation and variable VA interval. 1-6 Very often EAT present the
warm-up phenomena: when atrial tachycardia starts the cycle length tends to progressively shorten
for several cycles until its ultimate rate is achieved. During common or fast-slow AVNRT, atrial
and ventricular activation are concomitant and earliest atrial activation site is concentric in the
anterior or His bundle area with decremental pattern of conduction1. Retrograde atrial activation
during orthodromic AVRT starts at atrial insertion of AP. It could be defined, either during
tachycardia or ventricular pacing, as the point of earliest atrial activation of bipolar signal. With
the exception of antero-septal bypass tracts, atrial activation is eccentric and not decremental1,6.
Concomitant unipolar recording are used to optimize the accuracy of accessory pathways
localization. Sharp and negative unipolar waveform indicates the exact site of impulse spreading8.
Radiofrequency catheter ablation (RFCA)
Radiofrequency energy was first used as an alternative energy source in the experimental treatment
of cardiac arrhythmias in a closed-chest canine model by Huang and co investigators in 1987 9.
They showed that they were able to safely and effectively ablate the AV junction with a
conventional 2-mm-tipped electrode catheter. Since the initial introduction of RFCA, multiple
studies of RF ablation of cardiac tissue of animal models, including the ventricle, the coronary
sinus, the atrium and the tricuspid annulus, have emerged. Nowadays RFCA is the treatment of
choice for different cardiac arrhythmias such as AVRT, AVNRT, EAT and ventricular
tachycardia1. In veterinary clinical cardiology first report of RFCA is dated 19935, since that date
few other cases are reported and all for the treatment of orthodromic AVRT 4,6.
RF band of 0,3 to 30 kHz with a wavelength from 1000 to 10 meters is used in medicine for
ablating, coagulating and cauterizing tissue. When RF energy is used, the applied voltage induces a
current to flow between a small electrode inside the cardiac cavity to a large, grounded, dispersive
electrode on the surface. In our lab we use a thermocouple-tipped stereable 7F catheter connected
to a RF generator. Maximal catheter tip temperature and power output are usually set respectively
at 65°C and 75 watts. Each RF application is performed in controlled temperature and maximal
ablation time for a particular target is 60 seconds.
For AVRT ablation catheter is placed at the atrial endocardial insertion of AP around the tricuspid
valve annulus or within the coronary sinus. Ablation procedures is guided by intra-cardiac bipolar
recording, searching for the shorter VA interval, or bypass tract potentials, during OAVRT or
ventricular pacing, and with unipolar recording with sharp and negative waveform, which permit
to assess the pole closest to the bypass tract.8 For ablation within the coronary sinus particularly in
case of postero-septal AP, a cool-tipped ablation system can be used.
EAT in human being tend to be rare, are often incessant in children and cause tachycardia-induced
cardiomyopathy
10
. Most common site of origin of automatic tachycardias are along the crista
terminalis, atrial appendage, triangle of Koch, pulmonary veins, and the coronary sinus1. Mapping
these site of origin are usually performed using both bipolar and unipolar recordings. The goal of
mapping is to identify the electrical epicenter of atrial activation characterized by the earliest highfrequency and high-amplitude signal on a bipolar recording timed to the surface P waves (usually
precedes the onset of P waves by a minimum of 20 ms, mean 38 ms)11. Sharp and negative
unipolar recording are also useful in this setting.
AVNRT circuit can be eliminated with selective ablation of slow pathway during sinus rhythm
which sits in the isthmus of tissue between the tricuspid valve annulus and the ostium of the
coronary sinus where the atrial wave is multiphasic and the A/V ratio is 1:5. Two types of potential
have been described to locate slow pathway: slow potential of Haissaguerre
12
and rapid potential
13
of Jackman . Positive predictive value of efficacious ablation of slow pathways is the presence of
junctional escape during ablation procedure for the interaction of RF energy with compact AV
node 12-13.
Pubblicazioni Pacemaker
1.
Bellenger CR, Ilkiw JE, Nicholson AI. et al. Transvenous pacemaker leads in the
dog: an experimental study. Res Vet Sci 1990;49(2):211-215.
2.
Bonagura JD, Helphrey ML, Muir WW. Complications associated with permanent
pacemaker implantation in the dog. J Am Vet Med Assoc 1983; 182(2): 149-155.
3.
Bulmer BJ, Oyama MA, Lamont LA, Sisson DD. Implantation of a single-lead
atrioventricular synchronous (VDD) pacemaker in a dog with naturally occurring 3rd-degree
atrioventricular block. J Vet Intern Med 2002; 16(2): 197-200.
4.
Bulmer BJ, Sisson DD, Oyama MA et al. Physiologic VDD versus nonphysiologic
VVI pacing in canine 3rd-degree atrioventricular block. J Vet Intern Med 2006; 20(6): 12871290.
5.
Cobb MA, Nolan J, Brownlie SE et al. Use of a programmable, activity-sensing, rate
regulating pacemaker in a dog. J Small Anim Pract 1990; 31(8): 398-400.
6.
Darke PGG, Been M, Marks A. Use of a programmable, 'physiological' cardiac
pacemaker in a dog with total atrioventricular block (with some comments on complications
associated with cardiac pacemakers). J Small Anim Pract 1985; 26(6): 295-303.
7.
Darke PGG, McAreavey D, Been M. Transvenous cardiac pacing in 19 dogs and one
cat. J Small Anim Pract 1989; (9): 491-499.
8.
Domenech
O,
Santilli
R,
Pradelli
D
et
al.
The
implantation
of
a
permanenttransvenous endocardial pacemaker in 42 dogs: A retrospective study. Med Sci
Monit 2005; 11(6): BR168-BR175.
9.
Ferasin L, Faena M, Henderson SM et al. Use of a multi-stage exercise test to assess
the responsiveness of rate-adaptive pacemakers in dogs. J Small Anim Pract 2005; 46(3):
115-120.
10.
Fox PR, Moise NS, Woodfield JA et al. Techniques and complications of pacemaker
implantation in four cats. J Am Vet Med Assoc 1991; 199(12): 1742-1753.
11.
Hervé D, Troger JC. Retrospective study of the implantation of eighteen cardiac
pacemakers in the dog. Pract Med Chir Anim Comp 2003; 38(2): 161-166.
12.
Johnson MS, Martin MWS, Henley W. Results of pacemaker implantation in 104
dogs. J Small Anim Pract 2007; 48(1): 4-11.
13.
Lombard CW, Tilley LP, Yoshioka M. Pacemaker implantation in the dog: survey
and literature review. J Am Anim Hosp Assoc 1981; 17(5): 751-758.
14.
Oyama MA, Sisson DD, Lehmkuhl LB. Practices and outcome of artificial cardiac
pacing in 154 dogs. J Vet Intern Med 2001; 15(3): 229-39.
15.
Prosek R, Sisson DD, Oyama MA. Runaway pacemaker in a dog. J Vet Intern Med
2004; 18(2): 242-244.
16.
Roberts DH, Tennant B, Brockman D et al. Successful use of a QT-sensing rate-
adaptive pacemaker in a dog. Vet Rec 1992; 130(21): 471-472.
17.
Sisson DD, Thomas WP, Woodfield J et al. Permanent transvenous pacemaker
implantation in forty dogs. J Vet Intern Med 1991; 5(6): 322-331.
18.
Wess G, Thomas WP, Berger DM et al. Applications, complications, and outcomes
of transvenous pacemaker implantation in 105 dogs (1997-2002). J Vet Intern Med 2006;
20(4): 877-884.
Pubblicazioni Ablazione
1.
De Madron E, Kadish A, Spear JF et al. Incessant atrial tachycardias in a dog with
tricuspid dysplasia. Clinical management and electrophysiology. J Vet Intern Med
1987, 1(4);163-169.
2.
Sherlag BJ, Wang X, Nakagawa H, et al. Radiofrequency ablation of a concealed
accessory pathway as treatment for incessant supraventricular tachycardia in a dog. J Am
Vet Med Assoc 1993;203:1147-1152.
3.
Atkins CE, Kanter R, Wright K, et al. Orthodromic reciprocating tachycardia and
heart failure in a dog with a concealed postero-septal accessory pathway. J Vet Intern Med
1995;9:43-49.
4.
Wright KN, Hines DA, Bright JM. Cardiac electrophysiologic measurements in
dogs before and after intravenous administration of atropine and propranolol. Am J Vet Res
1996;57:1695-1701.
5.
Wright KN, Mehdirad AA, Giacobbe P et al. Radiofrequency catheter ablation of
atrioventricular accessory pathways in 3 dogs with subsequent resolution of tachycardiainduced cardiomyopathy. J Vet Intern Med 1999;13:361-371.
6.
Santilli RA, Bussadori C. Orthodromic incessant atrioventricular reciprocating
tachycardia in a dog. J Vet Cardiol 2000;2:23-27.
7.
Santilli RA, Spadacini G, Moretti P et al. Radiofrequency catheter ablation of
concealed accessory pathways in two dogs with symptomatic atrioventricular reciprocating
tachycardia. J Vet Cardiol 2006;8:157-165.
8.
Foster SF, Hunt GB, Thomas SP et al. Tachycardia-induced cardiomyopathy in a
young Boxer dog with supraventricular tachycardia due to an accessory pathway. Aust Vet J
2006 Sep;84(9):326-331.
9.
Santilli RA, Spadacini G, Moretti P et al. Anatomic distribution and
electrophysiologic properties of accessory pathways in dogs. J Vet Am Med Assoc
2007;231:393-398.
10.
Santilli RA, Perego M, Crosara S. et al. Utility of 12-lead electrocardiogram in
differentiating paroxysmal narrow QRS complex tachycardias in the dog. J Vet Intern Med
2008; 22(4):915-923.
Atti congressi nazionali ed internazionali
1) Santilli R.A., Spadacini GM., Moretti P. et al. Anatomical distribution and electrophysiological
properties of accessory pathways in seven dogs with orthodromic atrioventricular reciprocating
tachycardia. Proceedings 15th ECVIM-CA Congress. J Vet intern Med 2005;19:933.
2) Santilli R, Perego M, Voghera S. et al Impianto di pacemaker permanente endocardico nel cane:
studio retrospettivo su 36 casi. Proceeding SCIVAC forum Rimini 2007;1:
3) Santilli R.A. Diagnosi elettrocardiografica delle tachicardie sopraventricolari nel cane.
Proceedings 53° Congresso Nazionale SCIVAC 2006; 253-254.
4) Santilli R.A. Mapping and ablation of canine arrhythmias. Proceedings 16th ECVIM_CA
congress. Amsterdam 2006;1:48-50.
5) Santilli R.A. Diagnosis of orthodromic atrioventricular reciprocating tachycardia in dog.
Proceedings 25th ACVIM forum – Seattle 2007. 136-137.
6) Santilli R.A. Mapping and radiofrequency ablation of OAVRT in dogs. Proceedings 25th
ACVIM forum – Seattle 2007. 138-139.
7) Santilli R.A., Perego M., Borgarelli M. et al. Validation of a new algorithm for differentiating
paroxysmal supraventricular tachycardia in the dog. Proceedings 17th ECVIM-CA Congress.
Budapest 2007;1:196-197.
8) Santilli R.A., Noomanovà N., Perego M. Use of transcutaneous external pacing during
pacemaker implantation in dogs. Proceedings 17th ECVIM-CA Congress. Budapest 2007;1:235.
9) Perego M., Voghera S., Santilli R.A. Utility of implantable loop recorder (ILR) for the
investigation of unexplained syncope in dogs. Proceedings 17th ECVIM-CA Congress. Budapest
2007;1:235.
10) Santilli R.A., Bontempi L. Arrhythmogenic right ventricular cardiomyopathy in dogs and cats.
Proceedings 59th SCIVAC Congress. Rimini – 2008;1:320-322.
11) Santilli R.A., Perego M., Ramera L. et al. Focal junctional tachycardia in the dog. Proceedings
18th ECVIM-CA Congress. Ghent 2008;1:201.
12) Santilli R.A., Perego M., Carli A.. et al. Radiofrequency catheter ablation of cavotricuspid
isthmus as treatment of bidirectional atrial flutter in a dog. Proceedings 18th ECVIM-CA Congress.
Ghent 2008;1:222.
13) Santilli RA, Perego M, Bontempi L et al. Ventricular tachycardia in English Bulldog with
localized right ventricular outflow tract aneurysms. Proceeding 18th ECVIM-CA Congress. Ghent,
Belgium 2008;1:222.
I DIFETTI CONGENITI E LA RIPARAZIONE INTRACARDIACA
Augusta Pelosi, DMV, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
I difetti congeniti del cuore sono tra le malformazioni più frequenti se si escludono le
patologie acquisite della valvola mitrale: la loro incidenza annuale nella popolazione
canina è pari a circa 16.6 %. L'incidenza dei difetti congeniti del cuore nei piccoli animali
potrebbe essere sostanzialmente piu’ alta di quando riportato fino ad ora. Purtroppo la
difficoltà di eseguire un postmortem di routine in casi di morti perinatali rende questa
stima poco attendibile.
Specificazioni preoperatorie, anestetiche e postoperatorie
In ogni chirurgia intracardiaca, e’ fondamentale avere a disposizione diversi tipo di
monitoraggio. In caso di chirurgia intracardiaca, il paziente viene preparato sotto
sedazione. Una volta anestetizzato, un catetere centrale con tre porte di accesso, un
catetere arteriale e due cateteri periferici venosi vengono inseriti nel preoperatorio. A
livello esofagico viene inserito un termometro e un sonda per la eco transesofagica. Si
deve avere un costante monitoraggio dell’elettrocardiogramma, la pressione venosa
centrale, la pressione atriale con uno Swanz-Ganz, la pressione arteriale diretta ed
indiretta. La temperatura deve essere valutata a livelli diversi sia nella parte craniale che
caudale del corpo. Normalmente usiamo la temperatura della vescica, rettale, esofagica o
nasale. Il paziente viene indotto con isofluorano e può essere mantenuto con isofluorano
o sevofluorano. La somministrazione di anestetico inalatorio attraverso il tubo tracheale
viene interrotto durante il bypass e il gas anestetico viene immesso direttamente nel
circolo bypass. Anche la ventilazione assistita è interrotta. Quando il periodo di
perfusione cardiopolmonare è terminato, anche la ventilazione assistita è ripristinata.
Esistono diversi farmaci che sono essenziali durante queste chirurgie: eparina, protamina,
fenilefrina, dobutamina o dopamina. Altre importanti prodotti medici che devono essere a
portata di mano sono: soluzioni contenenti bicarbonato per effetto tampone, sangue per
trasfusioni. E’ necessaria la cardioplegia per eseguire alcuni interventi soprattutto nella
parte sinistra del cuore.
1
Spesso il paziente deve essere mantenuto con ventilazione assistita fin quando non si
constata la capacità di ossigenazione con respirazione volontaria. Alcune situazioni
necessitano tracheostomia anche se solo temporanea. Inoltre, in questa fase, si deve
considerare il supporto vascolare con cristalloidi, hetastarch, sangue o sostituti
dell'emoglobina. Il supporto cardiaco puo’ essere mantenuto con farmaci inotropici come
dopamine e dobutamina.
Classificazione
Esitono molteplici metodi di classificazione di queste patologie. Per il chirurgo, usare la
localizzazione anatomica come criterio di classificazione delle patologie chirurgiche è
quasi sempre utile. Basti pensare a fratture o ad una tipica chirurgia addominale, per
esempio, del sistema gastrointestinale. La conoscenza del sistema, della regione
anatomica è fondamentale per il tipo di approccio, la scelta della sutura etc. Purtroppo nel
caso di chirurgia cardiaca bisogna usare un approccio multidisciplinare non solo nella
classificazione, ma anche nel modo in cui il chirurgo fronteggia la pianificazione della
chirurgia e nel modo in cui affronta fattori imprevedibili che in questi tipi di chirurgia
possono avvenire in condizioni repentine. La conoscenza dell’ anatomia può essere di
aiuto per la pianificazione dell’approccio ma anche per anticipare possibili conseguenze
delle nostre azioni, per esempio conoscere dove si trova il sistema di conduzione nel setto
può aiutare ad evitare blocchi atrioventricolari postoperatori non desiderati. All’anatomia
si deve aggiungere la conoscenza delle variazioni emodinamiche e cardiovascolari indotte
dalla patologia cardiaca, per esempio quali condizioni producono danno ostruttivo,
restrittivo, le conseguenze della presenza di uno shunt destro-sinistro ed essere in grado
di riconoscere condizioni patologiche nel momento in cui avvengono (blocco
atrioventricolare dell’esempio precedente con necessita’ di impiantare un pacemaker).
Per ultimo, ma non meno importante, è necessario riconoscere e classificare la gravità
della condizione cardiaca per capire quando intervenire può essere vantaggioso e quando
invece il trattamento medico dovrebbe essere preferito. Naturalmente molte di queste
decisioni vengono prese in accordo con l’amico cardiologo, il quale tuttavia può non
essere presente in chirurgia. Pertanto la conoscenza di queste problematiche deve essere
parte integrante della formazione del chirurgo che intraprende la chirurgia cardiaca.
2
Di seguito le diverse patologie verranno spiegate in più dettaglio tenendo conto delle
diverse classificazioni:
Gravità
I difetti congeniti del cuore si possono classificare in gravi, moderati e lievi. Ogni
patologia può rientrare in una di queste categorie.
Sono definite gravi le forme congenite responsabili, già alla nascita o entro i primi mesi
di vita, di sintomatologia cardiaca drammatica che può portare a morte per insufficienza
cardiaca o aritmia.
Sono definite moderate quelle forme che richiedono un trattamento cardiologico non
intensivo alla nascita, oppure diagnosticate soltanto nei primi mesi di vita in genere in
seguito ad un’auscultazione anormale durante la visita annuale. La maggior parte dei
pazienti veterinari si trovano probabilmente in questa categoria. Anche se i segni clinici
sono moderati alla nascita e possono essere controllati con trattamento medico, esiste la
distinta possibilità che la progressione dei successivi processi di rimodellamento cardiaco
possano portare in poco tempo a scompenso cardiaco e alla morte.
Sono definite lievi le forme presenti in soggetti privi di sintomi che possono essere
accidentalmente diagnosticate in età giovane o a volte adulta.
Presenza di cianosi.
Un altro criterio di classificazione prevede la divisione in forme cianotiche e non
cianotiche. In questi casi la presenza di cianosi sistemica o differenziale può talvolta
aiutare nell’identificazione della lesione primaria. In ogni condizione di shunt, si può
verificare una situazione di questo tipo.
Da un punto di vista strettamente anatomo-fisiologico queste lesioni si possono
distinguere in base alla loro localizzatione anatomica e compromissione emodinamica.
Molteplici difetti congeniti possono essere presenti nello stesso individuo, pertanto
soprattuto in questi casi è importante valutare qual è l’effetto complessivo sul sistema
cardiovascolare (per esempio nella tetralogia di Fallot). A questo proposito è opportuno
ricordare che i problemi congeniti raramente si presentano contemporaneamente nella
3
parte destra e sinistra del cuore. Questo può essere facilmente spiegato ricordando la
formazione embriologica del cuore.
1. DIFETTI SETTALI (con volume overload)
Difetti del setto interatriale
Descrizione: Il difetto interatriale è un difetto del cuore caratterizzato dalla presenza di un
foro nella parete muscolare attraverso il quale vi è un passaggio di sangue, solitamente
con shunt sinistro-destro che può produrre overload di volume nel ventricolo destro con
conseguente insufficienza cardiaca di destra. Lo shunt può cambiare a destra-sinistra nei
casi di difetti molto ampi, aumento della pressione nell’atrio destro a causa di
insufficienza cardiaca destra, ipertensione polmonare o ostruzione del flusso ematico nel
tratto di uscita del ventricolo destro. Il difetto può essere di diverse dimensioni. Vengono
comunemente classificati in: Foramen ovale; Ostium primum: localizzato nella parte
inferiore del setto; Ostium secundum: localizzato nella parte media del setto; Seno
venosus: in posizione craniale e dorsale del setto nel punto di giunzione della vena cava
craniale; Seno coronario: separazione incompleta tra il seno coronario e l’atrio sinistro a
causa della persistenza della vena cava craniale di sinistra. Il soffio è spesso polmonare e
dovuto ad aumento della velocità attraverso la valvola. In alcuni casi si può auscultare
uno split perchè il tempo si espulsione attraverso il ventricolo destro è prolungato rispetto
a quello di sinistra producendo una chiusura asincrona della valvola polmonare.
Nell’ostium primum invece si può auscultare un soffio all’apice dovuto ad insufficienza
mitrale.
Trattamento: poichè spesso asintomatici, soprattutto nel caso del forame ovale, i pazienti
veterinari non richiedono trattamento medico o chirurgico. Il trattamento chirurgico può
rendersi necessario con ampi difetti, con flusso bidirezionale con segni di insufficienza
cardiaca. In questo caso, attraverso una toracocotomia laterale destra nel quinto spazio
intercostale, il setto atriale è raggiunto mediante un’atriotomia destra. Il difetto è chiuso
con un graft di pericardio autogeno possibilmente trattato con soluzione di gluteraldeide
usando suture continue o a mattress. Nel caso di ostium primum si deve provvedere a
riparare la valvola mitralica. La cannulazione bypass per questa chirurgia puo’ essere
l’arteria femorale (arteriale) e bicava (venosa).
4
Difetti del setto interventricolare
Descrizione: descritto nelle relazioni precedenti.
Trattamento: Attraverso una toracotomia laterale destra nel quinto spazio intercostale, il
setto è raggiunto mediante un’atriotomia destra. Se il setto è muscolare viene raggiunto
più facilmente da una toracotomia laterale sinistra e ventricolotomia destra. Il lembo
settale della tricuspide viene retratto e il difetto è chiuso con un graft di ePTFE (expanded
polytetrafluoroethylene), usando suture continue o a mattress. La parte più delicata è la
parte caudale del difetto a causa della presenza del sistema di conduzione. La
cannulazione bypass per questa chirurgia puo’ essere l’arteria femorale (arteriale) e
singola atriale o bicava venosa (venosa).
Possibili conseguenze: danno alle valvole tricuspidale o aortica, danno al sistema di
conduzione con blocco atrioventricolare completo.
Difetti del canale atrio-ventricolare (Cushion’s defect)
Descrizione: mancanza della normale separazione tra il tratto di uscita del ventricolo
sinistro e l’atrio destro (setto atrioventricolare). Pertanto è presente una comunicazione
atrioventricolare con anello fibroso comune e un’unica valvola con 5 lembi. Può essere
parziale o completo. E’ stato descritto in gatti persiani e si presenta con un soffio
pronunciato nella parte sinistra e spesso blocco di branca. La patologia può degenerare
sia in insufficienza cardiaca sinistra o destra o entrambe.
Trattamento: il trattamento medico consiste nell’uso dell’ idralazina, enalapril e
trattamento diuretico, a seconda dei casi. Il trattamento chirurgico ideale consiste nella
chiusura del setto atrioventricolare e riparazione delle valvole atrioventricolari se
necessario. La fascia pulmonare può essere usata se il bypass cardiopolmonare non è
disponibile.
2. LESIONI DEL CUORE DESTRO
Ostruttive
Stenosi polmonare con coronaria sinistra normale
Descrizione: presente nelle relazioni precedenti.
Trattamento: è lo stesso descritto precedentemente ma fatto con bypass cardiopolmonare
senza cardioplegia. La cannulazione bypass per questa chirurgia può essere l’arteria
femorale (arteriale) e singola atriale o bicava venosa (venosa).
5
Stenosi polmonare con origine anomala della coronaria sinistra
Descrizione: viene descritto con crescente frequenza non solo nella razza bulldog inglese
e francese, ma anche nel boxer e, recentemente, è stato notato in razze che si pensava
fossero completamente “immuni” da questa anomalia (cocker spaniel).
In questa anomalia, l’arteria coronaria sinistra si origina dall’ostio coronario di destra
che è l’unico pervio. La posizione dell’arteria sinistra circonflessa in relazione all’arteria
polmonare è la causa della stenosi. Infatti, l’arteria si viene a trovare davanti alla valvola
polmonare provocandone la stenosi. In alcuni casi esiste anche l’effetto combinato di una
valvola polmonare displastica che rende la stenosi ancora più drammatica.
Trattamento: l’implicazione chirurgica di questa forma di stenosi polmonare è che la
maggior parte delle tecniche chirurgiche ed interventistiche devono essere evitate per non
danneggiare l’arteria coronaria di sinistra e indurre morte. Il solo trattamento possibile è
la creazione di un condotto tra il ventricolo destro e l’arteria polmonare e il reimpianto
della coronaria. A causa della lunghezza della chirurgia e della difficoltà delle tecniche, si
dovrebbe considerare la chirurgia con il supporto del bypass cardiopolmonare.
Il torace può essere aperto sia con una toracotomia laterale che con una sternotomia
mediana. La sternotomia mediana è fortemente consigliata nelle razze brachiocefaliche e
sopprattutto nel bulldog, perchè a causa della conformazione del torace, l’accesso al
ventricolo destro con una toracotomia laterale sinistra è complesso e non soddisfacente
per un impianto corretto del condotto. Attraverso una toracotomia laterale destra nel
quarto-quinto spazio intercostale, il pericardio è aperto e il condotto è suturato al
ventricolo destro e all’arteria polmonare. Una parte di parete ventricolare destra deve
essere rimossa per permettere al condotto di rimanere pervio. La cannulazione bypass per
questa chirurgia puo’ essere l’aorta o arteria femorale (arteriale) e singola atriale
(venosa).
Double chamber right ventricle
Descrizione: trattato nelle relazioni precedenti.
Trattamento: l’argomento, già trattato nelle relazioni precedenti, verrà solo accennato in
questa presentazione.
Atriali
Cor triatriatum dexter
Descrizione: nelle condizioni di cor triatriatum esistono tre atri prodotti dalla presenza di
una membrana che divide l’atrio destro in due compartimenti. La membrana divide la
6
cavità atriale destra in una camera caudale e craniale. La camera craniale comunica con la
valvola tricuspide, mentre la caudale raccoglie il sangue venoso proveniente dalle vene
cave e dal seno coronarico. La comunicazione tra le due può avvenire attraverso un
orifizio di diverse dimensioni o talvolta può essere assente a questa assenza è dovuta una
diversa sintomatologia da ostruzione di ritorno venoso. L’aumento pressorio nella camera
caudale si risente in un aumento nella pressione venosa e della pressione nelle vene
epatiche con alto rischio di sintomatologia simile alla sindrome di Budd-Chiari e quindi
insufficienza cardiaca destra. Una caratteristica di questa patologia e’ che spesso non
produce distensione della giugulare.
Trattamento: attraverso una toracocotomia laterale destra nel quinto spazio intercostale, il
pericardio è aperto e l’atrio è visualizzato per individuare la membrana. Normalmente si
può visualizzare all’esterno. Sotto occlusione venosa o preferenzialmente bypass,
attraverso un’atriotomia destra, la membrana è rimossa. La cannulazione bypass per
questa chirurgia può essere l’aorta o arteria femorale (arteriale) e bicava o vena femorale
e giugulare (venosa).
3. LESIONI DEL CUORE SINISTRO
Ostruttive
Stenosi aortica
Descrizione: la stenosi aortica, è una patologia ereditaria che normalmente non è presente
alla nascita ma si sviluppa in età più adulta. E’ dovuta a ostruzione della via di deflusso
del ventricolo sinistro in posizione sottovalvolare, valvolare o sopravalvolare. La forma
sopravalvolare è rara nei cani ma è stata descritta nei gatti. La forma più comune è la
sottovalvolare dovuta alla presenza di una banda fibrotica ostruttiva. Tra le patologie
congenite si presenta con elevata frequenza soprattutto in varie razze tra cui boxer,
pastore tedesco, shorthair tedesco, rottweiler e Terranova. Il soffio è sistolico e può essere
facilmente udito a livello della base cardiaca. L’ostruzione al deflusso del ventricolo
sinistro porta a progressivo aumento della pressione ventricolare con inspessimento della
parete miocardica. La diminuita perfusione coronarica e l’ispessimento della parete
miocardica possono indurre fibrosi con aritimie e rischio di sincope e morte repentina. La
velocità aumentata e la turbulenza sono responsabili della dilatazione poststenotica.
Trattamento: Il trattamento medico mediante l’uso di beta bloccanti per ridurre la
frequenza cardiaca e il rimodellamento cardiaco possono risultare insufficienti quando il
7
gradiente pressorio è elevato. Questo normalmente si verifica quando il gradiente
pressorio attraverso la stenosi è superiore a 80-10 mmHg. In questo caso l’unico modo di
diminuire il gradiente pressorio è mediante valvuloplastica o chirurgia, ma esistono
opinioni controverse sui benefici di qualsiasi intervento. Le tecniche chirurgiche usate più
comunemente per questa patologia sono la valvuloplastica tranventricolare di dilatazione
della valvola (attraverso una sternotomia mediana) e una membranectomia con
miectomia (attraverso un approccio intercostale laterale nel quarto spazio). La
cannulazione bypass per questa chirurgia può essere arteria femorale (arteriale) e singola
atriale o bicava (venosa).
Coartazione aortica
Descrizione: è un restringimento dell’aorta causato da inspessimento della parete aortica
che forma una protrusione verso l’interno. La tipica localizzazione è tra l’origine della
succlavia di sinistra e l’inserzione del dotto o del legamento arterioso. E’ una patologia
molto frequente nei bambini e occasionalmente descritta in pazienti veterinari. Un soffio
cardiaco spesso non è presente e il metodo diagnostico per eccellenza è un differenziale
pressorio tra gli arti anteriori e posteriori.
Trattamento: resezione della porzione stenotica e anastomosi end-to-end.
Questo
intervento viene spesso effettuato senza bypass.
Interruzione aortica
Descrizione: non esiste communicazione tra l’aorta ascendente e discendente. Esistono
tre tipi di interruzioni: a): distale alla succlavia di sinistra; b): tra la succlavia di sinistra e
l’arteria carotide di sinistra; c): tra la carotide di sinistra e di destra. E’ spesso presente
anche un setto ventricolare incompleto.
Trattamento: l’aorta viene ricostruita nella porzione mancante usando un condotto
sintetico di dacron o PTFE
Atriali
Cor triatriatum sinister
Descrizione: nelle condizioni di cor triatriatum esistono tre atri prodotti dalla presenza di
una membrana che divide l’atrio sinistro in due compartimenti. La membrana divide la
cavità atriale sinistra in una camera superiore e caudale e una inferiore e craniale. E’
descritto più frequentemente nei gatti ed è dovuto ad un scorretto drenaggio delle vene
polmonari nell’atrio che, pertanto, drenano nella camera superiore o accessoria. La
comunicazione tra le due può avvenire attraverso un orifizio di diverse dimensioni o
8
talvolta può essere assente a questo è dovuta una diversa sintomatologia da ostruzione di
ritorno venoso. Più comunemente esistono uno o più buchi nella membrana. L’aumento
pressorio nella camera superiore si risente in un aumento nella pressione polmonare con
alto rischio di edema polmonare. La cannulazione bypass per questa chirurgia può essere
arteria femorale o aorta (arteriale) e singola atriale o bicava (venosa).
Trattamento: Il trattamento chirurgico è volto a rimuovere la membrana.
4. LESIONI VALVOLARI
Displasia tricuspidale
Descrizione: si tratta di una malformazione congenita che avviene con maggiore
frequenza nel Labrador, golder retriever, pastore tedesco, setter irlandese. La patologia
della valvola puo’ avvenire a tutti i livelli: delle corde, dei muscoli capillari, e della
valvola nella forma di ispessimento valvolare, fusione. I pazienti possono essere
asintomatici o avere segni di insufficienza cardiaca di destra.
Trattamento: il trattamento medico è il trattamento più comunemente usato. Intervento
chirurgico con bypass si dovrebbe considerare prima di arrivare ad insufficienza cardiaca.
Il trattamento correttivo consiste nel riparare la valvola con un anello bioprostetico o un
trapianto di valvola. La cannulazione bypass per questa chirurgia può essere arteria
femorale o aorta (arteriale) e bicava (venosa) con cardioplegia.
Displasia mitralica
Descrizione: si tratta di una valvola strutturalmente anormale che produce rigurgitazione
e a volte stenosi. La malattia è descritta in cani e gatti. Come nel caso della tricuspide, la
patologia può essere a diversi livelli della struttura valvolare. La pura displasia mitralica
è normalmente diagnosticata in cani danesi, rottweiler, e pastore tedesco, mentre la
stenosi è stata evidenziata con più frequenza nei bull terrier e possibilmente nei
newfoundlands. La stenosi è spesso presente con altre malattie congenite come la stenosi
aortica. Il soffio auscultato in questi soggetti è spesso sistolico anche nel caso della
stenosi, in cui il soffio da rigurgitazione predomina sul soffio diastolico della stenosi.
Trattamento: a seconda della sintomatologia predominante, il trattamento medico della
displasia mitralica è normalmente limitato a diuretici, inibitori ACE e digossina per
controllare ritmi sopraventricolari e migliorare la funzionalità miocardica. Idralazina e
altri diuretici possono essere considerati. Il trattamento della stenosi è più complesso
perchè una diuresi e venodilatazione eccessiva può diminuire il flusso attraverso la
9
valvola mitrale e diminuire l’output cardiaco. Il trattamento chirurgico ideale è la
riparazione della valvola o la sostituzione. La cannulazione bypass per questa chirurgia
può essere arteria femorale o aorta (arteriale) e singola atriale o bicava (venosa) con
cardioplegia.
Possibile conseguenze: i trattamenti di riparazione della valvola soprattutto nel caso della
stenosi possono accentuare l’insufficienza valvolare.
5. LESIONI EXTRACARDIACHE VASCOLARI ARTERIALI
Dotto arterioso patente: trattato nelle relazioni precedenti
Anelli vascolari: trattato nelle relazioni precedenti
4. LESIONI MULTIPLE
Tetralogia di Fallot (TOF)
Descrizione: descritta nelle revisioni precedenti
Trattamento: in questa relazione ci limiteremo al trattamento effettuato con bypass
cardiopolmonare. La riparazione definitiva prevede di intervenire sulle due componenti
principali emodinamiche di questa patologia: il setto incompleto (VSD) e la stenosi
polmonare (PS). Per il VSD viene usato un patch e per la PS si usa la tecnica con il patchgrafting, entrambe descritte precedentemente. L’approccio e da sinistra, nel quarto spazio
intercostale attraverso una ventriculotomia destra. La cannulazione bypass per questa
chirurgia può essere arteria femorale o aorta (arteriale) e singola atriale (venosa).
Trasposizione dei grandi vasi (TGA)
Descrizione: l’aorta ha origine dal ventricolo destro e l’arteria polmonare dal ventricolo
sinistro con una circolazione in parallelo invece di essere in serie. Il mix di sangue
avviene a livello di un setto ventricolare e/o atriale incompleto, ma può anche avvenire
attraverso un dotto arterioso pervio. Per permettere la sopravvivenza deve esserci uno
scambio sinistra-destra (dotto arterioso) e uno destro-sinistro (setto incompleto).
Paradossalmente più sono grandi le comunicazioni, più il paziente non è cianotico.
Trattamento: anche in questa circostanza siamo limitati in medicina veterinaria dalla
sintomatologia grave in giovane eta’. Se si interviene la tecnica chirurgica e’ chiamata
“arterial switch” con reimpianto delle coronarie. La cannulazione bypass per questa
chirurgia può essere arteria femorale (arteriale) e singola atriale o bicava (venosa).
10
Tronco arterioso
Descrizione: la persistenza del tronco presente in vita fetale fa sì che esista una sola
arteria che si origina dalla base del cuore che include l’aorta, la polmonare e le coronarie.
Nella forma di pseudotronco, l’arteria polmonare è presente ma ipoplastica o vestigiale.
Per la sua morfologia è simile alla TOF. E’ stato riportato in cani di razza keeshond. Ne
esistono di quattro tipi:
Tipo 1: un tronco singolo polmonare e un’aorta singola che si originano dal tronco
arterioso;
Tipo 2: le arterie polmonari di destra e sinistra si originano insieme dalla porzione dorsale
del tronco;
Tipo 3: una o due arterie polmonari si originano indipendentemente da ciascuno lato del
tronco
Tipo 4: nessun’arteria polmonare si origina del tronco. La circolazione polmonare viene
esclusivamente dalle arterie bronchiali.
Quasi sempre è presente in concomitanza con un setto ventricolare incompleto. Esiste
una sola valvola del tronco e siccome la circolazione polmonare offre la resistenza
minore, il flusso tende ad andare preferenzialmente nei polmoni dove può creare in poco
tempo segni di insufficienza cardiaca sinistra. La patofisiologia del tronco è simile a un
ampio dotto arterioso pervio con shunt destro-sinistro.
Trattamento: il trattamento in questi pazienti è complesso perchè si presentano con
sintomatologia grave in giovane età quando le possibilità di intervento chirurgico sono
limitate dalla taglia e dalla difficoltà in pazienti veterinari di intervenire ad una età così
giovane. La cannulazione bypass per questa chirurgia può essere arteria femorale
(arteriale) e bicava (venosa).
Bibliografia
Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine. St Louis: Mosby, Inc
1998
Orton EC, McCracken TO. Small Animal Thoracic Surgery. Malvern, PA: Williams and
Wilkins 1995
Mavroudis C, Backer CL Pediatric Cardiac Surgery. 3rd edizione Philadelphia, PA:
Mosby 2003
11
RIPARAZIONE O TRAPIANTO DELLE VALVOLE
ATRIOVENTRICOLARI
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
La degenerazione mixomatosa delle valvole atrioventricolari è un processo degenerativo
non associato a processo infiammatorio o infettivo. Rappresenta il 75 % delle patologie
cardiache nel cane. Colpisce soprattutto cani di età superiore ai cinque anni tranne nel
caso del cavalier king charles spaniel (CKCS) in cui è riconosciuto in età più giovane. Si
presenta in molte razze tra cui: miniature schnauzer, cocker spaniel, chihuahua, fox
terrier, dachshund, boston terrier. E’ tipico un soffio sistolico a livello dell’apice cardiaco
sinistro. Indipendentemente dalla causa scatenante: degenerazione mixomatosa (più
comune nel cane), processo infettivo o ischemico, valvola reumatica, la nefasta sequela di
questi processi è un’ insufficienza della valvola che può interessare una o più componenti
della struttura valvolare stessa. Le conseguenze devastanti si ripercuotono con il tempo
sulle altre strutture cardiache sia nella parte sinistra che in quella destra portando per
esempio ad ipertensione polmonare, dilatazione della parte destra fino ad insufficienza
sinistra e destra. In aggiunta alla causa primaria dell’insufficienza mitrale è bene
ricordare che l’overload di volume creatosi nel ventricolo sinistro porta in tutti i casi a
vari gradi di dilatazione dell’ anello anulare rendendo ancora più pronunciata la
rigurgitazione.
Opzioni chirurgiche
Esistono opinioni divergenti sui vantaggi del trapianto con valvola meccanica, valvola
bioprostetica o riparazione della valvola. Da recenti pubblicazioni in medicina veterinaria
sembra che quanto si verifica in medicina umana sia anche osservato in medicina
veterinaria, tuttavia, la carenza di casi rende queste teorie solo ipotetiche. Dalla
letteratura umana di fatto sappiamo che: il trapianto con valvole meccaniche offre
risultati più duraturi e standardizzati ma comporta trattamento anticoagulante per il resto
della vita del paziente (che comporta notevoli rischi soprattutto nel cane); mentre la
valvola bioprostetica è minimamente trombogenica e preserva meglio la funzione
miocardiaca. La riparazione della valvola offre il vantaggio di minimo danno alla
struttura valvolare, limitato danno alla funzionalità cardiaca, meno rischio di infezione e
tromboembolismo, ma con risultati variabili legati dell’abilità del chirurgo e
l’impossibilità di usare queste tecniche in tutte le patologie valvolari. Nei casi in cui sia
possibile usare una delle tecniche di riparazione, si dovrebbe optare per questa soluzione.
Approccio
Per accedere l’atrio sinistro, la toracotomia laterale sinistra nel quarto o quinto spazio
permette la visualizzazione della valvola mitrale.
Valvole meccaniche e bioprostetiche
Il primo trapianto di valvola venne eseguito nel 1961, anche se in questi primi casi tutte
le componenti della valvola venivano rimosse per evitare ostruzione della protesi con lo
svantaggio non indifferente di destabilizzare in questo modo l’equilibrio miocardico.
Anche se queste valvole riuscivano con successo a risolvere il problema della
rigurgitazione, esse erano estremamente trombogeniche e richiedevano trattamento
anticoagulante aggressivo. Nello stesso momento ci si accorse che la rimozione di tutte le
strutture valvolari contribuiva a creare un ventricolo sinistro sferico e che si poteva
facilmente ovviare a questo inconveniente mantenendo il lembo posteriore della valvola e
le strutture di supporto. Le valvole bioprostetiche cominciarono a diffondersi come
alternativa alle valvole meccaniche, ovviando a molte delle complicazioni delle
mecchaniche, ma non garantendo una durata soddisfacente soprattutto in pazienti giovani.
Nello stesso periodo tecniche di riparazione della valvola continuarono a diffondersi e
perfezionarsi.
Riparazione della valvola
E’ forse la tecnica più antica in chirurgia cardiaca. Infatti, nel 1923 venne usata da Elliot
Cutler per aprire una valvola stenotica. In realtà in questo caso si trattava soprattutto di un
processo distruttivo piuttosto che ricostruttivo. Si deve attendere il 1960 per la prima
riparazione di successo usando il bypass.
In medicina veterinaria, negli anni, ci sono state sporadiche pubblicazioni sull’uso di
valvole meccaniche e bioprostetiche, mentre la sola esperienza di una certa consistenza
con le tecniche di riparazione si deve al lavoro di un gruppo giapponese che ha
recentemente sottolineato i vantaggi della riparazione valvolare invece del trapianto.
Bibliografia
Savage EB, Bolling SF. Atlas of mitral valve repair. Philadelphia, PA: Lippincott
Williams and Wilkins, 2006 Philadelphia
Doty DB. Cardiac Surgery: Operative Technique. Mosby 1997
Braunwald E, Zipes DP, Libby P, Bonow R. Braunwald’s Heart Disease: A Textbook of
Cardiovascular Medicine 7th edizione, Saunders 2004