Chimica ambientale
Rita Giovannetti
Chimica dell'ambiente
REACH & CLP
La Scienza ambientale
La Scienza ambientale
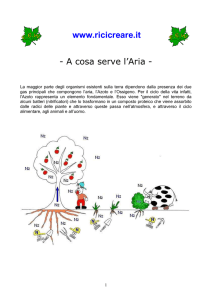
• L’atmosfera è il sottile strato di gas che
circonda la superficie terrestre.
• L’idrosfera contiene l’acqua terrestre.
• La geosfera è composta dalla terra solida,
compreso il suolo che sostiene la vita della
maggior parte delle piante.
• Tutti gli esseri viventi della terra compongono la
biosfera.
Chimica dell’ambiente
•
•
•
•
•
•
•
La chimica dell’ambiente
lo studio delle sorgenti,
delle reazioni,
del trasporto,
degli effetti
del destino delle specie chimiche in acqua, suolo e aria
degli effetti della tecnologia su di essi.
• la chimica dell’ambiente: interazioni tra acqua ,aria,
terra, vita e tecnologia.
Acqua, aria, suolo, vita, tecnologia
Acqua
• Sostanza di importanza vitale in tutte le parti
dell'ambiente.
• Copre il 70% circa della superficie della Terra.
• Si trova in tutte le sfere dell'ambiente.
• E’ parte essenziale di tutti i sistemi viventi ed è il
mezzo dal quale la vita si è evoluta e in cui
esiste.
• L'energia e la materia sono trasportate
dall'acqua.
Acqua, aria, suolo, vita, tecnologia
Acqua
• L'acqua scioglie i costituenti solubili dei
minerali e li trasporta
• Trasporta il nutrimento per le piante dal suolo
all'interno di esse, attraverso le radici.
• L'energia solare viene trasportata come calore
latente e rilasciata sulla terra emersa.
• Il rilascio del calore latente fornisce l'energia
che trasporta il calore dalle regioni equatoriali
verso i poli terrestri causando fortissime
tempeste.
Acqua, aria, suolo, vita, tecnologia
Aria ed atmosfera
• L'atmosfera è un mantello protettivo che
alimenta la vita sulla Terra e la protegge
dall'ambiente ostile dello spazio.
• è la sorgente di biossido di carbonio e di
ossigeno
• fornisce l'azoto per i batteri fissatori
• come parte fondamentale del ciclo idrologico,
trasporta l'acqua dagli oceani alla terra emersa
• ha una funzione protettiva per la vita,
• stabilizza la temperatura della Terra
Acqua, aria, suolo, vita, tecnologia
II suolo
• Litosfera: mantello più esterno e dalla crosta
• è estremamente sottile, se paragonata al
diametro terrestre, e varia tra i 5 e i 40 Km di
spessore.
Acqua, aria, suolo, vita, tecnologia
II suolo…. la geologia è la scienza della
geosfera:
• parte minerale della crosta terrestre.
• l'acqua, coinvolta nella erosione delle rocce e
nella formazione dei minerali, l'atmosfera e il
clima, che hanno profondi effetti
utilizza
• la chimica per spiegare la natura e il
comportamento dei materiali geologici,
• la fisica per spiegare il loro comportamento
meccanico
• la biologia per spiegare le mutue interazioni tra
geosfera e biosfera.
Acqua, aria, suolo, vita, tecnologia
II suolo
• La tecnologia moderna ha una profonda
influenza sulla geosfera.
• La parte più importante della geosfera, è il suolo
• Sul suolo crescono le piante e, virtualmente, tutti
gli organismi terrestri dipendono da esso per la
loro esistenza.
• La produttività del suolo è fortemente influenzata
dalle condizioni ambientali e dagli eventuali
inquinanti presenti.
Acqua, aria, suolo, vita, tecnologia
La vita
• La biologia è la scienza della vita.
• Essa è basata sulle specie chimiche
sintetizzate biologicamente
• è una componente chiave della scienza e
della chimica dell'ambiente.
• per guardare alla biosfera dal punto di
vista delle popolazioni delle diverse specie
Acqua, aria, suolo, vita, tecnologia
La vita
l'ecologia
• è lo studio dei fattori ambientali che influiscono
sugli organismi e del modo in cui gli organismi
interagiscono con questi fattori e tra di loro.
Ecosistema:
• insieme degli organismi mutuamente interagenti
e dell'ambiente in cui vengono scambiati
materiali in modo essenzialmente ciclico,
• possiede componenti fisiche, chimiche e
biologiche, insieme a fonti energetiche e
percorsi di scambio di energia e materiali.
Acqua, aria, suolo, vita, tecnologia
La tecnologia
• La tecnologia tratta dei modi in cui gli uomini
lavorano con i materiali e l'energia.
• usata per benessere e sopravvivenza.
• è essenziale nello studio della scienza
dell'ambiente, a causa della sua enorme
influenza su di esso.
• La sfida è adoperare la tecnologia tenendo
conto dell'ambiente
Acqua, aria, suolo, vita, tecnologia
La tecnologia
• La tecnologia, applicata correttamente, può
risultare enormemente positiva per la
salvaguardia dell'ambiente.
• La più scontata delle sue applicazioni è il
controllo dell'inquinamento dell'acqua e dell'aria
nella prevenzione nella formazione degli
inquinanti.
• La tecnologia dovrà essere sempre più utilizzata
per sviluppare processi altamente efficienti.
Energia e cicli energetici
• I cicli biogeochimici, e virtualmente tutti i
processi che avvengono sulla Terra, sono
azionati dall'energia proveniente dal sole.
• Il sole praticamente emette radiazioni come un
corpo nero,
• trasmette energia alla Terra sotto forma di
radiazione elettromagnetica
• L'energia nei sistemi naturali viene trasferita
come calore
• Questi trasferimenti sono governati dalle leggi
della termodinamica.
Energia e cicli energetici
• La prima legge della termodinamica stabilisce
che, anche se l'energia può essere trasferita o
trasformata, essa viene conservata e non persa.
• La seconda legge della termodinamica
descrive la tendenza al disordine nei sistemi
naturali: ogni volta che l'energia viene
trasformata, una parte viene dissipata
Energia e cicli energetici
Luce e radiazioni elettromagnetiche
• L'energia può essere trasportata attraverso lo
spazio alla velocità della luce, come radiazione
elettromagnetica
• Le radiazioni elettromagnetiche, in particolare la
luce, sono di massima importanza nel
considerare l'energia nei sistemi ambientali.
Energia e cicli energetici
Luce e radiazioni elettromagnetiche
• La radiazione elettromagnetica ha un carattere
ondulatorio.
• Le onde si muovono alla velocità della luce, e,
ed hanno lunghezza d'onda (λ), ampiezza, e
frequenza (υ) caratteristiche.
• λ υ=c
Energia e cicli energetici
Luce e radiazioni elettromagnetiche
• le radiazioni elettromagnetiche hanno anche
carattere di particelle: l'energia radiante può
essere assorbita o emessa solo in pacchetti
discreti chiamati quanti o fotoni.
• L'energia ogni fotone è data da: E = h υ
dove h è la costante di Planck, 6,63x10-34 Js (joule x secondi).
• l'energia di un fotone è tanto maggiore quanto
maggiore è la frequenza dell'onda ad esso
associata (e quanto minore è la lunghezza
d'onda).
Energia e cicli energetici
Flusso di energia e fotosintesi nei sistemi
viventi
• Mentre i materiali vengono riciclati attraverso gli
ecosistemi
• il flusso di energia utile può essere visto
essenzialmente come un processo a senso
unico.
• L'energia solare incidente può essere
considerata come energia ad alta forza
Energia e cicli energetici
Flusso di energia e
fotosintesi nei
sistemi viventi
• l'energia solare catturata
dalle piante verdi stimola
la clorofilla, che
permette quei processi
metabolici che
producono i carboidrati
da acqua e biossido di
carbonio.
Sole
Clorofilla
energetica
Assorbimento
energia solare
Acqua
Trasferimento di
energia attraverso ATP
ad alta energia
Ossigeno O2
Carboidrati CH2O
Biossido di
carbonio
Sintesi di
carboidrati
Impatto umano e inquinamento
• L'inquinamento dell'ambiente può essere suddiviso in
inquinamento dell'acqua, inquinamento dell'aria ed
inquinamento del suolo.
• Queste tre aree sono tutte collegate tra loro.
• Per esempio, alcuni gas immessi nell'atmosfera possono
essere convertiti in acidi forti attraverso processi chimici
atmosferici, quindi ricadere sulla terra come piogge
acide ed inquinare l'acqua abbassandone il pH.
• I rifiuti pericolosi, laddove impropriamente scaricati,
possono permeare nell'acqua di falda, che può essere
immessa come acqua inquinata nei fiumi.
Impatto umano e inquinamento
• inquinante è quella di una sostanza presente in
concentrazione maggiore rispetto a quella naturale, che
ha un netto effetto dannoso sull'ambiente
• Le sostanze contaminanti, che non sono classificate
come inquinanti a meno che non abbiano qualche effetto
dannoso, comportano delle deviazioni dalla normale
composizione dell'ambiente.
• Ogni inquinante ha origine da una sorgente.
• La sorgente è particolarmente importante perché
generalmente è il luogo più logico per eliminare
l'inquinamento.
• Dopo che un inquinante è stato rilasciato da una
sorgente, esso può agire su di un recettore.
Impatto umano e inquinamento
• Il recettore è qualsiasi cosa su cui l'inquinante ha
effetto.
• se l'inquinante ha vita lunga, può essere immagazzinato
in un sink (pozzo).
• un muro di calcare può essere un sink per l'acido
solforico proveniente dall'atmosfera, a causa della
reazione:
• CaCO3 + H2SO4 -> CaSO4 + H2O + CO2
Tecnologia: problemi e soluzioni
• La moderna tecnologia ha fornito i mezzi per una
massiccia alterazione dell'ambiente e per il suo
inquinamento.
• Tuttavia essa, applicata in modo intelligente ed
unitamente ad una buona conoscenza delle
problematiche dell'ambiente, può anche fornire i mezzi
per trattare i problemi dell'inquinamento e della
degradazione dell'ambiente.
Nonostante tutti i problemi che comporta, la tecnologia
basata sulle solide fondamenta della scienza
dell'ambiente può essere efficacemente utilizzata per
risolvere i problemi dell'ambiente.
Minimizzare l’impatto ambientale
• un generico processo di produzione con una accurata progettazione
in modo da minimizzare l’impatto ambientale
Reagenti
Contaminanti (impurezze)
Mezzi di reazione (acqua,
solventi organici)
Emissioni atmosferiche
Processi produttivi
Riciclo
Catalizzatori
Prodotti e sottoprodotti
utili.
Scarichi che possono
richiedere trattamenti
Sottoprodotti recuperati
Acque di scarico
Solidi e liquami
Minimizzare l’impatto ambientale
• Sistemi di controllo computerizzati
• Uso di materiali che minimizzino i problemi di
inquinamento
• Processi e materiali che consentano il massimo di
riciclaggio e minima produzione di sottoprodotti.
• Trattamento biologico dei rifiuti.
• Uso di migliori catalizzatori.
Cicli della materia
Atmosfera
Biosfera
Geosfera
Antroposfera
Idrosfera
Ciclo generale che mostra lo scambio di materia tra atmosfera, biosfera, antroposfera,
antroposfera, geosfera
e idrosfera.
Cicli della materia
Massa di neve,
ghiaccio
Infiltrazione verso
acqua sotterranea
Acqua sotterranea
Cicli della materia
Scambio di materiali tra le possibili sfere dell'ambiente
Da
A
Atmosfera
Idrosfera
Biosfera
Geosfera
Antroposfera
Atmosfera
-
H2O
02
H2S, partic.
SO2,CO2
Idrosfera
H2O
-
{CH20}
Soluti
minerali
Inquinanti
delle acque
Biosfera
O2, CO2
H2O
-
Nutrienti
minerali
Fertilizzanti
Geosfera
H2O
H2O
Materiale
organico
Antroposfera
O2, N2
H2O
Alimenti
Rifiuti
pericolosi
Minerali
-
Cicli endogeni ed esogeni
• Cicli endogeni: rocce del sottosuolo di
vario tipo
• Cicli esogeni: sulla superficie della Terra
con componenti dell'atmosfera.
• Sedimenti e suolo: equamente ripartiti tra
i due cicli e costituiscono l'interfaccia
principale tra essi.
Cicli endogeni ed esogeni
Atmosfera
Biosfera
Idrosfera
Sedimenti
Suolo
Roccia
sedimentaria
Roccia
Ignea
Roccia
metamorfica
Magma
Cicli endogeni ed esogeni
• Cicli biogeochimici : carbonio, azoto, ossigeno, fosforo e
zolfo.
• cicli esogeni: l'elemento in questione realizza parte del
ciclo stesso nell'atmosfera (O2 per l'ossigeno, N2 per
l'azoto, CO2 per il carbonio).
• Altri, in particolare il ciclo del fosforo, non possiedono
componenti gassose e sono endogeni.
• Tutti i cicli di sedimentazione coinvolgono soluzioni
saline o soluzioni del suolo che contengono sostanze
rilasciate da minerali erosi:
– si possono depositare come formazioni minerali
– oppure possono essere assorbite dagli organismi come nutrienti.
Cicli Biogeochimici
• Carbonio, idrogeno, ossigeno, fosforo, azoto, zolfo e
tutti gli altri elementi essenziali per la vita: circolano
tra l’ambiente fisico e quello vivente degli organismi
• Il flusso di energia attraverso gli ecosistemi è
unidirezionale: ogni ecosistema ha bisogno di una fonte
costante di energia “fresca”.
• Ogni elemento ha il suo ciclo e, questi cicli sono in
relazione tra di loro
Cicli Biogeochimici
• Nella Biosfera gli elementi chimici passano
continuamente dagli esseri viventi all’ambiente fisico e
viceversa.
• Passaggio di elementi da un organismo all’altro:
catene alimentari, trasporto nell’ambiente fisico.
Cicli Biogeochimici
Energia solare
X in forma
semplice
Produttori
Aria
Terra
X in forma
complessa
Consumatori
Acqua
X in forma
complessa
Serbatoi
Decompositori
X in forma
semplice
La natura ciclica del movimento di un ipotetico elemento X. Le linee tratteggiate
indicano cammini alternativi o meno comunemente usati.
Cicli Biogeochimici
Energia solare
X in forma
semplice
Produttori
Aria
Terra
X in forma
complessa
Consumatori
Acqua
X in forma
complessa
Serbatoi
Decompositori
X in forma
semplice
La natura ciclica del movimento di un ipotetico elemento X. Le linee tratteggiate
indicano cammini alternativi o meno comunemente usati.
Cicli Biogeochimici
• C’è una stretta interdipendenza dei componenti
abiotici (non viventi) e biotici della biosfera.
• Gli organismi viventi:
• fanno avvenire maggior parte delle reazioni chimiche
che trasformano un elemento essenziale durante il suo
ciclo.
• mediano molte delle reazioni chimiche che così
possono avvenire con efficienza.
• forniscono molti dei cammini di reazione.
Cicli Biogeochimici
Stabilità:
• più di un percorso in ogni ciclo
• fermate intermedie o cicli contenuti in altri cicli nei percorsi.
• i percorsi alternativi mantengono il funzionamento stabile di un
ciclo e, se un percorso è impedito, il flusso può continuare
attraverso altri percorsi.
Più percorsi vi sono entro un ciclo, migliori sono le probabilità
che non si abbia accumulo o carenza dell’elemento in alcun
punto.
• in un ciclo l’aumento o la diminuzione del moto di un elemento
attraverso un cammino è compensato da variazioni di velocità di
flusso attraverso altri cammini.
Cicli Biogeochimici
POOL DI RISERVA E POOL DI SCAMBIO
• Ciascun ciclo può essere diviso in due compartimenti o
"pools“, caratterizzati da vari tassi di scambio fra di loro:
• pool di riserva, che costituisce il componente più
ampio,meno attivo e generalmente non-biologico
• pool di scambio (pool labile), una porzione più piccola,
più attiva ed in rapido movimento tra gli organismi e
l'ambiente
POOL DI RISERVA
POOL DI
SCAMBIO
Cicli Biogeochimici
• In base alla localizzazione del pool di riserva, i cicli
biogeochimici vengono distinti in:
• gassosi, dove il pool di riserva è l'atmosfera o l'idrosfera
es: ciclo dell'azoto
ciclo dell'acqua
ciclo del carbonio
• sedimentari, dove l'elemento è presente in una riserva
localizzata nella litosfera
es: ciclo del fosforo
ciclo dello zolfo
ciclo del ferro
Cicli Biogeochimici
Differenze tra cicli gassosi e sedimentari
I cicli sedimentari:
• più semplici,
• meno percorsi diversi
• sono seriamente danneggiati più facilmente dei cicli
gassosi.
• le sostanze nutrienti tendono a essere meno facilmente
disponibili agli organismi viventi di quelle dei cicli
gassosi.
• insufficiente riciclaggio
• meno bilanciati.
Ciclo del carbonio
CO2 atmosferica
Biodegradazione
Solubilizzazione e processi chimici
Fotosintesi
C inorganico solubile
prevalentemente HCO3-
C fissato (CH2O)
e C xenobiotico
Xenobioti prodotti da
materie prime di
origine petrolifera
Dissoluzione come
CO2 disciolta
Precipitazione chimica e incorporazione
del carbonio minerale nelle conchiglie
Processi
biogeochimici
C organico fissato:
idrocarburi, CxH2x ..
C inorganico insolubile
prevalentemente CaCO3
e CaCO3 *MgCO3
Ciclo del carbonio
• il carbonio viene trasferito in sistemi biologici e infine
nella geosfera e nell'antroposfera in forma di carbon
fossile e di combustibile fossile:
– attraverso l'energia solare
• il carbonio organico o biologico, {CH2O}, è contenuto
in molecole ricche di energia, che possono reagire con
molecole di ossigeno, O2, per riformare il biossido di
carbonio e produrre energia:
– in un organismo ciò può avvenire biochimicamente attraverso la
respirazione aerobica,
– oppure può avvenire attraverso una combustione, come
quando viene bruciato del carbone o del combustibile fossile.
Ciclo del carbonio
Nel ciclo del carbonio sono fortemente coinvolti
microrganismi mediatori in cruciali reazioni
biochimiche….
•Le alghe fotosintetiche fissano il carbonio predominante in
acqua:
–quando esse consumano CO2 il pH dell'acqua sale, favorendo la
precipitazione di CaCO3 e di CaCO3*MgCO3.
•Il carbonio organico fissato dai microrganismi:
–viene trasformato da processi biogeochimici in petrolio fossile,
kerogene, carbone e lignite.
Ciclo del carbonio
• Nel ciclo del carbonio sono fortemente coinvolti
microrganismi mediatori in cruciali reazioni
biochimiche……
• Il carbonio organico delle biomasse, del petrolio e delle
sorgenti xenobiotiche
– viene degradato da microrganismi e riportato in atmosfera come
CO2.
• Gli idrocarburi come quelli contenuti nel petrolio grezzo,
e alcuni idrocarburi ottenuti per sintesi:
– vengono degradati da microrganismi.
– meccanismo importante nell'eliminazione degli idrocarburi
inquinanti, come quelli che sono stati immessi accidentalmente
in acqua o sul suolo.
Ciclo dell’azoto
Scariche elettriche,
combustione ad alta
temperatura
N2
Fissazione biologica
NO
O2
Proteine negli
organismi
fissatori
Fissazione
industriale
Batteri denitrificanti
NO2
N2O
H2O
Organismi in
decomposizione
Sintesi di proteine e
amminoacidi
Proteine vegetali
e animali prodotti
di rifiuto
NH3
NH4+
Batteri nitrificanti
Batteri nitrificanti
NO2Riduzione
catalizzata da enzimi
in organismi superiori
NO3Riduzione
catalizzata da
enzimi
Organismi in
decomposizione
La freccia tratteggiata rappresenta un cammino meno importante. L’importanza
di ogni serbatoio e di ogni cammino dipende dal particolare ecosistema
considerato.
Ciclo dell’azoto
Stato di
Formula
ossidazione
Nome
+5
Pentossido di diazoto
Acido nitrico
Ione nitrato
Diossido di azoto
Acido nitroso
Ione nitrito
Ossido di azoto
Ossido nitroso
Azoto
Ammoniaca
Ione ammonio
α-ammino acidi
Ammidi
Proteine
+4
+3
+2
+1
0
-3
N2O5
HNO3
NO3NO2
HNO2
NO2NO
N2O
N2
NH3
NH4+
Forme
ossidate
Forme
ridotte
Ciclo dell’azoto
• serie di reazioni di ossidazione e di riduzione
dell’azoto e di alcuni suoi composti.
• avvengono per azione degli organismi viventi
(piante verdi, alghe, batteri, funghi)
– che forniscono o l’energia per produrre molte reazioni
o sostanze che accelerano le reazioni, o entrambi le
cose.
• Il ciclo è pertanto un’interazione intima tra
organismi viventi e l’ambiente fisico:
– il benessere dell’uno dipende dall’altro.
Ciclo dell’azoto
Ciclo dell’azoto
Chimica dell’azoto e dei suoi composti
• Nel ciclo dell’azoto, l’azoto libero, o elementare, esiste
quasi esclusivamente nell’aria:
– l'atmosfera è infatti costituita per il 78 % in volume di azoto
elementare, N2
• Certi composti dell’azoto sono localizzati nel terreno e
nell’acqua.
• L'azoto, è un costituente essenziale delle proteine.
• La molecola N2 è molto stabile,
– Per rompere una molecola di N2 occorrono 225 kcal di energia:
– N2 + 225kcal 2N
– Ciò avviene quindi attraverso processi altamente energetici,
come ad esempio scariche elettriche.
Ciclo dell’azoto
Chimica dell’azoto e dei suoi composti
Fissazione
• L’azoto molecolare N2non può essere usato
direttamente ma viene fissato, da processi
biochimici mediati da microrganismi
– lo trasformano in composti solubili in acqua (NO3-,
NH4+ e NH3) e quindi assimilabili dagli organismi
attraverso il ciclo biogeochimico
– mediante l’uso di enzimi per accelerare le reazioni
Ciclo dell’azoto
Chimica dell’azoto e dei suoi composti
•L’azoto rientra nell’ambiente in parecchi modi
–la via più ovvia è attraverso la morte degli organismi.
•I loro corpi vengono decomposti da funghi e batteri:
– che rilasciano ammoniaca e ioni ammonio
•i quali poi con un processo chiamato nitrificazione
–possono essere utilizzati per la formazione di nitrati
Ciclo dell’azoto
Chimica dell’azoto e dei suoi composti
Nella nitrificazione si distinguono
•i batteri nitrificatori,
– che trasformano l'ammoniaca in nitriti (NO2-),
•i batteri nitratatori,
– che, a loro volta, ossidano i nitriti e
contribuiscono alla produzione dei nitrati
(NO3-).
Ciclo dell’azoto
Chimica dell’azoto e dei suoi composti
•Nel corso della decomposizione avviene la denitrificazione,
sempre a opera di batteri (anaerobi eterotrofi)
– attraverso la quale gli ossidi di N sono ridotti ad azoto
molecolare o a biossido di azoto
– quindi restituiti all’atmosfera.
Ciclo dell’azoto
•Autoregolazione
•Il ciclo dell’azoto è auto-regolante:
– può mantenere l’equilibrio
– vi è poco accumulo o impoverimento di azoto nei
serbatoi dell’ecosistema.
•L’unico squilibrio nel bilancio:
– riguarda la perdita di azoto organico che finisce nei
sedimenti marini profondi e inaccessibili.
Ciclo dell’azoto
•Autoregolazione
• I nitrati formati in questi sedimenti per azione batterica:
– possono nel tempo essere riportati alla superficie
della terra per formare depositi concentrati di nitrati.
– In altri casi, i meccanismi naturali del ciclo sono
incapaci di ristabilire l’equilibrio.
Ciclo dell’azoto
•Autoregolazione
•L’attività antropica ha creato disequilibri locali
alterando la quantità di ione nitrato negli
ecosistemi:
– sia togliendo nitrati da alcuni ecosistemi
– che aggiungendo troppi nitrati ad altri
ecosistemi con inevitabile cattiva
distribuzione e accelerazione di vari percorsi
del ciclo
– Influenzando anche altri cicli.
Ciclo dell’azoto
Energia nel ciclo dell’azoto
• muovendosi nel suo ciclo l’azoto subisce una serie di
ossidazioni e riduzioni.
• la riduzione dell’azoto molecolare e combinato ad altre
forme di azoto richiede energia
–che è fornita direttamente o indirettamente da microrganismi
associati nella trasformazione.
•Inversamente, l’ossidazione dell’azoto combinato libera
energia che può essere utilizzata dagli organismi;
–questo perché reagisce con l’ossigeno molecolare che prende
parte alla maggior parte delle reazioni redox.
–In tali reazioni l’ossigeno molecolare riceve elettroni da un atomo
meno elettronegativo come carbonio e azoto ossidandoli.
Ciclo dell’azoto
•Energia nel ciclo dell’azoto
•In tali trasformazioni la perdita di energia come
calore è inevitabile
– quindi, per il funzionamento ininterrotto del ciclo è
importante un continuo rifornimento di energia.
•Mentre l’azoto circola in modo ciclico,
– l’energia è dissipata come calore che non può
essere utilizzato dagli organismi
– Il flusso di energia è unidirezionale mentre quello dei
nutrienti è ciclico.
Ciclo dell’ossigeno
Ciclo del fosforo
Ciclo dello zolfo
Riepilogo
•I cicli del carbonio, zolfo e azoto contengono composti
gassosi
–che permettono agli elementi di circolare attraverso un cammino
atmosferico e sono legati tra loro attraverso i cicli dell’ossigeno e
dell’acqua. Se è attivo l’uno, sono attivi anche gli altri.
•Maggiore è il numero di cammini alternativi esistenti nel
ciclo biogeochimico di un elemento tra un punto all’altro
– meglio quel ciclo sarà capace di adattarsi a piccoli disturbi di
breve durata, e più perfetto sarà quel ciclo.
•I cicli gassosi tendono ad essere autoregolanti mentre
quelli sedimentari lo sono di meno:
–a causa della loro natura più semplice e alla loro tendenza a
perdere il loro elemento in sedimenti, dove l’elemento è
inaccessibile agli organismi e al riciclaggio.
ATMOSFERA TERRESTRE
INQUINAMENTO ATMOSFERICO
ATMOSFERA
TROPOSFERA
Va dal livello del mare fino a 11 km di altitudine a diretto contatto
con litosfera e idrosfera.
A questo livello avvengono i fenomeni
orizzontali e verticali delle masse d’aria.
climatici:
movimenti
Lo strato d’aria a più diretto contatto con la superficie terrestre
fino ad 1Km di altezza è caratterizzato da un buon mescolamento
dovuto ai moti convettivi.
Durante la notte lo spessore è ridotto dalle maggiori condizioni di
stabilità dell’aria: la presenza di alcuni contaminanti in prossimità
del suolo può essere maggiore durante la notte!!
STRATOSFERA
ATMOSFERA
Arriva a 50 km circa
Si verifica un aumento di temperatura che stabilizza il movimento
delle particelle di aria verso l’alto e quindi il mescolamento verticale.
Il flusso di aria è prevalentemente orizzontale.
Poiché non vi è pioggia per pulire l’atmosfera dai contaminanti, questi
permangono per tempi molto lunghi e possono spostarsi per grandi
distanze.
E’ caratterizzata dalla presenza di un sottile strato di ozono
responsabile
dell’assorbimento
della
radiazione
ultravioletta
proveniente dal sole.
MESOSFERA
ATMOSFERA
Va da 50 a 85 km circa.
Il gradiente di temperatura si inverte nuovamente.
Si hanno rapidi mescolamenti verticali.
TERMOSFERA
ATMOSFERA
Va da 85 a 500 km circa.
L’aria è altamente rarefatta.
ESOSFERA
ATMOSFERA
Oltre i 500 km di altezza.
Le molecole possono sfuggire all’attrazione gravitazionale e perdersi
nello spazio
COMPOSIZIONE DELL’ATMOSFERA
78%
Ossigeno
Azoto
Altro
21%
1%
Nell’atmosfera.
• l'acqua è variabile da 0.1 a 5%,
• materiale particellare o polveri.
• moltissime specie presenti a livelli di
concentrazione che vanno da (ppb) fino a poche
(ppt)
•hanno una grossa rilevanza nel determinare
le proprietà chimiche, fisiche dell’atmosfera
stessa.
INQUINAMENTO ATMOSFERICO
presenza nell'atmosfera di sostanze che
causano un effetto misurabile sull’essere
umano, sugli animali, sulla vegetazione o sui
diversi materiali.
Queste sostanze di solito non sono presenti nella
normale composizione dell’aria, oppure lo sono ad un
livello di concentrazione inferiore.
Gli inquinanti vengono solitamente distinti in due gruppi
principali:
quelli di origine antropica, cioè prodotti dall’uomo, e quelli
naturali.
INQUINANTI
Primari sono gli inquinanti che vengono immessi
direttamente nell’ambiente in seguito al processo che li ha
prodotti.
Secondari sono invece quelle sostanze che si formano
dagli inquinanti primari (sia antropogenici che naturali) a
seguito di modificazioni di varia natura causate da reazioni
che, spesso, coinvolgono l’ossigeno atmosferico e la luce.
INQUINANTI PRIMARI
I principali sono quelli emessi nel corso dei processi di
combustione di qualunque natura:
il monossido di carbonio,
il biossido di carbonio,
gli ossidi di azoto (NOx),
le polveri,
gli idrocarburi incombusti,
anidride solforosa.
TRASFORMAZIONI
inquinanti primari
Processi di diffusione, trasporto e deposizione.
Processi di trasformazione chimico-fisica che possono
portare
alla
formazione
degli
inquinanti
secondari.
DISPERSIONE, RIMOZIONE
Dispersione: da fenomeni di diffusione turbolenta
di trasporto delle masse d’aria.
Rimozione: è
deposizione.
determinata
dai
vari
processi
di
Dispersione e rimozione
processi meteorologici che regolano il comportamento
delle masse d’aria nella troposfera.
Microinquinanti organici in fase
gassosa
Il ciclo vitale delle sostanze
troposfera è determinato:
chimiche
nella
• dalla distribuzione territoriale
• dall’intensità emissiva delle sorgenti primarie,
• dai processi di veicolazione attraverso i venti, e delle
acque superficiali e sotterranee,
• dall’intervento dell’uomo
• dai meccanismi di conversione chimica e rimozione.
… Microinquinanti organici in fase
gassosa…
•il radicale ossidrile (OH.)
•
la sorgente primaria: il processo di
fotolisi dell’ozono troposferico
• altre importanti specie ossidanti
• radicale ossidrile
• all’ozono
• l’ossigeno atomico (O),
• il radicale idroperossile (HO2)
• il radicale nitrato (NO3).
… Microinquinanti organici in fase
gassosa…
Le possibili vie di rimozione atmosferica:
• la fotolisi diretta
• la reazione con ozono
• l’attacco diurno da parte del radicale OH
• quello notturno da parte del radicale nitrato.
Chimica della Stratosfera
Lo strato di ozono
è una regione dell’atmosfera che rappresenta il
naturale schermo della terra alle radiazioni solari
essendo in grado di filtrare le radiazioni UV.
La quantità totale di ozono che ci sovrasta in
qualsiasi punto dell’atmosfera è espressa in unità
Dobson (DU).
Una unità Dobson (DU) equivale ad uno strato di ozono puro dello spessore di 0.01 mm
alla densità che questo gas possiede pressione esistente all’altezza del suolo (1 atm).
I processi chimici alla base della diminuzione dello
strato di ozono
e di altri processi che si verificano nella stratosfera
sono alimentati dall’energia contenuta
nella luce solare.
Assorbimento
della luce
Attivazione delle
molecole
Reattività chimica
Le sostanze differiscono moltissimo fra loro
per la propensione ad assorbire luce di una data
lunghezza d’onda
differenze dei livelli energetici
degli elettroni.
Lunghezza
d’onda (nm)
Intervallo
principale
<50
Raggi X
Lunghezza
d’onda (nm)
Subintervallo
50
200
UV-C
Ultavioletto
280
UV-B
320
UV-A
400
400
Violetto
Visibile
Rosso
750
750
4000
Radiazioni
IR
termiche
Infrarosso
10000
Spettro di assorbimento
Rappresentazione grafica della frazione di luce che
può essere assorbita da una data molecola.
O2
125-175 nm
O3
220-320 nm
PRINCIPI
DI FOTOCHIMICA …
L’energia E di un fotone è in relazione con la
frequenza e la lunghezza d’onda della luce:
E = hν
ν
E = hc/λ
λ
h = costante di Planck = 6,626x10-34 J s
c = velocità della luce nel vuoto = 2,998x108 ms-1
PRINCIPI
DI FOTOCHIMICA …
nm
kJ/moli
220
544
290
413
320
374
400
299
750
160
Energie dei fotoni della luce di differenti
lunghezze d’onda.
PRINCIPI
DI FOTOCHIMICA …
Nel caso della luce UV-Vis,
le energie fotoniche sono dello stesso ordine di
grandezza dell’entalpia della reazioni chimiche
comprese quelle che dissociano atomi dalle
molecole.
Una reazione innescata da un imput di
energia sotto forma di energia luminosa
viene detta
reazione fotochimica
PRINCIPI
DI FOTOCHIMICA …
Molecole che assorbono luce in genere non
trattengono molto a lungo l’eccesso di energia.
In una piccola frazione di secondo le molecole
* devono utilizzare l’energia acquisita per reagire
fotochimicamente
* dissiparla come energia termica per collisione con le
molecole vicine
* aumentare la loro energia cinetica.
FORMAZIONE E DISTRUZIONE NON
CATALITICA DELL’OZONO
La reazione di formazione dell’ozono nella
stratosfera genera calore sufficiente per
influenzare la temperatura in questa regione
dell’atmosfera.
Al disopra della stratosfera
l’aria è assai sottile
La concentrazione delle molecole di O2è così bassa che
gran parte dell’O2, esiste in forma atomica O
in seguito a fotodissociazione di molecole di O2
O2 + hν
ν (200-280 nm) → 2 O
Gli atomi di ossigeno formati
finiscono per collidere e riformare O2
2 O → O2
che va ancora incontro a fotodissociazione.
Nella stratosfera
L’intensità della luce UV-C è assai minore:
gran parte di essa è filtrata da parte dell’O2 sovrastante.
L’aria è più densa con maggiore concentrazione di
O2.
Gran parte dell’ossigeno stratosferico: è in forma di
O2 piuttosto che di ossigeno atomico.
O + O2 → O3 + calore
Fonte di tutto
l’ozono presente
nella stratosfera
Nella parte inferiore della stratosfera
La concentrazione di O2 è maggiore che nella parte
superiore.
La radiazione UV sono filtrate prima: è poca la quantità
di ossigeno dissociata e poca la quantità di O3 formata.
La densità dell’O3 raggiunge il massimo dove è
più alto è il prodotto tra l’intensità della
radiazione UV-C e la concentrazione di O2.
Gran parte dell’O3 è localizzato
tra 15 e 35 Km di altezza cioè si situa nella parte inferiore e
intermedia della stratosfera, regione nota come strato di
ozono.
Il massimo di densità dell’ozono si trova:
a circa 25 Km di altezza al disopra delle aree tropicali,
a 21 km di altezza alle latitudini intermedie,
a 18 Km a livello delle regioni subartiche.
Per dissipare l’energia termica generata nelle
collisioni tra ossigeno atomico (O) e quello molecolare
(O2) che producono O3
è necessaria una terza molecola M (quale l’N2):
O + O2 + M → O3 + M + calore
Tale liberazione di calore è la causa della maggiore
temperatura della stratosfera rispetto a quella
dell’aria sovrastante e sottostante.
La stratosfera
è quindi definita come la regione dell’atmosfera compresa
tra questi due confini di temperatura in cui si ha
un’inversione termica.
Nella stratosfera l’aria è stratificata
perché il mescolamento verticale è lento per il fatto che
l’aria fredda con maggiore densità non sale
spontaneamente per effetto della forza di gravità.
La distruzione dell’O3
ad opera della radiazione UV di lunghezza d’onda minore di 320
nm:
ν (λ
λ < 320nm) → O2 + O*
O3 + hν
L’atomo O* si trova in uno stato eccitato a più alta energia e, se
non reagisce con altri atomi tale energia viene persa.
Le reazioni possibili di O*
O* + O2 → O3
O* + O3 → 2 O2
reazione molto lenta
RIASSUMENDO…
L’O3 della stratosfera viene continuamente formato,
decomposto e riformato durante le ore diurne.
Viene prodotto
in virtù della presenza delle radiazioni UV-C (200-280 nm)
viene provvisoriamente distrutto:
quando filtra gli UV-B e UV-C:
quando reagisce con atomi di ossigeno
…RIASSUMENDO
L’O3 non si forma
al di sotto della stratosfera per la mancanza degli UV-C
al di sopra dove predominano atomi di ossigeno che si
ricombinano a formare O2 .
… quindi …
stratosfera
troposfera