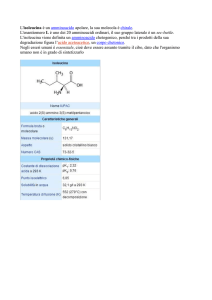
SCHEDA
8.7
Decarbossilazione degli amminoacidi e ammine
biogene
Una delle principali reazioni metaboliche
a carico degli amminoacidi è la loro decarbossilazione. La reazione è catalizzata da
un gruppo di enzimi noti come amminoacido decarbossilasi che utilizzano il piridossal fosfato come coenzima. I prodotti di
questa reazione sono ammine spesso di notevole importanza biochimica o dotate di
intense attività fisiologiche e pertanto indicate come ammine biogene (tabella).
Come si può vedere dalla tabella, molte
di queste sostanze o loro derivati sono mediatori chimici (istamina, dopamina) oppure neurotramettitori (noradrenalina, serotonina, acido ␥-amminobutirrico), ormoni (adrenalina, triptamina, melatonina)
o intermedi metabolici utilizzati per la sintesi di molecole più complesse (etanolammina, cisteammina, -alanina) o di organelli cellulari (putrescina, cadaverina, spermidina, spermina).
Queste considerazioni sottolineano l’importanza della decarbossilazione degli am-
minoacidi nell’economia del metabolismo
cellulare; tuttavia le amminoacido decarbossilasi hanno una notevole importanza
anche in medicina e farmacologia. Per
esempio, il morbo di Parkinson è una grave malattia neurodegenerativa che colpisce
le cellule di una particolare regione dell’ipotalamo, la substantia nigra. Queste cellule producono un neurotrasmettitore, la
dopamina, responsabile del funzionamento delle sinapsi della via nigro-striatale che
assicura la corretta attività contrattile di
molti dei muscoli del corpo, in particolare
di quelli locomotori. La morte di queste cellule causa anomalie neuromuscolari che si
manifestano con irrigidimento muscolare
e tremore a riposo che impediscono la corretta attività funzionale degli arti, in particolare riducendo progressivamente la possibilità di deambulazione. Uno dei trattamenti farmacologici più comuni di questa
patologia è stata la somministrazione di Ldiidrossifenilalanina (L-DOPA o levodopa),
Tabella Alcune ammine biogene
Amminoacido
Ammina formatasi
Distribuzione e funzione
Lisina
Ornitina
Metionina
Arginina
Serina
Treonina
Cisteina
Acido aspartico
Acido glutammico
Istidina
Tirosina
Cadaverina
Putrescina
(n Spermidina, spermina)
Agmatina
Etanolammina
Propanolammina
Cisteammina
-alanina
Acido ␥-amminobutirrico
Istamina
Tiramina
Dopamina
(n Adrenalina)
Triptamina
Serotonina (n Melatonina)
Ribosomi, batteri
Ribosomi, batteri
(Ribosomi, sperma)
Batteri (flora intestinale)
Fosfatidi
Vitamina B12
Coenzima A
Coenzima A, acido pantotenico
Cervello (blocca i gangli)
Attiva sulla pressione del sangue
Fa contrarre l’utero
Ormone tessutale
(n Ormone)
Ormone?
Ormone tessutale
3,4-diidrossifenilalanina
Triptofano
5-idrossitriptofano
Stefani-Taddei Percorsi di biochimica © Zanichelli 2011
1
Figura 1 Cellule di Trypanosoma brucei rhodiense in circolo.
il precursore della dopamina, in cui viene
trasformata una volta penetrata nel cervello attraverso la barriera emato-encefalica.
Tuttavia le amminoacido decarbossilasi presenti nei tessuti e nel sangue circolante trasformavano prematuramente la molecola
nel derivato attivo, che era successivamente metabolizzato prima di raggiungere il cervello. Per questo oggi la levodopa viene
somministrata insieme a un inibitore delle
decarbossilasi che permette al farmaco di
non essere decarbossilato e degradato prima di raggiungere il cervello.
Un altro esempio dell’importanza in medicina delle amminoacido decarbossilasi è
dato dalla terapia della malattia del sonno
africana, una patologia che colpisce molte
persone in Africa, causata dall’infezione di
un protista parassita, Trypanosoma brucei,
che causa febbre ricorrente cronica che indebolisce il paziente fino alla morte (figura 1).
La vaccinazione è inefficace come terapia perché una proteina di rivestimento del
parassita, contro cui si sviluppa la reazione
immunitaria, presenta un elevato tasso di
mutazione, talché il vaccino diviene presto
inefficace e l’infezione prodotta delle cellule resistenti sopravvissute si riacutizza. Una
terapia più efficace si basa sull’uso di inibi-
2
Stefani-Taddei Percorsi di biochimica © Zanichelli 2011
tori dell’ornitina decarbossilasi, una specifica amminoacido decarbossilasi che dall’ornitina produce spermina e spermidina,
poliammine che favoriscono il corretto ripiegamento del DNA e pertanto necessarie
in grande quantità alle cellule in attiva proliferazione come quelle di T. brucei. Al contrario dell’enzima di mammifero, l’enzima
di tripanosoma è particolarmente stabile e
non viene rimpiazzato facilmente quando
si inattiva; pertanto un inibitore di tale enzima che vi si leghi permanentemente lascia a lungo la cellula priva della possibilità di produrre poliammine ostacolandone
la riproduzione mentre non ha un effetto significativo sulle cellule dell’ospite. A tale
scopo è stato studiato un derivato dell’ornitina, la difluorometilornitina (DFMO), capace di inattivare molto rapidamente l’ornitina decarbossilasi. Il meccanismo di inibizione consiste nell’iniziale formazione
della normale base di Schiff tra DFMO e piridossal fosfato, il coenzima di questi enzimi, con la successiva decarbossilazione della base di Schiff stessa. Successivamente, il
prodotto decarbossilato forma un addotto
stabile con la catena laterale di un residuo
amminoacidico presente nel sito attivo dell’enzima. Pertanto la reazione non può procedere ma resta bloccata a questo stadio e
DFMO
F
F
CH
C
H2 N (CH 2 )3
O
C
NH 2
CH
O]
H 2N
(CH 2)3
H2 O
O
O
CH2
C
O
CH 2
1
Cys-S
OH
N
H
H
F
(CH 2)3
Enzima
H
Cys-S
C
C
1
F]
NH
H 2N
(CH 2)3
CH 2
NH
ulteriori
riarrangiamenti
CH
OH
1
N
H
C
1
CH
O
CH 3
Base di Schiff
C
P
CO2 1 F ]
1
CH 3
Piridossal
fosfato
H 2N
O]
NH
CH
P
OH
N
H
Enzima
O
C
1
CH
P
F
F
P
O
CH 2
Bloccato!
OH
1
CH 3
N
H
CH 3
Figura 2 Il meccanismo di inibizione dell’ornitina decarbossilasi da parte della DFMO.
l’enzima viene inattivato irreversibilmente
(figura 2).
La DFMO è un esempio di inibitore suicida, cioè di inibitore enzimatico che bloc-
ca irreversibilmente un enzima utilizzando
lo stesso meccanismo di reazione con cui
normalmente l’enzima catalizza la trasformazione del suo substrato fisiologico.
Stefani-Taddei Percorsi di biochimica © Zanichelli 2011
3