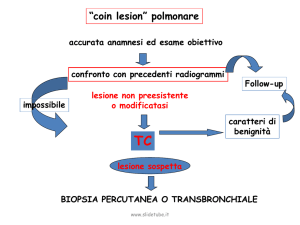
DIAGNOSTICA PER IMMAGINI E RADIOTERAPIA
Neuroradiologia
Prof. Colosimo
12-11-‘07
8.30-10.30
La patologia endocranica si basa sull’uso di TAC e RM. Nell’ambito delle
potenzialità di queste tecniche e metodologie di studio ci sono delle
specifiche modalità di impiego rivolte al SNC e l ‘ambiente anatomico del
compartimento endocranico è fondamentale.
I mezzi di contrasto validi per la radiologia di altri organi non sono utili
per il cervello, perché i contrasti non passano la barriera emato encefalica.
Quindi se il fegato si impregna di mdc sulla base della sua
vascolarizzazione,questo non è vero per il cervello. Questo è un concetto
fondamentale perché se io noto mdc nel cervello, questo è indice o di
assenza di barriera emato encefalica o di danneggiamento della stessa e
non che la vascolarizzazione è aumentata.
DIFFERENZA TRA TC E RM
→In TC misuriamo un parametro: la densità ,quindi tutto dipende dalla
nube elettronica, da quello che i raggi incontrano.
I mezzi di contrasto sono “organo iodati”, cioè a base di iodio.
Nel cervello la TC è ideale per riconoscere:
- l’emorragia cerebrale ( iperdensa rispetto al cervello)
-le calcificazioni
Sono densità molto diverse dal resto; la scala prevede a :
0 gradi: acqua
+ 1000 gradi: osso
-1000 gradi: aria
La TC è la soluzione ideale per le calcificazioni e per le fini strutture
scheletriche corticali, non della spongiosa, dove invece è preferibile la
RM.
→La RM, invece, è basata su più parametri: di rilassamento T1 e T2 (
tempo di rilassamento longitudinale e trasversale rispettivamente ), densità
dei protoni, flusso, diffusione, legame chimico.
Quindi la metodica è più complessa e più sensibile, più specifica, cioè più
capace rispetto alla TC di distinguere il tessuto nervoso normale da quello
ammalato e di rilevare in quest’ultimo il tipo di costituzione presente.
Non abbiamo un solo modo di ottenere le immagini, ma un’enorme
numero di sequenze, cioè modalità di somministrare lo stimolo di
radiofrequenze e raccogliere i segnali che privilegiano l’uno o l’altro
parametro.
I liquidi di contrasto sono paramagnetici, cioè non sono mdc organo iodati;
di fatto oggi i mdc sono tutti chelati del “ gadolinio”, ( sostanza
estremamente tossica, che viene chelata perché possa agire accorciando
solo il tempo di rilassamento T1; quindi le immagini si fanno solo nelle
sequenze che privilegiano il parametro T1.
Riassumendo, in RM si usano mdc paramagnetici a base di gadolinio che
accorciano il T1, quindi le immagini dopo contrasto sono solo immagini
T1.
Se è vero che la sensibilità della RM è 10 volte superiore nel SNC rispetto
alla TC, è anche vero che la sensibilità a dimostrare l’impregnazione dopo
contrasto con la RM è 10 volte superiore a quella della TC; è tutto più
complesso ma più sensibile.
IMMAGINE: tc senza contrasto di pz con infarto dell’arteria cerebrale
media. Nella fase acuta non si vede niente mentre dopo 24h il territorio
lesionale si vede come ipodenso, cioè meno denso del nostro punto di
riferimento che è la corteccia cerebrale.
In RM i contrasti dipendono dal tipo di sequenza, dalla tempistica della
raccolta del segnale ( T1,T2).
In T2 il liquido cefalorachidiano è fortemente intenso, bianco, come le
cisterne, mentre la sostanza bianca è ipointensa rispetto alla corteccia.
In T1, il liquido cefalorachidiano sarà ipointenso e la sostanza bianca
iperintensa rispetto alla corteccia.
In condizioni ideali, di elezione, in pz collaboranti e privi di
controindicazioni alla RM, come essere portatori di un pacemaker, si usa
solo la RM. La TC non ha indicazione perché costa di più e fa vedere di
meno. Questo per pz generali ( 80 % ).Si usano anche mdc paramagnetici (
più tollerati dei mdc organoiodati ).
In condizioni di urgenza e di emergenza si usa la TC, perché questa dura
pochi secondi, tutto il corpo può essere studiato in 30 secondi.
In pz critici, con sospetto di emorragia cerebrale, si usa la TC perché in 4
secondi di scansione si ha l’immagine. Inoltre il vantaggio della TC, oltre a
riconoscere le emorragie, riconosce anche le fratture e le calcificazioni,
molto meglio di quanto possa fare la RM.
SEMEIOTICA DEL COMPARTIMENTO ENDOCRANICO
Dipende dalla anatomia e dalla fisiologia del compartimento endocranico.
Segni diretti: le alterazioni del normale segnale RM e le relative
modificazioni di questo reperto dopo mdc.
Segni indiretti: gli effetti sulle altre strutture intracraniche, in
particolare gli effetti sugli spazi liquorali endocranici.
All’inizio la diagnostica delle immagini del cervello si era basata proprio
sugli spazi liquorali, perché quando non c’era la TC e la RM, si mandava
l’aria nel sistema ventricolare per vedere gli effetti della patologia sui
ventricoli.
Nel cervello la presa di contrasto è determinata dalla mancanza o dal
danno della barriera ematoencefalica, mentre molto meno rilevante è il
contributo che dà la vascolarizzazione.
Quando iniettiamo un liquido di contrasto per via venosa, va nel letto
vascolare; quando vediamo l’impregnazione, o siamo in grado di coglierla
quando ancora siamo nel letto vascolare, o quando passa nei tessuti,per
andare nel liquido extracellulare.
Se abbiamo due malattie che danno la stessa alterazione della barriera
ematoencefalica e la stessa vascolarizzazione, possiamo osservare delle
differenze, che dipendono da quanto spazio extracellulare c’è in quel
tessuto.
La vascolarizzazione ha un’importanza minore, quello che conta nel
cervello è l’integrità e la presenza della barriera ematoencefalica.
I segni indiretti sono fondamentali nello studio del cervello perché si tratta
dell’unico organo del corpo formato da un contenitore rigido,a volume
fisso e da un contenuto che è costituito da tessuto nervoso parenchimatoso,
dal liquido cefalorachidiano e dal sangue circolante. Il volume che
abbiamo a disposizione è quello, non può cambiare e questa situazione è
sub-compartimentata dalla presenza di strutture rigide: pareti ossee, falce e
tentorio.
LESIONI ESPANSIVE: occupano spazio e aumentano il volume
dell’area coinvolta.( es: infarto a. cerebrale media, in fase acuta).
LESIONI CON PERDITA DI SOSTANZA: riducono il volume
dell’area coinvolta. ( es :infarto a. cerebrale media, in fase cronica).
LESIONI CEREBRALI in cui non si riesce a rilevare né l’una né
l’altra cosa.
IMMAGINE: RM di immaginiT2. Molti tumori del cervello, che
colpiscono l’età media, non prendono mdc perché hanno la barriera
ematoencefalica integra. Questa è una grande differenza con un tumore,
per esempio, del fegato.
Nel cervello il comune denominatore dell’effetto espansivo è l’edema
cerebrale ( immagine bianca). Il MENINGIOMA è il tumore più
comune e più benigno,prende un sacco di mdc, diventa bianco come
una lampadina. E’ un tumore extracerebrale, sta sulla meninge.
I segni di massa sono: spostamento del terzo ventricolo ( ernia sotto la
falce) e edema.
La presa di contrasto non ha alcunché da riconoscere la natura e la
malignità di un tumore. Non è la presa di contrasto che decide.
Lesioni espansive non vogliono dire lesione neoplastica, perché
possono avere caratteristiche lesioni espansive anche lesioni
neoplastiche, ischemiche, emorragiche, traumatica, infettive,
infiammatorie, acute e subacute; il comune denominatore più
importante responsabile di queste caratteristiche espansive è l’edema,
che ha un significato del tutto aspecifico ( infarto, tumore, emorragie ).
La RM è la tecnica d’elezione. Ha il privilegio delle informazioni che
abbiamo scelto. La maggior parte degli studi patologici apparirà
iperintensa nelle immagini T1 dipendenti e ipointensa in quelle T2
dipendenti. E’ anche vero che la sensibilità che abbiamo di distinguere
il normale dal patologico è basata sulle immagini T2 dipendenti, mentre
le immagini T1 sono meno sensibili.
MEDICINA NUCLEARE
Dt.ssa Di Giuda
TECNICHE TOMOGRAFICHE
SPET:tomografia ad emissione di protoni singoli
PET: tomografia ad emissione di positroni
Entrambe le tecniche possono valutare i parametri fisiopatologici delle
neoplasie endocraniche,quindi caratterizzare dal punto di vista biologico i
processi biochimici tipo la sintesi proteica, metabolismo del glucosio ,
trasporto aminoacidico o operazioni della cinetica cellulare delle
neoplasie.
Le tecniche differiscono perché la SPET utilizza radionuclidi γ emittenti.
E’ una tecnica molto diffusa, presente in tutti i reparti di medicina
nucleare.
La PET, invece, è una tecnica molto più costosa, in quanto utilizza
radionuclidi emittenti positroni. Necessita per forza di un tomografo
delicato.
Il tomografo più usato è il “PET-TAC” che associa la scansione
tomografica PET e la scansione TAC.
Entrambe le metodiche possono studiare i tumori utilizzando i traccianti di
neoplasia, o radiofarmaci oncotropi, o tropismo tumorale.
SPET CEREBRALE CON RADIOFARMACI ONCOTROPI
E’la tecnica più diffusa.
Un tempo questi radiofarmaci erano gli indicatori positivi di neoplasia
perché si concentravano in maniera selettiva nelle cellule neoplastiche.
Esistono diversi tipi di traccianti SPET:
1. radiofarmaci di CELLULARITA’:
-201 Tl-cloruro
-99m TC-sesta MIBI
-99m TC-tetrofosmin
Sono sostanze che utilizziamo per l’imaging di per fusione miocardia.
Sono definiti di cellularità perché si concentrano nelle cellule
neoplastiche in rapporto alle alterazioni della barriera ematoencefalica,
all’aumento del flusso ematico e soprattutto all’aumento della cinetica
cellulare. Questi radiofarmaci sono captati da cellule attive dal punto di
vista metabolico, in replicazione.
2. radiofarmaci per il trasporto amminoacidico:
Sono radiofarmaci che riflettono la velocità della sintesi proteica,
aumentata nei tumori. Sono analoghi a degli amminoacidi.
In un soggetto normale 201 Tl-cloruro e 99m TC-sesta MIBI non sono
captati dal parenchima cerebrale sano per l’integrità della barriera
ematoencefalica.
In un soggetto per es. con GLIOBLASTOMA PUNTIFORME,neoplasia
maligna, c’è un intenso accumulo del radiofarmaco, visibile con entrambi i
radiofarmaci.
Non solo i gliomi maligni captano in maniera elettiva questi radiofarmaci,
ma anche altri tumori maligni: linfomi cerebrali, metastasi.
Nei tumori maligni c’è un’intensa captazione dei radiofarmaci.
Nei tumori benigni c’è una ridotta captazione, per cui per entrambi i
radiofarmaci, la captazione è correlata con il grading della neoplasia.(
soprattutto nei glomi).
Ciò che differenzia un tumore maligno da uno benigno è una prolungata
ritenzione del radiofarmaco ( visibile sia con il tallio che con il sesta-MIBI
).
Viceversa, esistono dei tumori benigni, es. il meningioma, in cui la
dismissione del radiofarmaco è molto rapida, cioè lo capta intensamente
ma subito lo dismette.
ESEMPIO:
astrocitoma di primo grado ( tumore a basso grado di malignità ): capta in
maniera scarsa o nulla il radiofarmaco.
Le aree di necrosi non captano il radiofarmaco,perché il presupposto per la
captazione è la vitalità cellulare; quindi un tumore maligno,che ha una
componente eterogenea, avrà anche delle aree di necrosi all’interno,quindi
queste appariranno come non captanti il tallio o il sesta-MIBI.
PET
E’la tecnica più applicata in oncologia.
La prima applicazione fu fatta nel 1982-86 nell’ambito delle neoplasie
cerebrali.
Con la PET possiamo studiare i processi biochimici:
- il metabolismo glucidico: il fluorodeossiglucosio ( FDG)
Il consumo di glucosio nelle neoplasie è aumentato.
- Trasporto amminoacidico:l’aumentato accumulo nelle cellule di
amminoacidi riflette la velocità del trasporto amminoacidico e della
sintesi proteica aumentata.
- Metabolismo fosfolipidico di membrana: anche qui la sintesi di
fosfolipidi è aumentata in cellule in attiva replicazione.
- Proliferazione cellulare: si valuta la sintesi del dna.
METABOLISMO DEL GLUCOSIO
Il FDG ( fluorodeossiglucosio) è il tracciante più utilizzato in oncologia
cerebrale.
Il FDG è un analogo del glucosio con una molecola di fluoro18 al posto di
un gruppo ossidrilico. Utilizza gli stessi mezzi di trasporto del glucosio per
entrare nelle cellule. A differenza del glucosio,però, una volta entrato nella
cellula, viene, ad opera della esochinasi, trasformato in FDG-6 PO4, che
rimane intrappolato nella cellula e non partecipa ai processi metabolici.
Il cervello utilizza il glucosio come principale sorgente energetica, quindi
il consumo di glucosio da parte del cervello, in condizioni normali, è
elevato; ci sono zone ( strutture sottocorticali, corteccia sott’occipitale )
che captano più FDG.
E’ quindi necessario, nei tumori, integrare l’immagine con il dato
neuroradiologico.
Il FDG è utilizzato nei tumori cerebrali perché questi sono associati ad un
elevato consumo di glucosio, in quanto aumenta il consumo energetico;
questo comporta un’aumentata espressione dei recettori del glucosio,
Glut1 e Glut3 e un aumento dell’attività glicolitica.
Il FDG viene captato da tutti i tumori che hanno un elevato consumo
metabolico; l’accumulo è maggiore nei tumori che sono più aggressivi dal
punto di vista biologico, correlato alla densità cellulare e soprattutto con il
grading di malignità, cioè i tumori ad elevato grado captano in maniera
intensa e sono lesioni che appaiono ipermetaboliche rispetto al parenchima
cerebrale circostante. Viceversa i tumori a basso grado di malignità,
appariranno ipometaboliche, o a volte isometaboliche, e in questo caso è
difficile l’identificazione con il FDG, e si dovranno utilizzare altri
traccianti che sono i traccianti per il trasporto amminoacidico, perché
vengono captati anche da tumori a basso grado di malignità.
PRINCIPALI APPLICAZIONI DELLA PET IN AMBITO
ONCOLOGICO.
L’applicazione medico-nucleare è un’informazione di tipo
funzionale;possiamo ottenere informazioni sullo stato metabolico
molecolare della lesione neoplastica.
La diagnosi in fase preterapeutica è appannaggio della RM, però ci sono
particolari situazioni in cui la medicina nucleare può essere di aiuto:
quando abbiamo dei dubbi sul grading di malignità della neoplasia,
quindi dell’aggressività biologica.
Valutazione della reale estensione della neoplasia, si può valutare
non solo la parte solida del tumore ( quella che ha la maggiore
densità cellulare), ma anche l’infiltrazione.
Guida metabolica alla biopsia stereotassica, perché andiamo a
valutare quelle che sono le parti biologicamente più attive, più
metaboliche e più proliferative della neoplasia.
Diagnosi cerebrale tra linfoma cerebrale primitivo e infezioni
cerebrali opportunistiche ( toxoplasmosi in soggetti con AIDS).
Ricapitolando: la PET può essere anche una guida metabolica, può essere
utile per identificare, in un tumore maligno con una componente cellulare
estremamente eterogenea ,la parte biologica, quindi più attiva del tumore,
su cui guidare la biopsia stereotassica,oppure guidare specifici agenti
terapeutici.
→LIMITI della PET con FDG IN ONCOLOGIA CEREBRALE:
Scarsa captazione da parte delle lesioni a basso grado di malignità o
a bassa attività metabolica, che appaiono come lesioni iso o
ipometaboliche rispetto al tessuto circostante.
Quindi le lesioni a basso grado non vengono viste, c’è una riduzione
della sensibilità della PET con FDG.
Il fisiologico accumulo nella sostanza grigia, che è elevato, può
rendere talvolta difficile l’interpretazione delle immagini.
L’accumulo nei processi flogistici, che riduce la specificità della
metodica.
Quindi, per i tumori a basso grado di malignità bisogna utilizzare altri tipi
di traccianti, in particolare i TRACCIANTI AMINOACIDICI, utilizzati
perché, in condizioni normali, c’è una scarsa captazione di questi traccianti
nel tessuto sano;questo comporta un contrasto aumentato lesione-non
lesione.
Quindi per i tumori a basso grado, bisogna utilizzare traccianti per il
trasporto aminoacidico. Questo non solo nella fase preterapeutica ma
anche per la valutazione delle recidive neoplastiche dopo trattamento.
La PET (e SPET) ha un ruolo importante anche nel follow-up; soprattutto
la PET viene utilizzata come indagine di routine quando la RM presenta
dei limiti nella diagnosi differenziale tra recidive ed esiti conseguenti a
trattamenti ( es:necrosi dopo trattamento).
La prima importante diagnosi differenziale da fare è la radionecrosi verso
la recidiva della malattia.
La PET con FDG può essere utilizzata per il viraggio del glioma da basso
grado ad alto grado. Se noi abbiamo in un tumore di basso grado di
malignità delle aree fortemente captanti,questo è un forte indice
sfavorevole perché vuol dire che è diventato un tumore ad alto grado di
malignità.
RADIOTERAPIA
Prof. Balducci
Neuroradiologia:
I tumori cerebrali sono rappresentati da una notevole varietà di istotipi; la
maggior parte sono di origine gliale ( circa il 60% ).
La radioterapia nel trasporto terapeutico del paziente si inserisce quasi
sempre. Solo in poche situazioni, come in tumori a bassi gradi o in alti
gradi ma con condizioni generali molto scadenti,non si inserisce.
Dopo la chirurgia interviene sempre la radioterapia perché i farmaci, per la
presenza della barriera ematoencefalica, difficilmente riescono a
raggiungere in dosi utili l’encefalo.
La radioterapia entra in gioco in tutte le fasi del percorso terapeutico del
paziente,dal momento della lesione iniziale, fino alla valutazione in corso
di follow-up dell’andamento della malattia.
Nella fase iniziale all’imaging viene richiesto di definire l’estensione della
malattia e cercare di dare un orientamento sul tipo e grado di aggressività;
la diagnosi di certezza spetta però all’istopatologia.
Si deve cercare anche di capire se sono presenti altre lesioni; per esempio,
nel caso di metastasi cerebrali bisogna capire se è presente una sola lesione
oppure più di una.
Esempio:
MEDULLOBLASTOMA:le lesioni possono diffondere lungo l’asse
spinale; quindi, nella fase di stadiazione è necessario uno studio non solo
dell’encefalo( sede iniziale della malattia ), ma di tutto l’asse spinale.
L’imaging è utile, quindi, nel definire la situazione iniziale della malattia e
la sua estensione per lo studio successivo dei volumi di trattamento.
In una lesione di alto grado di malignità ci troviamo di fronte ad una zona
di necrosi e ad una zona periferica rappresentata da una maggiore
impregnazione di mdc.
Il terapista, nella definizione del volume, deve tener conto non solo di
quello che vede l’imaging, ma anche dell’edema, perché in questa zona è
stato dimostrato che sono presenti molte cellule neoplastiche.
Dobbiamo fare ricorso alla integrazione delle diverse metodiche di
imaging e anche all’interno della stessa metodica di imaging,alle varie
dell’edema.
VANTAGGI DELLA TC E RM:
Sostanzialmente il vantaggio della TC è rappresentato dal fatto che è la
modalità di esame più frequentemente utilizzato nella pianificazione del
trattamento. E’ anche fondamentale perché tiene conto delle densità
elettroniche dei diversi tessuti e quindi ci consente di valutare cosa accade
nei tessuti quando andiamo a somministrare un trattamento radiante.
La RM,invece, nella caratterizzazione della lesione, quindi nella fase
iniziale di impostazione del trattamento. La RM non tiene conto delle
diverse densità dei tessuti.
La TC entra in gioco nella pianificazione del trattamento, la RM ci dà
informazioni che servono meglio a costruire il trattamento; sono due
metodiche strettamente correlate e possono essere integrate.
Si parte dall’ esame basale, che è la TC, effettuata a tutti i pz che devono
essere sottoposti ad un trattamento radiante, e la rapportiamo con la RM
nelle sue diverse sequenze, per trarre da ciascuna di quelle sequenze le
maggiori informazioni per una pianificazione del trattamento; possiamo
anche fondere tutto questo con la PET per ricavare il massimo di ciascuna
metodica per i trattamenti e per la migliore qualità di questi.
Se ci si basasse solo sulla TC si ridurrebbe la possibilità di un migliore
controllo della malattia.
→VANTAGGI TC:
Veloce
Adatta ai claustrofobici
Informazioni sulla densità elettronica
Interfaccia con i PTS
Interfaccia con simulazione virtuale
→VANTAGGI RM:
Imaging multiplanare
Imaging di sequenze multiple
Maggiori dettagli morfologici
RAPPRESENTAZIONE 3D DELLA DOSE
L’Imaging entra anche nel percorso terapeutico del paziente, quindi nella
rappresentazione della dose. Ci fa vedere le lesioni, ci fa contornare la
lesione e poi possiamo selezionare un assetto di fasci e visualizzare come
si distribuisce la dose nel nostro bersaglio ( i diversi tipi di colore indicano
i diversi livelli di dose).
La dose la possiamo anche rappresentare sul volume; e poiché possiamo
visualizzare i livelli di dose, possiamo capire anche qual è l’entità del
volume racchiuso da quelle isodosi.
Sappiamo anche capire gli organi critici, cioè quegli organi che se
superassero determinati livelli di dose comporterebbero della tossicità per
l’organo e quindi per la vita del paziente.
L’imaging ci consente anche una ricostruzione volumetrica del distretto
anatomico, ci consente di ricostruire il nostro target.
Entra in gioco nella quotidianità dei trattamenti: dobbiamo essere sicuri
che il paziente acquisti sempre la stessa dose, che il volume di dose
predefinito sia poi quello che effettivamente viene somministrato.
Infine bisogna capire se il risultato che ci eravamo prefissati di
raggiungere sia stato ottenuto. L’obiettivo principale della terapia è quello
di controllare la malattia e prevenirne eventuali recidive.