24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 943
Capitolo
24
La fisica nucleare
Concetti da
rivedere
Forze fondamentali (Paragrafo 2.9)
Funzioni esponenziali (Appendice A.3, Paragrafo 17.10)
24.1
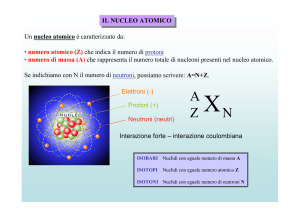
LA STRUTTURA NUCLEARE
Nell’atomo gli elettroni sono legati elettricamente a un nucleo carico positivamente. Il nucleo ha una massa alcune migliaia di volte maggiore di quella degli elettroni e occupa solo una piccola frazione del volume dell’atomo (circa 1 parte su 1012
o meno). La massa e il volume del nucleo producono degli effetti trascurabili sulla
configurazione elettronica e dunque sulle proprietà chimiche degli atomi. Tuttavia,
il nucleo ha una struttura complessa che si manifesta nel decadimento radioattivo e
nelle reazioni nucleari.
Il nucleo è un insieme di protoni e neutroni, chiamati anche nucleoni (particelle
che si trovano nel nucleo) legati tra di loro. Il numero atomico Z è il numero di
protoni presenti nel nucleo e ciascun protone ha una carica +e mentre il neutrone
non possiede carica. Dunque la carica del nucleo è +Ze. Il numero di elettroni in un
atomo neutro è uguale al numero di protoni, cioè al numero atomico Z che determina anche l’elemento o specie chimica.
Una volta si credeva che tutti gli atomi di un dato elemento fossero uguali; tuttavia ora sappiamo che di uno stesso elemento esistono differenti isotopi. Gli isotopi di un elemento hanno nel nucleo lo stesso numero di protoni ma hanno masse
differenti poiché il numero di neutroni (N) è diverso e, dunque, il numero totale di
nucleoni differisce da un isotopo all’altro. Il numero di nucleoni A è il numero totale di protoni e neutroni:
A=Z+N
(24-1)
Il nucleo di un determinato elemento è spesso chiamato nuclide ed è caratterizzato dall’avere dei ben precisi valori di A e Z. Il numero di nucleoni A è anche
chiamato il numero di massa in quanto quasi tutta la massa di un atomo si trova
nel nucleo. Dato che la massa del protone è quasi uguale alla massa del neutrone
possiamo affermare che la massa atomica è all’incirca proporzionale al numero di
nucleoni.
Poiché le masse degli isotopi di un elemento sono diverse, gli isotopi possono
esseri separati usando uno spettrometro di massa (Paragrafo 18.3). La differenza di
massa degli isotopi non ha generalmente effetto sulle proprietà chimiche dei diversi elementi ma attribuisce spesso proprietà nucleari molto diverse. Il numero di neutroni presenti influisce su quanto saldamente i nucleoni sono legati cosicché alcuni
atomi sono stabili mentre altri sono instabili (radioattivi). I livelli energetici nucleari, le vite medie e il decadimento radioattivo caratterizzano ogni particolare nu-
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 944
Capitolo 24 La fisica nucleare
944
clide; le proprietà appena elencate sono molto diverse anche per gli isotopi dello
stesso elemento.
Per distinguere i vari nuclidi vengono usate specifiche notazioni. Per esempio,
il simbolo chimico O sta per l’elemento ossigeno che ha il nucleo formato da 8 protoni e 8 neutroni. Per indicare un particolare isotopo dell’ossigeno bisogna specificare anche il numero di massa; per esempio per l’isotopo dell’ossigeno con A = 18
possiamo trovare la seguente notazione: Ossigeno-18, O-18, O18 e 18O. Qualche volta è utile includere anche il numero atomico anche se può essere ridondante in quanto, come abbiamo appena visto, l’ossigeno per definizione ha 8 protoni. La notazione in questo caso diventa: 188O; oppure troviamo in qualche testo più vecchio 8O18.
Esempio 24.1
Trovare il numero di neutroni
Quanti neutroni sono presenti nel nucleo di 18O?
Impostazione L’apice fornisce il numero di nucleoni (A) mentre consultando una tavola periodica
possiamo trovare il numero atomico (Z) per l’ossigeno. Il numero di neutroni è N = A – Z.
Soluzione Un nucleo di 18O ha 18 nucleoni. L’ossigeno ha numero atomico pari a 8, e quindi ci sono 8 protoni nel nucleo. Dunque otteniamo 18 – 8
= 10 neutroni.
Tabella 24.1
Masse e cariche
del protone,
neutrone ed elettrone
Particella Massa (u) Carica
Protone
Neutrone
Elettrone
1.007 276 5
1.008 664 9
0.000 548 6
+e
0
–e
Discussione Differenti isotopi dell’ossigeno hanno un diverso numero di neutroni ma sempre lo stesso numero di protoni.
Problema di verifica 24.1 Identificare
l’elemento
Scrivi il simbolo (nella forma ZAX) per il nuclide con
44 protoni e 60 neutroni e identifica l’elemento.
Di solito è più conveniente scrivere la massa di un nucleo, invece che in kg, in unità di massa atomica. Il simbolo moderno per l’unità di massa atomica è “u” mentre nella letteratura meno recente spesso si trova “amu”. L’unità di massa atomica è
1
definita esattamente come ᎏ1ᎏ2 della massa dell’atomo neutro di 12C. Il fattore di conversione tra u e kg è
1 u = 1.660 539 × 10–27 kg
(24-2)
I nucleoni hanno massa approssimativamente pari a una unità di massa atomica (1 u)
mentre l’elettrone ha una massa molto inferiore (Tab. 24.1). Dunque la massa del
nucleo equivale all’incirca a quella dell’intero atomo ed è approssimativamente A
unità di massa atomiche – questo giustifica il fatto che A venga chiamato “numero
di massa atomica”.
Esempio 24.2
Calcolare la massa
Calcola la massa in kg di una mole di 14C.
Impostazione Possiamo stimare 1 u di massa per
ciascun nucleone e ignorare la massa, relativamente
piccola, degli elettroni. Una mole contiene un numero di atomi pari al numero di Avogadro. Poi convertiamo gli u in kg.
Soluzione Un nucleo di 14C ha 14 nucleoni e quindi la massa dell’atomo di 14C è all’incirca di 14 u. Una
mole contiene un numero di atomi pari al numero di
Avogadro e dunque la massa di una mole è all’incirca
M = NAm = 6.02 × 1023 × 14 u = 8.4 × 1024 u
Ora, convertiamo in kg:
8.4 × 1024 u × 1.66 × 10–27 kg/u = 0.014 kg
Discussione Nota che la massa di una mole di un
isotopo con numero di massa 14 è all’incirca 14 g.
L’unità di massa atomica è definita in modo tale che
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 945
24.1 La struttura nucleare
945
Esempio 24.2 Continua
la massa di un atomo espressa in u sia numericamente
uguale alla massa di una mole di atomi espressa in
grammi.
La massa di un nucleo non è esattamente uguale ad A unità di massa atomiche per due ragioni. Le
masse del protone e del neutrone non sono esattamente uguali a 1 u. Ma anche se lo fossero, come vedremo nel Paragrafo 24.2, la massa del nucleo è mi-
nore della somma delle masse dei protoni e neutroni
che lo costituiscono.
Problema di verifica 24.2 Stimare la
massa di un nucleo in u
Approssimativamente qual è la massa in u di un nucleo di ossigeno che ha nove neutroni?
La massa atomica di un dato elemento della tavola periodica è una media delle masse di tutti gli isotopi di quell’elemento pesata sulle relative abbondanze percentuali
presenti in natura. In fisica nucleare dobbiamo consultare una tavola dei nuclidi (Appendice B) per conoscere le masse di uno specifico nuclide.
1H
1
Le dimensioni dei nuclei
Come facciamo a conoscere le dimensioni dei nuclei? La prima evidenza sperimentale della presenza dei nuclei atomici è dovuta all’esperimento di Rutherford,
nel quale un fascio di particelle alfa entrano in collisione con i nuclei contenuti in
una sottile lamina d’oro. Analizzando il numero di particelle alfa deviate ai diversi
angoli è possibile stimare le dimensioni del nucleo dell’oro. Recentemente, utilizzando elettroni molto energetici (ovvero con una lunghezza d’onda associata molto
corta), è possibile determinare non solo la dimensione del nucleo ma anche estrarre informazioni sulla sua struttura interna.
Questi e altri esperimenti mostrano che la densità di massa di tutti i nuclei è approssimativamente la stessa e quindi il volume di un nucleo è proporzionale alla sua
massa. Immagina che un nucleo sia come un contenitore sferico pieno di palline rigide (Fig. 24.1); ciascuna pallina rappresenta un nucleone. I nucleoni sono strettamente impacchettati assieme quasi a toccarsi uno con l’altro. Sia la massa sia il volume del nucleo sono proporzionali al numero di nucleoni e quindi la massa per unità di volume (la densità ρ) è all’incirca indipendente dal numero di nucleoni. Se m
è la massa di un nucleone, V il suo volume e A il suo numero di massa allora
m∝A e V∝A
m
⇒ r = ᎏᎏ è indipendetnte da A
V
La maggior parte dei nuclei hanno una forma all’incirca sferica e quindi
4
V = ᎏᎏp r 3 ∝ A
3
⇒ r 3 ∝ A o r ∝ A1/3
(24-3)
Il raggio di un nucleo è proporzionale alla radice cubica del suo numero di massa.
Sperimentalmente si vede che questo è una costante che vale approssimativamente
1.2 × 10–15 m:
Raggio di un nucleo:
r = r0 A1/3
(24-4)
–15
(24-5)
r0 = 1.2 × 10
m = 1.2 fm
Nel SI il prefisso “f-” sta per femto chiamato anche fermi in onore al fisico italiano
Enrico Fermi (1901-1954): per esempio fm sta per 1 × 10–15 m. Il raggio nucleare
varia da 1.2 fm (per A = 1) a 7.7 fm (per A ≈ 260).
4 He
2
Protone
Neutrone
84 Kr
36
Figura 24.1 Modello
semplificato di un nucleo
visto come una serie di
sfere rigide (rappresentanti
i nucleoni) impacchettate
tra loro in una sfera.
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 946
Capitolo 24 La fisica nucleare
946
Anche se la densità dei vari nuclei è all’incirca la stessa, quella dei loro atomi è
diversa. Gli atomi più pesanti sono generalmente più densi rispetto agli atomi più
leggeri. L’andamento con cui aumenta il volume di un atomo è diverso da quello
con cui aumenta la massa. Gli atomi più grandi (e più pesanti) hanno più elettroni ma questi elettroni sono in media più strettamente legati a causa della maggiore carica del nucleo.
Esempio 24.3
Raggio e volume di un nucleo di bario
Qual è il raggio e quale il volume di un nucleo di bario-138?
Impostazione Per trovare il raggio di un nucleo,
tutto quello che dobbiamo conoscere è il numero di
massa A che in questo caso è 138. Per trovare il volume approssimiamo il nucleo a una sfera.
Soluzione Per trovare il raggio applichiamo
l’Equazione (24-4) sostituendo A = 138:
r = r0 A1/3
r = 1.2 fm × 1381/3 = 6.2 fm
Il volume approssimato del nucleo è
4
V = ᎏ3ᎏp r3
Elevando al cubo l’Equazione (24-4)
24.2
r3 = r03 A
Dunque, il volume di un nucleo è all’incirca
4
V = ᎏ3ᎏp r03 A
Ora, sostituendo i valori numerici:
4
V = ᎏ3ᎏp × (1.2 × 10–15 m)3 × 138 = 1.0 × 10– 42 m3
Discussione Il raggio (6.2 fm) sta all’interno del4
l’intervallo 1.2 fm-7.7 fm. L’equazione V = ᎏ3ᎏp r03 A dice che il volume di un nucleo è proporzionale al numero di nucleoni (A) come previsto; ciascun nucleo4
ne occupa un volume di ᎏ3ᎏp r03.
Problema di verifica 24.3 Volume di un
nucleo di radio
Qual è il volume di un nucleo di radio-226?
L’ENERGIA DI LEGAME
Che cosa tiene legati tra loro i nucleoni all’interno del nucleo? La forza gravitazionale è troppo debole mentre la forza elettrica che s’instaura tra i protoni è di tipo repulsivo e tenderebbe a sfaldare il nucleo. I nucleoni sono tenuti assieme dalla forza nucleare forte, una delle quattro forze fondamentali descritte nel Paragrafo 2.9.
La forza forte non fa molta distinzione tra protoni e neutroni e diversamente dalla
forza di gravità e da quella elettromagnetica, la forza nucleare forte ha un raggio
d’azione estremamente corto. La forza gravitazionale così come quella elettromagnetica hanno raggi d’azione infiniti poiché l’intensità della forza tra due oggetti
puntiformi decresce con la distanza con l’andamento di 1/r2 e si annulla per distanze r infinite. Al contrario, la forza nucleare forte tra due nucleoni è presente solo per
distanze minori di 3.0 fm. Dato che la forza nucleare forte ha un raggio d’azione
corto, un nucleone risente solamente della forza esercitata dai nucleoni più vicini,
mentre ogni protone nel nucleo respinge tutti gli altri protoni poiché la repulsione
elettrica non ha un raggio limitato. Queste due forze in competizione (forza nucleare forte e forza di repulsione elettrica) determinano la stabilità dei nuclei.
Il concetto di energia di
legame permette
d’interpretare la coesione
nucleare in termini
d’energia piuttosto che di
forze attrattive.
L’energia di legame e il difetto di massa
L’energia di legame EB di un nucleo è l’energia che dev’essere fornita per separare un nucleo nei suoi singoli componenti: protoni e neutroni. Poiché il nucleo è un
sistema di nucleoni legati, la sua energia totale è minore dell’energia posseduta dai
singoli Z protoni e N neutroni isolati e a riposo.
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 947
24.2 L’energia di legame
947
Energia di legame:
EB = (energia totale dei Z protoni e N neutroni) – (energia totale del nucleo)
(24-6)
Il concetto di energia di legame si applica in generale ai sistemi legati e quindi anche ai nuclei. L’energia totale di un protone e di un elettrone isolati è di 13.6 eV
maggiore dell’energia delle due paticelle legate assieme a formare l’atomo d’idrogeno (nel suo stato base non eccitato). Questo sta a indicare che l’energia di legame di un atomo d’idrogeno è di 13.6 eV. Per la determinazione dell’energia di legame dei nuclei è necessario introdurre il concetto di equivalenza tra massa ed energia. Ovvero che la massa di una particella è una misura della sua energia a riposo
– energia totale di una particella in un sistema di riferimento in cui la sua velocità
è nulla: E0 = mc2.
La massa del nucleo è minore della somma delle masse dei protoni e neutroni che
lo costituiscono, la differenza è chiamata difetto di massa ∆m. Anche l’energia a
riposo di un nucleo; è minore dell’energia a riposo dei protoni e dei neutroni in esso contenuti. La differenza di energia è l’energia di legame del nucleo: infatti è l’energia necessaria per frantumare un nucleo in particelle elementari ovvero in Z protoni e N neutroni tra loro isolati. Il difetto di massa è legato all’energia di legame attraverso l’equazione E0 = mc2.
Difetto di massa ed energia di legame:
∆m = (massa dei Z protoni e degli N neutroni) – (massa del nucleo)
EB = (∆m)c2
(24-7)
(24-8)
L’unità di misura dell’energia comunemente utilizzata in fisica nucleare è il MeV.
Quando nell’Equazione (24-8) si usa il MeV per l’energia e l’unità di massa atomica per la massa è conveniente conoscere il valore di c2 espresso come MeV/u. Si
può vedere (Problema 10) che
c2 = 931.494 MeV/u
(24-9)
Le tabelle riportate nell’Appendice B forniscono le masse degli atomi neutri (elettroni e nucleo). Per trovare la massa del solo nucleo è necessario sottrarre la massa
di Z elettroni. L’energia di legame degli elettroni è molto più piccola e può essere
trascurata.
Esempio 24.4
Energia di legame di un nucleo di azoto-14
Trova l’energia di legame del nucleo di 14N.
Impostazione Dall’Appendice B, la massa di un
atomo di 14N è 14.003 074 0 u. La massa dell’atomo
di N include la massa di sette elettroni. Sottraendo
7 me dalla massa dell’atomo otteniamo la massa del
nucleo. Dopodiché possiamo trovare il difetto di massa e l’energia di legame.
= 14.003 074 0 u – 7 × 0.000 548 6 u
= 13.999 233 8 u
Il nucleo di 14N ha sette protoni e sette neutroni. Il
difetto di massa è
∆m = (massa dei 7 protoni e dei 7 neutroni)
– (massa del nucleo)
Soluzione
=7×1.007 276 5u+7×1.008 664 9u–13.999 233 8u
La massa di 14N = 14.003 074 0 u – 7me
= 0.112 356 0 u
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 948
Capitolo 24 La fisica nucleare
948
Esempio 24.4 Continua
L’energia di legame è dunque,
EB = (∆m)c2 = 0.112 356 0 u × 931.494 MeV/u
∆m = (massa dei 7 atomi di 1H e dei 7 neutroni)
– (massa dell’atomo di 14N)
=7×1.007 825 0u+7×1.008 664 9u–14.003 074 0u
= 104.659 MeV
Discussione L’energia della massa a riposo degli
elettroni è così piccola che può essere trascurata e
quindi possiamo assumere che la massa del nucleo
sia uguale alla massa dell’intero atomo. Possiamo così calcolare il difetto di massa usando
la massa dell’atomo d’azoto invece del solo nucleo d’azoto e la massa dell’atomo d’idrogeno al posto della massa del protone. Visto che i protoni sono
7, le masse dei 7 elettroni si sottraggono:
= 0.112 355 3 u
Problema di verifica 24.4 Energia
di legame dell’azoto-15
Calcola l’energia di legame del nucleo di 15N. La
massa del nucleo di 15N è 14.996 269 u. [Suggerimento: Questa volta ti è stata fornita la massa del nucleo, non la massa dell’atomo.]
La curva dell’energia di legame
Andamento dell’energia di
legame per nucleone (EB/A)
per i nuclidi più stabili in
funzione del numero A di
nucleoni. I diversi punti
rappresentano l’energia per
nucleone di elementi con
A < 100, una curva
continua rossa esprime il
suo andamento
complessivo. (Gli elementi
con A > 100 sono omessi
poiché differiscono poco
dai valori dati dalla curva
62
Ni ha l’energia di
rossa). 28
legame per nucleone
maggiore (8.795 MeV),
58
56
seguito da 26
Fe e da 26
Fe
(rispettivamente 8.792 MeV
e 8.790 MeV). Gli elementi
4
12
16
2He, 6C e 8O stanno
significativamente sopra
alla curva rossa – questi
nuclidi sono
particolarmente stabili
confrontati con i nuclidi
che hanno valori di massa
atomica A simile.
16O
8
12C
4He
Energia di legame per nucleone (MeV)
Figura 24.2
La Figura 24.2 mostra un grafico dell’energia di legame per nucleone in funzione del
numero di massa. Ricorda che la forza nucleare forte lega solamente i nucleoni più vicini. Poiché nei nuclidi più leggeri il numero medio di nucleoni vicini è piccolo, l’energia di legame è bassa. Con l’aumentare del numero di nucleoni la curva cresce fino a
circa 8.8 MeV; l’energia di legame per nucleone aumenta in quanto il numero medio
dei nucleoni vicini è grande. Questo fatto causa un rapido aumento dell’energia di legame per nucleone all’aumentare di A. Una volta che i nuclei hanno raggiunto una
certa dimensione (all’incirca le dimensioni del nucleo di Ni o di Fe), tutti i nucleoni
hanno lo stesso numero medio di vicini a eccezione di quelli che si trovano nella corteccia esterna del nucleo. Aumentando ulteriormente il numero di nucleoni l’energia
di legame media per nucleone non cresce più in quanto i nucleoni risentono all’incirca della stessa forza nucleare (hanno lo stesso numero di nucleoni vicini). Aggiungere nucleoni ai nuclei con A ≈ 60 provoca una lieve decrescita dell’energia media per
7
6
7
Li
6Li
5
4
3
3He
2
2H
1
0
0
50
100
150
Numero di nucleoni (A)
200
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 949
24.3 Radioattività
949
120
110
100
Z (numero di protoni)
90
N=Z
80
70
60
Stabile
Decadimento principale:
a
50
40
30
b–
Cattura elettronica (o b +)
20
Fissione spontanea
10
0
0
10
20
30
40
50
60
70 80 90 100 110 120 130 140 150 160 170 180
N (Numero di neutroni)
nucleone. L’energia di legame per nucleone assume valori compresi tra 7-9 MeV a eccezione dei nuclei più leggeri. Nell’Esempio 24.4 abbiamo trovato che l’energia di legame di 14N è 104.659 MeV. L’energia di legame per nucleone di 14N è
104.659 MeV
ᎏᎏ = 7.475 64 MeV/nucleone
14 nucleoni
I nuclidi che hanno A ≈ 60 sono quelli maggiormente legati con un’energia di legame di circa 8.8 MeV/nucleone.
Per i nuclidi più pesanti la repulsione coulombiana tra i protoni diventa molto
grande e per dare stabilità ai nuclei serve un numero di neutroni maggiore del numero di protoni (N > Z). La forza nucleare forte vince la repulsione coulombiana
dei protoni e dà stabilità al nucleo. D’altra parte c’è un limite all’eccesso di neutroni: i neutroni hanno una massa leggermente maggiore di quella dei protoni e dunque se c’è un forte eccesso di neutroni la massa (e quindi l’energia) del nucleo è più
alta di quella che avrebbe se uno o più neutroni fossero protoni.
La Figura 24.3 mostra il grafico del numero di protoni (Z) in funzione del numero di neutroni (N) per i nuclidi presenti in natura; quelli stabili sono rappresentati in verde. Per i nuclidi più leggeri si ha N ≈ Z ma quando il numero dei nucleoni (A = Z + N) aumenta la curva di stabilità si abbassa e il numero di neutroni aumenta più velocemente del numero di protoni. I nuclidi stabili più pesanti hanno un
numero di neutroni che è circa 1.5 volte quello dei protoni.
24.3
RADIOATTIVITÀ
Henri Becquerel (1852-1908) scoprì la radioattività nel 1896 quando, quasi per caso, trovò che un sale di uranio emetteva spontaneamente radiazioni in grado d’impressionare una lastra fotografica avvolta in un foglio opaco.
I nuclidi possono essere divisi in due grandi categorie: nuclidi stabili o nuclidi
instabili altrimenti detti radioattivi. Un nuclide instabile decade – avviene una reazione nucleare spontanea – con emissione di radiazioni. (La radiazione emessa può
essere elettromagnetica o corpuscolare). A seconda del decadimento il nuclide padre si può trasformare in un nuclide differente per esempio con una diversa carica
o con un diverso numero di nucleoni.
Studiando la radioattività si sono identificati tre diversi tipi di radiazione emessa dai nuclei radioattivi: la radiazione alfa, la radiazione beta e la radiazione gamma (dalle prime tre lettere dell’alfabeto greco). Questa distinzione si basa sulle di-
Figura 24.3 Carta dei
nuclidi più comuni. I
nuclidi stabili sono
rappresentati in colore
verde. Nota la tendenza ad
aumentare il rapporto N/Z
per i nuclidi stabili.
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 950
Capitolo 24 La fisica nucleare
950
Blocco di cemento
Sorgente
radioattiva
Piombo
schermante
a
Mano
Alfa
g
Beta
Gamma
Figura 24.4
Le
radiazioni alfa, beta e
gamma differiscono (a) sia
per le diverse capacità di
penetrare la materia sia per
(b) la loro diversa carica
elettrica.
1m
Linee di campo
magnetico
(a)
(b)
b–
verse capacità di penetrare nella materia (Fig. 24.4). La radiazione alfa è quella meno penetrante; essa riesce a percorrere pochi centimetri d’aria e viene completamente
bloccata dalla superficie della nostra pelle o da un sottile foglio di carta. La radiazione beta può fare un percorso maggiore in aria (circa un metro) e può attraversare anche la nostra mano o un sottile foglio di metallo. La radiazione gamma è decisamente più penetrante sia di quella alfa che di quella beta.
Dei 1500 nuclidi conosciuti solo il 20% è stabile. Tutti i nuclidi più pesanti
(quelli con Z > 83) sono radioattivi. I nuclei stabili rimangono tali per sempre senza subire decadimenti spontanei, invece i nuclidi radioattivi decadono e hanno una
vita media che li caratterizza. Le vite medie possono essere molto diverse e variano in un intervallo molto grande che va da circa 10–22 s (all’incirca il tempo che impiega la luce a percorrere una distanza uguale al diametro di un nucleo) a 1028 s
(1010 volte l’età dell’universo).
Le leggi di conservazione nel decadimento radioattivo
Nelle reazioni nucleari, la carica elettrica totale si conserva così come si conserva il
numero totale di nucleoni. Una reazione nucleare si bilancia applicando queste due
leggi di conservazione. Per bilanciare una reazione nucleare è utile scrivere i simboli di tutte le particelle coinvolte (elettroni, positroni e neutroni) come se fossero
dei nuclei, ossia con l’apice per il numero di nucleoni e il pedice per la carica elettrica in unità di e (vedi Tab. 24.2). Allora la reazione è bilanciata rispetto al numero di nucleoni se la somma degli apici è la stessa in entrambi i lati, mentre è bilanciata rispetto alla carica se la somma dei pedici è la stessa in entrambi i lati.
Un’altra legge di conservazione molto importante nel decadimento radioattivo
è quella dell’energia ovvero: l’energia di tutte le reazioni nucleari si conserva. Come può un nucleo, senza energia cinetica, decadere lasciando i prodotti della rea-
Tabella 24.2
Particelle generalmente coinvolte nel decadimento radioattivo e
altre reazioni nucleari
Carica (in unità di e)
Nome particella
Simboli
Numero di nucleoni
Elettrone
e–, β–, –10e
–1
0
Positrone
e+, β+, +10e
+1
0
Protone
p, 11p, 11H
+1
1
Neutrone
n, 01n,
0
1
Particella alfa
α, 24α, 42He
+2
4
Fotone
γ, 00γ
0
0
Neutrino
ν, 00ν
0
0
Antineutrino
ν, 00ν
0
0
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 951
24.3 Radioattività
zione con energie cinetiche non trascurabili? Da dove proviene questa energia? In
una reazione nucleare spontanea, parte dell’energia a riposo del nucleo radioattivo
viene convertita in energia cinetica delle particelle o dei nuclidi prodotti. La quantità di energia a riposo può essere convertita anche in energia di disintegrazione.
Per aumentare l’energia cinetica del sistema dev’esserci una corrispondente diminuzione dell’energia a riposo. La massa totale dei prodotti dev’essere minore della
massa del nucleo radioattivo originario affinché questo nucleo decada spontaneamente. In altre parole, i prodotti della reazione devono essere più fortemente legati
del nucleo originario. L’energia di disintegrazione è la differenza tra l’energia di legame del nucleo radioattivo e l’energia di legame totale dei prodotti della reazione.
951
Energia di disintegrazione
= energia di legame del
nucleo radioattivo –
energia di legame totale
dei prodotti del
decadimento.
Il decadimento alfa
La radiazione alfa è costituita da nuclei di 4He. Il nucleo di elio è formato da due
protoni e due neutroni fortemente legati. La massa di una particella alfa è 4.001 506 u
mentre la sua carica è pari a +2e.
Nel decadimento alfa il nuclide originario (padre) si trasforma in un altro nuclide, chiamato “figlio”, con l’emissione di una particella alfa. Bilanciando la reazione si vede che il nuclide figlio ha un numero di nucleoni ridotto di quattro e il
numero di carica ridotto di due. Chiamando P il nuclide padre e D il nuclide figlio
la reazione spontanea nella quale viene emessa una particella alfa è:
Decadimento alfa:
A
ZP
→ AZ –– 24D + 42a
(24-10)
Esempio 24.5
Un decadimento alfa
Il polonio-210 decade attraverso un decadimento alfa. Identifica il nuclide figlio.
Impostazione Per prima cosa guarda il numero
atomico del polonio nella tavola periodica. Poi scrivi la reazione nucleare con un nuclide ignoto e la particella alfa tra i prodotti. Bilanciando la reazione ottieni il valore di Z e A per il nucleo figlio.
Soluzione Il polonio ha numero atomico 84. La
reazione è
210
84Po
→ ZA(?) + 24a
dove A e Z sono il numero di nucleoni e il numero atomico del nucleo figlio. Per conservazione della carica
84 = Z + 2
E dunque Z = 82. Per conservazione del numero di
nucleoni,
210 = A + 4
E quindi A = 206. Controllando nella tavola periodica l’elemento con numero atomico 82 è il piombo.
Dunque, il nucleo figlio è il piombo-206 (206
82Pb).
Discussione Scrivendo per esteso l’intera reazione è più facile controllare se si conservano il numero di nucleoni e la carica elettrica totale:
210
84Po
4
→ 206
82Pb + 2a
Problema di verifica 24.5 Trovare
il nuclide padre conoscendo il figlio
Il radon-222, un gas radioattivo che in alcune aree
comporta rischi per la salute, è a sua volta prodotto
dal decadimento alfa di un altro nuclide. Identifica il
nuclide padre.
Nel decadimento alfa l’energia di disintegrazione è distribuita tra il nucleo figlio e
la particella alfa. La conservazione del momento determina esattamente come l’energia viene distribuita. Dunque, le particelle alfa rilasciate nel particolare decadimento radioattivo hanno un’energia caratteristica (assumendo che l’energia cinetica iniziale del nuclide padre sia trascurabile e possa essere considerata nulla).
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 952
Capitolo 24 La fisica nucleare
952
L’emissione alfa è il decadimento radioattivo più comune per i nuclidi con Z > 83.
Poiché nessun nuclide con Z > 83 è stabile, il decadimento alfa porta velocemente
il nuclide verso regioni di stabilità, infatti fa aumentare il rapporto neutroni/protoni
del nuclide figlio. Per esempio 238
92U ha un rapporto neutroni su protoni di (238-92)/92
234
= 1.587. Emettendo una particella alfa 238
92U diventa 90Th con un rapporto neutroni
su protoni più alto: 1.6.
Esempio 24.6
Decadimento alfa dell’uranio-238
Il nuclide
cella alfa:
238
U può decadere emettendo una parti238
U → 234Th + a
Le masse atomiche di 238U, di 234Th e di 24He sono
rispettivamente 238.050 782 6 u, 234.043 595 5 u
e 4.002 603 2 u. (a) Trova l’energia di disintegrazione. (b) Trova l’energia cinetica della particella
alfa assumendo che il nucleo padre 238U sia inizialmente fermo.
Impostazione I calcoli possono essere eseguiti
usando le masse atomiche. La massa di 238
92U include
92 elettroni; la somma delle masse degli atomi 234
90Th
e 24He includono 90 + 2 = 92 elettroni.
Ci aspettiamo che la maggior parte dell’energia cinetica vada alla particella alfa poiché la sua massa è
molto più piccola di quella del nucleo di torio. La conservazione del momento determina esattamente
come l’energia si divide tra le due particelle.
Soluzione (a) La massa totale del prodotto è
234.043 595 5 u + 4.002 603 2 u = 238.046 198 7 u
che è minore della massa del nucleo padre. La differenza di massa è
∆m = 238.046 198 7 u – 238.050 782 6 u
= –0.004 583 9 u
dove ∆m sta per la differenza in massa: massa finale meno massa iniziale. (Quando scriviamo il difetto di massa di un nucleo come ∆m immaginiamo una reazione
che separa il nucleo nei suoi costituenti, protoni e neutroni). La diminuzione di massa significa che l’energia
a riposo diminuisce. Secondo la relazione massa-energia di Einstein la differenza nell’energia a riposo è
E = (∆m)c2 = –0.004 583 9 u × 931.494 MeV/u
(b) Assumendo per il momento che il nucleo figlio e
la particella alfa possono essere trattati in maniera
non relativistica, le loro energie cinetiche sono legate ai loro momenti dalla relazione
p2
K = ᎏᎏ
2m
La conservazione del momento afferma che i loro momenti devono essere uguali in intensità ma opposti come verso. Dunque, il rapporto delle energie cinetiche è
Ka
p2/(2ma) mTh 234.043 595 5
ᎏᎏ = ᎏ
ᎏ = ᎏᎏ = ᎏᎏ = 58.4728
KTh p2/(2mTh) ma
4.002 603 2
Le due energie cinetiche sommate danno 4.2699 MeV.
Ka + KTh = 4.2699 MeV
Sostituendo per KTh dal rapporto dell’energia cinetica
Ka
Ka + ᎏᎏ
= 4.2699 MeV
58.4728
e risolvendo otteniamo Kα = 4.1981 MeV.
Discussione La differenza di massa è negativa: la
massa totale dopo il decadimento è minore della massa prima del decadimento. Una parte della massa (o
meglio, dell’energia a riposo) del nucleo di U è convertita in energia cinetica dei prodotti. L’energia di
disintegrazione è positiva perché è una quantità di
energia rilasciata.
Poiché l’energia cinetica della particella alfa è
molto più piccola dell’energia a riposo (circa 4 u ×
931.494 MeV/u ≈ 3700 MeV), l’espressione non relativistica per l’energia cinetica era appropriata. Un
calcolo relativistico mostra che la nostra risposta è
corretta fino a tre cifre significative.
Problema di verifica 24.6 Energia della
particella alfa nel decadimento del
polonio-210
= –4.2699 MeV
Dalla conservazione dell’energia, l’energia cinetica
del prodotto è 4.2699 MeV più dell’energia del nuclide padre. L’energia di disintegrazione è 4.2699MeV.
Trova l’energia cinetica della particella alfa emessa
dal decadimento del 210Po:
210
84Po
→ 206
82Pb + a
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 953
24.3 Radioattività
953
Il decadimento beta
Le particelle beta sono elettroni o positroni (spesso chiamate particelle beta-meno e
beta-più). Nel decadimento beta-meno un elettrone viene emesso e un neutrone del
nucleo si trasforma in un protone. Dunque, il numero di massa non cambia e la carica del nucleo aumenta di una unità:
Decadimento beta-meno:
A
ZP
→ Z A+1D + –10e + 00n–
(24-11)
Il simbolo ν rappresenta un antineutrino, una particella neutra con massa trascurabile. Nel decadimento beta-più un positrone viene emesso e un protone del nucleo
si trasforma in un neutrone. Questa volta la carica del nucleo decresce di uno:
Decadimento beta-più:
A
ZP
→ Z A– 1D + +10 e + 00n
(24-12)
Il simbolo +10e rappresenta un positrone emesso mentre il simbolo ν rappresenta un
neutrino senza carica e con una massa trascurabile. Il positrone è una particella
molto reattiva e, dopo aver perso la sua energia cinetica in molti urti, si fermerà vicino a un elettrone e la coppia (elettrone-positrone) si annichila per produrre una
coppia di fotoni.
Diversamente dal decadimento alfa, nel decadimento beta il radionuclide non
cambia il numero dei nucleoni. Nel decadimento beta un neutrone si trasforma in
un protone o viceversa. Poiché la massa del neutrone è leggermente maggiore della somma delle masse del protone e dell’elettrone, i neutroni liberi decadono spontaneamente emettendo beta-meno con una vita media di 10.2 min. Un protone libero non può decadere spontaneamente in un neutrone più un positrone perché violerebbe la conservazione dell’energia. Ma all’interno del nucleo un protone può convertirsi in un neutrone emettendo un positrone; l’energia necessaria a questo processo deriva dalla differenza nell’energia di legame del nucleo. Dunque, le reazioni
base del decadimento beta sono
b –:
1
0n
→ 11p +
0
–1e
+ 00n–
b +:
1
1p
→ 10n +
0
+1e
+ 00n
Il decadimento beta non cambia il numero di massa ma cambia il rapporto neutroni/protoni. Un nuclide che ha un eccesso di neutroni ha una grande probabilità di
subire un decadimento β– per diventare stabile. Un nuclide che ha un difetto di neutroni ha una grande probabilità di subire un decadimento β +.
Quando è stato scoperto il decadimento beta non si riusciva a giustificare il fatto che l’elettrone (o il positrone) emesso avesse uno spettro continuo di energia.
Nel decadimento alfa l’energia cinetica delle particelle alfa emesse era ben definita e calcolabile dalla legge di conservazione dell’energia e del momento. Quindi
anche le particelle beta avrebbero dovuto avere uno spettro monoenergetico. Tuttavia le misure sperimentali mostravano che le particelle beta venivano emesse in
un ampio intervallo di energia: da zero fino a un valore massimo (Fig. 24.5). L’energia cinetica massima era coincidente con il valore che la particella beta avrebbe dovuto avere.
Perché molte delle particelle beta hanno energie inferiori a quelle previste? Ci
si trovava in presenza di un’eccezione a una delle leggi fondamentali di conservazione (energia o momento)?
Qualche rispettabile scienziato – incluso Niels Bohr – iniziò a pensare che la
conservazione dell’energia era stata violata, ma poi Wolfgang Pauli suggerì una pos-
Il positrone è
l’antiparticella
dell’elettrone; ha la stessa
massa dell’elettrone ma
carica di segno opposto
(positiva) +e.
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 954
Numero di particelle beta emesse
Capitolo 24 La fisica nucleare
954
Figura 24.5
Tipico
spettro continuo di energia
degli elettroni emessi nel
decadimento beta da un
particolare nuclide.
Kmax
Energia cinetica delle particelle beta
sibile spiegazione che si dimostrò essere corretta. Pauli pensò che non una ma bensì due particelle fossero emesse nel decadimento beta: l’elettrone (particella beta) e
un’altra particella da identificare. Se un nucleo emette due particelle allora si può
conservare sia l’energia che il momento e l’energia cinetica si può distribuire in tutti i modi possibili tra le due particelle. Enrico Fermi chiamò questa ipotetica particella neutrino. Il simbolo per il neutrino è la lettera greca “nu” (ν). Un antineutrino è scritto con una barra sopra (ν). I neutrini sono molto difficili da rilevare perché non interagiscono né tramite interazione elettromagnetica né tramite forza nucleare forte. Dovettero passare 25 anni prima che la previsione di Pauli sull’esistenza
del neutrino potesse essere confermata. Un neutrino può attraversare facilmente il
nostro pianeta avendo una sola probabilità su 1012 di interagire. Un numero enorme
di neutrini provenienti dal sole attraversano ogni secondo il nostro corpo ma non
producono alcun effetto.
Esempio 24.7
Decadimento beta dell’azoto-13
L’isotopo di azoto con numero di massa 13 (13N) è
instabile e decade beta. (a) 14N e 15N sono isotopi stabili dell’azoto. Ti aspetti che 13N decada tramite β– o
β +? Spiega. (b) Scrivi la reazione di decadimento. (c)
Calcola l’energia cinetica massima della particella
beta emessa.
–
Impostazione Per capire se il nucleo decade β
o β + bisogna verificare se ha un eccesso o un difetto di neutroni.
Soluzione (a) Gli isotopi stabili dell’azoto hanno
più neutroni di 13N e dunque 13N ha pochi neutroni
per essere stabile. Il decadimento beta dovrebbe convertire un protone in un neutrone per aumentare il
rapporto neutroni su protoni. Questo significa che la
carica del nucleo decresce di e e dunque per conservare la carica un positrone (carica +e) deve essere
prodotto. Ci aspettiamo che l’isotopo 13N subisca decadimento β +.
(b) Poiché viene emesso un positrone, esso dev’essere accompagnato da un neutrino (non un antineu-
trino). Z decresce di 1, da 7 (azoto) a 6 (che è il carbonio). A non cambia. La reazione è
13
7N
→ 136C + +10 e + 00n
Sia la carica che il numero di nucleoni si conservano: 13 = 13 + 0 e 7 = 6 + 1.
(c) Dall’Appendice B, le masse atomiche di 137N e
13
6C sono 13.005 738 6 u e 13.003 354 8 u. Per ottenere le masse dei nuclei, sottraiamo Zme da entrambi. La massa del positrone è la stessa di quella dell’elettrone: me = 0.000 548 6 u. Il neutrino ha una
massa trascurabile (praticamente può essere considerata zero). Se MN e MC rappresentano le masse atomiche allora
∆m = [(MC – 6me) + me] – (MN – 7me)
= MC – MN + 2me
= 13.003 354 8 u – 13.005 738 6 u + 2 × 0.000 548 6 u
= –0.001 286 6 u
La massa decresce come accade in un decadimento
spontaneo. L’energia di disintegrazione è
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 955
24.3 Radioattività
955
Esempio 24.7 Continua
E = 兩∆m兩c2 = 0.001 286 6 u × 931.494 MeV/u
= 1.1985 MeV
Questa è l’energia cinetica massima che potrà avere
il positrone.
Discussione Generalmente è possibile determinare se un nuclide radioattivo decade β– o β +, ma ci
40
sono delle eccezioni. Per esempio 19
K può decadere
–
+
sia β che β . Il solo modo per essere sicuri è quello di confrontare le masse dei prodotti con la massa
del radionuclide per vedere se il decadimento spontaneo è energeticamente possibile.
Nota che nel decadimento β + le masse degli
elettroni (che sono inclusi nelle masse atomiche) non si compensano automaticamente come accade per il decadimento alfa.
Problema di verifica 24.7 Decadimento
del potassio-40
Trova l’energia massima dell’elettrone emesso nel
40
decadimento β– di 19
K.
La cattura elettronica
Ciascun nuclide che decade β + può anche decadere per cattura elettronica. Entrambi i processi convertono un protone in un neutrone. Nella cattura elettronica, invece di emettere un positrone, il nucleo cattura uno degli elettroni orbitali dell’atomo. La reazione base è
0
–1e
+ 11p → 01 n + 00n
(24-13)
Quando un nucleo cattura un elettrone i prodotti della reazione sono il nucleo figlio e il neutrino. Con solo due particelle, la conservazione del momento e dell’energia determina quale frazione dell’energia rilasciata viene distribuita a ciascuna particella. Il neutrino, con la sua piccolissima massa, prende quasi tutta
l’energia cinetica lasciando al nuclide figlio solo pochi eV di energia cinetica di
rinculo.
Il decadimento gamma
La radiazione gamma è composta da fotoni di alta energia. L’emissione di raggi gamma non converte il nucleo in un nuclide differente poiché non cambia né la carica
né il numero di nucleoni. Quando un nucleo si trova in uno stato eccitato emette un
fotone e fa una transizione a uno stato di energia inferiore. Il meccanismo è simile
a quello subito dagli atomi quando vengono emessi fotoni durante la transizione degli elettroni tra i vari livelli energetici dell’atomo.
La Figura 24.6 mostra alcuni dei livelli di energia del nucleo di tallio-208 (208
81Tl).
Quando un nucleo si trova in uno stato eccitato può irradiare un fotone e passare a
uno stato di più bassa energia. Per esempio, la terza freccia da destra, mostra una
transizione che porta il nucleo dallo stato eccitato di 492 keV allo stato eccitato di
40 keV con l’emissione di un fotone gamma da 452 keV.
Per enfatizzare il fatto che un nucleo si trova in uno stato eccitato si può inse*
rie un asterisco come apice destro nel simbolo del nuclide: 208
81Tl . Il decadimento
gamma di un nucleo eccitato di Tl-208 con l’emissione di un fotone gamma può essere scritto come
208 *
81Tl
→ 208
81Tl + g
I decadimenti alfa e beta non sempre portano il nucleo figlio nello stato stabile. Spesso il nucleo figlio si trova in uno stato eccitato e a sua volta emette uno o più fotoni gamma fino a raggiungere il livello energetico stabile.
492 keV
472 keV
327 keV
40 keV
0
Figura 24.6 Un
diagramma dei livelli
energetici della sorgente
gamma emittente 208
81Tl. Le
frecce rivolte verso il
basso mostrano le
transizioni permesse al
decadimento gamma.
24txtI:GIAMBATTISTA
956
14-12-2007
12:06
Pagina 956
Capitolo 24 La fisica nucleare
24.4
CINETICA DEL DECADIMENTO RADIOATTIVO
E VITA MEDIA DI UNA SORGENTE
Il fenomeno del decadimento radioattivo viene descritto con successo dalla meccanica quantistica che è in grado di fornire la probabilità con cui un dato processo può
avvenire. Se prendiamo un certo numero di nuclidi di un determinato radioisotopo,
essi non decadranno tutti nello stesso momento; poiché non c’è in alcun modo la
possibilità di sapere quando un determinato nuclide decide di decadere, possiamo
descrivere il processo di decadimento solamente in termini probabilistici. La probabilità di decadere di un nucleo è indipendente sia dalla sua storia (cioè da quello che
gli è capitato precedentemente) sia dal comportamento degli altri nuclidi vicini. Ciascun nuclide radioattivo ha una certa probabilità di decadere che dipende da quanto è lungo il tempo d’osservazione. La probabilità di decadimento nell’unità di tempo prende il nome di costante di decadimento e viene indicata con la lettera greca
λ (che non ha niente a che vedere con la lunghezza d’onda). Poiché la probabilità è
un numero puro la costante di decadimento ha come unità di misura s–1 (probabilità al secondo).
probabilità di decadimento
costante di decadimento l = ᎏᎏᎏᎏ
unità di tempo
(24-14)
La probabilità che un nucleo decada in un piccolo intervallo di tempo ∆ t è λ ∆ t.
Se ora abbiamo un numero N molto grande di nuclidi radioattivi tutti identici
ovviamente tutti hanno la stessa probabilità di decadere, per cui il numero medio di
nuclidi che decade in un breve intervallo di tempo ∆ t è N volte la probabilità di un
singolo decadimento:
∆N = –Nl ∆t
(24-15)
Il segno meno è necessario perché quando il nucleo decade il numero di nuclei rimanenti decresce e quindi la variazione di N è negativa. L’Equazione (24-15) fornisce il numero medio di decadimenti nell’intervallo di tempo ∆t. Poiché il decadimento radioattivo è un processo statistico non è detto che in quell’intervallo di
tempo si misurino esattamente N decadimenti; ma se N è sufficientemente grande
allora si può ritenere che l’Equazione (24-15) sia molto vicina al valore vero. Per
piccoli valori di N la differenza tra il valore misurato e quello fornito dall’equazione può essere significativa. Le fluttuazioni statistiche nel numero di decadimen苶; ossia se il numero
ti effettivamente misurate, 兩∆N兩, sono dell’ordine della 兹兩∆N兩
medio atteso di decadimenti è 104, il numero effettivo di decadimenti misurati può
variare di circa 兹10
苶
000 = 100 sopra o sotto il numero medio quindi: 104 ± 100.
L’Equazione (24-15) è valida solamente per un intervallo di tempo molto piccolo ∆t << 1/λ perché suppone che il numero di nuclei sia una costante N. Se l’intervallo di tempo è grande, N subisce grandi variazioni per cui per descrivere la cinetica del decadimento radioattivo è necessaria una nuova formula che non introduciamo in questo testo.
Il numero di decadimenti che avvengono nell’unità di tempo di un campione
prende il nome di attività (R). L’unità di misura dell’attività è il becquerel (Bq) che
corrisponde a un decadimento al secondo. I seguenti tre modi di scrivere l’unità di
misura dell’attività sono equivalenti
decadimento
–1
1 Bq = 1 ᎏ
s ᎏ=1s
(24-16)
Un’altra unità di misura dell’attività comunemente utilizzata è il curie (Ci):
1 Ci = 3.7 × 1010 Bq
(24-17)
Se in un breve intervallo di tempo ∆t il numero di decadimenti è 兩∆N兩, allora l’attività è:
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 957
24.4 Cinetica del decadimento radioattivo e vita media di una sorgente
numero di decadimenti
–∆ N
R = ᎏᎏᎏᎏ = ᎏᎏ = lN
unità di tempo
∆t
957
(24-18)
Nell’Equazione (24-18) la variazione di N (∆N/∆t) è una costante negativa (–λ) moltiplicata per N. Ogniqualvolta la variazione di una certa quantità è una costante negativa moltiplicata per la quantità stessa, allora la quantità iniziale cala con un andamento esponenziale a mano a mano che passa il tempo. Il numero di nuclei rimanenti N nel decadimento radioattivo (il numero che non è ancora decaduto) è:
N(t) = N0e–t/t
(24-19)
La Figura 24.7 mostra un grafico di N in funzione di t. Per il decadimento radioattivo la costante di tempo è:
1
t = ᎏᎏ
l
(24-20)
e N0 è il numero di nuclei all’istante t = 0. La costante di tempo τ è anche chiamata vita media poiché è il tempo medio che passa prima che un nucleo decada. Tuttavia, sarebbe errato pensare che un nucleo “invecchi” oppure che la costante di decadimento dipenda dall’età del nucleo stesso. Un nucleo di uranio-238 che si trova
da milioni di anni nelle rocce ha la stessa probabilità di decadere di un atomo che
si è appena formato da una qualche reazione nucleare. Infatti la probabilità di decadimento è indipendente dalla storia del nuclide. Le Equazioni (24-18) e (24-19)
ci dicono quanti nuclei decadono ma non ci dice quali.
Poiché il ritmo di decadimento è proporzionale al numero di nuclei instabili presenti anche l’attività decade esponenzialmente:
R(t) = R0e–t/t
(24-21)
Come in qualsiasi processo esponenziale, la costante di tempoτ è il tempo necessario in cui la quantità decresca di un fattore 1/e ≈ 36.8% del suo valore iniziale. In
questo intervallo di tempo, il 63.2% dei nuclei decade lasciandone il 36.8%. Dopo
un intervallo di tempo doppio, 2τ, abbiamo che il numero di nuclei che deve ancora decadere è 1/e2 ≈ 13.5%, mentre 1 – 1/e2 ≈ 86.5% è decaduto.
La cinetica del decadimento radioattivo può essere quantificata anche in termini di tempo di dimezzamento T1/2. Il tempo di dimezzamento è il tempo necessario affinché decada la metà dei nuclei iniziali. Se trascorrono due tempi di dimez1
zamento i nuclei che rimangono sono pari a ᎏ4ᎏ dei nuclei
inizialmente presenti; in
1 m
generale dopo m tempi di dimezzamento rimangono 冢ᎏ2ᎏ冣 nuclei non decaduti. Si può
vedere (Problema 39) che
T1/2 = t ln 2 ≈ 0.693t
(24-22)
dove ln 2 è il logaritmo (in base e) di 2. Allora
N(t) = N0(2
–t/T1/2
1 t/T1/2
) = N0 冢ᎏ2ᎏ冣
(24-23)
N
—
N0
1
0.5
0.25
0.125
0
0
0.5t
1.0t
T1/2
1.5t
2T1/2
2.0t
3T1/2
2.5t
t
Figura 24.7 Andamento
della funzione esponenziale
decrescente che esprime la
frazione dei nuclei
radioattivi rimanenti (N/N0)
in funzione del tempo.
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 958
Capitolo 24 La fisica nucleare
958
Esempio 24.8
Decadimento radioattivo dell’azoto-13
Il tempo di dimezzamento di 13N è 9.965 minuti. (a)
Se un campione contiene 3.2 × 1012 atomi di 13N al
tempo t = 0, quanti nuclei di 13N saranno presenti dopo 40 minuti? (b) Qual è l’attività (R) al tempo t = 0
e al tempo t = 40 minuti? Esprimi le attività in Bq.
(c) Qual è la probabilità che ciascun nucleo di 13N
decada nell’intervallo di tempo di un secondo?
Impostazione (a, b) Il numero di nuclei all’istante t = 0 è N0 = 3.2 × 1012 e il tempo di dimezzamento è T1/2 = 9.965 minuti. Il problema chiede di
trovare N a t = 40 minuti e l’attività R sia al tempo t
= 0 sia a t = 40 minuti. Poiché l’intervallo di tempo
è approssimativamente 4 volte la vita media possiamo stimare la soluzione: sia N che R vengono mol1
tiplicati per un fattore ᎏ2ᎏ per il numero di tempi di dimezzamento intercorsi.
(c) λ è la probabilità di decadimento in 1 secondo solo se 1 secondo può essere considerato un breve intervallo di tempo. Poiché il tempo di dimezzamento
è 9.965 minuti = 597.9 s, 1 s è una piccola frazione
del tempo di dimezzamento e dunque può essere considerato un breve intervallo di tempo.
Soluzione (a) Dopo un tempo pari a un tempo di
dimezzamento rimangono metà nuclei, dopo due T1/2,
1
1
1 m
1 4
ᎏᎏ × ᎏᎏ = 冢ᎏᎏ冣 , dopo 4 T , 冢ᎏᎏ冣 . Dunque, il numero di
1/2 2
2
2
2
nuclei rimanenti dopo 4 T1/2 è
N = 冢ᎏ2ᎏ冣 × 3.20 × 1012 = 2.00 × 1011
1 4
La costante di tempo τ è legata al tempo di dimezzamento dall’Equazione (24-22):
T 2 9.965 min × 60 s/min
= ᎏᎏᎏ = 862.6 s
t = ᎏ1/ᎏ
0.693 15
ln 2
Sostituiamo il numero di nuclei N a t = 0 e a t = 40.0
minuti per determinare il ritmo di decadimento in
quei due istanti. La costante di tempo non cambia.
A t = 0,
N
3.20 × 1012
R0 = ᎏᎏ0 = ᎏᎏ = 3.71 × 109 Bq
t
862.6 s
A t = 40 minuti,
1.98 × 1011
8
R = ᎏN
=
ᎏ
ᎏ
ᎏ = 2.30 × 10 Bq
t
862.6 s
(c) La probabilità per secondo è
1
l = ᎏᎏ = 1.1593 × 10–3 s–1
t
Un nucleo ha una probabilità di 1.1593 × 10–3 di decadere nell’intervallo di un secondo.
Discussione Come controllo, R dopo quattro vi1
te medie dovrebbe essere ᎏ1ᎏ6 di R0:
1
ᎏᎏ
16
× 3.71 × 109 Bq = 2.32 × 108 Bq
Poiché 40.0 minuti è leggermente di più di quattro
tempi di dimezzamento, l’attività a t = 40 minuti è
leggermente minore di 2.32 × 108 Bq.
Usando l’Equazione (24-23) otteniamo il risultato:
1 t/T1/2
N(t) = N0冢ᎏ2ᎏ冣
= N0冢ᎏ2ᎏ冣
1 40.0/9.965
= 1.98 × 1011
(b) L’attività e il numero di nuclei sono legati dall’Equazione (24-18):
R = lN = ᎏtN
ᎏ
Datazione con il
carbonio-14
Problema di verifica 24.8 Numero di
nuclei rimanenti dopo la metà di un tempo
di dimezzamento
Quanti atomi di 13N ci sono a t = 5 minuti?
Datazione con il carbonio radioattivo
14
C
La grande utilità della tecnica di datazione con carbonio radioattivo è basata sul decadimento di un isotopo raro del carbonio. Quasi tutto il carbonio naturale presente sulla terra è costituito dai suoi due isotopi stabili – 98.9% di 12C e 1.1% di 13C.
Tuttavia, ci sono tracce di 14C la cui abbondanza relativa è di circa 1 atomo ogni
1012 atomi di carbonio. 14C ha un tempo di dimezzamento relativamente breve, 5730
anni. Poiché la terra ha all’incirca 4.5 × 109 anni non dovremmo trovare più carbonio-14 a meno che esso non continui a formarsi in qualche modo.
La produzione di carbonio-14 avviene nell’atmosfera terrestre in quanto viene
colpita dai raggi cosmici. I raggi cosmici sono particelle cariche che provengono
dallo spazio con energie (velocità) estremamente elevate – la maggior parte sono
protoni. Quando una di queste particelle colpisce un atomo nell’alta atmosfera, si
crea uno sciame di particelle secondarie tra cui un gran numero di neutroni. Tipica-
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 959
24.4 Cinetica del decadimento radioattivo e vita media di una sorgente
959
mente ogni raggio cosmico produce 1 milione di neutroni e alcuni di essi interagiscono con i nuclei dell’azoto (14N) dell’atmosfera formando il 14C:
n + 14N → 14C + p
(24-24)
14
C forma a sua volta molecole di CO2 che raggiungono la superficie terrestre dove
vengono assorbite dalle piante (attraverso la fotosintesi) che le incorporano nei minerali carbonati. Gli animali ingeriscono 14C mangiando piante oppure altri animali e in questo modo 14C entra nella catena alimentare. 14C così formato decade successivamente attraverso decadimento beta:
C → 14N + e– + n–
14
(24-25)
L’equilibrio tra la velocità con cui 14C è continuamente prodotto dai raggi cosmici
e la velocità con cui esso decade dà un rapporto di 14C su 12C nell’atmosfera di 1.3
× 10–12 che persiste finché l’organismo è vivente, infatti il carbonio è continuamente scambiato con l’ambiente e quindi l’organismo stesso mantiene la medesima abbondanza relativa di 14C di quella dell’ambiente. L’attività del carbonio-14 nell’atmosfera o in un organismo vivente è 0.25 Bq per grammo di carbonio (vedi Problema 34). Quando le funzioni vitali di un organismo cessano viene meno il continuo assorbimento di 14C e il rapporto 14C su 12C cala. Dunque il rapporto 14C su 12C
in un campione può essere usato per determinarne l’età.
Esempio 24.9
Datazione di un campione di carbone
Un pezzo di carbone da un sito archeologico in Egitto viene datato con radiocarbonio. Il campione ha una
massa di 3.82 g e un’attività che deriva dal 14C di
0.64 Bq. Qual è l’età del campione di carbone?
L’attività presente è R = 0.64 Bq. Ora risolviamo in
funzione di t dai valori di R e R0.
Impostazione Finché gli alberi sono in vita
mantengono la stessa abbondanza relativa di 14C dell’ambiente. Quando gli alberi vengono abbattuti
l’abbondanza relativa di 14C inizia a calare poiché
non sono più attivi quei meccanismi metabolici che
mantenevano l’equilibrio del carbonio scambiato
con l’ambiente. Il numero di atomi di 14C cala in
quanto soggetti a decadimento, mentre il numero di
atomi di 12C che è stabile rimane costante. Il ritmo
con cui diminuisce il numero di nuclei di 14C è lo
stesso con cui cala l’attività del campione. L’attività decresce esponenzialmente dal suo valore iniziale che ha una tempo di dimezzamento di 5730 anni. Nell’ipotesi che l’abbondanza relativa 14C nell’antico Egitto fosse uguale a quella attuale, l’attività iniziale del campione era di 0.25 Bq per grammo di carbonio.
Prendendo il logaritmo naturale di ciascun membro
otteniamo:
Soluzione L’attività di 14C decresce esponenzialmente:
–t/t
R = R0 e
L’attività iniziale è
R0 = 0.25 Bq/g × 3.82 g = 0.955 Bq
R
–t/t
ᎏᎏ = e
R0
t
R
ln ᎏᎏ = ln e–t/t = – ᎏtᎏ
R0
R
T 2
R
t = –t ln ᎏᎏ = – ᎏ1/ᎏ
ln ᎏᎏ
R0
ln 2 R0
5730 anni
0.64 Bq
= – ᎏᎏ × ln ᎏᎏ = 3300 anni
ln 2
0.955 Bq
Il carbone ha 3300 anni.
Discussione Come controllo possiamo vedere se
R0(2–t/T1/2) = R
R0(2–t/T1/2) = 0.955 Bq × 2–3300 anni/5730 anni
= 0.955 Bq × 0.671 = 0.64 Bq = R
Problema di verifica 24.9 L’età di Ötzi
Nel 1991 un escursionista ha trovato i resti di un uomo, naturalmente mummificato, che sporgevano da
un ghiacciaio nelle alpi. L’uomo è stato nominato dai
ricercatori Ötzi mentre popolarmente viene denomi-
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 960
Capitolo 24 La fisica nucleare
960
Esempio 24.9 Continua
nato l’uomo dei ghiacci. L’attività di 14C dei resti dell’uomo dei ghiacci è stata misurata essere 0.131 Bq
per grammo di carbonio. Quanto tempo fa è morto
l’uomo dei ghiacci?
Esempio 24.10
Decrescita annua dell’attività di
14
C nei campioni non viventi
Di quale percentuale decresce in un anno l’attività di
14
C di un campione non vivente?
Impostazione Non sono state fornite né l’attività iniziale né quella finale, conosciamo solo l’intervallo di tempo trascorso: un anno. Possiamo determinare la variazione espressa come percentuale dell’attività iniziale. Il cambiamento percentuale è un
modo per esprimere il cambiamento dell’attività come frazione dell’attività iniziale. Supponiamo che
l’attività iniziale sia R0 e l’attività dopo un anno sia
R. La quantità da determinare è
∆R R – R
ᎏᎏ = ᎏᎏ0
R0
R0
espressa in termini percentuali.
Soluzione Le attività R0 e R sono legate da
R(t) = R0(2–t/T1/2)
Scegliamo questa forma piuttosto di quella esponenziale R = R0e–t/t perché conosciamo il tempo di dimezzamento T1/2. Sebbene non conosciamo né R né
R0 la formula ci permette di determinarne il rapporto.
R
ᎏᎏ = 2–t/T1/2 = 2–1/5730 = 0.999 879
R0
Ora, troviamo il cambiamento avvenuto nell’arco di
un anno in forma di frazione.
∆R R – R
R
ᎏᎏ = ᎏᎏ0 = ᎏᎏ – 1 = 0.999 879 – 1 = –0.000 121
R0
R0
R0
L’attività del carbonio-14 decresce di 0.012% ogni
anno.
Discussione Questa piccola variazione dell’attività
è una delle ragioni sul fatto che la tecnica del carbonio-14 non può fornire una datazione molto precisa.
Problema di verifica 24.10
della datazione
Precisione
Se l’attività di 14C di un frammento osseo può essere determinata con una precisione di ±0.1% con quale precisione possiamo aspettarci di datarlo (assumendo che non ci siano altre sorgenti di errore)? [Suggerimento: In quale intervallo di tempo l’attività cambia di 0.1%?]
La datazione con il carbonio può essere usata in campioni che hanno un’età massima di 60000 anni che corrisponde a circa 10 tempi di dimezzamento di 14C. Maggiore è l’età del campione e minore sarà l’attività 14C per cui la misura della radioattività su campioni estremamente vecchi è molto difficile.
Un’ipotesi importante fatta nei vari esempi è quella che il rapporto all’equilibrio tra 14C e 12C nell’atmosfera sia sempre stato lo stesso almeno fino all’inizio del
ventesimo secolo. È un’ipotesi corretta? Possiamo verificarla? Un modo per verificare questa ipotesi per vite medie relativamente corte, è quello di prendere dei campioni dalla parte interna di alcuni alberi molto vecchi – o dai resti di antichi alberi
– e misurare l’età in diverse parti del campione.
Oggi, gli scienziati sono convinti che l’abbondanza relativa di 14C nell’atmosfera
non sia cambiata molto negli ultimi 1000 anni anche se negli ultimi 60000 anni è variata considerevolmente raggiungendo un livello più alto del 40% di quello attuale.
Fortunatamente, la datazione con il carbonio-14 può essere aggiustata in maniera tale
da compensare le variazioni avvenute nel passato; gli anelli degli alberi ci permettono una tale correzione fino a circa 11000 anni fa. Nel lago Suigetsu in Giappone strati di alghe morte si depositano anno dopo anno sul fondo e ogni strato è separato dall’altro da sedimenti di argilla. Gli strati alternati di alghe di colore chiaro e argilla scura possono essere visti come gli anelli degli alberi permettendo di aggiustare le datazioni in base all’abbondanza di 14C nell’atmosfera fino a circa 43000 anni fa.
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 961
24.5 Effetti biologici delle radiazioni
961
L’abbondanza relativa di 14C nell’atmosfera ha iniziato a cambiare rapidamente nel
ventesimo secolo a causa dell’attività umana. Un’enorme aumento nell’uso di combustibili fossili ha introdotto nell’atmosfera grandi quantità di carbone con una bassa abbondanza di 14C mentre esperimenti nucleari a cielo aperto, bombe nucleari e
reattori nucleari, hanno aumentato l’abbondanza relativa di 14C nell’atmosfera. In
futuro sarà difficile utilizzare la datazione con il radiocarbonio su oggetti del ventesimo secolo a causa degli artefatti provenienti da questi avvenimenti.
Altri isotopi usati nella datazione radioattiva
Oltre al 14C anche altri nuclidi radioattivi sono utilizzati per la datazione radioattiva. Tra questi i più utilizzati per la datazione delle formazioni geologiche sono: l’uranio-235 (0.7), il potassio-40 (1.248), l’uranio-238 (4.5), il torio-232 (14) e il rubidio-87 (49). In fianco ai vari isotopi è riportato tra parentesi il loro tempo di dimezzamento T1/2 milardi di anni. Un modo per calcolare direttamente l’età della terra è quello basato sull’abbondanza dei vari isotopi del piombo nei campioni terrestri e nelle meteoriti. Pb-206 e Pb-207 sono i prodotti finali di una lunga catena di
decadimenti radioattivi che inizia rispettivamente con U-238 e U-235.
Pb-210 con un T1/2 di soli 22.20 anni è usato per la datazione negli ultimi 100150 anni. Esso si forma nelle rocce contenenti U-238 come prodotto di decadimento del gas radon. Il gas radon dall’atmosfera decade in un isotopo del piombo e passa dall’atmosfera al terreno dove viene intrappolato nel suolo o nel sedimento dei
laghi o degli oceani oppure nei ghiacci polari. L’età di uno strato di sedimento può
essere determinato misurando la quantità di Pb-210 presente.
Datazione
radioattiva delle
formazioni
geologiche
24.5
Effetti biologici
delle radiazioni
EFFETTI BIOLOGICI DELLE RADIAZIONI
Quando si parla di effetti biologici delle radiazioni è sempre necessario definire bene a quale tipo di radiazione ci stiamo riferendo.
In questo capitolo parleremo degli effetti biologici delle radiazioni ionizzanti. Si
definisce ionizzante quella radiazione che ha un’energia sufficiente per ionizzare, ossia estrarre uno o più elettroni da un atomo o da una molecola. L’energia necessaria
per ionizzare la materia dipende dal materiale irradiato e può variare da pochi eV nei
semiconduttori fino a qualche decina di eV (circa 30) per i gas come l’aria.
La radiazione ionizzante può essere suddivisa in radiazione neutra, costituita da
raggi X e gamma e neutroni (denominate anche radiazione X – gamma e radiazione neutronica), e radiazione carica, costituita da particelle cariche veloci come la radiazione alfa e la radiazione beta.
Ogni giorno siamo esposti alle radiazioni ionizzanti sia a causa della radioattività naturale e delle radiazioni cosmiche sia alla radioattività artificiale prodotta dall’uomo. Gli effetti delle radiazioni sugli esseri viventi dipendono da fattori come il
tipo di radiazione, la dose assorbita dall’organismo e il tempo di esposizione. Gli
effetti biologici sono causati dalle ionizzazioni delle molecole all’interno delle cellule. Infatti nelle cellule ci sono molti siti deputati a mantenere in vita la cellula il
cui funzionamento può essere compromesso dalla presenza di radicali liberi (molecole ionizzate). Alcuni esempi di questi siti sensibili sono: il DNA e i mitocondri.
Il primo contiene le informazioni genetiche mentre i secondi hanno il compito principale di fornire l’energia per la sopravvivenza della cellula.
La dose assorbita è la quantità di energia depositata dalle radiazioni ionizzanti nell’unità di massa di tessuto. L’unità di misura della dose assorbita è il gray (Gy):
1 Gy = 1
J
kg
(24-26)
Una vecchia unità di misura della dose assorbita è il rad (Radiation Absorbed Dose):
1 rad = 0.01 Gy
(24-27)
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 962
Capitolo 24 La fisica nucleare
962
Esperimenti radiobiologici hanno evidenziato che a parità di dose assorbita gli effetti biologici possono essere diversi: a parità di dose le radiazioni alfa sono molto
più dannose delle radiazioni gamma. Questo vuol dire che il valore della dose assorbita non è sufficiente per quantificare gli effetti biologici delle radiazioni.
La differenza degli effetti biologici risiede nella diversa densità di ionizzazione
prodotta dai vari tipi di radiazione. Le particelle alfa creano densi sciami di ionizzazione a differenza delle radiazioni beta e gamma.
La diversa efficacia di produrre un danno biologico può essere quantificata attraverso un parametro chiamato RBE (Relative Biological Effectiveness) in italiano
EBR (Efficacia Biologica Relativa). L’RBE permette di quantificare e confrontare
l’efficacia biologica delle diverse radiazioni. L’RBE è definita come il rapporto tra
una dose di riferimento DR, solitamente raggi X oppure raggi gamma e la dose della radiazione in esame D necessaria a produrre lo stesso effetto biologico (morte cellulare, mutazione di uno specifico gene ecc.):
RBE =
Tabella 24.3
Fattori di qualità
tipici per diversi tipi
di radiazione
Raggi Gamma
Particelle Beta
Protoni, neutroni
Particelle alfa, neutroni
da 100 keV a 2MeV
0.5-1
1
2-10
10-20
DR
D
(24-28)
Facciamo un esempio: se per ottenere un determinato effetto biologico necessitiamo di una dose pari a 400 mGy di raggi X e 40 mGy di particelle alfa allora l’RBE
delle particelle alfa è 10 rispetto alla radiazione X.
Conoscendo l’efficacia biologica relativa dei vari tipi di radiazione è possibile introdurre un parametro, chiamato fattore di qualità, che quantifica il livello di pericolosità della radiazione. La Tab. 24.3 riporta alcuni valori tipici dei fattori di qualità.
Moltiplicando la dose assorbita per il fattore di qualità si ottiene una stima del
danno causato dall’esposizione alla radiazione. Tale quantità viene chiamata dose
equivalente la cui unità di misura è il sievert (Sv).
dose equivalente (Sv) = dose assorbita (Gy) × fattore di qualità (24-29a)
1 Sv = 1
J
kg
(24-29b)
Il sievert ha la stessa unità di misura del gray ma ha un significato molto diverso.
Esempio 24.11
Dose equivalente in un esame scintigrafico al cervello
Un paziente di 60 kg viene sottoposto a un esame al
cervello e gli vengono iniettati 20 mCi di tecnezio99, 99Tcm, un radionuclide metastabile. Il 99Tcm decade nel suo stato fondamentale 99Tc con un tempo
di dimezzamento di 6 ore emettendo un fotone da 143
keV. Assumendo che la metà dei fotoni escono dal
corpo senza interagire, qual è la dose equivalente ricevuta dal paziente? Il fattore di qualità per questi fotoni è 0.97. Assumi che tutti i decadimenti del 99Tcm
avvengano nel corpo.
Impostazione La conoscenza dell’attività iniettata (20 mCi) e del tempo di dimezzamento (6 ore)
ci permette di calcolare il numero di nuclei di 99Tcm
iniettati nel paziente. Possiamo ora determinare
quanti fotoni sono assorbiti dal paziente; moltipli-
cando il numero di fotoni assorbiti per l’energia di
ciascun fotone (143 keV) otteniamo l’energia totale della radiazione assorbita. La dose assorbita è
l’energia assorbita per unità di massa del tessuto. La
dose equivalente è la dose assorbita per il fattore di
qualità.
Soluzione L’attività della soluzione iniettata
espressa in Bq diventa:
R0 = 20.0 × 10–3 Ci × 3.7 × 1010 Bq/Ci = 7.4 × 108 Bq
L’attività è legata al numero di nuclei N dalla seguente relazione
N
R0 = lN0 = ᎏᎏ0
t
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 963
24.5 Effetti biologici delle radiazioni
963
Esempio 24.11 Continua
Allora il numero di nuclei iniettati è
T 2
6.0 h × 3600 s/h
R0 = ᎏᎏ × 7.4 × 108 s–1
N0 = tR0 = ᎏ1/ᎏ
ln 2
ln 2
= 2.306 × 1013
Ciascuno di questi nuclei emette un fotone e la metà dei fotoni viene assorbita dal corpo. L’energia di
ciascun fotone è di 143 keV. Dunque, l’energia totale assorbita è
eV
J
1
E = ᎏᎏ × (2.306 × 1013 fotone) × 1.43 × 105 ᎏᎏ × (1.60 × 10–19 ᎏᎏ)
fo t one
eV
2
La dose equivalente è la dose assorbita moltiplicata
per il fattore di qualità:
0.0044 Gy × 0.97 = 0.0043 Sy
Discussione La quantità di materiale radioattivo
viene spesso identificata dalla sua attività piuttosto
che da altri parametri come la massa e il numero di
moli. È importante ricordare che il numero di nuclei
radioattivi può essere calcolato conoscendo l’attività
e il tempo di dimezzamento.
= 0.264 J
La dose assorbita è
0.264 J
ᎏᎏ = 0.0044 Gy
60.0 kg
Problema di verifica 24.11
la massa dall’attività
Calcolare
60
Qual è la massa di 50 miCi di 27
Co?
La dose equivalente media ricevuta da una persona nel corso di un anno dalle sorgenti naturali è all’incirca 3 mSv. Di questi, all’incirca 2 mSv sono dovuti all’inalazione di
gas radon-222 e dei suoi prodotti di decadimento. Il radon-222 è continuamente prodotto dal decadimento alfa del radio-226 presente nel suolo e nelle rocce. Il gas radon
solitamente entra nelle nostre case attraverso le fondamenta. Una volta inalato, i nuclei
di 222Rn decadono alfa e portano a una significativa dose assorbita dai polmoni. La
quantità di gas radon che entra nelle nostre case varia fortemente da luogo a luogo e in
alcune località è assolutamente trascurabile mentre in altre, dove si ha un’abbondante
quantità di radio nel sottosuolo, è la causa principale della dose assorbita dai polmoni.
Il 23% della dose annuale (circa 0.7 mSv) è dovuta ai nuclidi radioattivi presenti in natura; alcuni entrano nel nostro corpo per esempio con il cibo e con l’acqua (come 14C e 40K). Altri ci irradiano dall’esterno come i nuclidi radioattivi presenti nel sottosuolo o nei materiali usati per la costruzione degli edifici che possono contenere tracce di polonio, radio, torio e uranio. Altri 0.3 mSv sono dovuti ai
raggi cosmici. La dose dovuta ai raggi cosmici è significativamente maggiore alle
alte quote. Negli aerei commerciali che viaggiano a 11 km di altezza (35000 ft) la
dose ricevuta a causa dei raggi cosmici è all’incirca di 7 × 10–6 Sv per ora, e quindi con 40 ore di volo si riceve la dose equivalente media che il resto della popolazione assorbe in un anno; 90 ore di volo sono equivalenti alla dose annuale media
ricevuta da un individuo a causa delle esposizioni mediche.
Le attività umane contribuiscono con una dose equivalente di 0.6 mSv, circa –51
dei 3 mSv dovuti alle sorgenti naturali mentre una frazione significativa è dovuta
agli esami diagnostici (principalmente raggi X).
La cosiddetta sindrome da radiazione avviene quando un individuo viene esposto
in un singolo episodio a un’alta dose di radiazioni. I sintomi di questa sindrome sono: nausea, diarrea, vomito e perdita dei capelli e può essere fatale se la dose equivalente su tutto il corpo supera i 2-5 Sv. Se la dose è inferiore a 0.5 Sv difficilmente provoca i sintomi sopra elencati. Nel lungo periodo gli effetti dell’esposizione alla radiazione ionizzante provocano un aumento del rischio di contrarre gravi malattie (come
leucemie e cancro) e di trasmettere mutazioni genetiche alle popolazioni future.
Penetrazione delle radiazioni
Le radiazioni di tipo diverso hanno una diversa capacità di penetrare la materia e
questa capacità dipende molto dalla loro natura. Le radiazioni costituite da particel-
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 964
Capitolo 24 La fisica nucleare
964
le cariche, come le particelle alfa e le particelle beta, sono poco penetranti mentre
la radiazione neutra come neutroni e radiazione X o gamma hanno la capacità di attraversare anche grandi spessori di materiale.
Le particelle alfa vengono completamente fermate da pochi centimetri d’aria o
da sottili strati d’alluminio (0.02 mm) per cui, sebbene abbiano un grande potenziale di ionizzazione, non rappresentano un grande pericolo se provengono dall’esterno del nostro corpo, in quanto non riescono a superare lo strato superficiale
della nostra pelle. Molto diverso è invece il caso dell’ingestione o dell’inalazione di
sorgenti di particelle alfa. Il radon è un gas radioattivo che emette particelle alfa. Se
viene respirato, le particelle alfa entrano subito in contatto con gli alveoli polmonari creando seri danni. Anche se vengono ingerite attraverso i cibi, le particelle alfa
sono molto pericolose.
Le particelle beta-meno (elettroni) sono più penetranti delle particelle alfa. Il
loro range all’interno del corpo umano può essere di qualche centimetro (naturalmente a seconda della loro energia iniziale). Possono attraversare qualche metro
d’aria oppure poco più di 1 cm d’alluminio prima di essere completamente fermate. Quando gli elettroni entrano in un materiale e perdono la loro energia emettono
raggi X, non solo ionizzando la materia ma anche nel loro frenamento, che sono ancora più penetranti. Il fenomeno di produzione di raggi X per frenamento è detto
bremsstrahlung, che in tedesco significa radiazione di frenamento. Le particelle beta-più (positroni o elettroni positivi) dopo il frenamento subiscono un processo chiamato annichilazione. Questo processo avviene quando un elettrone e un positrone
attraendosi a vicenda vengono a contatto, scompaiono e al loro posto compaiono
due fotoni gamma da 511 keV.
Anche se in misura minore rispetto alle particelle alfa anche i materiali beta
emettitori sono decisamente pericolosi quando entrano nel nostro organismo (per
esempio attraverso inalazione o ingestione). I test nucleari fatti in atmosfera negli
anni ’50 hanno prodotto molti radionuclidi pericolosi tra cui lo stronzio-90 che è
prodotto dalla fissione di 235U. Lo stronzio è chimicamente simile al calcio; entrambi
sono alcalini e sono uno sotto l’altro nella tavola periodica degli elementi. Lo stronzio-90 ingerito attraverso i cibi contaminati si fissa nelle ossa e nei denti soprattutto negli individui in fase di crescita come i bambini. Lo stronzio-90 decade beta con
un tempo di dimezzamento di 28 anni e quindi, una volta fissato nelle ossa, irradia
per un tempo molto lungo impartendo dosi non trascurabili a cui si associa un aumento nel rischio di contrarre leucemia o altri tumori. Fortunatamente ora gli esperimenti nucleari in atmosfera sono banditi a livello internazionale e quindi la contaminazione di stronzio-90 nell’aria è significativamente diminuita.
Contrariamente alle radiazioni alfa e beta, che attraversano modesti spessori di
materiale, le radiazioni X e gamma possono attraversare anche oggetti di grande
spessore. Anche il loro modo d’interagire è molto diverso: le radiazioni X e gamma
perdono tutta o gran parte della loro energia in una singola collisione (collisioni di
varia natura che prendono il nome di effetto fotoelettrico, effetto Compton e produzione di coppie).
Per i fotoni X e gamma la capacità di penetrazione viene espressa con lo spessore medio di materiale attraversato oppure con lo spessore di dimezzamento. Per
esempio, se un fascio di fotoni gamma da 5 MeV si riduce del 50% nell’attraversare 23 cm di tessuto oppure 1.5 cm di piombo, diremo che lo spessore di dimezzamento sarà pari a 23 cm di tessuto oppure 1.5 cm di piombo.
Applicazioni mediche delle radiazioni
Traccianti
radioattivi in
diagnostica
Molte applicazioni mediche utilizzano radiazioni o materiali radioattivi ma le più
importanti sono in radiodiagnostica e in radioterapia. Nella diagnostica si usano spesso i traccianti radioattivi uno dei quali è il tecnezio-99 metastabile prodotto dal
decadimento beta-meno del molibdeno. Lo stato metastabile del tecnezio-99 ha un
tempo di dimezzamento di 6 ore che confrontato ai tempi di dimezzamento di mol-
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 965
24.5 Effetti biologici delle radiazioni
ti altri (da 10–15 a 10–8) è eccezionalmente lungo. Questo tempo di decadimento è
perfetto per essere usato come tracciante. Infatti, se il tempo di dimezzamento è molto più breve, accade che molto tracciante radioattivo decade prima di raggiungere i
tessuti di interesse e diventa inutilizzabile. Viceversa, se il tempo di dimezzamento
è molto più lungo, è necessario somministrare grandi quantità di sostanza radioattiva per far sì che una buona frazione dei raggi gamma venga emessa e rilevata nel
tempo di esecuzione dell’esame.
Un modo per produrre immagini con i traccianti radioattivi è attraverso l’uso
della camera Anger o camera gamma (vedi Fig. 24.10) che è costituita da un collimatore di piombo con fori paralleli. Il piombo assorbe i raggi gamma cosicché solamente i fotoni emessi parallelamente ai buchi possono passare attraverso il collimatore. Dietro al collimatore c’è un cristallo scintillante che produce un impulso di
luce quando un fotone gamma vi interagisce. I tubi fotomoltiplicatori posizionati
dietro al cristallo rivelano questi impulsi di luce che, opportunamente trattati, permettono di ricostruire l’immagine dell’organo di interesse.
Nella tomografia a emissione di positroni (PET), si iniettano radioisotopi emettitori di positroni. Alcuni isotopi emettitori di positroni sono: il carbonio-11, l’azoto-13 e l’ossigeno-15. Un positrone emesso nel corpo del paziente si annichila velocemente con un elettrone per produrre due raggi gamma con la stessa direzione
ma versi opposti. I fotoni possono essere rilevati da un anello di rilevatori posizionati attorno al corpo per ricostruire l’immagine.
L’effetto biologico delle radiazioni è maggiore nei tessuti tumorali rispetto a
quelli sani anche per il fatto che le cellule tumorali sono in continua crescita. L’obiettivo della radioterapia è quello di fornire una dose sufficiente di radiazioni per distruggere le cellule tumorali senza arrecare un eccessivo danno ai tessuti sani.
La radioterapia può essere effettuata sia dall’interno che dall’esterno del corpo.
Nel primo caso (radioterapia con sorgente interna al corpo) si usano radiofarmaci
(farmaci radioattivi) che possono essere opportunamente veicolati sul tumore. Una
tecnica molto promettente di radioterapia interna è quella di legare un atomo radioattivo a una proteina in grado di entrare solo nelle cellule tumorali e rilasciare nel
loro interno l’energia della radiazione di decadimento.
La radioterapia esterna viene effettuata utilizzando sorgenti di raggi X o di raggi gamma e posizionando i tessuti tumorali nel campo di radiazione opportunamente collimato. Per ottenere la radioterapia esterna di piccoli tumori cerebrali è stata sviluppata una tecnica molto sofisticata chiamata “gamma knife radiosurgery” (letteralmente: radiochirurgia con bisturi gamma) (Fig. 24.9). Questa tecnica fa uso di uno
speciale elmetto metallico con centinaia di fori in grado di collimare e focalizzare le
965
Tomografia a
emissione di
positroni (PET)
Radioterapia
Radiochirurgia
gamma knife
Tubi fotomoltiplicatori
Cristallo scintillante
Piatto collimatore in piombo
Raggi gamma
Zona tumorale
(a)
Figura 24.8
(a) Schema semplificato di una camera Anger. Un tracciante radioattivo accumulato nel tumore
emette raggi gamma. Un fotone che passa attraverso un foro del collimatore viene rilevato dall’apparato. (b)
Questa foto mostra una camera Anger con due teste di misura: una sopra il torace del paziente e un’altra alla sua
sinistra. I collimatori di piombo, i cristalli scintillanti e i tubi fotomoltiplicatori sono nascosti dietro alle griglie
che delimitano le dimensioni dei rilevatori.
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 966
Capitolo 24 La fisica nucleare
966
Raggi gamma
provenienti dall’esterno
Elmetto di piombo
Tumore
(a)
Figura 24.9 (a) Schema di un “elmetto” in piombo usato nella radiochirurgia gamma knife. (b) Il paziente è
attentamente posizionato nell’elmetto per essere sicuri che i raggi gamma convergano nel punto desiderato del
cervello. Un grembiule di piombo protegge il corpo dall’esposizione alla radiazione.
radiazioni gamma in piccoli volumi di tessuto. Con questa tecnica la dose rilasciata
nella zona focale è molto più grande della dose rilasciata ai tessuti circostanti.
Un’altra tecnologia fisica si sta diffondendo sempre più nelle strutture ospedaliere: il ciclotrone. Il ciclotrone è un acceleratore di particelle che viene utilizzato per produrre radionuclidi con breve tempo di dimezzamento come il fluoro-18 (18F). Questi
radionuclidi, generalmente beta-più emittenti, vengono usati nella PET, un’indagine
diagnostica estremamente importante per la valutazione della funzionalità cerebrale.
RIEPILOGO
• Ogni nuclide è caratterizzato dal numero atomico Z
(il numero di protoni) e dal numero di nucleoni A
(la somma del numero di neutroni e dei protoni).
Gli isotopi di un elemento hanno lo stesso numero
atomico ma un diverso numero di neutroni.
• La densità di massa di tutti i nuclei è approssimativamente la stessa. Il raggio di un nucleo è
r = r0 A1/3
(24-4)
dove
–15
r0 = 1.2 × 10
m = 1.2 fm
(24-5)
• L’energia di legame di un nucleo EB è l’energia
che deve essere fornita al nucleo per separare le singole particelle (protoni e neutroni) che lo costituiscono. Poiché il nucleo è un sistema legato, la sua
energia totale è minore dell’energia dei singoli Z
protoni e N neutroni quando questi sono lontani tra
loro e a riposo.
EB = (∆m)c2
(24-8)
• In qualsiasi reazione nucleare, si conserva sia la carica elettrica totale che il numero totale di nucleoni.
• Un nuclide instabile o radioattivo decade emettendo radiazione.
Decadimento alfa
A
ZP
→ ZA –– 24D + 24a
(24-10)
Decadimento beta-meno
A
ZP
→ Z +A 1D + –10 e + 00n–
(24-11)
Decadimento beta-più
A
ZP
→ Z –A 1D + +10e + 00n
(24-12)
Decadimento gamma
P* → P + g
• Ciascun nuclide radioattivo è caratterizzato da una
probabilità per unità di tempo di decadere λ. L’attività R di un campione con N nuclei è
numero di decadimenti –∆ N
R = ᎏᎏᎏ = ᎏᎏ = lN
(24-18)
unità di tempo
∆t
L’attività è generalmente misurata in becquerels
(1 Bq = 1 decadimento al secondo) oppure in curies (1 Ci = 3.7 × 1010 Bq).
• Nella cinetica del decadimento radioattivo, il numero N di nuclei instabili che rimangono al passare del tempo segue una legge esponenziale
N(t) = N0 e–t/t
(24-19)
dove la costante di tempo o vita media è τ = 1/λ. Il
tempo di dimezzamento T1/2 è il tempo durante il
quale la metà dei nuclei instabili decade:
T1/2 = t ln 2 ≈ 0.693t
(24-22)
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 967
Problemi
(a) 105B + 24He → 137N + 11H
(b) 105B + 01n → 115B + b – + n–
23
20
(c) 11
Na + 11H → 10
Ne + 24He
14
1
13
(d) 7N + 1H → 6C + b + + n
(e) Nessuna di queste
(f) Tutte
(g) Tutte tranne la (c)
(h) (a) e (d)
Delle ipotetiche reazioni nucleari riportate nella
precedente domanda 4, quale viola la conservazione del numero di nucleoni?
L’attività di un campione radioattivo (con un singolo nuclide radioattivo) diminuisce di 1/8 rispetto
al suo valore iniziale in un intervallo di tempo di
96 giorni. Qual è la vita media del nuclide radioattivo descritto?
(a) 6 giorni
(b) 8 giorni
(c) 12 giorni
(d) 16 giorni
(e) 24 giorni
(f) 32 giorni
Il piombo ha una densità circa 4 volte quella dell’alluminio. Qual è il motivo principale per cui il
piombo ha una densità così alta?
(a) L’atomo di piombo è più piccolo dell’atomo
di alluminio.
(b) Il nucleo di piombo è più piccolo di quello di
alluminio.
(c) Il nucleo di piombo ha più massa del nucleo
di alluminio.
(d) Il nucleo di piombo è più denso del nucleo di
alluminio.
(e) L’atomo di piombo ha più elettroni dell’alluminio.
Quale tra le seguenti unità di misura è quella della
costante di decadimento λ di un nuclide radioattivo?
(a) s
(b) Ci
(c) rd
(d) s–1
(e) rem
(f) MeV
Quesiti
1. Come sono riusciti Henri Becquerel e gli altri ricercatori a capire che esistono tre diversi tipi di radiazione prima di aver determinato le cariche elettriche
e le masse delle particelle alfa, beta e gamma?
2. Quale tecnica può aver usato Becquerel (e altri) per
scoprire che le particelle alfa sono cariche positivamente, quelle beta sono cariche negativamente
mentre la radiazione gamma è neutra? Spiega come
hanno potuto scoprire che le particelle alfa hanno
un rapporto carica su massa che è la metà di quello dello ione H+, mente le particelle beta hanno lo
stesso rapporto (carica su massa) dei “raggi catodici”, cioè degli elettroni. (Vedi il Capitolo 18 per avere qualche idea).
3. Perché è più probabile che un neutrone lento induca una reazione nucleare (come nell’attivazione
neutronica e fissione indotta) piuttosto di un protone con la stessa energia cinetica?
4. Spiega perché i nuclidi attivati dai neutroni hanno
la tendenza a decadere β– piuttosto che β +.
5. Perché nei calcoli come quelli dell’Esempio 24.4
possiamo trascurare le energie di legame degli elettroni dell’atomo? Non c’è un difetto di massa dovuto all’energia di legame degli elettroni?
6. Perché dovremmo aspettarci che gli esperimenti nucleari effettuati a cielo aperto porteranno a un aumento del carbonio-14 nell’atmosfera?
Quesiti a risposta multipla
decade in 215
84Po. Quale di queste particelle viene emessa nel decadimento?
(a) Un protone.
(b) Un elettrone.
(c) Un positrone.
(d) Una particella alfa.
(e) Un neutrone.
(f) Nessuna delle precedenti.
2. Per tutti i nuclei stabili
(a) C’è un uguale numero di protoni e neutroni.
(b) Ci sono più protoni che neutroni.
(c) Ci sono più neutroni che protoni.
(d) Nessuna delle risposte precedenti è vera.
3. Per tutti i nuclei stabili
(a) La massa del nucleo è minore di Zmp + (A – Z)mn.
(b) La massa del nucleo è maggiore di Zmp + (A –
Z)mn.
(c) La massa del nucleo è uguale a Zmp + (A – Z)mn.
(d) Nessuna delle precedenti può essere vera.
4. Delle ipotetiche reazioni nucleari sotto riportate,
quale viola la conservazione di carica?
1.
967
5.
6.
7.
8.
215
83Bi
Problemi
Problema di tipo concettuale e quantitativo
Applicazione biologica o medica
1.
Soluzione dettagliata sul sito
1.
1
Problemi con unità di misura non SI
2
Problemi concettualmente associati
Livello di difficoltà:
Nessun ✦ semplice
✦
medio
✦✦
alto
24.1 La struttura nucleare
1. Stima il numero di nucleoni che si trovano nel corpo di una persona che pesa 75 kg.
2. Calcola la densità di massa di un nucleo.
24txtI:GIAMBATTISTA
14-12-2007
968
12:06
Pagina 968
Capitolo 24 La fisica nucleare
3. Una stella di neutroni è una stella che è collassata
ed è formata solamente da neutroni tutti fittamente
impacchettati. Dunque, è un qualcosa di simile a un
nucleo gigante elettricamente neutro dove non c’è
la repulsione coulombiana che cerca di romperlo.
La forza che tiene assieme questa stella è la forza
di gravità. Supponi che il sole collassi in una stella
di neutroni, quale sarebbe il suo raggio? Assumi che
la densità sia all’incirca la stessa del nucleo. Esprimi la tua risposta in km.
4. Scrivi il simbolo (nella forma AZX) per il nuclide che
ha 38 protoni e 50 neutroni e identifica l’elemento.
5. Quanti neutroni ci sono nel nucleo di 35Cl?
6. Quanti protoni ci sono nel nucleo di 136Xe?
7. Trova il raggio e il volume del nucleo di 107
43Tc.
24.2 L’energia di legame
8. Qual è l’energia di legame di una particella alfa (nucleo di 4He)? La massa di una particella alfa è
4.00151 u.
9. Trova l’energia di legame di un deutone (nucleo di
2
H). La massa del deutone (non l’atomo di deuterio) è 2.013 553 u.
10. Usando uno spettrometro di massa, si trova che la
+
✦ massa dello ione 238
92U è 238.050 24 u. (a) Usa questo risultato per calcolare la massa del nucleo di
238
92U. (b) Poi trova l’energia di legame del nucleo
di 238
92U.
40
Ar?
11. Qual è l’energia di legame media per nucleone di 18
2
12. Mostra che c = 931.494 MeV/u. [Suggerimento:
inizia convertendo le unità di misura in MeV e u.]
13. Cos’è e quanto vale il difetto di massa del nucleo 14N?
14. Quanto vale in MeV/c2 la massa di un atomo di 16O?
(1 MeV/c2 è la massa di una particella con energia
a riposo 1 MeV).
15. (a) Quanto vale il difetto di massa di un atomo di
1
H tenendo in considerazione l’energia di legame
dell’elettrone (nel suo livello base)? (b) Dovremmo
tenere in considerazione questo difetto di massa
quando calcoliamo la massa del nucleo di 1H sottraendo la massa di un elettrone dalla massa dell’atomo di 1H?
16. Dando un ordine di grandezza, stima gli spazi che
✦ separano i livelli energetici nel nucleo assumendo
che un nucleone sia confinato in una scatola di lato 10 fm (un tipico valore di diametro nucleare).
Calcola l’energia del livello fondamentale.
24.3 Radioattività
–
17. Identifica il nucleo figlio quando 40
19K decade β .
18. 232
90Th decade alfa. Scrivi la reazione e identifica il
nucleo figlio.
19. Scrivi la reazione e identifica il nucleo figlio quando 22
11Na decade per cattura elettronica.
20. Scrivi la reazione e identifica il nucleo figlio quando il 22
11Na decade emettendo un positrone.
21. Il radio-226 decade nel seguente modo: 226
88Ra →
222
4
226
86Rn + 2He. Se il nucleo di 88Ra è a riposo prima del decadimento e il nucleo di 222
86Rn si trova
nel suo stato fondamentale, stima l’energia cinetica della particella alfa. (Assumi che il nucleo di
222
86Rn riceva una frazione insignificante dell’energia cinetica).
22. Calcola l’energia cinetica della particella alfa del
✦ Problema 21. Questa volta non assumiamo che il
nucleo di 222
86Rn sia a riposo dopo la reazione. Iniziamo calcolando il rapporto delle energie cinetiche
della particella alfa e del nucleo di 222
86Rn.
31
23. In che modo decade, secondo te, 14Si: α, β + o β–?
Spiega. [Suggerimento: Osserva il rapporto neutroni-protoni.]
24. Mostra che non è possibile il decadimento spontaneo alfa di 19O.
25. Calcola l’energia cinetica massima della particella
40
beta quando 19
K decade β–.
90
26. Calcola l’energia dell’antineutrino quando 38
Sr de–
cade β supponendo che la particella beta abbia
un’energia cinetica di 435 keV.
22
Na decade emettendo β +.
27. Un isotopo del sodio, 11
✦ Stima la massima energia cinetica possibile del positrone assumendo che l’energia cinetica del nucleo
figlio e l’energia totale del neutrino emesso siano
entrambi zero. [Suggerimento: Ricorda di considerare le masse degli elettroni.]
28. Il nucleo di un atomo di 127N cattura uno degli elet✦✦ troni diventando 126C ed emettendo un neutrino. Qual
è l’energia totale del neutrino emesso? [Suggerimento: Puoi usare la classica espressione dell’energia cinetica dell’atomo di 126C e l’espressione
relativistica per l’energia cinetica del neutrino.]
24.4 Cinetica del decadimento
radioattivo e vita media di una sorgente
29. Un certo nuclide radioattivo ha una vita media di
200 s. Un campione contenente solamente questo
nuclide radioattivo ha un’attività iniziale di 8 × 104
s–1. (a) Qual è l’attività dopo 600 s? (b) Quanti nuclei ci sono inizialmente? (c) Qual è la probabilità
per secondo che ciascuno dei nuclei decada?
30. Calcola l’attività, in Ci, di 1 g di radio-226.
31. Qual è l’attività in Bq di 1 kg di 238U?
32. La vita media di I-131 è 8 giorni. Un campione
contenente I-131 ha un’attività di 6.4 × 108 Bq.
Dopo quanti giorni il campione avrà un’attività di
2.5 × 106 Bq?
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 969
Problemi di riepilogo
33. Alcune ossa ritrovate in una cripta in Guatemala sono state datate utilizzando la tecnica del radiocarbonio. L’attività di 14C nelle ossa è stata misurata
ed è di 0.242 Bq per grammo di carbonio. Approssimativamente, quanto vecchie sono le ossa?
34. In questo problema verificherai l’affermazione (del
Paragrafo 24.4) che dice che l’attività di 14C in un
campione vivente è 0.25 Bq per grammo di carbonio. (a) Qual è la costante di decadimento λ per 14C?
(b) Quanti atomi di 14C ci sono in 1 g di carbonio?
Una mole di atomi di carbonio ha una massa di
12.011 g e un’abbondanza relativa di 14C di 1.3 ×
10–12. (c) Usando i risultati delle domande (a) e (b)
calcola l’attività del 14C per grammo di carbonio in
un campione vivente.
35. La datazione al carbonio è usata per datare le ossa
trovate negli scavi archeologici. Se il rapporto degli atomi di C-14 e C-12 è 3.25 × 10–13, quale sarà
l’età delle ossa? [Suggerimento: Nota che questo
1
rapporto è ᎏ4ᎏ del rapporto 1.3 × 10–12 che si trova
nei campioni viventi.]
36. Un campione di 214
83Bi radioattivo che ha una vita
media di 19.9 minuti ha un’attività di 0.058 Ci. Quale sarà la sua attività dopo un’ora?
37. L’attività di un campione contenente 108Ag è 6.4 ×
104 Bq. Dopo 12 minuti l’attività diventa 2 × 103
Bq. Calcola la vita media di 108Ag.
38. Un campione radioattivo ha un numero uguale di
✦ nuclei di 15O e 19O. Usa le vite medie riportate nell’Appendice B per determinare quanto tempo deve
trascorrere affinché il numero di nuclei di 15O sia
doppio rispetto a quelli di 19O. Quale percentuale
di nuclei di 19O è decaduta in tale intervallo di tempo?
t/T1/2
1
39. Mostra matematicamente che 2–t/T1/2 = 冢ᎏ2ᎏ冣
= e–t/t
✦ se e solo se T1/2 = t ln 2. [Suggerimento: Prendi il
logaritmo naturale di ciascun membro.]
Problemi di riepilogo
40. (a) Trova il numero approssimato di molecole d’acqua in 1 litro d’acqua. (b) Quale frazione del volume di 1 litro è occupata dai nuclei d’acqua?
41. Quali di questi nuclidi incogniti sono isotopi uno
71
175
167
71
180
con l’altro? 175
71(?), 32(?), 74(?), 71(?), 30(?), e 74(?).
42. Qual è l’energia media di legame per nucleone per
23
11Na?
43. L’isotopo 15C del carbonio decade molto più velocemente di 14C. (a) Usando l’Appendice B, scrivi
una reazione nucleare che mostri il decadimento di
15
C. (b) Quanta energia viene rilasciata dal decadimento di 15C?
969
44. Un campione radioattivo di radon ha un’attività di
2050 Bq. Quanti kg di radon ci sono?
45. Lo iodio radioattivo, 131I, con una vita media di
8.0207 giorni, viene usato in medicina. (a) Se l’attività iniziale di un campione è 64.5 mCi qual è la
massa di 131I nel campione? (b) Quale sarà l’attività dopo 4.5 giorni?
46. Una particella alfa con energia cinetica di 1 MeV è
diretta contro un nucleo d’oro. (a) Trova la distanza
minima raggiunta tra il centro della particella alfa e
quello del nucleo d’oro. (Assumi che il nucleo d’oro
rimanga fermo. Poiché la sua massa è molto più grande di quella della particella alfa questa assunzione è
una buona approssimazione.) (b) I due arriveranno a
essere abbastanza vicini in modo da “toccarsi”? (c)
Qual è la minima energia cinetica iniziale che permette alla particella alfa di toccare il nucleo d’oro?
47. La Figura 24.6 è un diagramma dei livelli energetici per 208Tl. Quali sono le energie dei fotoni emessi nelle sei situazioni mostrate?
48. Un meteorite contiene 3 g di 147
62Sm e 0.150 g di
143
Nd
con
una
vita
media
di
1.06
× 1011 anni. Se il
60
meteorite originariamente non conteneva 143
60Nd qual
è la sua età?
49. Nel potassio naturale lo 0.0117% dei nuclei sono radioattivi, 40K. (a) Quanto 40K si trova nel gambo del
broccolo che contiene 300 mg di potassio? (b) Qual
è l’attività dovuta a 40K del gambo del broccolo?
50. 212
83Bi può decadere alfa in un livello fondamentale
✦ di 208
81Tl oppure in uno dei quattro stati eccitati del
208
Tl
come mostrato in Figura 24.6. L’energia cine81
tica massima delle particelle alfa emesse dal 212
83Bi
è 6.090 MeV. Quali altri valori di energia cinetica
sono possibili? [Suggerimento: Stima la massa atomica di 208
81Tl.]
51. Approssimativamente qual è l’energia del neutrino
22
emesso quando 11
Na decade per cattura elettronica?
106
102
52. 52Te è radioattivo, decade alfa in 102
50Sn. 50Sn è anch’esso radioattivo e ha una vita media di 4.5 s. Al
tempo t = 0, un campione contiene 4 moli di 106
52Te
e 1.5 moli di 102
50Sn. A t = 25 µs, il campione con102
tiene 3 moli di 106
52Te e 2.5 moli di 50Sn. Quanto
102
50Sn ci sarà al tempo t = 50 µs?
53. Supponi che un campione radioattivo contenga al
✦ tempo t = 0 un’uguale quantità di due nuclidi radioattivi A e B. A ha una vita media di 3 ore mentre B ha una vita media di 12 ore. Trova il rapporto delle attività RA/RB nei seguenti momenti: (a) t =
0, (b) t = 12 ore, (c) t = 24 ore.
54. L’alimentazione di un pacemaker è costituita da un
piccolo pezzo radioattivo di 238Pu. Questo nuclide
decade alfa con una vita media di 86 anni. Generalmente il pacemaker viene sostituito dopo 10 anni. (a) Di quale percentuale decresce l’attività del
24txtI:GIAMBATTISTA
14-12-2007
12:06
Pagina 970
Capitolo 24 La fisica nucleare
970
238
Pu nel corso di 10 anni? (b) L’energia delle particelle alfa emesse è di 5.6 MeV. Assumi un’efficienza del 100% – tutta l’energia delle particelle alfa viene usata per far funzionare il pacemaker. Se
il pacemaker inizialmente ha 1 mg di 238Pu quale
sarà la potenza iniziale e quella dopo 10 anni?
55. Il gas radon (Rn) è prodotto dal decadimento alfa
del 226
88Ra. (a) Quanti neutroni e quanti protoni sono
presenti nel nucleo dell’isotopo di Rn prodotto in
questo decadimento? (b) In una stanza di media
grandezza nell’aria di un appartamento seminterrato di Ithaca, NY, ci sono all’incirca 107 nuclei di
Rn. Il nucleo di Rn è anch’esso radioattivo e decade alfa. La vita media di Rn è di 3.8 giorni. Quante particelle alfa al secondo sono emesse dal decadimento dei nuclei di Rn nella stanza?
Risposte ai problemi di verifica
24.1 Il rutenio,
104
44Ru.
24.2 17 u.
24.3 1.6 × 10–42 m3.
24.4 115.492 MeV.
24.5
226
88Ra
radio-226.
24.6 5.3044 MeV.
24.7 1.3111 MeV.
24.8 2.26 × 10–12.
24.9 5300 anni fa.
24.10 ±8 anni.
24.11 4.4 × 10–6 g.