UNIVERSITÀ DEGLI STUDI DI SIENA
Dottorato di Ricerca in Medicina Molecolare
XXII° CICLO
Coordinatore: Prof. Vincenzo Sorrentino
IDENTIFICAZIONE DI NUOVI GENI MUSCOLOSPECIFICI: STUDIO DELL’ISOFORMA YIP1B
Relatore: Prof. Vincenzo Sorrentino
Correlatore: Dott.ssa Virginia Barone
Dottoranda:
Dott.ssa Elisa Mazzoli
Anno Accademico 2008-2009
Sommario
Riassunto
1
1 Introduzione
3
1.1
Il tessuto muscolare
3
1.2
Il muscolo scheletrico
4
1.3
1.4
Reticolo sarcoplasmatico, tubuli T e triade
Organizzazione del reticolo sarcoplasmatico durante lo
sviluppo
8
12
1.5
Rapporti tra
sarcoplasmatico
1.6
Localizzazione dell’apparato di Golgi nella fibra muscolare
18
1.7
Il traffico vescicolare nelle cellule mononucleate
20
1.8
Il traffico vescicolare nel muscolo scheletrico
28
1.9
La famiglia di proteine YIP in lievito
31
1.10
La famiglia di proteine YIP nei mammiferi
33
reticolo
endoplasmatico
e
reticolo 14
2 Scopo della tesi
37
3 Materiali e metodi
39
3.1
Colture cellulari
39
Miociti primari
39
3.1.1
3.2
Esperimenti di immunofluorescenza
41
3.2.1
Esperimenti di immunofluorescenza su cellule
41
3.2.2
Esperimenti di immunofluorescenza su sezioni di tessuto
42
I
3.2.3
Esperimenti di immunofluorescenza su diaframma
42
3.2.4
Microscopia confocale
43
3.3
Preparazione di lisati cellulari e di tessuto
43
3.3.1
Lisati cellulari
43
3.3.2
Lisati di tessuto
43
3.4
Preparazione di microsomi da cellule e da tessuto
44
3.5
Quantizzazione proteica con il metodo Bradford
44
3.6
Elettroforesi in gel di poliacrilammide (SDS-PAGE)
45
3.7
Western blot
46
3.8
Clonaggi
46
3.9
Trasfezioni
48
3.9.1
Trasfezione transiente in cellule
48
3.9.2
Trasfezione transiente in vivo
49
3.10
mRNA interference
49
3.11
Estrazione RNA totale
50
3.12
Preparazione del cDNA (RT-PCR)
51
3.13
Real-Time PCR
51
3.14
Produzione e purificazione di anticorpi policlonali
53
Trattamento degli animali
54
4 Risultati
55
4.1
Identificazione di nuovi geni espressi nel muscolo striato
55
4.2
Espressione dei membri della famiglia YIP1 in diversi tessuti
57
4.2.1
Espressione delle due isoforme di Yip1 in cellule C2C12
60
4.3
Validazione dell’anticorpo anti-Yip1B mediante Western blot
62
4.4
Analisi dell’espressione di Yip1B nei tessuti e in C2C12
63
4.5
Localizzazione sub-cellulare di Yip1B
64
Localizzazione di Yip1B in cellule C2C12
64
4.5.1
II
4.5.2
Localizzazione di Yip1B in miociti primari
67
4.5.3
Localizzazione di Yip1B in fibre muscolari adulte
69
4.6
4.7
Espressione di Yip1B durante il differenziamento cellulare
delle C2C12
Espressione di Yip1B e Yip1A durante lo sviluppo muscolare
embrionale
71
72
4.7.1
Analisi mediante Real-time PCR
72
4.7.2
Analisi mediante Western blot
75
4.7.3
Analisi mediante esperimenti di immunofluorescenza
75
4.8
Espressione di Yip1B in fibre rigeneranti
76
4.9
Effetto dell’overespressione di Yip1B e Yip1A in C2C12
indifferenziate
Knock-down di Yip1B
77
4.10
78
5 Discussione
84
6 Bibliografia
87
III
Riassunto
Il sistema di membrane interne delle fibre muscolari scheletriche, che
comprende il reticolo endo/sarcoplasmatico, i tubuli T e l’apparato di Golgi,
presenta una precisa organizzazione spaziale rispetto al sarcomero. Infatti nel
reticolo sarcoplasmatico si possono distinguere due regioni strutturalmente e
funzionalmente differenti: la porzione longitudinale, dove ci sono proteine
specializzate per la ricattura del calcio, e la porzione di reticolo giunzionale, in
corrispondenza dei tubuli T, dove sono presenti le proteine per il rilascio di calcio.
Anche l’apparato di Golgi ha una distribuzione particolare: esso appare costituito
da poche cisterne impilate l’una sull’altra disperse lungo la fibra e intorno ai
nuclei.
In questo contesto i meccanismi responsabili della localizzazione delle proteine
residenti nel reticolo sarcoplasmatico non sono ancora noti.
Allo scopo di studiare questi meccanismi, in laboratorio è stato isolato un
cDNA codificante una proteina chiamata Yip1B, omologa alla proteina Yip1p di
lievito. Diversi studi presenti in letteratura hanno mostrato che in lievito Yip1p è
una proteina importante per la biogenesi delle vescicole di trasporto rivestite da
COPII gemmanti dall’ER e per la loro competenza alla fusione con l’apparato di
Golgi.
Nei mammiferi l’omologo di Yip1p è presente come due isoforme: Yip1A e
Yip1B. Allo scopo di verificare e quantificare l’espressione di Yip1A e Yip1B nel
muscolo scheletrico sono stati effettuati esperimenti di Real-Time PCR su diversi
tessuti. Yip1A è espressa in modo ubiquitario, ad esclusione del muscolo
scheletrico adulto, mentre Yip1B è espressa esclusivamente nel muscolo striato.
E’ stata poi analizzata l’espressione di entrambe le isoforme di Yip1 durante lo
sviluppo embrionale e post-natale del muscolo. Dati di Real-Time PCR hanno
evidenziato una riduzione dell’espressione di Yip1A con il progredire dello
sviluppo e quindi del differenziamento muscolare, e un contemporaneo aumento
1
dei livelli d’espressione di Yip1B, la cui espressione proteica compare circa al 16°
giorno di vita embrionale.
Per studiare la localizzazione sub-cellulare e per meglio comprendere la
funzione di Yip1B sono stati prodotti anticorpi policlonali contro la porzione
idrofilica di Yip1B. Grazie ad esperimenti di Western blot, è stato visto che
l’antisiero prodotto é in grado di riconoscere la proteina endogena nel muscolo
striato, in cellule C2C12 differenziate, ma non in C2C12 non differenziate e in
altri tessuti, a conferma che si tratta di una proteina muscolo-specifica. Inoltre la
proteina è presente in maggiori quantità nella frazione microsomiale dei muscoli
scheletrici, a conferma della sua associazione con la membrana.
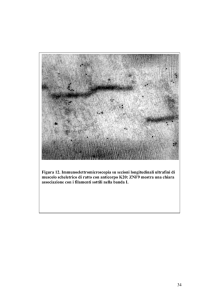
Esperimenti di immunofluorescenza nel muscolo scheletrico hanno rivelato
che la proteina Yip1B è localizzata ai poli del nucleo e in file di strutture
puntiformi lungo la fibra e co-localizza parzialmente con il marcatore del cisGolgi GM130.
Dati presenti in letteratura dimostrano che l’over-espressione dell’isoforma
Yip1A e soprattutto della sua porzione N-terminale, comporta la frammentazione
dell’apparato di Golgi. Per verificare se anche Yip1B possiede le stesse proprietà e
per indagare quale porzione possa essere responsabile di questo effetto, sono stati
trasfettati in cellule tre vettori d’espressione contenenti diverse porzioni del gene.
I risultati mostrano che l’over-espressione della forma intera e della porzione Nterminale provocano la frammentazione dell’apparato di Golgi, fenomeno che
però non si verifica esprimendo la porzione di divergenza delle due isoforme
composta dai primi 80 amminoacidi.
Studi di knock-down sia in vitro che in vivo hanno infine dimostrato che il
silenziamento di Yip1B non altera la distribuzione del marcatore del cis-Golgi
GM130, indicando che la diminuzione della proteina ha un effetto diverso
rispetto alla sua over-espressione.
2
INTRODUZIONE
___________________________
1 Introduzione
1.1 Il tessuto muscolare
Nei Mammiferi sono presenti due tipi di tessuto muscolare: il tessuto
muscolare liscio e il tessuto muscolate striato.
Il
tessuto
muscolare
liscio
(fig.
1.1a)
è
costituito
da
unità
morfologicamente distinte, dette fibrocellule muscolari lisce presenti a livello
delle tonache muscolari degli organi cavi e dei vasi sanguigni, e poiché
innervato dal sistema nervoso vegetativo, la sua contrazione è al di fuori del
controllo volontario.
Il tessuto muscolare striato, così chiamato a causa della distribuzione delle
proteine contrattili che gli conferiscono un aspetto striato al microscopio
ottico, si divide in muscolo striato cardiaco e scheletrico.
Il tessuto muscolare cardiaco (fig. 1.1b) o miocardio è responsabile della
contrazione del cuore ed è formato da singoli elementi mononucleati uniti tra
loro da giunzioni di membrana. Il miocardio è in grado di generare
autonomamente lo stimolo alla contrazione grazie al nodo seno-atriale dal
quale si propagano gli impulsi elettrici che generano il battito cardiaco. Il
ritmo cardiaco è invece influenzato dall’attività del sistema nervoso autonomo
e da stimoli ormonali.
Il tessuto muscolare scheletrico (fig. 1.1c) costituisce la muscolatura
scheletrica di tutto l’organismo; essa è un sincizio formato dalla fusione,
durante lo sviluppo muscolare, di elementi mononucleati detti mioblasti che
fondendosi formano la fibra muscolare o miofibra. Il muscolo scheletrico è
un muscolo volontario in quanto riceve terminazioni nervose dal sistema
nervoso centrale.
3
INTRODUZIONE
___________________________
(a)
(b)
(c)
Fig
1.1
Tipologie
di
muscolo
nei
mammiferi
(Adattata
http://www.colorado.edu/intphys/Class/IPHY3430-200/010muscles.htm)
da
1.2 Il muscolo scheletrico
Nel muscolo scheletrico le fibre muscolari sono disposte parallelamente e
circondate esternamente da una guaina connettivale detta epimisio. Da questa si
dipartono verso l’interno della struttura muscolare dei setti, che rappresentano
il perimisio, che vanno a circondare ciascun fascio di fibre. Dal perimisio si
dipartono dei setti più sottili che circondano ogni singola miofibra, formando
l’endomisio,
che
contiene
capillari
e
assoni
(fig.1.2).
4
INTRODUZIONE
___________________________
Fig.1.2 Rappresentazione schematica della sezione longitudinale del
muscolo scheletrico
Sotto l’endomisio si trova il sarcolemma, ossia la membrana plasmatica, che
racchiude il citoplasma (sarcoplasma) della miofibra. Compresi tra il
sarcolemma e l’endomisio troviamo le cellule satelliti, mioblasti quiescenti in
grado di conferire al tessuto le capacità rigenerative.
E’ interessante notare che dal lato citoplasmatico del sarcolemma il
citoscheletro è molto sviluppato ed ha un ruolo fondamentale nel mantenerne
l’integrità della miofibra durante gli stress meccanici della contrazione. In
particolare è presente una proteina citoscheletrica, la distrofina che è il
componente principale di un complesso proteico multimerico chiamato
“dystrophin glicoprotein complex” (DGC); l’alterazione o l’assenza di
distrofina o di uno dei componenti del complesso DGC comporta
l’insorgenza di diverse forme di distrofia muscolare (Blake et al., 2002).
Immediatamente sotto la membrana plasmatica sono presenti numerosi
nuclei e all’interno del sarcoplasma troviamo gruppi di mitocondri, numerosi
5
INTRODUZIONE
___________________________
piccoli apparati di Golgi, gocce lipidiche e granuli di glicogeno per il
fabbisogno energetico della miofibra, e la mioglobina, che rappresenta
un’importante riserva d’ossigeno. E’ inoltre presente un esteso reticolo
endoplasmatico specializzato detto reticolo sarcoplasmatico, che sarà trattato in
dettaglio nel paragrafo successivo.
La maggior parte del citoplasma della miofibra è occupata dalle miofibrille,
lunghe strutture cilindriche con un diametro compreso tra 1 e 3 m, disposte
lungo l’asse maggiore della fibra, responsabili del fenomeno contrattile.
Ciascuna miofibrilla presenta ad un esame al microscopio a luce polarizzata
una striatura trasversale dovuta all’alternanza di bande chiare e scure. Le
bande scure sono birifrangenti o anisotrope, da qui il nome di bande A,
mentre le bande chiare che appaiono isotrope sono dette bande I. Ciascuna
banda I è divisa in due parti uguali da una linea più scura trasversale detta disco
Z. Al centro della banda A è presente una zona più chiara detta banda H
attraversata centralmente da una linea trasversale, la linea M. Il tratto
compreso tra due dischi Z prende il nome di sarcomero e rappresenta l’unità
strutturale e funzionale del tessuto muscolare scheletrico (fig. 1.3).
Le miofibrille sono costituite a loro volta da miofilamenti disposti
longitudinalmente e compenetranti tra loro: i miofilamenti spessi di miosina e i
miofilamenti sottili costituiti principalmente da actina.
I miofilamenti spessi occupano l’intera banda A e sono caratterizzati da
due fasci di molecole di miosina disposti in modo opposto e uniti al centro
del filamento; questa porzione in cui i filamenti hanno un diametro maggiore
costituisce la banda H. La miosina ha una struttura esamerica formata da 2
catene pesanti e da 2 coppie di catene leggere. Le catene pesanti si avvolgono
tra loro a formare la coda della molecola C-terminale mentre le porzioni Nterminali si avvolgono separatamente e si associano con le catene leggere a
formare le teste della miosina, in cui si concentra l’attività ATPasica
responsabile della contrazione muscolare.
6
INTRODUZIONE
___________________________
Fig. 1.3 Rappresentazione schematica dell’organizzazione delle miofibrille in
una
fibra
muscolare
scheletrica
(Adattata
da
http://faculty.etsu.edu/forsman/Hystologyofmuscleforweb.htm)
I miofilamenti sottili si dispongono in numero di 6 intorno a ciascun
filamento spesso e occupano l’intera banda I, parte della banda A, arrivando
fino ai limiti della banda H, e si ancorano a livello del disco Z. Sono formati
da monomeri di G-actina che polimerizza a formare una doppia elica di Factina, a sua volta circondata dalla doppia elica di tropomiosina, a cui sono
legate a intervalli regolari le 3 sub-unità della troponina.
Tropomiosina e troponina cooperano tra loro, in un meccanismo Ca 2+
dipendente, per regolare l’associazione e lo scivolamento reciproco dei
filamenti spessi e sottili, che è alla base del meccanismo della contrazione
muscolare. Durante la contrazione, infatti, i filamenti sottili di actina scorrono
su quelli spessi di miosina con una conseguente riduzione della lunghezza
delle bande I e della banda H (Rosati et al., 2007).
7
INTRODUZIONE
___________________________
Esistono diversi tipi di fibre muscolari scheletriche che sono
principalmente distinte in base alle isoforme delle catene pesanti della
miosina: I, IIA, IIB, IIX. In linea più generale le fibre sono distinte in base
alla velocità di contrazione: si può affermare che le fibre a contrazione lenta
contengono miosina di tipo I, le fibre a contrazione veloce contengono
miosina di tipo IIB e IIX, le fibre intermedie contengono miosina di tipo IIA
(Schiaffino e Reggiani, 1996). E’ infine da tenere presente che fibre muscolari
con diversa velocità di contrazione, possiedono anche differenze nel tipo di
metabolismo, resistenza alla fatica ed altre proprietà.
1.3 Reticolo sarcoplasmatico, tubuli T e triade
Il reticolo sarcoplasmatico (RS) rappresenta una forma specializzata di
reticolo endoplasmatico e nella fibra muscolare occupa circa il 10% del
volume cellulare. La sua funzione principale è quella di regolare la
concentrazione del Ca2+ intracellulare durante la contrazione muscolare. Il
reticolo sarcoplasmatico è un complesso sistema di endomembrane che
circonda ciascuna miofibrilla e che instaura con le sue diverse zone dei precisi
rapporti spazio-funzionali. E’ costituito da 2 domini morfologicamente e
funzionalmente distinti: il reticolo sarcoplasmatico longitudinale, specializzato
nel recupero del calcio, e il reticolo sarcoplasmatico giunzionale, che ha la
funzione di rilascio del calcio (fig 1.4). Il RS longitudinale è formato da una
rete di tubuli disposti in modo longitudinale rispetto all’asse maggiore della
fibra localizzati, nei mammiferi, a livello della banda A e della parte centrale
della banda I. Questa porzione di reticolo è specializzata nel recupero di ioni
calcio dal sarcoplasma grazie alla presenza di proteine integrali di membrana
che fungono da pompe ioniche: le Ca2+ ATPasi SERCA. I tubuli del RS
longitudinale confluiscono in porzioni dilatate di reticolo, dette cisterne terminali
localizzate in corrispondenza della giunzione tra la banda A e la banda I, a
costituire il RS giunzionale (Franzini-Armstrong, 2004).
8
INTRODUZIONE
___________________________
Fig.1.4 Localizzazione del reticolo sarcoplasmatico in relazione alle diverse
zone
della
miofibrilla
(Adattata
da
http://faculty.etsu.edu/forsman/Hystologyofmuscleforweb.htm)
Nel lume del RS giunzionale è presente la calsequestrina, una proteina che
lega ioni calcio con elevata capacità ma con moderata affinità, che ha quindi la
funzione di aumentare la capacità d’immagazzinamento del calcio nel RS per
poi renderlo disponibile per la contrazione muscolare (Beard et al., 2004).
Tra due cisterne terminali adiacenti è presente un’invaginazione della
membrana plasmatica, denominata tubulo traverso o tubulo T, che porta alla
formazione di una struttura specializzata detta triade, costituita da due cisterne
terminali che fiancheggiano un tubulo T. Questa struttura rende possibile un
accoppiamento tra il segnale nervoso che arriva alla membrana plasmatica (e
quindi ai tubuli T) e il rilascio del calcio dal RS (ed in particolare dalle cisterne
terminali), fenomeno che è chiamato accoppiamento eccitazione-contrazione
(EC coupling). Nei tubuli T sono presenti infatti i recettori della diidropiridina
(DHPR), dei canali del calcio voltaggio-dipendenti che si trovano a diretto
contatto con i recettori della rianodina (RyR1 la principale isoforma presente
9
INTRODUZIONE
___________________________
nel muscolo scheletrico), un canale di rilascio del Ca 2+ localizzato nelle
cisterne terminali del reticolo sarcoplasmatico. Queste due molecole formano
le unità di rilascio del calcio (fig. 1.5) e rappresentano i siti in cui avviene l’EC
coupling (Flucher and Franzini-Armstrong, 1996).
Fig.1.5 Struttura di un’unità di rilascio del calcio nelle fibre di muscolo
scheletrico adulto (Adattata da Protasi F., 2002).
Durante l’EC coupling si ha la depolarizzazione della membrana
plasmatica dovuta all’impulso nervoso, che viene trasmessa fino ai tubuli T.
Qui le molecole di DHPR funzionano da sensori di voltaggio e stimolano in
modo calcio-indipendente l’apertura dei canali del calcio RyR1 permettendo la
fuoriuscita del calcio immagazzinato nel reticolo sarcoplasmatico. Il calcio
liberato è quindi in grado di legarsi alle proteine contrattili ed attivare la
10
INTRODUZIONE
___________________________
contrazione muscolare (Dulhunty, 2006). Dopo l’eccitazione, il rilassamento
del muscolo avviene grazie al trasporto ATP-dipendente del Ca 2+ dal citosol
al lume del reticolo sarcoplasmatico, trasporto effettuato dalle Ca 2+ ATPasi
SERCA presenti nel reticolo longitudinale (MacLennan, 1990).
Oltre a DHPRs e RYRs, altre proteine sono presenti a livello della triade e
partecipano al meccanismo dell’EC coupling. Tra queste troviamo la
calsequestrina, che, come detto in precedenza, è localizza a livello delle
cisterne terminali. La calsequestrina va incontro a modificazioni strutturali
dipendenti dalle variazioni della concentrazione di calcio. Un aumento della
concentrazione di calcio comporta infatti la sua polimerizzazione ed il suo
ancoraggio alla membrana del RS (fig. 1.6); inoltre cambia la sua
conformazione anche durante l’EC coupling, cambiamento che permette il
rilascio del calcio. L’ancoraggio alla membrana del RS avviene probabilmente
indirettamente, ossia mediante due altre proteine presenti a livello del reticolo
giunzionale: la triadina e la giuntina (fig. 1.6). Si tratta di due proteine
transmembrana contenenti siti di legame sia per la calsequestrina che per RyR
la cui funzione specifica non è stata ancora completamente chiarita (Beard et
al., 2004).
Un’altra proteina di ancoraggio presente a livello della triade è la
giuntofilina una proteina transmembrana fondamentale per la stabilizzazione
del complesso giunzionale che fa da ponte molecolare tra i tubuli T e il
reticolo sarcoplasmatico (Takeshima et al., 2000).
11
INTRODUZIONE
___________________________
Fig. 1.6
Modello dei cambiamenti strutturali che avvengono nella
calsequestrina in funzione della concentrazione di calcio (da Beard N.A. et al.,
2004)
1.4 Organizzazione del reticolo sarcoplasmatico durante lo
sviluppo
Il muscolo scheletrico origina dai somiti, delle masse di mesoderma
disposte ai lati della corda dorsale, costituiti da una parte miogenica posta
nella regione dorso-mediale del somite: il miotomo. Le cellule del miotomo si
differenziano in mioblasti che fondendosi e allungandosi formano i miotubi,
dei sincizi cellulari multinucleati dai quali si formeranno le fibre muscolari
adulte. Subito dopo la fusione dei mioblasti ha inizio la sintesi delle proteine
contrattili e il loro assemblaggio in miofibrille, che evolvono in un modello di
differenziamento a tre stadi: inizialmente si formano le “premiofibrille”
caratterizzate dalla presenza di Z-bodies, piccoli aggregati di alfa-actinina a cui
sono attaccati i filamenti di actina e di miosina, quest’ultima ancora di tipo
non muscolare; successivamente si formano le “miofibrille nascenti” nelle
12
INTRODUZIONE
___________________________
quali compaiono anche filamenti di miosina di tipo muscolare. Nell’ultimo
stadio di “miofibrilla matura” scompare la miosina non muscolare, gli Zbodies si fondono formando la linea Z e i filamenti di miosina muscolare si
dispongono a formare la banda A (Sanger et al., 2002). Durante la formazione
delle miofibrille avviene anche la maturazione del reticolo sarcoplamatico.
Il reticolo sarcoplasmatico subisce una serie di modificazioni graduali che
iniziano nella vita embrionale e continuano fino alle prime settimane di vita
post-natale. Nella vita embrionale le proteine tipiche del reticolo
sarcoplasmatico adulto sono distribuite in “clusters” posizionati in modo
casuale lungo la fibra in via di sviluppo. Ogni “cluster” è costituito da tutte le
componenti della triade, come RyR e triadina, e le proteine del tubulo T come
il DHPR, suggerendo quindi che i meccanismi responsabili della formazione e
del mantenimento di questa struttura sono presenti sin dai primi stadi dello
sviluppo (Takekura, 2001). E’ possibile quindi ipotizzare che tali meccanismi
includano eventi multipli quali l’instaurarsi di contatti diretti tra le proteine del
citoscheletro e della membrana plasmatica e la segregazione di diverse
proteine in domini distinti del RS (Rossi et al., 2008).
Il DHPR, ad esempio, al 14° e 15° giorno di vita embrionale (E14-E15)
nel ratto, si presenta sotto forma di piccoli “clusters” distribuiti all’interno
della fibra ma principalmente concentrati alla periferia della stessa; al giorno
E16 i “clusters” risultano longitudinalmente allineati e una frazione più
piccola comincia ad allinearsi anche in direzione trasversale. Al 17° giorno di
sviluppo embrionale cominciano a formare delle bande trasversali a livello
della giunzione tra la banda A ed I e dall’E18 queste doppie bande diventano
ben allineate, come nella fase adulta. Anche le pompe del calcio SERCA
fanno la loro comparsa allo stadio E14 sotto forma di “clusters” distribuiti in
modo casuale nell’intera fibra e a E16 cominciano ad allinearsi a livello del
disco Z. Questa distribuzione viene mantenuta fino allo stadio adulto ma
intorno al 5° giorno di vita postatale (D5) si aggiunge un bandeggio meno
marcato a livello della banda M (Giacomello e Sorrentino, 2009).
13
INTRODUZIONE
___________________________
I meccanismi coinvolti nell’organizzazione del reticolo sarcoplasmatico
rispetto alle diverse zone del sarcomero durante lo sviluppo non è però
ancora ben chiara. Ad esempio la comparsa delle prime strutture triadiche
avviene prima della comparsa e dell’allineamento delle miofibrille (Flucher et
al., 1994), ma per il mantenimento dei rapporti tra le diverse regioni del
reticolo sarcoplasmatico sembra invece sia molto importante l’associazione
con l’apparato miofibrillare. E’ stato infatti proposto il coinvolgimento di due
proteine, l’ankirina 1.5 e l’oscurina, nell’assemblaggio del RS intorno al
sarcomero. Essendo l’oscurina associata alle miofibrille ed in grado di
interagire con l’ankirina 1.5 localizzata nel reticolo sarcoplasmatico, è stato
ipotizzato un loro possibile ruolo nel mantenimento di connessioni stabili tra
il RS e le miofibrille (Bagnato et al., 2003). Inoltre l’ankirina 1.5 è una delle
prime proteine del RS a concentrarsi in particolari zone del reticolo poste
intorno alle miofibrille durante lo sviluppo e questo sembra suggerire un suo
ruolo nelle successive fasi dell’assemblaggio del reticolo sarcoplasmatico
(Giacomello and Sorrentino 2009).
1.5
Rapporti
tra
reticolo
endoplasmatico
e
reticolo
sarcoplasmatico
Nelle cellule eucariotiche il reticolo endoplasmatico (ER) rappresenta un
sistema di membrane di forma tubulare e di cisterne appiattite suddiviso in
due sub-compartimenti: il reticolo endoplasmatico ruvido, così chiamato per la
presenza sulla sua membrana di numerosi ribosomi, dove avviene la sintesi
proteica, e il reticolo endoplasmatico liscio, privo di ribosomi, in cui
avvengono diversi processi metabolici come la sintesi di lipidi e che svolge la
funzione di deposito di calcio. Nel reticolo endoplasmatico liscio sono
presenti anche zone specializzate che costituiscono il reticolo endoplasmatico
di transizione, così chiamato in quanto contiene i “siti di uscita dall’ER” (ER
exit sites o ERES) da cui gemmano le vescicole di trasporto contenenti
14
INTRODUZIONE
___________________________
proteine e lipidi di nuova sintesi destinati all’apparato di Golgi (Alberts et al.,
2004).
Nel muscolo scheletrico la distribuzione di questi compartimenti del
reticolo endoplasmatico all’interno del reticolo sarcoplasmatico non è ancora
ben nota.
Alcuni lavori di Metsikkö e colleghi hanno cercato di chiarire la
distribuzione di marcatori tipici del reticolo endoplasmatico all’interno del RS
delle fibre muscolari scheletriche. Esperimenti di immunofluoerescenza con
l’uso di anticorpi diretti contro diverse proteine tipiche del reticolo
endoplasmatico ruvido hanno evidenziato una distribuzione perinucleare e un
evidente bandeggio. In particolare, due proteine luminali dell’ER, la disulfide
isomerasi (PDI) e BIP, che svolgono la funzione di chaperon molecolari, e la
riboforina II (RibII, una proteina di membrana associata al macchinario della
glicosilazione) mostrano una distribuzione perinucleare e un bandeggio che
occupa l’intera banda I e la giunzione di questa con la banda A (Rahkila et al.,
1997). La stessa distribuzione si riscontra anche per la proteina associata al
complesso del traslocone, la proteina di membrana TRAP. Comparando
questa distribuzione a quella della proteina SERCA residente all’interno del
reticolo sarcoplasmatico longitudinale e alla calsequestrina presente a livello
delle cisterne terminali, si nota una sovrapposizione dei differenti segnali che
non risulta però completa (fig. 1.7). Sembra quindi che la localizzazione delle
proteine dell’ER sia differente da quella delle proteine del RS, ma che tali
proteine risiedano comunque all’interno del sistema di membrane del reticolo
sarcoplasmatico (Kaisto and Metsikkö, 2003).
15
INTRODUZIONE
___________________________
Fig. 1.7 Distribuzione dei marcatori del reticolo endoplasmatico e del
reticolo sarcoplasmatico di una fibra di ratto. (da Kaisto T. and Metsikkö K.,
2003).
Nello stesso lavoro è stata individuata anche la posizione occupata dalle
vescicole di trasporto rivestite dal complesso molecolare COPII, mediante
l’uso di un anticorpo diretto contro la sub-unità Sec23. Tale marcatore si
localizza a livello della regione perinucleare, in strutture puntiformi lungo la
miofibra ma principalmente presenta un bandeggio a livello della linea Z;
inoltre, come emerge dalla doppia colorazione con anticorpi contro
calsequestrina, non mostra nessuna colocalizzazione con quest’ultima che
rappresenta un marcatore delle cisterne terminali (fig. 1.8).
16
INTRODUZIONE
___________________________
Fig 1.8 Distribuzione del marcatore degli ER exit sites (sec23) e delle
cisterne terminali (CSQ) in una fibra di ratto. (da Kaisto T. and Metsikkö K.,
2003).
Gli autori hanno quindi proposto un modello di localizzazione del reticolo
endoplasmatico ruvido all’interno del reticolo sarcoplasmatico: la porzione di
ER ruvido in cui avvengono i processi di traslocazione, glicosilazione e
folding sarebbe localizzato a livello delle cisterne terminali, mentre la
porzione di reticolo in cui si ha la formazione delle vescicole di trasporto e
quindi i siti di uscita dall’ER, il cosiddetto reticolo endoplasmatico di
transizione, si troverebbe a livello della linea Z (fig.1.9). In un lavoro più
recente dello stesso gruppo è stata inoltre proposta l’esistenza di microdomini
lipidici
contenti
proteine
residenti
nell’ER
all’interno
del
reticolo
sarcoplasmatico, indicando che probabilmente si tratta di un sistema di
membrane continuo (Kaakinen et al., 2008).
Tuttavia l’organizzazione e i rapporti tra questi due compartimenti non
sono ancora chiari; in particolare non è noto come le proteine del RS una
volta prodotte nell’ER raggiungano la loro localizzazione definitiva nelle
regioni specializzate dell’SR, e più in generale come sia organizzato il
trasporto di membrana tra il reticolo endoplasmatico e l’apparato di Golgi
nelle fibre muscolari scheletriche. Questo argomento sarà ripreso in uno dei
paragrafi successivi.
17
Proteine tipiche del
reticolo endoplasmatico
ruvido
Proteine tipiche del
reticolo endoplasmatico
di transizione
Fig. 1.9 Rappresentazione schematica della distribuzione delle proteine
tipiche del reticolo endoplasmatico all’interno del reticolo sarcoplasmatico.
(adattata da Kaisto e Metsikkö, 2003).
1.6 Localizzazione dell’apparato di Golgi nella fibra muscolare
L’apparato di Golgi nelle cellule eucariotiche è composto da membrane
che formano una serie di cisterne appiattite impilate l’una sull’altra in una
struttura relativamente compatta che svolge un ruolo centrale nel traffico
cellulare. Il Golgi viene suddiviso in 3 regioni: il cis-Golgi più vicino al reticolo
endoplasmatico, il medial-Golgi centrale e il trans-Golgi posto dal lato della
membrana plasmatica. Nelle cellule muscolari indifferenziate, i mioblasti, il
Golgi presenta ancora questa forma compatta, ma con il procedere del
differenziamento, e quindi con la fusione dei diversi mioblasti, assume una
conformazione peculiare delle cellule muscolari. Infatti il Golgi da compatto
assume l’aspetto di una struttura frammentata che si dispone intorno al
INTRODUZIONE
___________________________
nucleo e che con il progredire del differenziamento comincia a disporsi anche
lungo i miotubi (Lu et al., 2001).
In una fibra muscolare adulta queste strutture frammentate si riducono di
dimensioni andando a costituire delle strutture puntiformi che si
distribuiscono in modo differente nella fibra di tipo veloce e in quella di tipo
lento. Nelle fibre a composizione lenta, come il soleo, l’apparato di Golgi si
dispone in strutture puntiformi lungo il perimetro dei nuclei e in file
distribuite lungo l’intera fibra; nelle fibre veloci occupa invece i poli del
nucleo e si distribuisce in modo più casuale lungo la fibra formando delle file
più corte contenenti da 1 a 3 strutture puntiformi (fig. 1.10); le fibre a
composizione intermedia mostrano una distribuzione del Golgi che presenta
entrambe le disposizioni (Ralston et al., 1999).
Fig 1.10 Apparato di Golgi in una fibra di tipo lento (riquadri a sinistra) e in
una ti tipo veloce (riquadri a destra). I due riquadri superiori rappresentano la
superficie della fibra. La scala colorata nei due riquadri inferiori indica i diversi piani
a cui sono state acquisite le immagini: il rosso indica la superficie, il blu la sezione
più interna della fibra. (da Ralston E. et al., 1999).
L’uso della microscopia elettronica ha evidenziato la presenza di piccoli
apparati del Golgi composti da tre o quattro cisterne impilate distribuiti lungo
l’intera fibra, corrispondenti alle strutture puntiformi osservate con
immunofluorescenza.
19
INTRODUZIONE
___________________________
La diversa distribuzione dell’apparato di Golgi nei diversi tipi di fibre
sembra dovuta alla diversa attività neurale imposta dal motoneurone. Le
proprietà delle fibre lente e veloci sono infatti in parte il risultato
dell’innervazione: l’innervazione di una fibra lenta con un impulso tipico di un
motoneurone veloce comporta la trasformazione della fibra da lenta a veloce
e viceversa (Pette, 2001). L’applicazione di uno stimolo opposto a quello
proprio della fibra comporta anche una riorganizzazione della distribuzione
del Golgi: ad esempio una fibra veloce denervata e stimolata con un impulso
lento assumerà una distribuzione del Golgi tipico di una fibra lenta (Ralston et
al., 2001).
1.7 Il traffico vescicolare nelle cellule mononucleate
I processi di secrezione e di endocitosi sono meccanismi complessi che
procedono attraverso diversi stadi quali la formazione di vescicole di
trasporto contenenti molecole cargo specifiche, il loro trasporto e la loro
fusione ad una membrana bersaglio specifica.
Il processo endocitotico permette l’ingresso di macromolecole dall’esterno
della cellula attraverso la membrana plasmatica mediante la formazione di
vescicole spesso rivestite di clatrina contenenti recettori specifici per le
macromolecole che devono essere inglobate nella cellula; in questo modo si
viene a creare un sistema molto selettivo di internalizzazione cellulare. Una
parte di queste macromolecole viene degradata nei lisosomi passando prima
per gli endosomi precoci e poi tardivi, due compartimenti di membrana che
fungono da sedi di smistamento. Negli endosomi precoci avviene anche il
riciclaggio dei recettori della membrana plasmatica mediante un trasporto
vescicolare.
Nella via biosintetica-secretoria le proteine sono smistate nella cellula e
secrete attraverso il passaggio dall’ER all’apparato di Golgi fino alla
membrana plasmatica mediante vescicole di trasporto che continuamente
20
INTRODUZIONE
___________________________
gemmano e si fondono con le diverse membrane interessate (fig. 1.11). Il
flusso di membrana tra i diversi compartimenti è costantemente bilanciato
con vie di recupero nella direzione opposta, portando membrane e proteine
specifiche al compartimento d’origine (Alberts et al., 2004).
Le proteine neo-sintetizzate, solubili e di membrana, entrano in questa via
passando dal reticolo endoplasmatico ruvido che rappresenta il primo
compartimento ad essere coinvolto nella via biosintetica-secretoria. Le
proteine destinate ad altre sedi della cellula passano poi nel reticolo
endoplasmatico liscio, così chiamato perché privo di ribosomi, dove avviene
l’esportazione verso l’apparato di Golgi. La fuoriuscita delle proteine avviene
in zone specializzate del reticolo liscio dette siti d’uscita dall’ER (ER Exit
Sites o ERES) o reticolo endoplasmatico di transizione. Qui le proteine
vengono selettivamente immagazzinate in vescicole di trasporto rivestite dal
complesso molecolare COPII in modo diretto (per quanto riguarda le
proteine di membrana) o indirettamente (come nel caso di proteine solubili)
mediante l’interazione con specifici recettori transmembrana come ad
esempio la proteina ERGIC53 (Derby and Gleeson, 2007).
Fig 1.11
Schematizzazione del pathway biosintetico-secretorio ed
endocitotico che avviene tra il reticolo endoplasmatico e la membrana
plasmatica. (da http:// 219.221.20061/ywwy/zbsw(E)/edetail7.htm)
21
INTRODUZIONE
___________________________
Questo rappresenta il modello classico di formazione e trasporto delle
vescicole secretorie. Inoltre è stato visto che le molecole di grandi dimensioni,
come ad esempio il procollagene, gemmano dall’ER mediante la formazione
di strutture tubulari e non di vescicole (Mironov et al., 2003), in modo
indipendente dal rivestimento COPII.
Il traffico vescicolare tra il reticolo endoplasmatico e l’apparato di Golgi
(early secretory pathway) ha inizio quindi con la formazione delle vescicole di
trasporto rivestite da COPII, complesso che oltre a selezionare le proteine
che devono essere trasportate fuori dall’ER, contribuisce alla deformazione
della membrana indispensabile per la formazione delle vescicole stesse.
COPII rappresenta un complesso molecolare costituito da 5 sub-unità
proteiche: Sar1, Sec23, Sec24, Sec13 e Sec31. L’assemblaggio di COPII ha
inizio quando Sec12, una proteina che svolge la funzione di fattore di scambio
del nucleotide guanilico (GEF), converte Sar1 (una proteina G facente parte
della famiglia delle proteine ARF) dalla forma legata a GDP a quella legata a
GTP; questa reazione permette il legame di Sar1-GTP alla membrana dell’ER
(Barlowe et al., 1994). A questo punto Sar1 permette il reclutamento di altre
due proteine del complesso: l’eterodimero Sec23/Sec24 portando alla
formazione del complesso di “pre-budding”. Tale complesso è già in grado di
reclutare le proteine cargo nella zona di formazione delle vescicole (Kuehn et
al., 1998). Successivamente si ha il reclutamento di un altro eterodimero
formato dalle proteine Sec13/Sec31 che comporta la polimerizzazione del
rivestimento e la deformazione della membrana (Matsuoka et al., 1998),
(fig.1.12).
Per quanto riguarda il reclutamento delle proteine cargo, sembra che tale
processo sia dovuto principalmente alla sub-unità Sec24. Questa sembra
essere presente come isoforme multiple (tre in lievito e quattro negli eucarioti
superiori) e questo probabilmente aumenta la varietà di cargo che possono
essere esportati dall’ER. Quello che si è visto è che Sec24 è in grado di
riconoscere domini di sequenza specifici presenti all’estremità C-terminale
delle proteine transmembrana che devono uscire dall’ER. Sono state
22
INTRODUZIONE
___________________________
identificate tre tipologie di domini: uno è il motivo di-acidico Asp-X-Glu,
l’altro è formato da due ingombranti residui idrofobici ed è per questo
identificato come motivo di-idrofobico (Barlowe, 2003). La terza classe invece
è rappresentata dai domini di-basici che sono localizzati in prossimità del
dominio transmembrana e che sembrano interagire direttamente con la subunità Sar1 invece che con Sec24 (Giraudo and Maccioni, 2003).
Fig 1.12 Schematizzione della formazione delle vescicole rivestite dal
complesso molecolare COPII a livello dei siti di uscita dall’ER. (da Mancias
J.D. and Goldberg J., 2005)
Esistono anche numerose proteine solubili che sono efficientemente
esportate fuori dall’ER ma che non prendono contatto diretto con le proteine
di COPII. Sono stati elaborati due modelli, che non si escludono l’un l’altro,
per spiegare il reclutamento di tali proteine: uno di questi è il modello di
esportazione mediato da recettori in cui diverse proteine transmembrana,
presenti nella membrana della vescicola ricoperta da COPII in formazione,
riconoscono e quindi concentrano le proteine solubili a livello di questi siti di
esportazione. Tali proteine recettrici sono state identificate in ERGIC53, p24
o Erv29p in lievito (Tang et al., 2005). Il secondo modello, detto ”bulk flow”,
23
INTRODUZIONE
___________________________
rappresenta invece un processo passivo cioè un trasporto continuo in cui le
proteine non hanno bisogno di un segnale di riconoscimento per i recettori
per essere inglobate nella vescicola. Questo rappresenta un trasporto “per
default” e presuppone che la concentrazione di queste proteine sia simile tra i
siti di uscita dall’ER e il resto del lume endoplasmatico (Barlowe, 2003).
Una volta gemmate dall’ER, le vescicole di trasporto si fondono prima di
raggiungere l’apparato di Golgi formando delle strutture tubulari (“vesicular
tubular cluster” o VTC) che formano il compartimento intermedio (ERGIC),
posto tra gli ERES e il Golgi, che manca negli eucarioti inferiori come i lieviti
(fig. 1.13).
Fig. 1.13 Schematizzazione dell’early secretory pathway che avviene tra l’ER,
l’ERGIC e l’apparato di Golgi. (da http://mcb.berkeley.edu/labs/schekman)
Il compartimento intermedio rappresenta una stazione di smistamento per
le proteine derivanti dall’ER che da qui o vengono trasportate al Golgi
mediante il traffico anterogrado, o vengono riportate indietro mediante il
traffico retrogrado (Appenzeller-Herzog and Hauri, 2006). Il traffico
retrogrado che avviene nell’ERGIC è mediato da vescicole di trasporto
rivestite dal complesso COPI. Tale complesso è formato da 7 sub-unità (α, β,
24
INTRODUZIONE
___________________________
γ, δ, β’, ε, ζ-COP) il cui assemblaggio è controllato da Arf1, una piccola
GTPasi della superfamiglia delle proteine Ras. Quando la sub-unità Sec7 del
fattore di scambio del nucleotide guanilico GBF1 catalizza lo scambio del
GDP con il GTP, Arf1-GTP subisce un cambiamento conformazionale che
lo lega in modo più saldo alla membrana e recluta le diverse sub-unità di
COPI. Arf1 legato al GDP si trova infatti già ancorato alla membrana
mediante il dimero p23/p24 e p24 svolge anche la funzione di aiutare la
polimerizzazione del rivestimento e la successiva deformazione della
membrana (fig 1.14).
Fig 1.14 Schematizzione della formazione delle vescicole rivestite dal
complesso molecolare COPI nel traffico retrogrado (da Beck R. et al., 2009).
Per quanto riguarda il trasporto anterogrado, il ruolo di COPI non è stato
ancora completamente chiarito. COPI ha sicuramente un ruolo importante
nel traffico retrogrado sia dall’ERGIC e dal Golgi all’ER sia tra le diverse
cisterne del Golgi.
Il traffico retrogrado rappresenta una via di recupero per le proteine
residenti nell’ER, ma anche per tutte quelle proteine importanti per la
gemmazione delle vescicole che devono essere necessariamente restituite al
25
INTRODUZIONE
___________________________
reticolo endoplasmatico. Generalmente queste proteine contengono delle
sequenze di riconoscimento indispensabili per il loro impacchettamento nelle
vescicole COPI e quindi per il loro ritorno nell’ER. Per esempio, per quanto
riguarda le proteine solubili coinvolte nel folding o nell’assemblaggio proteico,
è stato visto che molte sono caratterizzate dalla presenza di una sequenza di
ritenzione all’estremità C-terminale, KDEL, responsabile del recupero delle
proteine che devono tornare all’ER. Grazie a questa sequenza le proteine si
legano a recettori specifici posti sia a livello dell’ERGIC che dell’apparato di
Golgi, che interagendo con COPI permettono la loro cattura e il loro ritorno
al reticolo endoplasmatico. Molte proteine di membrana residenti nell’ER
contengono invece la sequenza KKXX all’estremità C-terminale che le lega
direttamente
al
complesso
COPI
e
vengono
quindi
prontamente
impacchettate all’interno delle vescicole (Beck et al., 2009).
Alcune proteine che sono prive di tali motivi (come la Shiga toxin)
vengono trasportate mediante il traffico retrogrado COPI-indipendente. Le
informazioni riguardo alla macchina molecolare che opera in questo traffico
sono molto poche, quello che è noto è che sembra essere coinvolta la Rab6
(White, 1999).
Oltre che una stazione di smistamento, il compartimento dell’ERGIC
sembra importante anche nel controllare la qualità delle proteine secretorie,
essendo caratterizzato dalla presenza di diverse proteine chaperon (Breuza et
al., 2004): quindi probabilmente le proteine con conformazione errata
potranno essere ri-inviate all’ER mediante il traffico retrogrado, per poi essere
degradate dal sistema di degradazione associato all’ER (Appenzeller-Herzog
and Hauri, 2006).
Il traffico vescicolare sia retrogrado che anterogrado tra il reticolo
endoplasmatico e l’apparato di Golgi avviene lungo i microtubuli del
citoscheletro e con un meccanismo dipendente dall’interazione tra due
proteine motrici: la dineina e la dinactina. La dineina lega i microtubuli,
mentre è stato visto che la dinactina è in grado di legarsi al rivestimento
26
INTRODUZIONE
___________________________
vescicolare COPII (Watson et al., 2005), COPI (Chen et al., 2005) e al
compartimento intermedio (Roghi and Allan, 1999).
Altro aspetto importante del traffico vescicolare è rappresentato
dall’abilità delle vescicole di trasporto di legarsi e poi fondersi con il
compartimento cellulare di destinazione. Il riconoscimento e quindi il legame
tra le diverse membrane interessate avviene grazie a tre classi proteiche: le
proteine di “tethering”, le proteine SNARE e le Rab GTPasi.
Le prime sono proteine che formano ponti tra una determinata vescicola e
la sua specifica membrana target prima della fusione, permettendo quindi il
riconoscimento. Sembra tuttavia che svolgano anche altre funzioni come
l’assemblaggio del complesso SNARE, la selezione del cargo, l’attacco al
citoscheletro e l’assemblaggio dei complessi di rivestimento vescicolare
(Lupashin and Sztul, 2005,) come per il fattore di tethering p115 che controlla
il traffico tra ER e Golgi a livello di diversi siti: durante la formazione delle
vescicole COPII, a livello dell’ERGIC e del Golgi (Appenzeller-Herzog and
Hauri, 2006).
Le proteine SNARE, oltre a fornire una specificità di legame, permettono
il contatto fisico tra le due membrane che devono fondersi. Queste proteine si
suddividono in v-SNARE poste sulla membrana della vescicola e in t-SNARE
presenti invece sulla membrana bersaglio. Il loro legame specifico porta alla
formazione di complessi stabili che bloccano insieme le due membrane e ne
permettono la successiva fusione (Hong, 2005), (fig. 1.15).
Le Rab GTPasi fanno parte della superfamiglia delle proteine RAS e
hanno la funzione di reclutare sulle membrane numerose proteine effettrici
coinvolte in diverse funzioni del traffico vescicolare come la gemmazione
delle vescicole, il loro trasporto, il riconoscimento e la fusione con le
membrane accettrici. Si tratta di proteine che nello stato legante il GDP sono
libere nel citosol e inattive grazie al legame con le proteine GDI (GDPdissociation inhibitor) che inibisce la dissociazione del GDP. La dissociazione
del GDI dalla proteina Rab è catalizzata dal GDI-displacement factor (GDF)
che permette il legame della Rab alla membrana.Una volta legata, la Rab passa
27
INTRODUZIONE
___________________________
nella sua forma attiva legante il GTP grazie ad un fattore di scambio del
nucleotide guanilico (GEF) ed è ora in grado di legare la specifica proteina
effettrice (fig. 1.15). La Rab torna nel suo stato inattivo legante il GDP grazie
all’azione di una proteina GAP che catalizza l’idrolisi del GTP (Grosshans et
al., 2006).
Fig. 1.15 Rappresentazione schematica del ciclo delle proteine SNARE e
delle Rab GTPasi. (da Alberts B. et al., 2004).
1.8 Il traffico vescicolare nel muscolo scheletrico
Il differenziamento miogenico dei mioblasti in fibre muscolari adulte
comporta una massiccia riorganizzazione nella distribuzione degli organelli
cellulari e la comparsa di nuove strutture cellulari, come il reticolo
sarcoplasmatico. In questa profonda riorganizzazione anche il traffico
vescicolare subisce delle modificazioni nel muscolo, rispetto alle cellule
mononucleate. Ad oggi non è ancora completamente chiarito come le
proteine tipiche del reticolo sarcoplasmatico raggiungano la loro sede
28
INTRODUZIONE
___________________________
definitiva dopo esser state prodotte all’interno del reticolo endoplasmatico, e
come sia localizzato il reticolo endoplasmico “canonico” all’interno del RS.
Questo aspetto è stato in parte analizzato in un lavoro di Rahkila e colleghi
(1997) nel quale è stata studiata la localizzazione di diverse proteine coinvolte
nel traffico vescicolare tra ER e Golgi nelle fibre muscolari scheletriche di
ratto. Esperimenti di immunofluorescenza con anticorpi diretti contro la
proteina p58 (omologa alla proteina ERGIC53 umana), un marcatore del
compartimento intermedio, hanno evidenziato una distribuzione perinucleare,
un’evidente striatura longitudinale e un bandeggio trasversale che occupa
l’intera banda I. L’uso di anticorpi diretti contro la Rab1, coinvolta nel traffico
tra l’ER e l’apparato di Golgi, ha evidenziato una distribuzione simile a quella
di p58. In un lavoro precedente dello stesso gruppo è stato visto che anche βCOP, una delle sub-unità di COPI, che è localizzata nell’apparato di Golgi e
che partecipa al traffico retrogrado tra quest’ultimo e l’ER, nel muscolo è
presente nella regione perinucleare, bandeggia a livello della banda I ed ha una
striatura longitudinale spesso caratterizzata da strutture puntiformi più intense
presumibilmente riconducibili ai gruppi di cisterne del Golgi. La distribuzione
dei diversi compartimenti coinvolti nel traffico vescicolare tra ER e Golgi è
stata verificata anche grazie all’analisi del traffico della proteina G, prodotta
dal virus della stomatite vescicolare (VSV), nella sua forma mutata
temperatura-sensibile tsO45, il cui traffico tra i vari compartmenti può essere
seguito modulando la temperatura. Alla temperatura di 39°C, che non
permette il folding della proteina G, questa si trova bloccata nell’ER ruvido a
livello della giunzione tra la banda A e la banda I; quando la temperatura
viene abbassata a 32°C, temperatura permissiva per il folding della proteina, e
la gemmazione delle vescicole bloccata con il dinitrofenolo, questa localizza
negli ER exit sites distribuendosi sia a livello della linea Z che nella regione
perinucleare. Se la temperatura viene portata a 20°C la proteina viene
trasportata all’apparato di Golgi andando a localizzarsi nella regione
perinucleare e in strutture puntiformi lungo la fibra (Rahkila et al., 1996). Con
esperimenti di doppia marcatura è emerso che le strutture longitudinali di p58
29
INTRODUZIONE
___________________________
e Rab1 seguono il corso dei microtubuli, così come anche il marcatore del cisGolgi GM130 evidenzia delle strutture puntiformi che colocalizzano con i
microtubuli longitudinali. Anche il traffico retrogrado sembra sia associato ai
microtubuli in quanto il trattamento con brefeldina A (che comporta la
ridistribuzione delle proteine del Golgi all’ER) delle fibre infettate con il VSV,
comporta il ritorno della proteina G dal Golgi all’ER, con una distribuzione
che segue quella dei microtubuli. Sembra quindi che il traffico vescicolare tra
ER/RS e l’apparato di Golgi avvenga nella fibra muscolare, come nelle cellule
mononucleate, lungo i microtubuli (Rahkila et al., 1997).
In un altro lavoro, effettuato su fibre di muscolo scheletrico e in cellule
mioblastiche, è stato visto che per un corretto targeting della calsequestrina
nelle cisterne terminali del RS c’è bisogno di un’attiva uscita dall’ER,
probabilmente mediata dalla gemmazione di vescicole rivestite di COPII:
sembra quindi ci sia bisogno di un trasporto mediato da vescicole per il
sorting della calsequestrina. Inoltre, poiché la distruzione del Golgi non
comporta un’alterazione della localizzazione di questa proteina nel RS, è stato
ipotizzato che molto probabilmente questo apparato non è coinvolto nel
targeting della calsequestrina (Nori et al, 2004).
Molte proteine sono mantenute all’interno del lume del reticolo
sarco/endoplasmatico mediante la sequenza KDEL, ma molte proteine del
RS, tra le quali la calsequestrina, non contengono questo segnale di ritenzione.
E’ stato ipotizzato che tale proteina sia mantenuta all’interno del reticolo
grazie alla sua capacità di polimerizzazione, che rappresenterebbe quindi un
meccanismo di ritenzione (Gatti et al., 2001; Houle et al., 2006).
Un’altra proteina residente nel reticolo sarcoplasmatico che non presenta
nessuna sequenza caratteristica di ritenzione è la pompa del calcio ATPasica
SERCA. In un lavoro di Newton e colleghi è stata dimostrata la presenza,
all’interno dell’isoforma SERCA1, di due motivi transmembrana (M1 e M2)
all’interno della regione N-terminale che svolgono il ruolo di segnali di
recupero. Infatti la ritenzione della proteina nel reticolo sarcoplasmatico non
è assoluta, in quanto è stato visto che una buona parte della proteina si ritrova
30
INTRODUZIONE
___________________________
anche nell’ERGIC, ma non prosegue il suo cammino lungo il pathway di
secrezione, ed infatti non raggiunge il trans-Golgi (Newton et al., 2003).
Sembra quindi che SERCA1 sia mantenuta nel RS tramite un processo di
recupero dall’ERGIC, come ipotizzato anche per altre due proteine di
membrana residenti nel reticolo sarcoplasmatico, il fosfolambano e la
sarcolipina. (Butler et al., 2007).
1.9 La famiglia di proteine Yip in lievito
La famiglia di proteine Yip rappresenta un insieme di piccole proteine di
membrana, capaci di interagire con le proteine Rab e con gli altri membri della
famiglia Yip stessa, che si sono conservate durante l’evoluzione; infatti le
ritroviamo in tutti gli organismi eucarioti, dai lieviti alle piante fino agli animali
più evoluti come i mammiferi. Il primo membro della famiglia ad essere stato
identificato è Yip1p di lievito quale interattore delle Rab GTPasi Ypt1p e
Ypt31p (Yang et al., 1998). Successivamente sono stati individuati altri
membri di questa famiglia: Yip2p o Yop1p (Calero et al., 2001), Yip3p (Calero
and Collins, 2002), Yip4p e Yip5p (Calero et al., 2002) e Yif1p che forma un
complesso con Yip1p (Matern et al., 2000) (fig. 1.16).
Fig. 1.16 Membri della famiglia di proteine YIP in lievito. (Adattata da
Pfeffer e Aivazian, 2004).
31
INTRODUZIONE
___________________________
Si tratta di proteine caratterizzate da un’estremità N-terminale idrofilica,
probabilmente sufficiente per il legame con le Rab GTPasi, seguita da 4-5
regioni idrofobiche molto conservate, che rappresentano i domini
transmembrana (Shakoori et al., 2003).
Yip1p rappresenta il membro della famiglia fin’ora meglio studiato. Si
localizza a livello dell’apparato di Golgi, e poichè è in grado di legarsi alle Rab
GTPasi coinvolte nel traffico tra l’ER e l’apparato di Golgi, probabilmente è
richiesta per il trasporto vescicolare a livello dell’early secretory pathway.
Infatti in un lavoro di Barrowman e colleghi (2003), è stato visto che anticorpi
diretti contro Yip1p o Yif1p, che formano un complesso, bloccano il
trasporto vescicolare verso l’apparato di Golgi, ma questo effetto non si
presenta se gli anticorpi sono aggiunti dopo la formazione delle vescicole. Gli
autori di questo lavoro hanno quindi concluso che il complesso Yip1p-Yif1p
è richiesto per produrre vescicole secretorie competenti per la fusione con
l’apparato di Golgi. In un altro lavoro, è stato visto che anticorpi diretti
contro Yip1p non permettono la gemmazione dall’ER delle vescicole rivestite
da COPII, ma non ostacolano la fusione di queste con l’apparato di Golgi
(Heidtman et al., 2003). Tale risultato è in parte contrastante con quello del
lavoro precedente, ma può essere spiegato con l’ipotesi che altri membri della
famiglia possono svolgere la stessa funzione di Yip1p e Yif1p. Il complesso
Yip1p-Yif1p ha anche un terzo interattore: Yos1p, una proteina di membrana
che si localizza a livello del reticolo endoplasmatico, dell’apparato di Golgi e
delle vescicole di trasporto ricoperte da COPII, distribuzione che ha fatto
quindi ipotizzare un suo coinvolgimento nel traffico tra ER e apparato di
Golgi; questa ipotesi è sostenuta anche dal fatto che il silenziamento di Yos1p
comporta difetti nella secrezione caratteristici del blocco del trasporto tra
questi due compartimenti (Heidtman et al., 2005).
La capacità di Yip1p-Yif1p di interagire con due proteine Rab ha portato
ad ipotizzare un possibile ruolo di questo complesso come GDF (GDI
displacement factor), che permette la dissociazione del GDI dalla proteina
Rab e il legame della Rab alla membrana. Questa ipotesi è stata incoraggiata
32
INTRODUZIONE
___________________________
dalla scoperta che la proteina umana PRA1, omologa alla Yip3p di lievito, è in
grado di dissociare il complesso Rab9-GDI per il reclutamento della Rab9
sulla membrana degli endosomi (Sivars et al., 2003); Yip3p però agisce a livello
del trans-Golgi e ha una limitata omologia con la sequenza di Yip1p o Yip1f.
In un lavoro di Chen e colleghi è stato visto che una serie di proteine Rab che
agiscono a livello dell’apparato di Golgi, sono necessarie per lo svolgimento
delle funzioni di Yip1p e mutazioni di Yip1p diminuiscono la capacità di
interazione con le Rab. Gli autori hanno quindi ipotizzato un modello che
vede Yip1p agire in un pathway comune che coinvolge sia COPII che le Rab,
quest’ultime necessarie in una fase successiva alla gemmazione vescicolare,
(Chen et al., 2004). La Rab1 oltre ad avere un ruolo nella fusione delle
vescicole COPII con l’apparato di Golgi (Cao and Barlowe, 2000) sembra sia
coinvolta anche nella fusione delle vescicole COPI con il reticolo
endoplasmatico, e quindi nel traffico retrogrado tra l’apparato di Golgi e l’ER
(Kamena et al., 2008). Un ruolo simile del suo interattore Yip1p non è stato
però ancora dimostrato, ma evidenze del coinvolgimento del suo omologo di
mammifero, Yip1A, nel traffico retrogrado derivano da un lavoro recente di
Kano e colleghi, che verrà preso in esame nel paragrafo successivo.
Nonostante le numerose informazioni riguardanti la famiglia di proteine
Yip di lievito raccolte in questi ultimi anni, il loro ruolo nel trasporto
vescicolare non è ancora chiaro e ulteriori studi saranno necessari per
chiarirne la funzione.
1.10 La famiglia di proteine YIP nei mammiferi
La famiglia di proteine YIP nei mammiferi è composta da un numero
maggiore di proteine, 16 nell’uomo e 14 nel topo, e la maggior parte di esse ha
un’espressione ubiquitaria, ma la loro funzione è per lo più sconosciuta
(fig.1.17). Ad esse, nel lavoro di Shakoori e colleghi (2003), è stato attribuito
anche il nome di FinGERs, “Five-pass transmembrane proteins localizing in
33
INTRODUZIONE
___________________________
the Golgi apparatus and in the ER”, in quanto colocalizzano con il marcatore
del cis-Golgi GM130 e alcune mostrano una distribuzione cellulare simile a
quella dell’ER. In questo lavoro è stato osservato che l’over-espressione di tali
proteine comporta la disgregazione dell’apparato di Golgi, e questo può
avvenire o come diretta conseguenza dell’accumulo della proteina nell’ER,
che quindi comporterebbe un blocco del traffico anterogrado, o come effetto
sul mantenimento della struttura del Golgi dovuto all’alterazione del processo
di riconoscimento e/o fusione delle vescicole con l’apparato di Golgi.
Fig. 1.17 Membri della famiglia di proteine YIP nei mammiferi . (Adattata da
Pfeffer S. and Aivazian D., 2004).
Il componente della famiglia Yip1A (FinGER5 o YIPF5. NCBI Ref Seq
NM_023311) rappresenta l’omologo di mammifero di Yip1p.
Yip1A condivide circa il 31% di omologia nucleotidica con Yip1p ed ha
un’espressione ubiquitaria. Yip1A possiede un’isoforma espressa solo nel
34
INTRODUZIONE
___________________________
muscolo striato, chiamata Yip1B (FinGER9 o YIPF7. NCBI Ref Seq
NM_023784), con la quale condivide circa il 61% di omologia; la regione di
divergenza risiede principalmente all’estremità N-terminale a livello dei primi
80 amminoacidi (fig. 1.18). Entrambe le isoforme sono caratterizzate, come
Yip1p di lievito, da una regione idrofilica all’N-terminale e da una regione Cterminale idrofobica, contenete domini multipli potenzialmente in grado di
attraversare le membrane cellulari. E’ stato dimostrato che Yip1A si localizza
a livello dei siti di uscita dal reticolo endoplasmatico (ERES) ed è in grado di
legare Sec23 e Sec24, che rappresentano due delle sub-unità del complesso
molecolare COPII (Tang et al., 2001). Inoltre è stato riportato che l’overespressione del dominio idrofobico all’N-terminale di Yip1A comporta il
blocco del traffico tra l’ER e l’apparato di Golgi della proteina G del virus
della stomatite vescicolare (VSVG) e causa la frammentazione e la dispersione
dell’apparato di Golgi. Questi risultati fanno presuppore che Yip1A sia
coinvolta nella regolazione del traffico vescicolare tra ER e apparato di Golgi,
a livello degli ERES, come dimostrato per l’omologo di lievito Yip1p.
Fig. 1.18 Allineamento delle sequenze amminoacidiche di Yip1A e Yip1B di
topo con Yip1p di lievito. (Adattata da Tang B.L. et al., 2001).
Tuttavia in un altro studio è stato riportato che il knockdown di Yip1A o
del suo interattore Yif1A non altera in alcun modo il traffico vescicolare
anterogrado tra ER e Golgi, ma provoca la frammentazione dell’apparato di
35
INTRODUZIONE
___________________________
Golgi in piccoli stacks circondati da numerose strutture vescicolari (Yoshida et
al., 2008). Gli autori hanno invece ipotizzato un ruolo nel traffico retrogrado
tra cis-Golgi ed ERGIC, e tra quest’ultimo e l’ER.
Questa ipotesi è in contrasto con i risultati ottenuti da Tang e colleghi
(2001), ed è in contrasto con quanto visto in lievito; tuttavia in un lavoro
molto recente tale ipotesi è stata riconsiderata, in quanto si è visto che il
silenziamento di Yip1A comporta il rallentamento del trasporto retrogrado
della tossina Shiga, dal Golgi all’ER, e contemporaneamente non altera il
trasporto anterogrado della VSVG. Inoltre la regione N-terminale di Yip1A
inibisce il trasporto retrogrado COPI-indipendente, ma non quello COPIdipendente
o
quello
anterogrado
(Kano
et
al.,
2009).
36
2 Scopo della tesi
Il sistema di membrane interne delle cellule del muscolo scheletrico, che
comprende il reticolo endo/sarcoplasmatico, i tubuli T e l’apparato di Golgi,
presenta una precisa organizzazione spaziale rispetto al sarcomero. All’interno del
reticolo endo/sarcoplasmatico, il reticolo endoplasmatico “di transizione” è
localizzato a livello del disco Z, in strutture puntiformi lungo la fibra e nella
regione perinucleare, il reticolo endoplasmatico canonico è localizzato nell’intera
banda I e nella giunzione A-I (dove si trovano le triadi), mentre l’apparato di
Golgi si presenta distribuito in strutture puntiformi lungo la fibra e intorno ai
nuclei.
I meccanismi molecolari alla base dell’organizzazione spaziale e funzionale di
questo complesso sistema di membrane interne della fibra muscolare, non sono
ancora molto conosciuti.
Allo scopo di identificare nuovi geni coinvolti nello sviluppo e nel
mantenimento di quest’organizzazione di membrane nel muscolo striato, è stato
avviato uno studio, che si è servito di un approccio bioinformatico, per
l’identificazione di nuovi geni preferenzialmente espressi nel muscolo striato e
codificanti per proteine contenenti almeno un dominio idrofobico in grado di
ancorarle alle membrane interne.
L’attenzione è stata rivolta ad uno di questi geni identificati: Yip1B. Questo
gene codifica per una proteina omologa alla proteina Yip1p di lievito che sembra
coinvolta nel “early secretory pathway”. Nei mammiferi sono presenti due
isoforme, chiamate Yip1A e Yip1B, la cui localizzazione e funzione sono poco
note.
Lo scopo di questa tesi è stato quello di caratterizzare l’isoforma muscolospecifica Yip1B, attraverso lo studio della sua espressione e localizzazione in
cellule miogeniche e nel tessuto muscolare scheletrico, sia nella fase adulta che
durante lo sviluppo, grazie all’uso di un anticorpo policlonale specifico prodotto
in laboratorio, utilizzato in esperimenti di immunofluorescenza e in Western blot.
SCOPO DELLA TESI
___________________________
Questi esperimenti hanno mostrato che l’isoforma Yip1B è muscolo-specifica ed
è localizzata in parziale sovrapposizione al marcatore del cis-Golgi GM130.
Sono state inoltre effettuate delle Real-Time PCR per lo studio dell’espressione
in diversi tessuti e durante lo sviluppo muscolare di entrambe le isoforme di Yip1.
Questi esperimenti hanno mostrato che l’isoforma Yip1B inizia ad essere espressa
intorno al 16° giorno di vita embrionale del topo, ed aumenta la sua espressione
fino all’età adulta, mentre l’isoforma Yip1A ha un andamento opposto.
Allo scopo di comprendere il ruolo svolto dalla Yip1B nel tessuto muscolare
scheletrico sono stati infine effettuati esperimenti di tipo funzionale. In particolare
è stato indagato l’effetto dell’over-espressione di diverse porzioni della proteina
Yip1 e sono stati effettuati esperimenti di RNA-interference allo scopo di studiare
l’effetto del silenziamento dell’isoforma Yip1B.
38
3.Materiali e metodi
3.1 Colture cellulari
Le cellule sono state coltivate utilizzando materiali e soluzioni sterili e
lavorando sotto una cappa a flusso laminare. Le cellule sono state coltivate in
piastre petri di diverse dimensioni, in un incubatore alla temperatura di 37° C con
CO2 al 5%.
Le cellule sono state allargate staccandole dalla piastra utilizzando una
soluzione di Tripsina-EDTA (0.05% Tripsina, 0.53 mM EDTA, Invitrogen), e
mantenute in coltura in terreni di coltura diversi a seconda della linea cellulare
utilizzata.
La linea cellulare NIH-3T3 (fibroblasti di topo) è stata coltivata in DMEM
(Dulbecco’s modified Eagle’s medium) con aggiunta di glutammina 2 mM,
streptomicina 100μg/ml, penicillina 100U/ml, sodio-piruvato 1mM, 10% siero
fetale bovino (FBS). Le cellule sono state fatte crescere fino ad una confluenza di
circa l’80%, poi staccate con tripsina-EDTA con un trattamento a 37° C per circa
5 minuti, risospese in terreno completo, contate in camera di Burker e infine
piastrate. Per gli esperimenti d’immunofluorescenza le cellule sono state piastrate
direttamente su vetrini posizionati nella piastra di coltura.
La linea cellulare C2C12 (mioblasti di topo) è stata coltivata nello stesso
terreno di coltura utilizzato per la linea NIH-3T3 (DMEM completo con 10%
FBS). Per il differenziamento in miotubi, al DMEM è stato aggiunto 2% di siero
di cavallo. Per esperimenti d’immunofluorescenza, le cellule sono state piastrate su
vetrini ricoperti di gelatina animale al 2% disciolta in PBS 1x (Phosfate Buffer
Solution 10x: NaCl 137 mM, KCl 2.7 mM, Na2HPO4/KH2PO4 10mM, pH 7.4).
3.1.1 Miociti primari
I miociti primari di ratto e di topo sono stati prelevati dagli arti posteriori di
animali sacrificati a tre giorni di vita poiché garantiscono una resa maggiore di
MATERIALI E METODI
___________________________
cellule satelliti. Gli arti posteriori sono stati privati della pelle e lavati in PBS. Il
tessuto è stato sminuzzato, trasferito in provette da 50 ml, lavato con PBS e
lasciato sedimentare a 37° C. Il sedimento è stato lavato con nuovo PBS, e
l’operazione ripetuta più volte finchè il tampone non è apparso limpido. Al fine di
isolare le singole cellule è stata effettuata un’incubazione a 37° C con tripsina allo
0,25% per 5 minuti. Il sovranatante ottenuto dalla prima tripsinizzazione è stato
scartato. Successivamente sono state effettuate tre incubazioni in tripsina di 15
minuti ciascuna durante le quali il campione è stato agitato mediante vortex ogni 3
minuti, per favorire la disgregazione meccanica del tessuto. I campioni sono stati
poi centrifugati per 10 minuti a 1000 g a temperatura ambiente. Il sovranatante è
stato trasferito in provette da 50 ml contenenti 5 ml di terreno DMEM completo
con 10% di FBS e poi filtrato attraverso due strati di garza sterile. La sospensione
cellulare è stata poi centrifugata per 10 minuti a 1000 g. I pellet cellulari sono stati
trasferiti in un’unica provetta utilizzando una pipetta pasteur di vetro e risospesi in
40 ml di terreno DMEM completo contenente 10% FBS.
La sospensione così ottenuta è costituita da cellule satelliti e da una frazione di
fibroblasti contaminanti. Per eliminare la frazione contaminante è stata effettuato
un pre-piastramento, ponendo la sospensione cellulare a 37° C per 50 minuti in
piastra Petri, per favorire l’adesione dei fibroblasti alla piastra. La frazione di
cellule rimasta in sospensione è stata raccolta in un’unica provetta e centrifugata
per 10 minuti a 1000 g. Il pellet ottenuto è stato risospeso in 20 ml di terreno
DMEM completo con 10% FBS, contato in camera di Burker e piastrato ad una
concentrazione di 80000 cellule per piastra da 35 mm, contenente vetrini ricoperti
di gelatina al 2%. Le cellule sono state fatte moltiplicare per due giorni e poi fatte
differenziare in terreno αMEM completo con aggiunta di dexametasone 0,1 μM,
idrocortisone 50 μM, 10% FBS e 5% HS.
40
MATERIALI E METODI
___________________________
3.2 Esperimenti di immunofluorescenza
Gli anticorpi primari utilizzati negli esperimenti di immunofluorescenza sono:
α-Yip1B prodotto nel presente lavoro (diluizione 1:1000); α-triadina ottenuto dalla
Prof.ssa Isabelle Marty (Grenoble, France) (diluizione 1:10000); α-myc (Clontech,
diluizione 1:500 per immunofluorescenza e 1:1000 per Western blot); α-GM130
(BD Biosciences, diluizione 1:200); α-actinina (Sigma, diluizione 1:2000); αactinina (Sigma, diluizione 1:3000) premarcata mediante il sistema Alexa Fluor
Monoclonal Antibody Labeling Kit (Invitrogen).
Gli anticorpi secondari marcati con Cy-2/Cy-3 sono della Jackson ImmunoR,
mentre quello marcato con Alexa Fluor647 è Invitrogen.
3.2.1 Esperimenti di immunofluorescenza su cellule
Le cellule cresciute sui vetrini sono state lavate due volte con PBS per togliere
il terreno di coltura. Le cellule sono state fissate con una soluzione di PBS
contenente il 3% di paraformaldeide e il 2% di saccarosio per 7 minuti. Poi sono
stati effettuati tre lavaggi veloci in PBS contenente BSA al 0.2% e
successivamente le cellule sono state permeabilizzate con Hepes-Triton buffer
(Hepes 20 mM pH 7.4, saccarosio 300 mM, NaCl 50 mM, MgCl 2 3 mM, TritonX100 0.5%) per 3 minuti. Dopo tre lavaggi in PBS + 0.2% BSA, le cellule sono
state saturate con siero di capra (goat serum 5% in PBS + 0.2% BSA) per circa
un’ora a temperatura ambiente, per impedire legami aspecifici dell’anticorpo. Poi
sono state incubate con l’anticorpo primario diluito in PBS + 0.2% BSA per
qualche ora o per 16 ore, dipendentemente dall’anticorpo utilizzato, in camera
umida a 4°C. Sono stati quindi effettuati tre lavaggi da 10 minuti ciascuno in PBS
+ 0.2% BSA e poi aggiunto l’anticorpo secondario (coniugato con un
fluorocromo) per 1h a temperatura ambiente, al riparo dalla luce. Sono stati di
nuovo effettuati tre lavaggi da 10 minuti ciascuno prima di procedere al
montaggio dei vetrini, utilizzando il montante Mowiol (PBS pH 7.4, Mowiol 20%,
41
MATERIALI E METODI
___________________________
1.4-diazabiciclico-[2,2,2]-ottano DABCO come antifading agent). I vetrini sono stati
conservati al buio a 4° C
3.2.2 Esperimenti di immunofluorescenza su sezioni di tessuto
Il tessuto muscolare di interesse è stato prelevato e fissato su un supporto di
sughero in una goccia di OCT (Tissue Tek OCT) e allungato tramite spilli, poi
immerso in 2-metilbutano raffreddato in azoto liquido (-196° C) e conservato a 80° C. Il campione è stato poi tagliato in sezioni sottili (circa 7-8 μm) tramite un
criostato (CM 1850, Leica) alla temperatura di circa -25° C. Le sezioni sono state
poste su vetrini (Superfrost) e conservate a -80° C. La qualità delle sezioni è stata
controllata tramite colorazione rapida con ematossilina di Herris (Sigma) al
microscopio ottico.
Il protocollo utilizzato per le reazioni di immunofluorescenza su sezioni è
uguale a quello utilizzato per le cellule, con l’unica differenza che lo step di
permeabilizzazione è stato omesso e l’incubazione con l’anticorpo primario è stata
effettuata per 16 ore.
3.2.3 Esperimenti di immunofluorescenza su diaframma
Il diaframma è stato prelevato e fissato in paraformaldeide al 3% e Triton
0.5% per un’ora a temperatura ambiente. Sono stati conservati in PBS 1X a +4°
C. Il protocollo utilizzato per le reazioni di immunofluorescenza sul diaframma è
uguale a quello utilizzato per le cellule, con l’unica differenza che lo step di
permeabilizzazione è stato effettuato contemporaneamente al fissaggio e
l’incubazione con l’anticorpo primario è stata effettuata per 16 ore.
42
MATERIALI E METODI
___________________________
3.2.4 Microscopia confocale
Per
l’osservazione
dei
preparati
ottenuti
mediante
reazioni
di
immunofluorescenza e per l’acquisizione delle immagini è stato utilizzato il
microscopio confocale LSM 510 META (Zeiss) dotato di microscopio a
epifluorescenza invertito Axiovert 200 M, e di tre laser: argon (verde) 40mW con
un laser di eccitazione a 458, 488, 514 nm; HeNe (rosso) a 543 nm; HeNe (rosso
lontano, Cy5 etc.) a 633nm. Le immagini sono state acquisite con un obiettivo 40x
o 63.3x ad immersione, ad una risoluzione 1024x1024 pixels, con una profondità
di immagine di 8 bits, ed elaborate con software Zeiss LSM 510 Image Examiner
e Adobe Photoshop CS4.
3.3 Preparazione di lisati cellulari e di tessuto
3.3.1 Lisati cellulari
Le cellule in coltura sono state lavate due volte in PBS, staccate
meccanicamente (il tutto lavorando in ghiaccio), raccolte risospendendole in PBS
e centrifugate a 9300 g per 10 minuti. Il pellet è stato risospeso in tampone di lisi
RIPA (Tris HCl 50 mM, NaCl 150 mM, Sodio deoxicholato 1%, Triton-X100
1%, SDS 0.1%, NaN3 0.02%) a cui è stato aggiunto l’inibitore delle serin-proteasi
fenilmetilsulfonilfluoruro (PMSF) alla concentrazione finale di 0,1 mM. Le cellule
sono state tenute in ghiaccio durante la lisi, per circa 1 ora, agitando di tanto in
tanto; sono state poi centrifugate a 4° C per togliere i detriti cellulari, e il
sovranatante è stato raccolto e conservato a -80° C.
3.3.2 Lisati di tessuto
I campioni di tessuto muscolare sono stati omogenati con l’omogenizzatore
ultraturax 10 secondi per tre volte in ghiaccio e poi risospesi in buffer di lisi
43
MATERIALI E METODI
___________________________
RIPA+PMSF (come per i lisati cellulari). Il campione è stato poi trasferito in tubo
o in Eppendorf e tenuto circa un’ora in ghiaccio agitando di volta in volta, per poi
essere centrifugato a 4° C per togliere i detriti cellulari. Il sovranatante è stato
raccolto e conservato a -80° C.
3.4 Preparazione di microsomi da cellule e da tessuto
I campioni cellulari sono stati raccolti come descritto per i lisati cellulari
mentre i campioni di tessuto muscolare sono stati tagliati in piccole porzioni
mediante bisturi (lavorando su una piastra petri posta in ghiaccio). A questo punto
sia le cellule che i tessuti sono stati trasferiti in dounce da 7 ml con pestello di tipo
tight contente il tampone di omogenizzazione (HEPES 5 mM pH 7.4, saccarosio
0.32 M e PMSF 0.1 mM) e omogenati con 40 colpi, in ghiaccio. L’omogenato è
stato trasferito in corex da 15 ml e centrifugato a 7000 g per 10 minuti a 4° C. Il
sovranatante è stato trasferito in provette da ultracentrifuga Nalgene e
centrifugato a 100000 g per un’ora a 4° C in ultracentrifuga (Beckam). Il pellet di
microsomi è stato risospeso in un piccolo volume di tampone di
omogenizzazione, aliquotato e conservato a -80° C.
3.5 Quantizzazione proteica con il metodo Bradford
La concentrazione proteica sia dei lisati che dei microsomi è stata valutata con
il metodo Bradford (1976), che consiste in un saggio colorimetrico basato sul
confronto della densità ottica del campione con quella di una quantità nota di una
proteina standard, nel nostro caso la BSA (albumina serica bovina). Sia quattro
concentrazioni scalari note (di solito 1, 3, 5, 9 μg) di proteina standard che un
volume preciso del campione, sono stati sciolti in acqua e reattivo di Bradford
(Coomassie G-250 blu, Biorad) mescolati in un rapporto di 4:1 Il reattivo di
Bradford si lega alle proteine in una forma anionica blu che assorbe a 595 nm. Le
44
MATERIALI E METODI
___________________________
quattro concentrazioni note di BSA sono state utilizzate per costruire una curva di
calibrazione, misurandone l’assorbanza a 595 nm, mediante uno spettrofotometro
(Ultrospec 2100 pro, UV/Visible Spectophotometer, Amersharm Pharmacia
Biotech), sulla quale si basa la quantizzazione della concentrazione proteica del
campione.
3.6 Elettroforesi in gel di poliacrilammide (SDS-PAGE)
Per permettere la separazione di proteine in base al peso molecolare è stata
utilizzata la tecnica SDS-PAGE (sodiumdodecylsulfate-polyacrylamid gel
electrophoresis). Il gel è formato da una parte superiore (stacking gel), che
compatta le proteine e gli pemette di raggiungere contemporaneamente la seconda
parte del gel (running gel) dove le proteine vengono separate, e la cui
concentrazione determina la dimensione dei pori e quindi la differente risoluzione
del gel stesso. I gels sono stati preparati utilizzando Acrilammide:Bis 37,5:1 al 4%
per lo stacking, e al 10 o 12,5% per il running in una soluzione di H 2O, SDS 0,1%,
APS 0,1%,Temed 0,1% e Tris HCl 0,5 M, pH 6,8 per lo stacking gel o Tris HCl 1,5
M, pH 8,8 per il running gel.
I campioni sono stati preparati aggiungendo un’opportuna quantità di acqua e
di tampone Sample Buffer (0.065 M Tris HCl pH 6.8, SDS 2%, Glicerolo 10%, 2mercaptoetanolo 5%, Bromophenol-Blue 0.001%) e poi denaturati a 95° C per 2
minuti. Un pozzetto è caricato con un marker di peso noto (All Blue Precision
Plus Standards, Biorad). La corsa è stata eseguita in tampone di corsa TGS ( Tris
25 mM, Glicina 192 mM, SDS 0.1% pH 8.3) ad un amperaggio costante di 25
mA/gel.
45
MATERIALI E METODI
___________________________
3.7 Western Blot
Le proteine separate mediante elettroforesi sono state trasferite su una
membrana PVDF (Polyvinylidene Difluoride) utilizzando un apposito apparato di
trasferimento (Biorad) contenente il tampone di trasferimento (Tris 0.25%, glicina
1.92 M, SDS 0.01%, metanolo 10%). Il trasferimento è stato effettuato a 400 mA
per un’ora a 4° C oppure per 16 ore a 100 mA. Il gel è stato montato in un
“sandwich” all’interno della cella di trasferimento in cui sono stati posti in ordine:
due spugne, due fogli di carta 3 MM, il gel, la membrana PVDF, due fogli di carta
3 MM e due spugne.
Terminato il trasferimento, la membrana è stata saturata per un’ora in
agitazione a temperatura ambiente in TBS-T (Tris HCl 20 mM ph 7.4, NaCl 150
mM, Tween20 0.05%) con aggiunta di latte in polvere al 5%. E’ stato poi aggiunto
l’anticorpo primario per un’ora in agitazione a temperatura ambiente (se per 16
ore a 4° C). Gli anticorpi utilizzati sono: anti-Yip1B, prodotto nel presente lavoro,
anti-myc (Clontech) e anti PDI (Santa Cruz Biotechnology). Successivamente
sono stati effettuati 3 lavaggi da 10 minuti ciascuno in TBS-T ed è stato aggiunto
l’anticorpo secondario coniugato con la perossidasi di rafano (HRP) (Amersham
Pharmacia) per un’ora in agitazione a temperatura ambiente. Al termine
dell’incubazione sono stati effettuati altre tre lavaggi in TBS-T.
La rivelazione delle bande è stata ottenuta mediante ECL Western Blotting
Detection (Amersham Bioscience) ed esposizione su lastre fotografiche
HYPERFILMTM (Amersham Bioscience), sottoposte a sviluppo e fissaggio con
liquidi fotografici (KODAK) in camera oscura.
3.8 Clonaggi
I cloni utilizzati in questo studio sono riportati sinteticamente in tabella 3.2.
Per il clone Yip1B-Myc la sequenza completa del cDNA (Mus Musculus)
46
MATERIALI E METODI
___________________________
codificante la proteina Yip1B è stata inserita nel vettore di espressione
pcDNA.3.1/myc-His in frame con l’epitopo Myc.
La porzione N-terminale priva di domini transmembrana da base 1 a base 366
del cDNA (Mus Musculus) di Yip1B è stata clonata nel vettore d’espressione
pGEX4T-1 (Amersham Biosciences) per la produzione della proteina di fusione
Yip1B-GST.
I plasmidi ricombinanti Yip1B-N-ter, Yip1B-1-80, Yip1A intera, Yip1A N-ter,
Yip1A 1-80, sono stati creati per inserimento degli inserti corrispondenti nel
vettore pcDNA.3.1/myc-His(-)C con l’epitopo Myc non in frame con la proteina
e quindi non espresso. Gli inserti sono stati ottenuti per PCR, con primers
contenenti i siti di restrizione adatti, partendo dal cDNA (Mus Musculus) delle
proteine Yip1B e Yip1A. In tabella 3.1 è riportata la lunghezza degli inserti
clonati.
Plasmide
cDNA
Inserto
Yip1B-N-ter
Yip1B
..da base 1 a 366
Yip1B-1-80
Yip1B
..da base 1 a 240
Yip1A intera
Yip1A
..da base 1 a 774
Yip1A N-ter
Yip1A
..da base 1 a 378
Yip1A 1-80
Yip1A
..da base 1 a 246
Tab. 3.1 Lunghezza degli inserti ottenuti per PCR
I plasmidi ricombinanti Yip1B-notag e Yip1B-GFP sono stati ottenuti per
digestione enzimatica XhoI/BamHI prelevando l’inserto dal clone Yip1B-Myc.
Per la costruzione del plasmide Yip1B-notag il vettore utilizzato è il
pcDNA.3.1/myc-His(-)C con l’epitopo Myc non in frame con la proteina e quindi
non espresso. Per la costruzione del plasmide Yip1B-GFP è stato utilizzato un
vettore di espressione eucariotica, pEGFP-N3 (Clontech) per l’espressione della
proteina Yip1B con GFP all’estremità C-terminale. Tutti i costrutti utilizzati sono
stati confermati per sequenza.
47
MATERIALI E METODI
___________________________
Plasmide
Primers
Seq. primers
7a GST FW
cgGGATCC atg tca aac cca gaa cag tat
7a GST REV
ccgCTCGAG cgt ttc att cat gat gct gcc
P7PFW
ccgCTCGAGcg atg tca aac cca gaa cag tat
P7PR
cgGGATCC ttc gaa aac ggt cag aag ggc
Yip1B-GST
Sito di restrizione
BamHI /XhoI
Yip1B-MYC
XhoI/BamHI
Yip1B-GFP
Ottenuto per digestione
XhoI/BamHI
Yip1B-notag
Ottenuto per digestione
XhoI/BamHI
7a GST FW
cgGGATCC atg tca aac cca gaa cag tat
BamHI/KpnI
Yip1B-N-ter
mYip1b 366Rev-Kpn
ggGGATCC cgt ttc att cat gat gct gcc
7a GST FW
cgGGATCC atg tca aac cca gaa cag tat
mYip1b 240Rev-Kpn
ggGGTACC aac tga ggg aga ctg tga gta
mYip1a 1FwBamHI
cgGGATCC atg tca ggc ttt gat aac tta
mYip1a 772Rev KpnI
ggGGTACC gaa gac aga aat cag ggc aaa
mYip1a 1FwBamHI
cgGGATCC atg tca ggc ttt gat aac tta
mYip1a 378Rev KpnI
ggGGTACC gtc cgt ctc att cat gat gct
mYip1a 1FwBamHI
cgGGATCC atg tca ggc ttt gat aac tta
mYip1a 246Rev KpnI
ggGGTACC ata gaa tgg ctg agg tgt tgt
Yip1B-1-80
Yip1A intera
Yip1A N-ter
Yip1A 1-80
BamHI/KpnI
BamHI/KpnI
BamHI/KpnI
BamHI/KpnI
Tab. 3.2 Elenco dei costrutti utilizzati
3.9 Trasfezioni
3.9.1 Trasfezione transiente in cellule
Le cellule sono trasfettate al raggiungimento di una confluenza di circa il 60 %,
usando il Lipofectamine Plus Reagent (Invitrogen), seguendo le istruzioni
riportate dalla ditta produttrice. Le cellule sono state incubate 3 ore a 37° C al 5%
CO2 in presenza dei reagenti di trasfezione e poi il terreno è stato sostituito con
DMEM completo con 10% FBS. Nel caso di C2C12 che devono essere
48
MATERIALI E METODI
___________________________
differenziate, il terreno di differenziamento è stato aggiunto il giorno successivo
alla trasfezione.
3.9.2 Trasfezione transiente in vivo
Le trasfezioni transienti in vivo sono state effettuate su muscolo tibiale di topo
adulto (CD1 di circa tre mesi). Gli animali prima trattati con anestetico Avertin
1,25% (Aldrich 24), sono stati trasfettati con i costrutti di interesse isolando il
tibiale e sottoponendolo ad elettroporazione con l’utilizzo dell’Electro Square
Porator ECM 830, BTX. Condizioni per l’elettroporazione: voltage 25 V, p.length
20 ms, impulse 5, interval 200 ms.
I DNA dei cloni usati per trasfettare sono stati preparati con Kit Nucleobond
Xtra Midi; Macherey-Nagel; e per ogni costrutto sono stati iniettati nel tessuto dai
15 ai 20 µg di DNA diluito in acqua in un volume massimo di 15 µl. I tessuti sono
stati prelevati dopo 15 giorni dalla trasfezione.
3.10 mRNA interference
Per inibire l’espressione genica della proteina di interesse è stato utilizzato il kit
BLOCK-iTTM Pol II miR RNAi Expression Vector (Invitrogen), che fa uso di
microRNA (miRNA), corte molecole di RNA della lunghezza di circa 22
nucleotidi. Il vettore di espressione contiene il promotore precoce del virus
umano citomegalovirus (CMV), che permette un’espressione elevata del miRNA.
Nel vettore è compresa la sequenza codificante per la proteina EmGFP (Emerald
Green Fluorescent Protein, proteina bioluminescente della medusa Aequorea
victoria), incorporata in modo che il sito di inserzione del pre-miRNA si trovi nella
regione al 3’ non tradotta (3’ UTR) dell’mRNA della EmGFP. L’espressione della
EmGFP permette di individuare le cellule esprimenti il miRNA ed è quindi
correlata al silenziamento del gene target.
49
MATERIALI E METODI
___________________________
Negli esperimenti di inibizione dell’espressione della proteina Yip1B sono stati
utilizzati tre miRNA, le cui sequenze sono state ottenute con il programma
BLOCK-iTTM RNAi Designer (Invitrogen), specifici per cDNA di topo (Mus
Musculus). I tre miRNA riconoscono tre sequenze a partire rispettivamente dal
nucleotide 93, 135, 553 (tab. 3.3). Il kit BLOCK-iTTM Pol II miR RNAi
comprende anche un controllo negativo costituito da un plasmide esprimente un
miRNA che non riconosce la sequenza di alcun gene conosciuto di vertebrato.
miRNA
Sequenza riconosciuta
93
ATGACATGGGCTTCTACCAAT
135
AGGAGCCGAGTTGCAATGATT
553
TCACGCCTTACTGAACTTGAT
Tab. 3.3 Sequenze riconosciute dai tre miRNA utilizzati negli esperimenti di
RNA interference.
3.11 Estrazione RNA totale
Tutte le operazioni per l’estrazione dell’RNA sono effettuate in ghiaccio o a
4°C.
L’estrazione dell’RNA totale da tessuto di topo è effettuata tramite TRIzol
(Invitrogen) seguendo il protocollo standard indicato dalla casa produttrice.
Brevemente, 50-100 mg di tessuto sono stati omogenizzati in presenza di 1ml di
TRIzol. I campioni omogenizzati sono stati incubati per 5 minuti a temperatura
ambiente e successivamente sono stati aggiunti 0,2 ml di cloroformio per ml di
TRIzol usato. I campioni sono stati agitati e centrifugati a 12000 g per 15 minuti.
L’RNA rimasto nella fase acquosa è stato trasferito in un nuovo tubo e fatto
precipitare con l’aggiunta di isopropanolo, 0,5 ml per ml di TRIzol. Per
l’estrazione di RNA da cellule invece, è stato usato il Kit Nuclespin RNA II
(Macherey-Nagel). L’RNA dopo l’estrazione è stato risospeso in acqua RNAsifree e conservato a -80°C.
50
MATERIALI E METODI
___________________________
La misura della concentrazione dell’RNA è stata effettuata tramite lettura
spettrofotometrica
(Ultrospec
2100
pro,
UV/Visible
Spectophotometer,
Amersharm Pharmacia Biotech), misurando l’assorbanza a 260 nm, dove 1 OD260
= [40 μg/ml]. L’integrità dell’RNA è stata determinata tramite corsa
elettroforetica su gel di agarosio all’1%.
3.12 Preparazione del cDNA (RT-PCR)
La sintesi di cDNA tramite RT-PCR è stata effettuata con reagenti Promega;
l’enzima usato è l’M-MLV RT (Moloney Murine Leukemia Virus reverse
transcriptase) in presenza di esanucleotidi random, secondo le istruzioni della casa
produttrice.
La qualità del cDNA ottenuto è stata saggiata tramite PCR utilizzando una
coppia di primers (di senso: 5’TGCGTGACATCAAAGAGAAG; antisenso: 5’
CGGATGTCAACGTCACACTT ) che amplificano per il gene ubiquitario della
β-actina.
Per la RT-PCR semi-quantitativa di Yip1B sono stati utilizzati i seguenti
primers: di senso 5’ AGAGATGTTCCTGCCATCAGA e antisenso 5’
AAAGGATGGGTCCTGTGAGAT
3.13 Real Time PCR
Per studiare l’espressione genica sono stati effettuati degli esperimenti di RealTime PCR, una tecnica di amplificazione del cDNA di tipo quantitativo, che
permette di seguire l’andamento dell’amplificazione in tempo reale grazie all'uso di
coloranti fluorescenti, come il SYBR Green, che s’intercalano con il DNA a
doppio filamento.
Per effettuare la Real-Time PCR è stata ustata la Real-Time Step One Plus
(Applied Biosystems). I reagenti impiegati per la mix di reazione sono tutti
51
MATERIALI E METODI
___________________________
contenuti nella Power SYBR Green PCR Master Mix (Applied Biosystems) ad
esclusione, ovviamente, dei primers e del templato:
Volume (μl) Concentrazione finale
Power SYBR Green PCR Master Mix (2X)
10
1X
Primer Forward [1 μM]
1
50 nM
Primer Reverse [1 μM]
1
50 nM
Templato (1:5)
5
-
Acqua
3
-
Totale
20
-
Come gene housekeeping è stato scelto quello della β-actina. In tabella 3.4
sono elencate le coppie di primers utilizzate.
Primer
Sequenza 5’→3’
Primer
Sequenza 5’→3’
β-actina
F
β-actina
R
GATCTGGCACCACACCTTCT
Yip1B
F
Yip1B
R
AGAGATGTTCCTGCCATCAGA
GGGGTGTTGAAGGTCTCAAA
AAAGGATGGGTCCTGTGAGAT
Yip1A F
CTTAAACAGCGGTTTCTACCAGAC
Yif1A
F
TGCAATACAGCCATGATGTGCC
Yip1A R
CTTGCTGTAGGGTCCTCCACT
Yif1A
R
CACCTCTGGGGAGAACCTTTG
Yif1B F
ATGCACGCGACAGGTTTGGC
Yif1B R
GGGCAGAACTCGTGTCATCAA
Tab. 3.4 Primers utilizzati per la RealTime-PCR.
I dati ottenuti sono stati elaborati mediante software Gene Expression Macro
(Bio-Rad), che per la quantizzazione relativa impiega la formula del ΔΔCt
52
MATERIALI E METODI
___________________________
modificata da Pfaffl (Pfaffl M.W., 2001), che tiene conto dell’efficienza di ciascuna
coppia di primers.
Per calcolare l’espressione di Yip1A e Yip1B all’interno dello stesso tessuto è
stata utilizzata la seguente formula: E-(ΔCt) che richiede un’efficienza dei primers
simile, come nel nostro caso, e che non tiene conto del gene housekeeping,
essendo la PCR di entrambi i geni effettuata sulla stessa preparazione di cDNA.
Per trasformare i valori ottenuti sottoforma di folds in valori percentuali, è
stata utilizzata la seguente formula: Yip1A(%)=100/1+X dove X rappresenta
l’espressione di Yip1B rispetto a Yip1A in fold (E-(ΔCt)). I valori ottenuti sono stati
messi su grafico mediante software Excel.
3.14 Produzione e purificazione di anticorpi policlonali
Per produrre la proteina ricombinante Yip1B-GST da utilizzare per
l’immunizzazione dei conigli, è stato utilizzato il plasmide Yip1B-GST, che
codifica per i primi 122 aminoacidi della Yip1B murina in frame con la
Glutatione-S-Transferasi (GST). La produzione e la purificazione della proteina
sono state effettuate secondo tecniche standard indicate dalla casa produttrice.
Gli anticorpi policlonali sono stati prodotti tramite immunizzazione di due
conigli (Oryctolagus cuniculus) New Zealand White, mantenuti secondo le condizioni
stabilite dai protocolli ministeriali. Ai conigli, dopo un periodo di adeguamento
alle condizioni di stabulazione locali, vengono prelevati alcuni ml di sangue per
ottenere il siero pre-immune, dopodichè sono immunizzati con iniezioni ripetute
contenenti 250 μg di proteina Yip1B-GST diluita in PBS al volume finale di 500
μl. Per la prima iniezione, 500 μl di soluzione proteica vengono addizionati a 500
μl di adiuvante di Freund completo (SIGMA), l’emulsione così ottenuta è iniettata
sottocute mediante iniezioni multiple. Per la seconda immunizzazione è stato
utilizzato l’adiuvante incompleto di Freund (SIGMA) e l’emulsione è iniettata a
livello sottoscapolare tramite iniezioni ripetute. Dopo la seconda immunizzazione,
è stato effettuato un prelievo di sangue dalla vena centrale dell’orecchio
53
MATERIALI E METODI
___________________________
dell’animale, sedato con Zoletil. Dopo le prime due immunizzazioni ed il primo
prelievo è stata effettuata un’iniezione endovena della soluzione proteica priva di
adiuvante nella vena periferica dell’orecchio del coniglio; in seguito il prelievo e
l’immunizzazione (tramite iniezione intramuscolare) sono stati effettuati a
settimane alterne.
I sieri sono stati preparati raccogliendo il sangue coagulato a 4° C over-night,
poi centrifugato a 1100 g a 4° C per 30 minuti. I campioni di siero sono stati
aliquotati e conservati alla temperatura di -20° C.
La purificazione dell’anticorpo policlonale è stata effettuata per affinità
utilizzando una colonna di proteina A come matrice. Tutti i passaggi della
purificazione sono stati fatti a 4°C o in ghiaccio per impedire la degradazione
dell’anticorpo. Le IgG totali sono state eluite dalla colonna con 100mM Glicina
(pH3). Le IgG sono state alla fine dializzate con Centricon Plus-20 (AMICON
Bioseparations) e la concentrazione di immunoglobuline è stata calcolata mediante
una lettura allo spettrofotometro misurando l’assorbanza a 280nm.
La qualità del purificato è stata infine verificata caricando circa 10 µg di IgG su
gel di acrilammide.
Trattamento degli animali
I campioni di tessuto utilizzati negli esperimenti sono stati prelevati dal
personale autorizzato dello stabulario del Polo Scientifico di San Miniato
dell’Università degli Studi di Siena, dove gli animali vengono trattati nel rispetto
delle normative vigenti riguardanti la protezione e l’utilizzo degli animali vertebrati
a fini sperimentali e scientifici: Decreto Legislativo del 27 gennaio 1992 n.116, la
decisione del Consiglio 1999/575/CE del 23 marzo 1998 e Decisione 2003/584/CE del
Consiglio del 22 luglio 2003.
54
4 Risultati
4.1 Identificazione di nuovi geni espressi nel muscolo striato
Negli anni passati nel nostro laboratorio la Dott.ssa Jelena Kunic ha avviato
uno studio mirato all’identificazione di nuovi geni preferenzialmente espressi nel
muscolo striato. Con l’uso di differenti database di espressione genica, come
SymAtlas, basati sui profili di espressione ottenuti mediante microarray, sono stati
identificati 235 geni di Mus Musculus caratterizzati da elevati livelli di espressione
nel muscolo striato rispetto agli altri tessuti (almeno 10 volte maggiori). Le
proteine codificate da questi 235 geni sono state sottoposte all’analisi mediante
software di predizione di domini transmembrana, come SOSUI, per selezionare i
geni codificanti per proteine contenenti almeno un dominio idrofobico,
potenzialmente in grado di ancorarle alle membrane interne del muscolo
scheletrico. Da questo screening sono state alla fine selezionate 4 proteine le cui
funzioni sono in parte o completamente sconosciute. I loro profili d’espressione
sono a questo punto studiati anche mediante esperimenti di RT-PCR allo scopo di
confermare la loro espressione preferenziale nel muscolo striato.
Gli studi successivi si sono concentrati su una di queste quattro proteine,
chiamata Yip1B (NCBI Ref Seq NM_023784). In figura 4.1 sono illustrati i livelli
d’espressione ottenuti mediante l’analisi dei microarray, dove si può osservare un
alto livello d’espressione nel muscolo cardiaco (barra in verde chiaro) e nel
muscolo scheletrico (barra in verde scuro). In figura 4.2 è rappresentata la
struttura secondaria, elaborata dal software di predizione dei domini
transmembrana SOSUI, di Yip1B: tale proteina sembra sia costituita da una
porzione citosolica all’N-terminale e da 4-5 domini idrofobici transmembrana
all’estremità C-terminale.
RISULTATI
___________________________
Fig. 4.1 Profili d’espressione di Yip1B in diversi tessuti. In verde chiaro espressione
nel cuore, in verde scuro nel
(http://symatlas.gnf.org/SymAtlas/).
muscolo
scheletrico.
Da
Gene
Atlas
Fig. 4.2 Rappresentazione schematica degli ipotetici domini transmembrana di
Yip1B. Da SOSUI (www.sosui.proteome.bio.tuat.ac.jp).
Esperimenti di RT-PCR (fig. 4.3), hanno confermato l’espressione
esclusivamente muscolare della Yip1B che risulta espressa nel muscolo tibiale, nel
soleo, nel diaframma e nel cuore, ma non in tutti gli altri tessuti analizzati.
56
RISULTATI
___________________________
Fig. 4.3
RT-PCR di Yip1B. E’ stato utilizzato come normalizzatore il gene
housekeeping β-actina.
4.2 Espressione dei membri della famiglia Yip1 in diversi
tessuti
Allo scopo di verificare e quantificare l’espressione di Yip1B e della sua
isoforma ubiquitaria Yip1A, sono stati effettuati esperimenti di Real-Time PCR su
diversi tessuti, compresi quattro tipi di tessuto muscolare scheletrico.
Come illustrato nel grafico derivante dall’analisi dell’espressione di Yip1A, tale
isoforma è espressa in tutti i tessuti analizzati anche se a livelli differenti, ma la sua
espressione è assente nei diversi tipi di muscolo scheletrico presi in esame, ossia il
muscolo tibiale, il soleo, l’EDL e il diaframma; è invece espressa nel muscolo
cardiaco (fig. 4.4).
57
RISULTATI
___________________________
Fig. 4.4 Espressione di Yip1A in diversi tessuti. L’espressione relativa è calcolata
rispetto a quella del muscolo tibiale (*).
Al contrario, Yip1B è espressa nel muscolo striato, quindi scheletrico e
cardiaco, a conferma di quanto emerso negli esperimenti di RT-PCR (vedi fig.
4.3), mentre la sua espressione è assente in tutti gli altri tessuti analizzati (fig. 4.5).
Yip1B sembra quindi rappresentare l’isoforma muscolo-specifica.
Fig. 4.5 Espressione di Yip1B in diversi tessuti. L’espressione relativa è calcolata
rispetto a quella della milza (*).
58
RISULTATI
___________________________
Poichè è noto che Yip1A e Yip1B formano complessi molecolari con altri
membri della stessa famiglia, ed in particolare con Yif1A e Yif1B, è stata
analizzata anche l’espressione di Yif1A e Yif1B. Entrambe le isoforme sono
risultate presenti, sebbene con diversi livelli d’espressione, in tutti i tessuti
analizzati, compresi i diversi tipi di muscolo (fig. 4.6 e 4.7). Non sembra quindi
emergere un’isoforma muscolo specifica tra questi due interattori.
Fig. 4.6 Espressione di Yif1A in diversi tessuti. L’espressione relativa è calcolata
rispetto a quella della milza (*).
Fig. 4.7 Espressione di Yif1B in diversi tessuti. L’espressione relativa è calcolata
rispetto a quella della milza (*).
59
RISULTATI
___________________________
4.2.1 Espressione delle due isoforme di Yip1 in cellule C2C12
Confermata l’espressione muscolo-specifica della Yip1B, sono stati effettuati
esperimenti di Real-Time PCR anche sulla linea cellulare miogenica C2C12, per
analizzare l’espressione delle due isoforme di Yip1 durante il differenziamento di
queste cellule. Dall’analisi dei dati ottenuti è emerso che l’espressione di Yip1B
nelle C2C12 differenziate aumenta di circa 1700 volte rispetto alle cellule non
differenziate, dove sembra essere assente (fig. 4.8).
Fig. 4.8
Espressione di Yip1B in C2C12 non differenziate e differenziate.
L’espressione relativa è calcolata in base a quella delle C2C12 non differenziate (*).
La Yip1A è invece presente anche nelle C2C12 non differenziate (dato
rilevabile dal valore di ct, ma non dal grafico in fig. 4.9), ma la sua espressione
aumenta di sole 10 volte con il differenziamento. Questo dato sembra essere in
contrasto con quanto emerso nel grafico di fig. 4.4, poichè la Yip1A non è stata
riscontrata nel muscolo scheletrico. La presenza della Yip1A nella linea cellulare
C2C12 può essere spiegata dal fatto che solo circa il 40% delle cellule
differenziano in miotubi, mentre le restanti rimangono mononucleate e
continuano a proliferare, contribuendo probabilmente all’aumento d’espressione
di Yip1A rilevato in questi esperimenti. Inoltre, trattandosi di un sistema in vitro,
non si raggiunge un differenziamento completo paragonabile a quello delle fibre
muscolari adulte.
60
RISULTATI
___________________________
Fig. 4.9
Espressione di Yip1A in C2C12 non differenziate e differenziate.
L’espressione relativa è calcolata rispetto a quella delle C2C12 non differenziate (*).
Analizzando i livelli d’espressione di un’isoforma rispetto all’altra, nelle cellule
non differenziate e differenziate, emerge che nelle prime si ha esclusivamente la
presenza dell’isoforma Yip1A, mentre con il differenziamento la sua espressione
diminuisce e comincia a comparire quella dell’isoforma muscolare Yip1B (fig.
4.10).
Fig. 4.10 Espressione di entrambe le isoforme Yip1 nelle C2C12 non differenziate
e differenziate.
61
RISULTATI
___________________________
4.3 Validazione dell’anticorpo anti-Yip1B mediante Western
blot
Per studiare la localizzazione sub-cellulare e per meglio comprendere la
funzione di Yip1B è stato prodotto un anticorpo policlonale contro la porzione
idrofilica di Yip1B di topo. In particolare, il cDNA codificante per la porzione Nterminale della proteina è stata clonata nel vettore pGEX-4T1. Tale costrutto è
stato poi utilizzato per la produzione della proteina ricombinante in frame con la
GST, necessaria per la produzione dell’anticorpo specifico in grado di riconoscere
la Yip1B.
Per saggiare la specificità dell’anticorpo ottenuto sono state inizialmente
trasfettate cellule NIH3T3 con il cDNA codificante la Yip1B in frame con
l’epitopo myc, e successivamente effettuati esperimenti di Western blot con
l’anticorpo prodotto e con l’anticorpo monoclonale α-myc di controllo. Parte
degli esperimenti di Western blot sono stati effetuati dalla Dott.ssa Antonietta
Corrado durante lo svolgimento della sua tesi di laurea.
E’ stato così verificato che l’anticorpo è in grado di riconoscere in modo
specifico la Yip1B ricombinante, caratterizzata da una banda di circa 37 KDa (fig.
4.11A); infatti la stessa banda è stata individuata anche dall’anticorpo α-myc
(fig.4.11B).
A
B
Fig. 4.11 Analisi della specificità dell’anticorpo mediante Western blot. In ogni
pozzetto sono stati caricati 60 g di proteine totali.
62
RISULTATI
___________________________
4.4 Analisi dell’espressione di Yip1B nei tessuti e in C2C12
Una volta verificata la specificità dell’anticorpo prodotto, è stata verificata
anche la sua capacità di riconoscere la proteina endogena, e contemporaneamente
è stata analizzata, sempre mediante esperimenti di Western blot, la sua espressione
in diversi tessuti. L’antisiero prodotto é in grado di riconoscere la proteina
endogena in quanto si evidenzia una banda intorno ai 30 KDa, come atteso, ed
inoltre la banda specifica è presente nei muscoli striati e non in altri tessuti (fig.
4.12A), ad ulteriore conferma che si tratta di una proteina muscolo-specifica.
Inoltre è stato visto che la Yip1B è presente in tutte e tre le tipologie di muscolo
scheletrico: nel soleo, che è composto in prevalenza da fibre muscolari di tipo
lento; nell’EDL, che è un muscolo a composizione prevalentemente veloce, e nel
diaframma che è formato da fibre di entrambi i tipi ed è quindi considerato un
muscolo misto (fig. 4.12B). L’espressione di Yip1B è stata studiata anche nella
linea cellulare miogenica C2C12: la proteina è presente solo in cellule
differenziate, e quindi solo nei miotubi (fig. 4.12C), confermando i dati ottenuti
dagli esperimenti di Real-Time PCR.
A
B
C
Fig. 4.12 Analisi dell’espressione di Yip1B all’interno di diversi tessuti e in cellule
C2C12. In ogni pozzetto sono stati caricati 60 g di proteine totali.
63
RISULTATI
___________________________
Poiché l’analisi informatica ha evidenziato che Yip1B presenta almeno quattro
domini di membrana, esperimenti di Western blot sono stati effettuati anche sulla
frazione microsomiale purificata da muscoli prelevati dagli arti inferiori di topo. I
risultati ottenuti mostrano che Yip1B è presente in maggiori quantità nella
frazione microsomiale dei muscoli scheletrici, confermando la sua associazione
alle membrane (fig. 4.13A).
A
B
Fig. 4.13 Analisi dell’espressione di Yip1B nella frazione microsomiale di
muscolo scheletrico. La banda intorno ai 100 KDa (B) rappresenta la triadina utilizzata
per verificare la qualità della preparazione microsomiale. In ogni pozzetto sono stati
caricati 60 g di proteine totali e 30 g della frazione microsomiale.
4.5 Localizzazione sub-cellulare di Yip1B
Allo scopo di studiare la localizzazione sub-cellulare di Yip1B nelle cellule
muscolari, sono stati effettuati esperimenti di immunofluorescenza su C2C12
differenziate, su miociti primari differenziati di ratto e su sezioni di muscolo
scheletrico tibiale di topo.
4.5.1 Localizzazione di Yip1B in cellule C2C12
Al fine di analizzare la localizzazione di Yip1B sono stati effettuati degli
esperimenti preliminari su cellule C2C12 trasfettate con diversi costrutti della
proteina in esame, prima di passare ad esaminare la distribuzione della proteina
64
RISULTATI
___________________________
endogena. Dopo aver piastrato, trasfettato e differenziato per circa 7 giorni cellule
C2C12, sono stati condotti esperimenti di immunofluorescenza con l’utilizzo
dell’anticorpo appropriato e le cellule sono state analizzate al microscopio
confocale. Cellule trasfettate con la proteina di fusione Yip1B-myc e colorate con
l’anticorpo α-myc mostrano una distribuzione perinucleare e in strutture
puntiformi distribuite lungo il miotubo (fig. 4.14).
Fig. 4.14 Immunofluorescenza su cellule C2C12 trasfettate con Yip1B-myc e
differenziate. Il segnale specifico è stato evidenziato con l’uso dell’anticorpo primario αmyc (1:500) e dell’anticorpo secondario rosso (barra: 5 μm).
Una distribuzione simile è stata evidenziata anche trasfettando la proteina in
frame con l’epitopo GFP.
Per escludere un’eventuale localizzazione errata dovuta alla presenza
dell’epitopo, le cellule sono state trasfettate con la Yip1B priva di tag e colorate
con l’anti-siero α-Yip1B. Come si osserva dalla figura 4.15 il segnale rimane
perinucleare e in strutture puntiformi, indicando che gli epitopi non sembrano
alterare la localizzazione della proteina ricombinante.
65
RISULTATI
___________________________
Fig. 4.15 Immunofluorescenza su cellule C2C12 trasfettate con Yip1B senza tag e
differenziate. Il segnale specifico è stato evidenziato con l’uso dell’anticorpo α-Yip1B e
dell’anticorpo secondario rosso (barra: 5 μm).
Una volta dimostrata la specificità dell’anticorpo prodotto, si è passati
all’esame della localizzazione della proteina endogena. Le cellule C2C12 sono state
piastrate, fatte differenziare per circa 8 giorni e poi colorate con l’uso
dell’anticorpo specifico. I risultati mostrano che la proteina endogena si
distribuisce in modo simile a quella ricombinante, localizzandosi nella regione
perinucleare e lungo i miotubi (fig. 4.16).
Fig. 4.16 Immunofluorescenza su cellule C2C12 differenziate. Il segnale specifico è
stato evidenziato con l’uso dell’anticorpo α-Yip1B e dell’anticorpo secondario rosso
(barra: 5 μm).
66
RISULTATI
___________________________
4.5.2 Localizzazione di Yip1B in miociti primari
Per verificare la localizzazione della proteina in cellule primarie, la stessa analisi
è stata effettuata su miociti primari di ratto. I miociti sono stati piastrati su vetrini
gelatinati, trasfettati con tre costrutti differenti, fatti differenziare per circa sei
giorni, colorati con l’anticorpo specifico e analizzati al microscopio confocale.
Anche nei miotubi derivati dai miociti primari, come nelle C2C12, il segnale
dato dalla Yip1B-myc e Yip1B-GFP (fig. 4.17) trasfettate è localizzato intorno al
nucleo e in strutture puntiformi distribuite lungo il miotubo.
A
B
Fig. 4.17 Immunofluorescenza su miociti primari di ratto trasfettati con Yip1Bmyc (A) e Yip1B-GFP (B) e differenziati. Per i miociti trasfettati con Yip1B-myc il
segnale specifico è stato evidenziato con l’uso dell’anticorpo primario α-myc (1:500) e
dell’anticorpo secondario verde (barra: 5 μm).
67
Inoltre, come per le C2C12, i miociti sono stati trasfettati anche con la Yip1B
priva di epitopi per escludere una localizzazione errata delle proteine con i diversi
tag. Anche nei miociti la proteina priva di tag si dispone in modo simile a quella
ricombinante (fig. 4.18).
Fig. 4.18 Immunofluorescenza su miociti primari di ratto trasfettati . con Yip1B
senza tag e .differenziati. Il segnale specifico è stato evidenziato con l’uso
dell’anticorpo α-Yip1B e dell’anticorpo secondario rosso (barra: 5 μm).
Per analizzare la distribuzione della proteina endogena nei miotubi derivanti da
miociti primari, è stata effettuata una doppia colorazione con l’antisiero α-Yip1B e
con l’anticorpo diretto contro l’ α-actinina, una proteina dell’apparato contrattile
che è localizzata in corrispondenza del disco Z del sarcomero solo nei miociti
differenziati. Come si può osservare dalla figura 4.19, la Yip1B si dispone intorno
ai nuclei e in strutture puntiformi lungo la fibra, come avviene per la proteina
ricombinante e come visto nella linea cellulare miogenica C2C12.
RISULTATI
___________________________
Yip1B
α-actinina
merge
Fig. 4.19 Immunofluorescenza su miociti differenziati. Il segnale specifico è stato
evidenziato con l’uso dell’anticorpo α-Yip1B in rosso, e con l’anticorpo contro l’ αactinina in verde (barra: 5 μm).
4.5.3 Localizzazione di Yip1B in fibre muscolari adulte
Si è passati poi ad analizzare la localizzazione di Yip1B nei muscoli adulti. A
tale scopo sono stati prelevati muscoli tibiali di topo adulto, dai quali sono state
preparate delle sezioni, colorate poi con l’anti-siero α-Yip1B purificato. Come si
osserva dalla figura 4.20, la Yip1B si distribuisce in file di due o tre strutture
puntiformi lungo la fibra e ai poli del nucleo, evidenziato con l’uso del colorante
nucleare DAPI.
69
RISULTATI
___________________________
Fig. 4.20
Immunofluorescenza su fibre di muscolo tibiale adulto . Il segnale
specifico è stato evidenziato con l’uso dell’anticorpo α-Yip1B in rosso, i nuclei con il
DAPI in blu (non in confocale), (barra: 5 μm).
Poiché tale localizzazione sembra essere molto simile a quella dell’apparato di
Golgi nelle fibre muscolari di tipo veloce, come appunto il muscolo tibiale, è stata
effettuata una doppia colorazione con l’anticorpo contro la Yip1B e con il
marcatore del cis-Golgi, il GM130.
Quello che si osserva è una co-localizzazione della Yip1B con il cis-Golgi, sia
in sezione longitudinale (fig. 4.21A) che in sezione trasversale (fig. 4.21B), anche
se ad un ingrandimento maggiore si può osservare che si tratta di una colocalizzazione solo parziale con il cis-Golgi (fig. 4.21C).
70
RISULTATI
___________________________
A
C
Yip1B
GM130
merge
B
Yip1B
GM130
merge
Yip1B
GM130
merge
Fig. 4.21 Immunofluorescenza su fibre di muscolo tibiale adulto . La sezione
trasversale (A) e longitudinale (B) è stata colorata con l’anticorpo α-Yip1B in rosso e con
il marcatore del cis-Golgi GM130 in verde. Il riquadro C indica l’ingrandimento della
zona indicata dal riquadro in verde (barra: 5 μm).
4.6 Espressione di Yip1B durante il differenziamento
cellulare delle C2C12
Essendo la Yip1B espressa, come visto dai dati di Real-Time PCR e da
esperimenti di Western blot, nelle cellule C2C12 differenziate, ma non in quelle
mononucleate, l’espressione della proteina è stata analizzata durante il
differenziamento di questa linea cellulare. Cellule C2C12 sono state fatte
differenziare per un massimo di 10 giorni e raccolte anche a tempi intermedi, ossia
al terzo, quinto e settimo giorno. Le cellule sono state quindi lisate e caricate su
gel per poi effettuare un Western blot con l’anti-siero α-Yip1B.
71
RISULTATI
___________________________
I risultati mostrano che l’espressione della proteina inizia intorno al 3° giorno
di differenziamento ed aumenta con il progredire del differenziamento dei
mioblasti in miotubi (fig.4.22).
Fig. 4.22 Analisi dell’espressione di Yip1B durante il differenziamento delle
cellule C2C12. In ogni pozzetto sono stati caricati 60 μg di proteine totali, la
normalizzazione della quantità di proteine caricate è stata effettuata con l’anticorpo αPDI.
4.7 Espressione di Yip1B e Yip1A durante lo sviluppo
muscolare embrionale
Essendo Yip1B una proteina muscolo-specifica che mostra un aumento
d’espressione con il progredire del differenziamento delle C2C12, abbiamo
analizzato come varia la sua espressione durante lo sviluppo del muscolo
scheletrico adulto.
4.7.1 Analisi mediante Real-time PCR
L’aumento dell’espressione di Yip1B durante lo sviluppo è stato verificato con
esperimenti di PCR quantitativa, effettuata su un mix di tessuti muscolari
72
RISULTATI
___________________________
scheletrici prelevati dall’arto posteriore di topo a diversi stadi di sviluppo
embrionale, ossia al 14°, 16° e 18° giorno e al 1°, 5° e 15° giorno di vita postnatale, oltre che allo stadio adulto. La sua comparsa si ha al 16° giorno di sviluppo
embrionale ed aumenta con l’avanzare dello sviluppo, raggiungendo livelli
massimi d’espressione nel muscolo adulto. Sono stati analizzati anche quattro tipi
di muscoli separatamente, a due differenti stadi: al 15° giorno di vita post-natale,
(fase in cui compaiono le caratteristiche tipiche che contraddistinguono le diverse
tipologie muscolari), e nello stadio adulto. Per ogni muscolo analizzato si ha
l’aumento d’espressione di Yip1B passando dal 15° giorno di vita post-natale alla
fase adulta (fig. 4.23).
Fig. 4.23 Espressione di Yip1B a differenti stadi di sviluppo embrionale e postnatale. L’espressione relativa è calcolata in base a quella del muscolo totale al 14° giorno
di vita embrionale (SKM*).
E’ stata analizzata anche l’espressione dell’isoforma ubiquitaria Yip1A durante
le stesse fasi dello sviluppo, e quello che è emerso è un andamento
completamente opposto: il gene è espresso a livelli maggiori al 14° e 16° giorno di
sviluppo embrionale e la sua espressione diminuisce progressivamente con il
raggiungimento dell’età adulta. L’abbassamento d’espressione si verifica, come
atteso, anche nei quattro tessuti muscolari analizzati separatamente (fig. 4.24).
73
RISULTATI
___________________________
Fig. 4.24 Espressione di Yip1A a differenti stadi di sviluppo embrionale e postnatale. L’espressione relativa è calcolata in base a quella del muscolo totale adulto
(SKMad*).
Comparando i livelli d’espressione delle due isoforme in ogni fase dello
sviluppo muscolare, si può vedere che con l’avanzare del differenziamento si ha la
diminuzione dell’espressione della Yip1A e un parallelo aumento dell’espressione
dell’isoforma muscolo-specifica Yip1B (fig.4.25).
Fig. 4.25. Espressione delle due isoforme in ogni stadio dello sviluppo
muscolare.
74
RISULTATI
___________________________
4.7.2 Analisi mediante Western blot
La stessa indagine effettuata con la tecnica di Western blot su lisati proteici
derivanti da muscolo intero, prelevato al 14° e 18° giorno di sviluppo embrionale
e al 1°, 5° e 12° giorno di sviluppo post-natale, ha confermato la comparsa della
proteina Yip1B dopo il 14° giorno di vita embrionale ed un aumento
d’espressione nella fase post-natale (fig. 4.26). Non è stato possibile effettuare lo
stesso esperimento anche per Yip1A, poichè non abbiamo a disposizione un
anticorpo specifico per questa isoforma.
Fig. 4.26 Espressione di Yip1B a differenti stadi di sviluppo embrionale e postnatale. In ogni pozzetto sono stati caricati 40 g di proteine totali. A destra è raffigurato
il gel di acrilammide caricato come il precedente e colorato con Blue di Comassie per
normalizzare la quantità di proteine caricate.
4.7.3 Analisi mediante esperimenti di immunofluorescenza
Esperimenti di immunofluorescenza sul diaframma prelevato al 14°, 16° e 18°
giorno di sviluppo embrionale e al 1° e 5° giorno di vita post-natale hanno
confermato la comparsa di Yip1B al 16° giorno di sviluppo embrionale, come già
emerso dallo studio dell’espressione del gene mediante esperimenti di PCR
quantitativa. Inoltre i risultati ottenuti evidenziano che la proteina, sin dal
momento della sua comparsa, mostra una parziale co-localizzazione con il
marcatore del cis-Golgi (GM130), (fig. 4.27).
75
RISULTATI
___________________________
Yip1B
GM130
merge
Fig. 4.27 Immunofluorescenza sul diaframma di topo prelevato al 16° giorno di
sviluppo embrionale. La sezione è stata colorata con l’anticorpo α-Yip1B in rosso, con
il marcatore del cis-Golgi GM130 in verde. Le frecce indicano la co-localizzazione dei
due segnali (barra: 5 μm).
4.8 Espressione di Yip1B in fibre rigeneranti
Effettuando esperimenti di trasfezione in vivo, poiché l’elettroporazione
comporta un danno notevole alle fibre, si è ottenuta la formazione di numerose
fibre rigeneranti. Dalla colorazione con l’anticorpo α-Yip1B di sezioni ottenute da
muscolo tibiale di topo prelevato dopo sette giorni dalla trasfezione, si è osservato
un notevole aumento dell’espressione della proteina nelle fibre rigeneranti rispetto
alle fibre non rigeneranti. In figura 4.28 si osserva infatti una fibra rigenerante al
cui interno la Yip1B (in rosso) è espressa ad alti livelli e si distribuisce in numerosi
aggregati di strutture puntiformi non ancora disposti in file ordinate, e in parte
localizzati in prossimità dei nuclei (non mostrati in questa immagine). Inoltre da
una doppia colorazione con l’anticorpo contro il GM130, si può osservare una
buona co-localizzazione con il cis-Golgi come osservato anche nelle fibre adulte e
in quelle in via di sviluppo.
76
RISULTATI
___________________________
Fig. 4.28 Immunofluorescenza su muscolo tibiale di topo contenente fibre
rigeneranti. La sezione è stata colorata con l’anticorpo α-Yip1B in rosso e con
l’anticorpo α-GM130 in verde (barra: 5 μm).
4.9 Effetto dell’overespressione di Yip1B e Yip1A in C2C12
indifferenziate
Dati presenti in
letteratura
hanno
mostrato
che l’over-espressione
dell’isoforma Yip1A e soprattutto della sua porzione N-terminale in cellule
mononucleate comporta la frammentazione dell’apparato di Golgi, suggerendo
che questa proteina sia coinvolta nel mantenimento dell’apparato di Golgi stesso
(Tang et al., 2001). Per verificare se anche l’isoforma Yip1B è in grado di
provocare questo effetto sull’apparato di Golgi e quale porzione della proteina sia
eventualmente coinvolta in questo fenomeno, sono stati generati tre vettori
d’espressione codificanti per la proteina intera, per la porzione N-terminale
citosolica e per la porzione N-terminale citosolica costituita dai primi 80
amminoacidi, che rappresenta la porzione di divergenza tra le due isoforme
Yip1A e Yip1B. I costrutti così ottenti sono stati poi trasfettati in cellule C2C12.
Le cellule una volta trasfettate sono state colorate con l’anticorpo α-Yip1B e con
l’anticorpo α-GM130 per evidenziare l’apparato di Golgi. I risultati mostrano che:
trasfezioni transienti in cellule mononucleate della proteina intera e della porzione
77
RISULTATI
___________________________
N-terminale completa sembrano in grado di indurre la frammentazione e\o
dispersione dell’apparato di Golgi, come riportato in letteratura per l’isoforma
Yip1A. Tuttavia la porzione di divergenza rappresentata dai primi 80 aminoacidi
non sembra in grado di produrre lo stesso effetto (fig. 4.29).
A
B
C
Yip1B
Yip1B
Yip1B
GM130
GM130
GM130
merge
merge
merge
Fig. 4.29 Immunofluorescenza su cellule C2C12 trasfettate con Yip1B intera (A),
Yip1B N-terminale (B) e Yip1B N-terminale composta dai primi 80 aa (C). La
Yip1B è stata evidenziata con l’uso dell’anticorpo α-Yip1B in rosso e l’apparato di Golgi
con l’anticorpo α-GM130 in verde. Nei riquadri centrali e in basso si possono osservare
cellule non trasfettate caratterizzate da un apparato di Golgi normale (barra: 5 μm).
4.10 Knock-down di Yip1B
Per comprendere la funzione di Yip1B nel muscolo scheletrico sono stati
effettuati esperimenti di RNA-interference, allo scopo di abbassare l’espressione
della proteina e di verificare un eventuale effetto sul muscolo scheletrico dovuto
alla mancanza di una quantità sufficiente di Yip1B.
Dopo aver disegnato due miRNA (con il programma BLOCK-iT RNAi
Designer) in grado di riconoscere due sequenze differenti dell’mRNA codificante
per la Yip1B, i vettori d’espressione codificanti per i due miRNA e per un miRNA
78
RISULTATI
___________________________
di controllo non silenziante, sono stati trasfettati in cellule NIH3T3 mediante una
doppia trasfezione con il cDNA codificante per la Yip1B, allo scopo di testare in
vitro quale miRNA fosse in grado di silenziare la proteina bersaglio. Per ogni
miRNA sono state effettuate due trasfezioni variando il rapporto tra la quantità di
cDNA codificante per Yip1B e quella codificante per il miRNA. Nel rapporto 1:0
non è presente il miRNA e quindi il silenziamento dovrebbe essere nullo, ed è
stato quindi utilizzato come controllo negativo; nel rapporto 1:1 sono presenti le
stesse quantità dei due costrutti. La quantità di cDNA di Yip1B trasfettata è
uguale per ogni rapporto utilizzato e quindi la quantità di DNA totale trasfettato è
stata mantenuta costante aggiungendo il DNA del vettore vuoto. Le cellule
trasfettate sono state lisate 48 ore dopo la trasfezione e le proteine ottenute
caricate su gel su cui è stato effettuato un Wester blot con l’anticorpo contro la
Yip1B e con quello contro il PDI per normalizzare la quantità di proteine caricate
su gel (fig. 4.30).
Fig. 4.30 Analisi dell’espressione di Yip1B in cellule NIH3T3 co-trasfettate con
il cDNA codificante Yip1B e tre miRNA differenti, nei rapporti 1:0, 1:1. In ogni
pozzetto sono stati caricati 40 μg di lisato totale
Le bande ottenute dal blot, riguardanti l’espressione della Yip1B nelle diverse
combinazioni, sono state quantizzate e normalizzate rispetto al PDI mediante
densitometria effettuata con il software ImageJ. Dal grafico così ottenuto,
illustrato in figura 4.31, si osserva che entrambi i miRNA sono in grado di
silenziare la Yip1B, anche se in percentuali differenti. In particolare si può
79
RISULTATI
___________________________
osservare che il miRNA93 comporta un abbassamento dell’espressione della
Yip1B di circa il 33% rispetto al miRNA di controllo, mentre la diminuzione
dell’espressione della Yip1B sembra essere più consistente per il miRNA553 che
comporta un abbassamento dell’espressione della Yip1B di circa il 72%.
Fig. 4.31 Grafico derivante dall’analisi densitometrica effettuata sul Western blot
di figura 4.30.
Per osservare l’effetto dei miRNA, cellule C2C12 sono state trasfettate con i
plasmidi codificanti il miRNA 93 e 553, e con il miRNA non silenziante come
controllo negativo. Una volta trasfettate e differenziate per circa 6 giorni, è stata
effettuata una colorazione con anticorpi contro Yip1B e contro il GM130, un
marcatore del cis-Golgi. Come si osserva dalla figura 4.32A, la fibra in verde che
esprime il miRNA di controllo presenta un evidente segnale di Yip1B (in rosso),
come atteso. Nella stessa figura, nel riquadro B e C, si osservano rispettivamente
una fibra trasfettata con il miRNA93 e una con il miRNA553, in cui notiamo un
notevole abbassamento dell’espressione di Yip1B, come riscontrato nel blot. Per
quanto riguarda il segnale dato dal GM130 (in viola), si può osservare che il
80
RISULTATI
___________________________
silenziamento di Yip1B, provocato da entrambi i miRNA, non produce nessun
evidente effetto sull’apparato di Golgi, il quale mantiene la stessa morfologia delle
fibre di controllo e non sembra essere frammentato, come invece osservato nel
lavoro di Yoshida e colleghi (2008).
A
C
GM130
GM130
Yip1B
Yip1B
GFP
GFP
merge
merge
B
GM130
Yip1B
GFP
merge
Fig. 4.32 Immunofluorescenza su cellule C2C12 trasfettate con il miRNA di
controllo (A), il miRNA93 (B) e il miRNA553(C). Le cellule trasfettate con il miRNA
sono indicate in verde in quanto esprimono la GFP. Le cellule fatte differenziare per 6
giorni dopo la trasfezione, sono state colorate con l’anticorpo α-Yip1B in rosso e con il
marcatore del cis-Golgi GM130 in viola (barra: 5 μm).
L’effetto del silenziamento è stato studiato anche nel muscolo scheletrico
adulto. Muscoli tibiali di topo sono stati trasfettati in vivo con il plasmide di
81
RISULTATI
___________________________
controllo
e
con
entrambi
i
plasmidi
contemporaneamente
(miRNA93+miRNA553), e prelevati dopo 6 e 15 giorni dalla trasfezione. Dopo 6
giorni non è stato rilevato alcun silenziamento della proteina; dopo 15 giorni
invece, come si può osservare in figura 4.34A, è ben visibile l’abbassamento
dell’espressione di Yip1B, che non si osserva invece trasfettando il plasmide di
controllo (fig.4.33A).
A
B
Yip1B
GM130
GFP
GFP
merge
merge
Fig. 4.33 Immunofluorescenza su sezioni di muscolo tibiale di topo, trasfettato in
vivo con il miRNA di controllo. Le fibre trasfettate con il miRNA sono indicate in
verde in quanto esprimono la GFP. Le sezioni, prelevate 15 giorni dopo la trasfezione,
sono state colorate con l’anticorpo α-Yip1B in rosso (colonna A) e con l’anticorpo αGM130 in rosso (colonna B), (barra: 5 μm).
82
RISULTATI
___________________________
Fig. 4.34 Immunofluorescenza su sezioni di muscolo tibiale di topo, trasfettato in
vivo con il miRNA93+miRNA553. Le fibre trasfettate con il miRNA sono indicate in
verde in quanto esprimono la GFP. Le sezioni, prelevate 15 giorni dopo la trasfezione,
sono state colorate con l’anticorpo α-Yip1B in rosso (colonna A) e con l’anticorpo αGM130 in rosso (colonna B), (barra: 5 μm).
Yip1B
GM130
Come nelle C2C12, anche nel muscolo adulto non si evidenzia alcuna
alterazione dell’apparato di Golgi nelle fibre che esprimono i miRNA93 e 553 (fig
4.34B).
GFP
GFP
merge
merge
83
5 Discussione
Yip1B è una proteina omologa alla proteina Yip1p di lievito e fa parte della
numerosa famiglia di proteine YIP di mammifero che comprende anche un’altra
isoforma di Yip1, la Yip1A. Da dati presenti in letteratura è noto che la Yip1A
rappresenta l’isoforma ubiquitaria, mentre la Yip1B sembra essere l’isoforma
muscolo-specifica (Tang et al., 2001). Per verificare l’espressione di queste due
isoforme sono stati effettuati esperimenti di Real-Time PCR in diversi tessuti. E’
emerso che la Yip1A è espressa in molti dei tessuti analizzati anche se a livelli
differenti, compreso il cuore, ma la sua espressione è assente nei diversi tipi di
muscolo scheletrico adulto analizzati. Al contrario Yip1B è espressa
esclusivamente nei muscoli scheletrici e nel muscolo cardiaco: è stata quindi
confermata la sua natura di proteina muscolo-specifica. Poiché è noto che Yip1A
forma un complesso molecolare con il membro della stessa famiglia di proteine
Yif1A, è stata analizzata anche l’espressione della Yif1A e della sua omologa
Yif1B, per vedere se ci fosse un’isoforma muscolo-specifica. Entrambe sono
espresse, con diversi livelli d’espressione, in tutti i tessuti analizzati, quindi non
sembra evidenziarsi l’esistenza di una proteina Yif1 esclusivamente di tipo
muscolare.
Da esperimenti d’immunofluorescenza e analisi al microscopio confocale è
emerso che Yip1B si dispone in strutture puntiformi lungo il miotubo e nella
regione perinucleare, distribuzione osservata anche nelle fibre muscolari adulte.
Questa distribuzione della Yip1B è in gran parte sovrapponibile con la regione del
cis-Golgi. Tale localizzazione è quindi in accordo con una parte della letteratura
sull’isoforma omologa, Yip1A, che indica come questa isoforma sia localizzata
negli exit sites dell’ER, nell’ERGIC e nel cis-Golgi e cicli tra questi compartimenti,
mentre e’ in contrasto con il lavoro di Tang e colleghi (2001) che la localizza solo
nei siti di uscita del reticolo endoplasmatico.
DISCUSSIONE
___________________________
E’ stata poi analizzata l’espressione di entrambe le isoforme di Yip1 durante lo
sviluppo embrionale e post-natale del muscolo. Dati di Real-Time PCR hanno
evidenziato una riduzione dell’espressione di Yip1A con il progredire dello
sviluppo e quindi del differenziamento muscolare, e un contemporaneo aumento
dei livelli d’espressione di Yip1B, la cui espressione proteica compare dopo il 14°
giorno di vita embrionale. Questo indica che con il delinearsi delle caratteristiche
muscolari all’interno del tessuto, si ha la sostituzione di Yip1A con l’isoforma
muscolo-specifica Yip1B. Questo potrebbe significare che la funzione, ancora
poco chiara, di Yip1A nelle cellule non muscolari sia svolta da Yip1B nel muscolo
adulto, e che la sostituzione di un’isoforma con l’altra sia dovuta alle
caratteristiche
specifiche
dell’isoforma
Yip1B,
probabilmente
legate
ai
cambiamenti del sistema di membrane interne proprie delle cellule muscolari.
Con esperimenti di over-espressione è stata confermata la capacità di Yip1, e
della sua porzione N-terminale, di disgregare l’apparato di Golgi (Tang et al.,
2001), capacità che invece non ha la porzione di divergenza tra Yip1A e Yip1B
composta dai primi 80 amminoacidi. Sembra quindi che la sequenza proteica
responsabile di questo effetto risieda nella porzione N-terminale citosolica,
compresa tra gli amminoacidi 80 e 120, che rappresenta la regione solubile di
maggiore omologia tra le due isoforme.
Per comprendere la funzione di Yip1B è stato messo a punto un sistema di
mRNA-interference, con il quale si è ottenuto un notevole abbassamento
dell’espressione della proteina, sia in cellule C2C12 che in vivo in fibre muscolari
adulte. Dati presenti in letteratura hanno mostrato risultati contrastanti e
riguardanti soltanto l’isoforma ubiquitaria Yip1A: in un lavoro è emerso che il
silenziamento di Yip1A e del suo interattore Yif1A comporta la frammentazione
dell’apparato di Golgi (Yoshida et al., 2008). In un altro lavoro di Kano e colleghi
(2009), questo effetto non si verifica. Nei nostri risultati non abbiamo osservato
alcuna disgregazione dell’apparato di Golgi in accordo con il lavoro di Kano et al
(2009).
Il prossimo passo sarà quindi quello di indagare la funzione di Yip1B ed in
particolare di verificare se il silenziamento di Yip1B possa comportare una
85
DISCUSSIONE
___________________________
localizzazione errata delle diverse proteine residenti nel reticolo sarcoplasmatico.
Attualmente non si conoscono i meccanismi responsabili della localizzazione delle
proteine residenti nel reticolo sarcoplasmatico ed in particolare quali siano i
meccanismi di ritenzione nel reticolo e di targeting nelle diverse regioni
specializzate. Infatti la maggior parte delle proteine residenti nel reticolo
sarcoplasmatico è priva dei tipici segnali di ritenzione nell’ER.
A questo proposito è stato ipotizzato che alcune di esse si localizzano in modo
diverso da quello canonico, cioè che vengano trasportate fuori dal reticolo
attraverso il traffico vescicolare e che vengano poi riportate nel RS, ma il
meccanismo attraverso il quale ciò avviene è ancora sconosciuto.
A supporto di questa ipotesi sono presenti in letteratura alcuni dati riguardanti
alcune proteine del reticolo sarcoplasmatico. Per la calsequestrina sembra che la
corretta localizzazione nel RS sia dovuta ad un’attiva uscita dall’ER, tramite il
trasporto mediato da vescicole COPII (Nori et al, 2004), mentre per altre proteine
del reticolo sarcoplasmatico longitudinale, quali la SERCA1 (Newton et al., 2003).
ed il fosfolambano e la sarcolipina (Butler et al., 2007), e’ stato ipotizzato un
meccanismo di continuo recupero dall’ERGIC in quanto presenti anche a livello
del compartimento intermedio. Successivamente sarà quindi importante verificare
se Yip1B possa essere coinvolta nel “targeting” di queste o di altre proteine nelle
diverse regioni della fibra muscolare.
86
6 Bibliografia
Alberts B., Johnson A., LewisJ., Raff M., Roberts K. and Walter P. (2004).
Biologia molecolare della cellula. IV ed. Zanichelli.
Appenzeller-Herzog C. and Hauri H.P. (2006). The ER-Golgi intermediate
compartment (ERGIC): in search of its identity and function. J. Cell Sci. 119:
2173-2183.
Bagnato P., Barone V., Giacomello E., Rossi D. and Sorrentino V. (2003).
Binding of an ankyrin-1 isoform to abscurin suggests a molecular link between the
sarcoplasmic reticulum amd myofibrils in striated muscle. J. Cell Biol. 160: 245253.
Barlowe C. (2003). Signals for COPII-dependent export from the ER: what’s the
ticket out? TrendsCell Biol. 13: 295-300.
Barlowe C., Orci L., Yeung T., Hosobuchi M., Hamamoto S., Salama N., Rexach
M.F., Ravazzola M., Amherdt M. and Schekman R. (1994).COPII: a membrane
coat formed by Sec proteins that drive vescicle budding from the endoplasmic
reticulum. Cell 77: 895-907.
Barrowman J., Wang W., Zhang Y. and Ferro-Novick S. (2003). The Yip1p.Yif1p
complex is required for the fusion competence of endoplasmic reticulum-derived
vescicles. J. Biol. Chem. 278: 19878-19884.
Beard N.A., Laver D.R. and Dulhunty A.F. (2004). Calsequestrin and the calcium
release channel of skeletal and cardiac muscle.Prog.Biophys. Mol. Biol. 85: 33-69.
Beck R., Ravet M., Wieland F.T. and Cassel D. (2009). The COPI system:
molecular mechanisms and function. FEBS Letters 583: 2701-2709.
Blake D.J., Weir A., Newey S.E. and Davies K.E. (2002). Function and genetics of
dystrophin and dystrophin-related proteins in muscle. Physiol. Rev. 82: 291-329.
BIBLIOGRAFIA
______________________________________
Breuza L., Halbeisen R., Jeno P., Ottes S., Barlowes C., Hong W. and Hauri H.P.
(2004). Proteomics of endoplasmic reticulum-Golgi intermediate compartment
(ERGIC) membrane from brefeldin A-treated HepG2 cells identifies ERGIC-32,
a new cycling protein that intercts with human Erv46. J. Biol. Chem. 279: 4724247253.
Butler J., Lee A.G., Wilson D.I., Spalluto C., Hanley N.A. and East M. (2007).
Phospholamban and sarcolipin are maintained in the endoplasmic reticulum by
retrieval from the ER-Golgi intermediate compartment. Cardio. Res. 74: 114-123.
Calero M. and Collins R.N. (2002). S. Cerevisiae Pra1p/Yip3 interacts with Yip1p
and Rab proteins. Biochem. Byophys. Res. Comm.290:676-681.
Calero M., Whittaker G.R. and Collins R.N. (2001). Yop1p, the yeast homolog of
the polyposis locus protein 1, interacts with Yip1p and negatively regulates cell
growth. J. Biol. Chem. 276: 12100-12112.
Calero M., Winand N.J. and Collins R.N. (2002). Identification of the novel
proteins Yip4p and Yip5p as Rab GTPase interacting factors. FEBS Lett. 515:8998.
Cao X. and Barlowe C. (2000). Asymmetric requirements for a Rab GTPase and
SNARE proteins in the fusion of COPII vesicles with acceptor membranes. J.
Cell Biol. 149: 55-65.
Chen C.Z., Calero M., DeRegis C.J., Heidtman M., Barlowe C. and Collins R.N.
(2004). Genetic analysis of Yip1p function reveals a requirement for Golgilocalized Rab proteins and Rab-GDI. Genetics 168: 1827-1841.
Chen J.L., Fucini R.V., Lacomis L., Erdjument-Bromage H., Tempst P. and
Stamnes M.(2005). Coatomer-bound Cdc42 regulates dynein recruitmen to COPI
vesicles. J. Cell Biol. 169: 383-389.
Derby M.C. and Gleeson P.A.(2007). New Insight into membrane trafficking and
protein sorting. Int. Rev. Cito. 261: 47-116.
88
BIBLIOGRAFIA
______________________________________
Dulhunty A.F.(2006). Excitation-contraction coupling from 1950s into the new
millennium. Clin. Exp. Pharmacol. Physiol. 33: 763-72.
Flucher B.E., Andrews S.B. and Daniels M.P. (1994). Molecular organization of
transverse tubule/sarcoplasmic reticulum junctions during development of
excitation-contraction coupling in skeletal muscle. Mol. Biol. Cell5: 1105-1118.
Flucher B.E. and Franzini-Armstrong C.(1996). Formation of junctions involved
in excitation-contraction coupling in skeletal and cardiac muscle. Proc. Natl.
Acad. Sci. USA 93: 8101-8106.
Franzini-Armstrong (2004). The membrane systems of muscle cells, 3rd edn. In:
Miology. Mc Graw-Hill. Pp. 232-56.
Gatti G., Trifari S., Mesaeli N., Robert Parker J.M., Michalak M. and Meldolesi J.
(2001). Head-to-tail oligomerization of calsequestrin: a novel mechanism for
heterogeneous distribution of endoplasmic reticulum. J.Cell Biol. 154: 525-534.
Giacomello E. and Sorrentino V. (2009). Localization of ank 1.5 in the
sarcoplasmic reticulum precedes that of SERCA and RyR: relantionship with the
orgazination of abscurin in developing sarcomeres. Histochem. Cell Biol. 131:
371-382.
Giraudo C.G. and Maccioni H.J. (2003). Endoplasmic reticulum export of
glycosyltransferases depends on interaction of a cytoplasmic dibasic motif with
Sar1. Mol. Biol. Cell 14: 3753-3766.
Grosshans B.L., Ortiz D. and Novick P. (2006). Rabs and their effectors:
achieving specificity in membrane traffic. Proc. Natl. Acad. Sci USA 103: 1182111827.
Heidtman M., Chen C.Z., Collins R.N. and Barlowe C. (2003). A role for Yip1p in
COPII vesicle biogenesis. J. Cell Biol. 163: 57-69.
Heidtman M., Chen C.Z., Collins R.N. and Barlowe C. (2005). Yos1p is a novel
subunit of the Yip1p-Yif1p complex and is required for transport between the
endoplasmic reticulum and the Golgi complex. Mol. Biol. Cell 16: 1673-1683.
89
BIBLIOGRAFIA
______________________________________
Hong W. (2005). SNARE and traffic. Biochim. Biophys.Acta 1744: 120-144.
Houle T.D., Ram M.L., McMurray W.J. and Cala S.E. (2006). Different
endoplasmic reticulum trafficking and processing pathways for calsequestrin
(CSQ) and epitope-tagged CSQ. Exp.Cell Res. 312: 4150-4161.
Kaakinen M., Papponen H. and Metsikkö K. (2008). Microdomains of
endoplasmic reticulum within the sarcoplasmic reticulum of skeletal muscle
myofibers. Exp.Cell Res. 314: 237-245.
Kaisto T. and Metsikkö K. (2003). Distribution of the endoplasmic reticulum and
its relationship with the sarcoplasmic reticulum in skeletal myofibers. Exp. Cell
Res. 289: 47-57.
Kaisto T., Luukela V., Birr E. and Metsikkö K. (2002). Retargeting of viral
glycoproteins into a non-exporting compartment during the myogenic
differntiation of rat L6 cells. Cell. Tissue Res. 308:381-390.
Kamena F., Diefenbacher M., Kilchert C., Schwarz H. and Spang A. (2008).
Ypt1p is essential for retrograde Golgi-ER transport and for Golgi maintenance
in S. Cerevisiae. J. Cell Sci. 121: 1293-1302.
Kano F., Yamauchi S., Yoshida Y., Watanabe-Takahashi M., Nishikawa K.,
Nakamura N. and Murata M. (2009). Yip1A regulates the COPI-independent
retrograde transport from the Golgi copmplex to the ER. J. Cell. Sci. 122: 22182227.
Kuehn M.J., Hermann J.M. and Schekman R. (1998). COPII-cargo interactions
direct protein sorting into ER-derived transport vesicles. Nature 391: 187-190.
Lu Z., Joseph D., Bugnard E., Zaal K.J.M. and Ralston E. (2001). Golgi complex
reorganization during muscle differenziation: visualization in living cells and
mechanism. Mol. Biol. Cell 12: 795-808.
Lupashin V. and Sztul E. (2005). Golgi tehtering factors. Biochim.Biophys. Acta
1744: 325-339.
90
BIBLIOGRAFIA
______________________________________
MacLennan D.H.(1990). Molecular tools to elucidate problems in excitationcontraction coupling. Biophys. J. 58: 1355-1365.
Mancias JD and Goldberg J. (2005). Exiting the endoplasmic reticulum. Traffic. 6:
278-85.
Matern H., Yang X., Andrulis E., Sternglanz R., Trepte H.H. and Gallwitz
D.(2002). A novel Golgi membrane protein is part of a GTPase-binding protein
complex involved in vesicle targeting. EMBO J. 19:4485-4492.
Matsuoka K., Orci L., Amherdt M., Bednarek S.Y., Hamamoto S., Schekman R.
and Yeung T. (1998). COPII-coated vesicle formation reconstituted with purified
coat proteins and chemically defined liposomes. Cell 93: 263-275.
Mironov A.A., Beznoussenko GV., Trucco P., Lupetti P., Smith J.D., Geerts A.J
et al. (2003). Er-to-Golgi carriers arise through direct en bloc protusion and
multistage maturation of specialized ER exit domains. Dev.Cell 5: 583-594.
Newton T., Black J.P.J., Butler J., Lee A.G., Chad J. and East M. (2003).
Sarco/endoplasmic-reticulum calcium ATPase SERCA1 is manteined in the
sarcoplasmic reticulum by a retrieval signal located between residues 1 and 211.
Biochem. J. 371: 775-782.
Nori A., Bortoloso E., Frasson F., Valle G. and Volpe P. (2004). Vesicle budding
from endoplasmic reticulum is involved in calsequestrin routing to sarcoplasmic
reticulum of skeletal muscles. Biochem. J. 379: 505-512.
Pette D. (2001). Historical perspective: plasticity of mammalian skeletal muscle. J.
Appl. Physiol. 90: 1119-1124.
Pfaffl M.W. (2001). A new mathematical model for relative quantification in RealTime RT-PCR. Nucl. Acids Res. 29: 2002-2007.
Pfeffer S and Aivazian D. (2004). Targeting Rab GTPases to distinct membrane
compartments. Nat Rev Mol Cell Biol. 5: 886-96.
91
BIBLIOGRAFIA
______________________________________
Protasi F. (2002). Structural interaction between RYRs and DHPRs in calcium
release units of cardiac and skeletal muscle cells. Front Biosci. 7:d650-8.
Rahkila P., Alakangas A., Väänänen K. and Metsikkö K. (1996). Transport
pathway, maturation,and targetting of the vesicular stomatitis virus glycoprotein in
skeletal muscle fibers. J. Cell Sci. 109: 1585-1596.
Rahkila P., Väänänen K., Saraste J. and Metsikkö K. (1997). Endoplasmic
reticulum to Golgi trafficking in multinucleated skeletal muclefibers. Exp.Cell Res.
234: 452-464.
Ralston E., Lu Z. and Ploug T. (1999). The organization of the golgi complex and
microtubules in skeletal muscle is fiber type-dependent. J. Neurosci. 19: 10964705.
Ralston E., Ploug T., Kalhovde J. and Lømo T.(2001). Golgi complex,
endoplasmic reticulum exit sites and microtubules in skeletal muscle fibers are
organized by patterned activity. J. Neurosci. 21: 875-883.
Roghi C. and Allan V.J. (1999). Dynamic association of cytoplasmic dynein heavy
chain 1a with the Golgi apparatus and intermediate compartment.J. Cell Sci. 112:
4673-4685.
Rosati P., Colombo R., Maraldi N. (2007). Istologia. V ed. Casa Editrice EdisErmes.
Rossi D., Barone V., Giacomello E., Cusimano V. and Sorrentino V. (2008). The
sarcoplasmic reticulum: an organized patchwork of specialized domains. Traffic 9:
1044-1049.
Sanger J.W., Chowrashi P., Shaner N.C., Spalthoff S., Wang J., Freeman N.L. and
Sanger J.M. (2002). Myofibrillogenesis in skeletal muscle. Clin. Ortho. Relat. Res.
403S: 153-162.
Schiaffino S. and Reggiani C. (1996). Molecular diversity of myofibrillar proteins:
gene regulation and functional significance. Physiol Rev. 76:371-423.
92
BIBLIOGRAFIA
______________________________________
Shakoori A., Fujii G., Yoshimura S., Kitamura M., Nakayama K. et al. (2003).
Identification of a five-pass transmembrane protein family localizing in the Golgi
apparatus and the ER. Biochem. Biophys. Res.Commun. 312: 850-857.
Sivars U., Aivazian D. and Pfeffer S.R. (2003). Yip3 catalyses the dissociation of
endosomal Rab-GDI complexes. Nature 425: 856-859.
Takekura H., Flucher B.E. and Franzini-Armstrong C. (2001). Sequential docking,
molecular differentiation, and positioning of T tubult/SR junction in developing
mouse skeletal muscle. Dev. Biol. 239: 204-214.
Takeshima H., Komazaki S., Nishi M., Lino M. and Kangawa K. (2000).
Junctophilins: A novel family of junctional membrane complex proteins. Mol. Cell
6: 11-22.
Tang B.L., Ong Y.S., Huang B., Wei S., Wong E.T., Qi R., Horstmann H. and
Hong W. (2001). A membrane protein enriched in endoplasmic reticulum exit
sites interacts with COPII. J. Biol. Chem. 276: 40008-40017.
Tang B.L., Wang Y., Ong Y.S. and Hong W. (2005). COPII and exit from the
endoplasmic reticulum. Biochim. Biophys. Acta 1744: 293-303.
Yang X., Matern H.T. and Gallwitz D. (1998). Specific binding to a novel and
essential Golgi membrane protein (Yip1p) functionally links the transport
GTPases Ypt1p and Ypt31p. EMBO J. 17: 4954-4963.
Yoshida Y., Suzuki K., Yamamoto A., Sakai N., Bando M., Tanimoto K.,
Yamaguchi Y., Sakaguchi T., Akhter H. and Fujii G. (2008). YIPF5 and YIF1A
recycle between the ER and the Golgi apparatus and are involved in the
maintenance of the Golgi structure. Exp. Cell Res. 314: 3427-3443.
Watson P., Forster R., Palmer K. J., Pepperkok R. and Stephens D.J. (2005).
Coupling of ER exit to microtubules through direct interaction of COPII with
dynactin. Nat. Cell Biol. 7: 48-55.
93
BIBLIOGRAFIA
______________________________________
White J., Johannes L., Mallard F., Girod A., Grill S., Reinsch S., Keller P.,
Tzschaschel B., Eckard A., Goud B. and Stelzer EHK (1999). Rab6 coordinates a
novel Golgi to ER retrograde transport pathway in live cells. J Cell Biol 147: 743759.
94