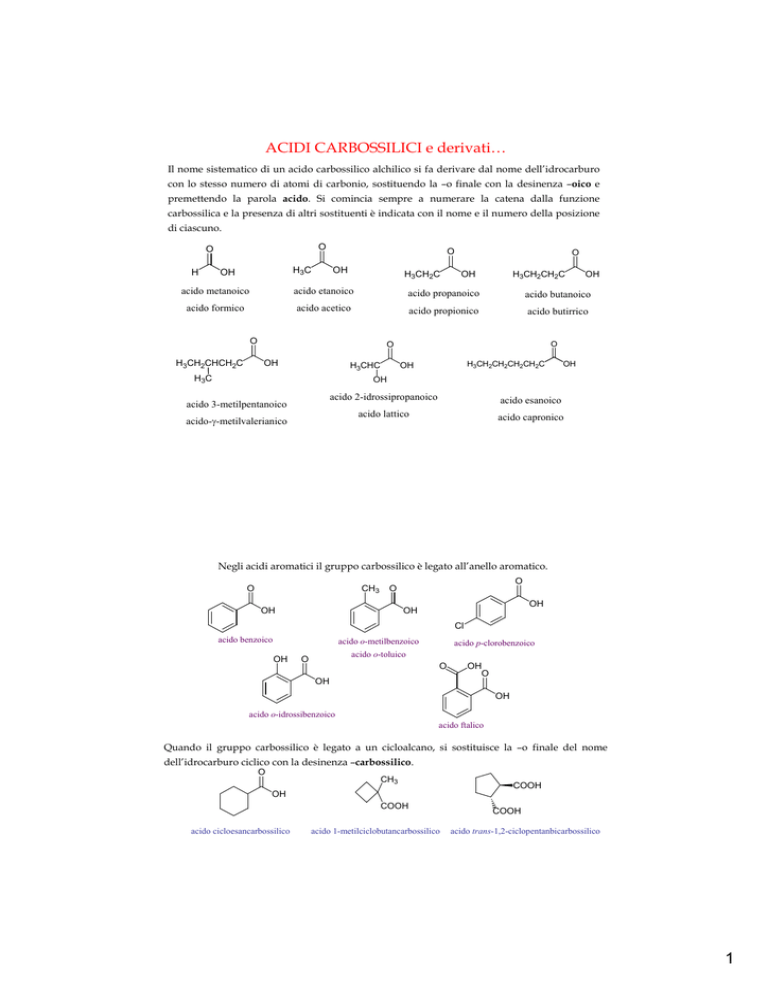
ACIDI CARBOSSILICI e derivati…
Il nome sistematico di un acido carbossilico alchilico si fa derivare dal nome dell’idrocarburo
con lo stesso numero di atomi di carbonio, sostituendo la –o finale con la desinenza –oico e
premettendo la parola acido. Si comincia sempre a numerare la catena dalla funzione
carbossilica e la presenza di altri sostituenti è indicata con il nome e il numero della posizione
di ciascuno.
O
O
H
H 3C
OH
O
OH
H3CH2C
O
OH
H3CH2CH2C
OH
acido metanoico
acido etanoico
acido propanoico
acido butanoico
acido formico
acido acetico
acido propionico
acido butirrico
O
H3CH2CHCH2C
O
OH
H3CHC
H 3C
O
H3CH2CH2CH2CH2C
OH
OH
OH
acido 3-metilpentanoico
acido 2-idrossipropanoico
acido esanoico
acido lattico
acido capronico
acido-γ-metilvalerianico
Negli acidi aromatici il gruppo carbossilico è legato all’anello aromatico.
O
CH3
O
O
OH
OH
acido benzoico
acido o-metilbenzoico
OH
Cl
OH
acido p-clorobenzoico
acido o-toluico
O
O
OH
OH
O
OH
acido o-idrossibenzoico
acido ftalico
Quando il gruppo carbossilico è legato a un cicloalcano, si sostituisce la –o finale del nome
dell’idrocarburo ciclico con la desinenza –carbossilico.
O
CH3
OH
COOH
acido cicloesancarbossilico
acido 1-metilciclobutancarbossilico
COOH
COOH
acido trans-1,2-ciclopentanbicarbossilico
1
Il gruppo ottenuto dagli acidi carbossilici per rimozione dell’ossidrile è noto come acile
e il suo nome viene formato da quello dell’acido corrispondente cambiando la desinenza
–ico con –ile. Quando nel nome dell’acido è usata la dizione –carbossilico, questa si
trasforma in –carbonilico.
O
O
H
O
H
OH
acido formico
H3C
formile
O
OH
H3C
acetile
acido acetico
O
O
O
O
OH
OH
acido benzoico
benzoile
acido
ciclopentancarbonile
ciclopentancarbossilico
I cloruri degli acidi sono indicati con il nome sistematico di cloruri di acile.
O
H3C
H3CH2CH2C
Cl
cloruro di acetile
O
O
O
Cl
Cl
cloruro di butanoile
cloruro di
cicloesancarbonile
cloruro di etanoile
Cl
cloruro di benzoile
Il nome delle anidridi si ottiene sostituendo la terminazione -o degli acidi
carbossilici corrispondenti con –a preceduto da anidride anziché da acido.
O
H3C
O
O
O
CH3
H3C
anidride acetica
O
H
anidride acetica formica
anidride etanoica
anidride simmetrica
O
anidride etanoica metanoica
anidride mista
2
Il nome dei sali e degli esteri degli acidi carbossilici si forma dalla stessa radice trasformando
la desinenza –ico dell’acido in –ato cui si fa seguire il nome del catione (nel caso del sale) o il
nome del radicale organico che si trova sull’ossigeno del carbossile (nel caso dell’estere).
O
O
O-Na+
O-
H3CH2C
benzoato di sodio
2
Ca2+
propanoato di calcio
O
O
OCH2CH3
O
H3CH2C
O2N
CHCH3
O
propanoato di fenile
p-nitrobenzoato di etile
CH3
O
cicloesancarbossilato di isopropile
Gli esteri ciclici sono chiamati lattoni. Nella nomenclatura sistematica essi sono denominati
come “ossa-2-cicloalcanoni”. I loro nomi comuni derivano dal nome comune dell’acido
carbossilico, che determina la lunghezza della catena carboniosa, e da una lettera greca che
indica il carbonio a cui è legato l’ossigeno carbossilico.
O
O
O
O
O
O
O
O
2-ossaciclopentanone
2-ossacicloesanone
3-metil-2-ossacicloesanone
3-etil-2-ossaciclopentanone
γ-butirrolattone
δ-valerolattone
δ-caprolattone
γ-caprolattone
3
Il nome delle ammidi si forma sostituendo la desinenza –oico in ammide (o –carbossilico
in –carbossiammide).
H
O
O
O
H3C
NH2
NH2
NH2
metanammide
etanammide
formammide
acetammide
O
NH2
cicloesancarbossiammide
benzammide
Se l’atomo di azoto dell’ammide porta dei sostituenti alchilici, il nome dell’ammide si fa
precedere dalla maiuscola N-, per precisare la sostituzione dell’azoto, seguita dal nome o
dai nomi dei radicali alchilici.
O
O
H
N
N
CH3
CH2CH3
O2N
CH3
N,N-dimetilformammide
CH3
N-etil-N-metil-p-nitrobenzammide
Se il sostituente è un fenile, la desinenza del nome dell’acido carbossilico si sostituisce con –
anilide.
H
N
H
N
CCH3
O
C
O
acetanilide
benzanilide
Nella nomenclatura sistematica dei nitrili, il suffisso –nitrile è aggiunto al nome
dell’idrocarburo con lo stesso numero di atomi di carbonio, compreso l’atomo di carbonio
del gruppo ciano.
5
4
3
2
1
CH3CH2CH2CH2C
N
pentanonitrile
CH3C CHC N
CH3
3-metil-2-butenenitrile
I nitrili correlati agli acidi acetico e benzoico sono chiamati rispettivamente acetonitrile e
benzonitrile
C N
CH3C N
acetonitrile
benzonitrile
etanonitrile
Quando il gruppo ciano si trova su un cicloalcano, si indica con il nome dell’idrocarburo
seguito dal suffisso –carbonitrile.
CN
C N
H3C
cicloesancarbossinitrile
trans-2-metilciclopropanocarbonitrile
4
PREPARAZIONE DI ACIDI CARBOSSILICI DA REAZIONI DI OSSIDAZIONE
1. Gli alcoli primari sono inizialmente ossidati ad aldeidi con ossidanti a base di Cr6+. La
reazione tuttavia non si ferma all’aldeide che è ulteriormente ossidata ad acido carbossilico.
O
H3CH2CH2CH2C
H2CrO4
OH
O
ulteriore
H3CH2CH2CC
H
ossidazione
OH
H3CH2CH2CC
2. In soluzione basica l’acido carbossilico si forma come sale e dagli alcoli e dalle aldeidi.
L’acidificazione del sale carbossilato, dopo che la reazione di ossidazione è giunta a
completezza, genera l’acido carbossilico libero.
CH2CH3
CH2CH3
CHCH2OH
H3CH2CH2CH2C
CHCO
KMnO4
OH, H2O
o
CH2CH
3
-
H2SO4
H3CH2CH2CH2C
CHCOH
H3CH2CH2CH2C
O
O
CH2CH3
CHCH
H3CH2CH2CH2C
O
PREPARAZIONE DI ACIDI CARBOSSILICI DA REAZIONI DI OSSIDAZIONE
3. Un agente ossidante blando quale Ag2O è utilizzato nell’ossidazione di aldeidi ad acidi
carbossilici (saggio di Tollens).
O
H3CH2CH2CC
O
O
H
H+
Ag2O
NaOH, H2O
O-
H3CH2CH2CC
OH
H3CH2CH2CC
PREPARAZIONE DI ACIDI CARBOSSILICI PER CARBONATAZIONE DI REATTIVI
DI GRIGNARD
I reattivi di Grignard reagiscono con CO2 per dare, dopo trattamento con un acido, acidi
carbossilici. Il meccanismo di reazione comporta un attacco nucleofilo del reattivo sul
carbonio di CO2 per dare un carbossilato, che, per protonazione durante lo spegnimento
della reazione, porta all’acido carbossilico.
CH2CH3
CHCH2MgCl
H3CH2CH2C
CH2CH3
CO2
CHCH2CO [MgCl]
H3CH2CH2C
CH2CH3
H+
-
+
CHCH2COH
H3CH2CH2C
O
O
5
Esercizio: Mostrare come preparare l’acido pentanoico dai seguenti composti:
a. 1-pentanolo
L’ossidazione dell’1-pentanolo con acido cromico o permanganato di potassio porta all’acido
pentanoico
O
H2CrO4
OH
H3CH2CH2CH2CH2C
H3CH2CH2CH2CC
O
ulteriore
H
ossidazione
H3CH2CH2CH2CC
OH
b. 1-butanolo
La trasformazione dell’1-butanolo in 1-bromobutano e quindi in butilmagnesio bromuro, seguita
dalla carbonatazione e acidificazione fornisce l’acido pentanoico.
H3CH2CH2CH2C
OH
PBr3
Mg, etere
H3CH2CH2CH2C
H3CH2CH2CH2C
Br
MgBr
CO2
H
+
H3CH2CH2CH2CH2COH
H3CH2CH2CH2CCO-
O
O
Esercizio: Mostrare come sintetizzare ciascun acido carbossilico partendo da un
alogenuro alchilico o arilico:
CH3
CH3
CH
COOH
a)
CHBr
da
1) Mg, etere
2) CO2
3) H+
1) Mg, etere
2) CO2
b)
H3CHC
CHCH2COOH
da
H3CHC
CHCH2Br
3) H+
6
MECCANISMO DELLE REAZIONI DI SOSTITUZIONE NUCLEOFILA
Tutti i derivati degli acidi carbossilici danno reazione di sostituzione nucleofila acilica.
Se il nucleofilo è carico negativamente:
O
O
+
R
+
Y
R
Il nucleofilo carico
negativamente attacca il
carbonio carbonilico
Y
OH
R
O
O
+
H2O
R
Y
Y
OH
Eliminazione della base più
debole dall’intermedio
tetraedrico
Se il nucleofilo è neutro:
R
O
OH
O
O
+
Y
OH2
R
Il nucleofilo neutro
attacca il carbonio
carbonilico
Y
OH
R
Rimozione di un
protone
dall’intermedio
tetraedrico ad
opera di una base
Y
OH
Eliminazione della base più
debole dall’intermedio
tetraedrico
REAZIONI DEGLI ALOGENURI ACILICI
Gli alogenuri acilici reagiscono con ioni carbossilato per formare anidridi, con gli alcoli per
formare esteri, con acqua per formare acidi carbossilici e con le ammine per formare ammidi.
In ognuno di questi casi il nucleofilo entrante è una base più forte dello ione alogenuro
uscente.
a) Scrivere il meccanismo di reazione del cloruro di acetile con acqua per formare acido
acetico
O
O
+
H3C
H
Cl
H3C
O
Cl
H3C
Cl
H
H3C
H
O
Cl
OH
O
O
OH
O
O
H3C
H
O
H
H3C
OH
H
B
7
b) Scrivere il meccanismo di reazione del cloruro di propanoile con metilammina per formare Nmetilpropionammide.
O
+
H3CH2C
O
N
H3C
H
H
Cl
O
H3CH2C
NHCH3
O
O
O
H3CH2C
H3CH2C
Cl
H3CH2C
Cl
Cl
NHCH3
N
N
H3C
H3C
H
H
H3CH2C
NHCH3
H
H
B
REAZIONI DELLE ANIDRIDI
La sostituzione nucleofila avviene a uno dei due gruppi carbonilici, mentre il secondo
gruppo carbonilico diventa parte del gruppo uscente.
N.B. Le anidridi non possono essere utilizzate per preparare un cloruro acilico, perché
RCOO- è una base più forte e quindi un gruppo uscente peggiore di Cl-.
Scrivere il meccanismo di sintesi della benzammide utilizzando anidride benzoica ed un
opportuno nucleofilo
+
O
O
H
N
H
H
NH2
O
O
NH3
H
NH3
H2N
O
O
O
O
O
O
NH2
O
O
NH2
O
O
+
O
O
8
REAZIONI DEGLI ACIDI CARBOSSILICI
Gli acidi carbossilici sono acidi organici forti
Reazione acido-base
O
Sostituzione nucleofila
+
H
R
Nu
+
O
O
O
O
R
+
H
NuH
R
O
H
Nu
R
O
O
Nu
Conversione di acidi carbossilici in cloruri degli acidi
Gli acidi carbossilici possono essere convertiti nei cloruri degli acidi utilizzando SOCl2 o PCl3.
O
O
+
R
OH
O
O
S
Cl
Cl
O
SOCl
R
+
SOCl
O
R
O
R
Cl
Cl
SO2
+
Cl
Cl
Conversione di acidi carbossilici in esteri
Il trattamento di un acido carbossilico con un alcol in presenza di un catalizzatore acido forma
un estere. Questa reazione è nota con il nome di esterificazione di Fisher.
H+
O
R
OH
OH
R
OH
OH
OH
R
OH
R
O
R'OH
OH
R'O
H
R'
B-
H+
B-
R
OH
OH
O
OR'
R
OR'
R
OH2
R'O
9
Mostrare come trasformare l’acido fenilacetico nel seguente composto:
O
OCH3
H2C
O
L’estere metilico dell’acido fenilacetico può essere preparato mediante esterificazione di Fisher con
metanolo in ambiente acido.
H+
O
PhH2C
OH
OH
OH
PhH2C
OH
OH
PhH2C
OH
PhH2C
H3CO
O
CH3OH
OH
H
H 3C
B-
B-
O
PhH2C
H+
OH
OH
OCH3
PhH2C
PhH2C
H3CO
OCH3
OH2
REAZIONI DEGLI ESTERI
Gli esteri sono idrolizzati con acqua in presenza sia di acidi sia di basi per formare degli
acidi carbossilici o dei carbossilati, rispettivamente.
Reazione acido catalizzata di idrolisi di un estere ad acido carbossilico
H+
O
R
OH
OR'
R
OH
OR'
OH
R
OR'
R
O
H2O
OR'
HO
H
H
B-
H+
B-
R
OH
OH
O
OH
R
OH
R
HO
O
R'
H
10
Reazione base catalizzata di idrolisi di un estere ad acido carbossilico
O
O
O
O
+
R
OR'
R
OR'
R
OH
OR'
+
R
R'OH
O
HO
OH-
Scrivere la formula di struttura del composto principale della reazione del benzoato di etile con i seguenti
reagenti:
a. H2O, NaOH
O
O-Na+
b. H2O, H2SO4
O
OH
c. n-butanolo, HCl
O
OCH2CH2CH2CH3
Mostrare i meccanismi di ciascuna reazione…
11
Mostrare come effettuare la seguente conversione:
O
H3CH2CH2C
O
H
H3CH2CH2CHC
C
Cl
CH2CH3
La reazione si realizza in più stadi di reazione.
STADIO 1. Una condensazione aldolica base-catalizzata seguita da disidratazione per dare un chetone α,βinsaturo.
O
O
O
H3CH2CH2C
NaOH
H3CH2CH2C
H
1
H3CH2CHC
H
H
H3CH2CH2CHC
H2O
O
HO
CH
H
CH2CH3
NaOH
- H2O
2
O
H3CH2CH2CHC
C
OH
CH2CH3
SOCl2
3
H3CH2CH2CHC
O
Ag2O
NaOH, H2O
H3O+
H3CH2CH2CHC
C
CH2CH3
H
STADIO 2. l’ossidazione
dell’aldeide
ad
acido
carbossilico
può
essere
effettuata con una soluzione
di Tollens.
O
C
CH2CH3
Cl
STADIO 3. la reazione dell’acido carbossilico con il cloruro di tionile
porta al cloruro dell’acido.
12