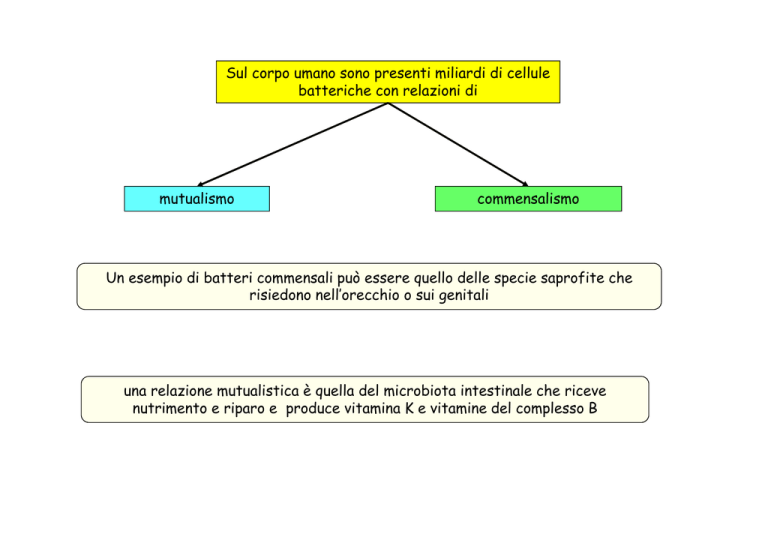
Sul corpo umano sono presenti miliardi di cellule
batteriche con relazioni di
mutualismo
commensalismo
Un esempio di batteri commensali può essere quello delle specie saprofite che
risiedono nell’orecchio o sui genitali
una relazione mutualistica è quella del microbiota intestinale che riceve
nutrimento e riparo e produce vitamina K e vitamine del complesso B
La quantità di microrganismi presenti sul corpo umano è sbalorditiva: una persona
“media” ha 1013 cellule proprie, 1014 cellule batteriche
nell’ intestino e 1011 cellule batteriche sulla pelle
In termini percentuali, questo significa che il 90% circa delle
cellule presenti in un corpo umano è procariotico
L’epidermide intatta è la prima barriera di difesa
È colonizzata soprattutto da monodermi
che sfruttano i nutrienti prodotti da
Ghiandole sebacee
Ghiandole sudoripare
Corynebacterium
Micrococcus
Staphylococcus
Dopo la pubertà il possono diventare dominanti i batteri del genere
Propionibacterium
Scindono i lipidi del sebo producendo acidi grassi
(es ac.oleico) che limitano la crescita di altre specie
La cute è un ambiente omogeneo per temperatura ma il tasso di umidità, variabile,
definisce ambienti differenti in cui si trovano specie diverse.
occludendo un'area della cute
dell'avambraccio (secca), nel giro di 4
giorni la popolazione microbica passa da
3x103 a 3x108 cellule /cm2
3x1038
3x10
Aw è il fattore abiotico più importante nel limitare la quantità di batteri
I microrganismi nelle ghiandole
sebacee e nei follicoli di peli e
capelli non sono raggiunti dalla
normale pulizia
e provvedono al rapido
ripopolamento delle aree
dopo la detersione
Carica microbica su oggetti toccati di frequente
Tratto respiratorio
superiore+bocca
umido
Ingresso continuo di
microrganismi
Nella bocca si trovano specie capaci
di adesione forte
Gli streptococchi orali producono glucani
e formano la placca
Nel cavo orale e nell’orofaringe si trovano
anche molte specie anaerobie
Il nasofaringe può essere colonizzato
da specie potenzialmente patogene
Tratto gastro-enterico
Dal duodeno verso l’ileo diminuisce l’ossigeno e aumenta il pH
duodeno
Tenue
LATTOBACILLI
E COCCHI
digiuno
ileo
ANAEROBI E
FACOLTATIVI
Nll’intestino crasso (colon)
l’ossigeno è stato consumato
Gli anaerobi fermentano
i polimeri indigeribili
Il rapporto Bacteroides/E. coli
è = 100:1
Le osservazioni sull’effetto protettivo della flora intestinale contro
i patogeni sono all’origine degli studi sull’impiego di batteri
probiotici come additivi per gli alimenti
Probiotici: batteri che mantengono in
equilibrio funzionale l’intestino proteggendo
l'organismo dalle malattie
Sono principalmente bifidobatteri e lattobacilli (batteri che utilizzano gli
zuccheri come fonte di energia e producono acido lattico)
Tratto uro-genitale
Il tratto esterno dell’uretra è
colonizzato in entrambi i sessi
VAGINA
Nelle donne adulte la vagina
è colonizzata dai
Scindono il glicogeno prodotto
dalle cellule epiteliali
Mantengono il pH
intorno a 4,4-4,6
Lattobacilli
RICAPITOLANDO..
105-106
Cuoio capelluto
106-107
Cute umida
103
Cute secca
<10-103
Occhi, protetti
109
Cavo orale
Aerobi e anaerobi
105-106
Tenue
Lattobacilli, enterococchi
109-1011
Crasso
pH alcalino, Gram-negativi
Le quantità sono riferite al numero di microrganismi per grammo di
tessuto o fluido o per cm2 di superficie
L’importanza del microbiota “normale” è stata confermata da
studi sugli animali germ-free
La malattie infettive sono causate
Da poche specie che hanno evoluto
adattamenti specifici per il parassitismo
Dalla rottura dell’equilibrio tra
specie commensali e il loro ospite
ESISTONO PATOGENI
INVASIVI
TOSSIGENICI
i batteri patogeni possono essere:
Intracellulari
facoltativi
Intracellulari
extracellulari
Usando strategie differenti per interagire con l’ospite
Una specie che abbia evoluto strategie di adattamento per
parassitare un ospite, viene definita patogena.
Il potere patogeno è un attributo della specie, e
viene definito dalla precisazione dell’ospite
Vibrio cholerae
è patogeno per l’uomo;
Aeromonas salmonicida è
patogeno per i pesci
All’interno di una specie
patogena la forza della
patogenicità di un ceppo ne
definisce virulenza..
Anche quando è avirulento, un ceppo
appartenente a una specie patogena
continua a essere considerato
patogeno
Shasta
1177
POTERE PATOGENO:
E’ davvero funzione
del solo microrganismo?
La complessità e la varietà dei fattori di virulenza sono state da
sempre oggetto di studio
La definizione del “potere patogeno” è stata considerata
tenendo conto delle sole potenzialità dei microrganismi
“postulati di Koch”
(1890)
1. Il parassita si ritrova in tutti i casi di una
determinata malattia, in circostanze tali da far ritenere
che esso sia responsabile delle alterazioni patologiche e
del decorso clinico della malattia
2. Il parassita non si ritrova in altre malattie come
parassita non patogeno
3. Dopo il suo isolamento dal malato e ripetuti passaggi in vitro,
il parassita deve riprodurre la malattia, se inoculato
4 (?) il microrganismo deve essere reisolato dall’animale
infettato sperimentalmente
Ma già all’epoca di Koch erano evidenti eccezioni come
Il colera: V. cholerae può essere isolato anche da
individui sani (non è valido il secondo postulato)
La lebbra: M.leprae non si coltiva in vitro
(non è applicabile il terzo postulato)
Da allora molti altri casi di difficile definizione sono stati messi in
evidenza, anche perché la situazione della medicina è
profondamente cambiata dai tempi di Koch
L’interazione ospite-parassita è complessa: non si può
prescindere dal considerare entrambi gli organismi coinvolti
Il potere patogeno si può valutare come danno provocato
rappresentandolo schematicamente con un grafico
L’entità del
danno varia con
il grado di
virulenza
Entità
del danno
STATO IMMUNITARIO
Scarsa
patogenicità
I
Patogeno; la risposta
può aggravare il
quadro
Patogeno + danno
da risposta
III
patogeno
II
Bassa patogenicità +
danno da risposta
IV
risposta alla presenza di
un microrganismo
V
VI
I microrganismi di classe 1
Es. Legionella pneumophila
sono associati a malattie solo in individui
con funzioni immunitarie insufficienti
sono di solito considerati
opportunisti o commensali
non provocano infezioni sintomatiche
in individui con uno stato
immunitario normale
Classe 2: la capacità di provocare malattia in individui normali è
indice della capacità di evadere le difese immunitarie
La risposta immune indotta nell’ospite normale dai patogeni di classe 2 non è tale
da provocare danni dopo la risoluzione dell’infezione acuta es. pneumococco
patogeni tossigenici: la loro curva è piatta
Entità
del danno
le tossine sono attive rapidamente e a dosi tanto basse
da rendere inifluente la reattività immunitaria dell’ospite
Il danno provocato dai microrganismi della classe tre può essere
mediato dal patogeno (in individui con immunità debole o normale)
Ma anche effetto di una violenta reazione infiammatoria se
la risposta immunitaria dell’ospite è imponente
es. Escherichia coli O157:H7 (ceppo EHEC)
trasmesso con l’ingestione di
hamburger poco cotti
in individui normali provoca diarrea con sangue nelle
feci e assenza di febbre
in individui con immunità insufficiente
provoca diarrea emorragica molto grave
se al danno provocato dal patogeno si associa quello provocato da una forte
reazione dell’ospite si ha la sindrome uremico-emolitica (HUS)
“relatività” del concetto di patogenesi Æ
riconsiderare la definizione di “Fattore di virulenza”
Tutto ciò che favorisce l’espressione della
patogenicità va considerato un fattore di virulenza
REGOLAZIONE
COLONIZZAZIONE
REGOLATORI
TOX
INVASINE
ENZIMI
GENICA
VIRULENZA
LA STRADA VERSO LA PATOGENESI
PUO’ ESSERE LUNGA
Ancestrale benigno, a
vita libera
E. coli
Acquisizione di PAI
E. coli O157H7
Patogeno a largo
spettro
S. Typhimurium
B. bronchiseptica
Specializzazione verso
un ospite
Patogeno virulento a
ristretto spettro d’ospite
S. Typhi
Isolamento della popolazione
Perdita di ricombinazione
M. tuberculosis
B. pertussis
M. leprae
Rickettsia
Mycoplasma
Patogeno virulento ospitedipendente
Perdita massiva di geni,
accumulo di pseudogeni,
decadimento del genoma
Patogeno obbligato ospitedipendente
IL PROCESSO COMPORTA SPESSO
L’ACQUISIZIONE DI TRATTI PER TGO
(trasferimento genico orizzontale)
Molti geni che codificano fattori di virulenza possono trasferirsi
orizzontalmente e si trovano spesso nelle PAI (Pathogenesis Islands)
tRNA
int
virA
virB
DR
Patogeno
mobA
DR
tRNA
NON patogeno
Le PAI sono presenti solo nei ceppi virulenti e hanno una struttura a mosaico,
frutto di diversi e successivi eventi di integrazione; ilcontenuto G+C è diverso
dal resto del cromosoma
Progresso evolutivo della formazione di PAI
Dopo molto tempo restano solo i geni
di virulenza, integrati nel cromosoma
I codoni nei geni estranei si
adattano al resto del cromosoma
vir
nei geni inattivati
si creano vaste delezioni
vir
int
int
int
vir
mob
vir
vir
mob
vir
mob
inattivazio/delezione
nei geni di mobilita’
nei geni delle integrasi si
verificano mutazioni puntiformi
Un fago o un plasmide si integra nel cromosoma
tempo
Se acquisire è essenziale
anche liberarsi di qualcosa può
essere molto utile..
Eliminare i
“GENI DI AVIRULENZA”
I cambiamenti che accompagnano l’adozione di uno stile di vita da patogeno,
rivelano geni di ANTIVIRULENZA nei patogeni emergenti
L’eliminazione patoadattativa di questi loci
migliora la fitness nel nuovo stile di vita
ma, contemporaneamente, può ridurre quella
nello stile precedente
l’evoluzione verso la patogenesi diventa via via
sempre più conveniente
PER UN PATOGNO, LA PRIMA NECESSITA’ E’ QUELLA DI
ELUDERE LE DIFESE DELL’OSPITE
corredo COMUNE
ai diversi individui
DIFESE INNATE
(RAPIDE)
BARRIERE, INFIAMMAZIONE
complemento
Esperienza PERSONALE
di contatto con i microbi
Difese a ponte
Intermedie
NK + B-B1
DIFESE ADATTATIVE
(LENTE)
Linfociti B, linfociti T
sebo
Muco
ciglia
detersione (fluidi)
BARRIERE
Cute
FISICHE mucose integre
pH +/- acido
succhi gastrici
Cute
vagina
Barriere esterne (aspecifiche):
CHIMICHE
Fattori umorali dell’immunità naturale
(composti chimici) Es.
lisozima
Transferrine
lattoperossidasi
Fattori umorali
dell’immunità naturale
LISOZIMA
rompe i legami β-1-4
glicosidici tra
N-acetil-glucosamina e
acido N-acetilmuramico
Legame β (1-4)
glucosidico
.
N-acetilmuramico
NAM
Distrugge il
peptidoglicano
attivo soprattutto sui
monodermi
NAG
N-acetil-glucosamina
Latte, lacrime, saliva
chela il ferro
LATTOFERRINA
(famiglia transferrine)
limitazione del
ferro disponibile
CONTROLLO
Crescita microbica
fagocitosi
chemiotassi dei
leucociti
SUPERAMENTO DIFESE INNATE
Propagazione
attraverso vettori
FATTORI DI ADESIONE
I patogeni i usano proteine specifiche (adesine) per legarsi alle
mucose e non essere allontanati
La cellula batterica e la cellula ospite sono
entrambe cariche negativamente
SI RESPINGONO
Per superare la repulsione le adesine sono
localizzate sull’estremità delle FIMBRIE (PILI)
Appendici proteiche composte di
piccole subunità di pilina
batteri privi di fimbrie non
possono colonizzare
non sono in grado di
infettare
CURLI
Fimbrie arricciate osservate in
virotipi di E. coli e in salmonelle
Strutturalmente e biochimicamente
identiche alle fibre amiloidi eucariotiche
legano fibronectina o proteine circolanti
(plasmina), e soprattutto il complesso maggiore di
istocompatibilità di classe I (MHC I)
I batteri che li possiedono aderiscono a
superfici biologiche e artificiali
La curlina si libera nell’ospite e ha una
moderata attività tossica
Anche i pili di DI TIPO IV possono aiutare a superare le forze repulsive
Il pilo si aggancia alla superficie e si “contrae” trascinando la cellula
poro formato da PilQ
assemblaggio
della fibra
Disassemblaggio
della fibra
Si possono aggregare a formare fasci
DIFESE INNATE
seconda linea (Oltre le barriere)
INFIAMMAZIONE ACUTA
CALOR: Innalzamento
della temperatura
(iperemia e aumento
del metabolismo
cellulare)
RUBOR: Aumentato
flusso sanguigno
TUMOR: Edema
(fuoruscita di liquidi
nei tessuti)
DOLOR: Mediatori
chimici e compressione
dei nervi
FUNCTIO LAESA:
Aulo Cornelio Celso
(25 a.C. - 50 d.C.)
Rudolf L. K. Virchow
1821 –1902
NORMALITA’
OFF
IN CONDIZIONI DI NORMALITÀ IL
MECCANISMO DELL’INFIAMMAZIONE
DEVE ESSERE INATTIVO
INFEZIONE
ON
QUAL’E’ L’INTERRUTTORE?
OFF
Microbe Associated
Molecular Pattern
ON
Si ritiene che il sistema immunitario
innato ne riconosca CIRCA 1000
Riconoscimento
MAMP
ALLARME
RISPOSTA
INNATA
MODULATA IN MODO PROPORZIONALE ALL’ENTITA’
DELL’ATTACCO
FAGOCITI
SIERO
Monociti e macrofagi
Granulociti
neutrofili
COMPLEMENTO
GRANULOCITI NEUTROFILI
INFARCITE DI GRANULI
Polimorfonucleati (PMN)
= LISOSOMI GIGANTI
CELLULE TERMINALI
enzimi
ossidativi
proteasi
VITA BREVE
ROS
Il richiamo dei PMN non è
garanzia di uccisione dei microbi
UCCISIONE
BATTERI
Morte PMN
PUS
defensine
FAGOCITOSI
fagosoma
nascente
fagosoma
precoce
Fusione con
lisosoma
(fagolisosoma)
Ogni stadio ha
marcatori specifici
fagosoma
tardivo
La cascata si
completa in 40-60’
minuti
morte
batterica
nella fagocitosi
intervengono alcune frazioni del
complemento
COMPLEMENTO (C’): 25 proteine
plasmatiche
7 recettori diversi
riconoscono le
componenti di C’
Opsonizzazione batteri
lisi batteri
lisi cellule infettate
(da virus)
Induzione
dell’infiammazione
Normalità: OFF
ATTIVAZIONE
Chemiotassi dei
leucociti
via classica
(Complesso Ag/Ab)
RICHIEDE ANTICORPI
(RISPOSTA
ADATTATIVA)
via della lectina
Mannano (patogeno) +
lectine (siero)
via alternativa
superficie del patogeno
In realtà la più
frequente..
Attivazione del complemento
VIA ALTERNATIVA
C3
C3b
Idrolisi spontanea
(instabile in fase acquosa)
C3a
In presenza di un patogeno C3b si
lega covalentemente alla superficie
C3b
B
Bb
C3b legato si lega al “fattore B”
Ba
Il fattore B legato a C3b viene
tagliato dal fattore D (proteasi)
C3bBb = C3 convertasi della via
alternativa
RUOLO CHIAVE
NELL’INFIAMMAZIONE
C5b si lega e richiama
C6-C7-C8-C9
(polimerico)
Formando il MAC
(membrane attack complex )
C5b
C5a
Complesso C3bBb3b:
C5 convertasi
C3b
Che provoca la formazione di fori nelle membrane
di cellule eucariotiche e batteri didermi
C3a
C3
Una molecola di C3 o C5 convertasi può catalizzare il
taglio di centinaia-migliaia di molecole bersaglio
C3 convertasi
C3b (C4b) ha un’azione
OPSONIZZANTE
Opsonine
Legano i microbi ai
fagociti
Con un meccanismo a cerniera
che coinvolge recettori
sui batteri
e sui fagociti
C3b si lega in modo ASPECIFICO alle
superfici batteriche
Il taglio espone un legame
tioestere molto reattivo
C3b
OH
Che reagisce con gruppi OH
di cellule vicine
Se C3b si lega a cellule eucariotiche è
distrutto dal fattore H (proteasi)
I batteri non hanno il fattore H
restano opsonizzati
Sui fagociti ci sono recettori SPECIFICI
che stimolano la fagocitosi dei batteri
opsonizzati
C3b
chemiotassine
complemento
Chemiotassine batteriche
Es. N-term rimosse
dalle proteine
RICHIAMO
NORMALITÀ
ATTIVAZIONE
Fagocitosi lenta
OPSONINE
Anticorpi
ATTIVITA’ ANAFILOTOSSICA
C5a-C3a-C4a si legano
anche ai mastociti
Cellule ricche di granuli citoplasmatici
situate nel tessuto connettivo,
specialmente lungo i vasi sanguigni
ne inducono la degranulazione
Rilascio di istamina
e NO
vasodilatazione
MONOCITI
RICHIAMO:
sostanze emesse
dai PMN
CELLULE A
VITA LUNGA
DIFFERENZIABILI
ARRIVANO
DOPO I PMN
I monociti possono
stabilirsi nei tessuti
citochine
citochine
MACROFAGI
ATTIVAZIONE
CITOCHINE:
molecole proteiche prodotte
da vari tipi cellulari
ELIMINANO
DETRITI E
BATTERI RESIDUI
MONOCITI/MACROFAGI: RUOLO CENTRALE
NELLA RISPOSTA IMMUNITARIA
INTERAGISCONO CON ALTRE CELLULE
ATTRAVERSO LE CITOCHINE
INFIAMMAZIONE ACUTA
CELLULE DELL’IMMUNITA’
ADATTATIVA
Cellule delle mucose
Attivazione dei macrofagi
TLR (Toll-Like-Receptors)
Specifici per le
sottopopolazioni di MAMP
Altri sulla membrana del
fagosoma
Alcuni sulle membrane di
molte cellule
Bersagli interni
Bersagli esterni
TLR + bersaglio
NF-kB (nuclear Factor kB)
citochine
ELUSIONE DELLE DIFESE DELL’OSPITE
Impedire l’attivazione del
complemento
Es. Neisseria: acido sialico
Reprimere l’attivazione
Poxvirus: proteina che quella
adibita al controllo
dell’attivazione di C’
MASCHERAMENTO DEI RECETTORI
PER IL COMPLEMENTO
STRATI S
Impedire la penetrazione del
M.A.C
Es. Salmonella: rivestimenti
esterni
PREVENZIONE DELLA FAGOCITOSI
MODULAZIONE NEGATIVA DELLA
PRODUZIONE DI MOLECOLE
CHEMOTATTICHE
VARIAZIONE DI
ANTIGENI SUPERFICIALI
INIBIZIONE DEL
RICHIAMO DEI PMN
OSTACOLO AL
RICONOSCIMENTO
Paralizzare il citoscheletro di
actina dei fagociti
CIRCONDARSI DI UNA CAPSULA
VISCOSA (BATTERI DIFFUSI
DAL SANGUE)
OSTACOLO ALLA
FAGOCITOSI
microrganismi relativamente
resistenti agli enzimi lisosomiali
L’ESPLOSIONE DEI LISOSOMI
NEL CITOPLASMA
UCCISIONE DEI FAGOCITI
Sono in grado di causare..
ELUSIONE DELLE DIFESE INNATE
(DOPO LA FAGOCITOSI)
INIBIZIONE DELLA FORMAZIONE
DEL FAGOLISOSOMA
Il patogeno altera l’assetto
superficiale della vescicola
lisosomale impedendo la fusione con
il lisosoma
FUGA DAL FAGOSOMA
Alcuni patogeni lisano la
membrana del fagosoma
E si moltiplicano nel
citoplasma
Alcune specie (Listeria, Shigella, Rickettsia) possono intervenire sui filamenti di
actina dell’ospite e farsi “spingere” da una cellula all’altra
-SHIGELLE IN MOTOSERVIZIO FOTOGRAFICO INSTITUT PASTEUR
VITA INTRACELLULARE
Una strategia diversa è quella di
restare nel fagosoma (o fagolisosoma)
Adattandosi a resistere alle mutate
condizioni ambientali
alcuni microrganismi che sopravvivono nei
macrofagi (Salmonella, Mycobacterium) attivano
rapidamente set di geni per sopravvivere nelle
condizioni estreme del fagolisosoma
ANAPLASMA: UN
CASO LIMITE
Blocco esplosione+
antiapoptosi