“OSPEDALE SANTA CORONA”
ASL 2 PIETRA LIGURE (SV)
U.O. DI NEURORADIOLOGIA
direttore: Dott. R.Padolecchia
RM Funzionale:
Studio con Brain Mapping nella
Patologia Tumorale e nella
Riabilitazione Post-ictus
G. BOLELLI
IL Cervello
•
•
•
•
Chimica
Fisiologia
Elettricità
Magnetismo
Analisi dei dati
Analisi della Funzione Cerebrale
•
•
•
PET, SPECT
EEG, MEG
RMN @ alto campo
Mappaggio Corticale
Funzioni Mappabili
•
•
•
•
•
Sensitiva
Motoria
Uditiva
Visiva
Linguaggio
Funzioni Cognitive
Tecniche di Brain Mapping
Registrazione Elettromagnetica
•
•
•
•
•
EEG , MEG
Registrazione diretta
Non invasività
Limitata risoluzione spaziale
Buona risoluzione temporale
Registrazione Emodinamica
•
•
•
•
PET, f MRI
Registrazione indiretta
Non invasività
Ottima risoluzione spaziale
PET
•
Radiazioni ionizzanti
•
Risoluzione spaziale ridotta
•
Sensibilità elevata
fMRI
•
Campo magnetico + RF
•
Ris. spaziale – temporale elevata
•
Sensibilità elevata
RM @ alto campo
•
•
•
•
•
•
•
caratteristiche
Elevata risoluzione spaziale
Elevata risoluzione temporale
Elevato contrasto
Elevata sensibilità
Non invasiva
Versatilità
MRI
Risonanza Magnetica funzionale
f MRI
•
•
•
•
non è invasiva
fornisce importanti informazioni morfo-funzionali
non ci sono radiazioni
è ripetibile
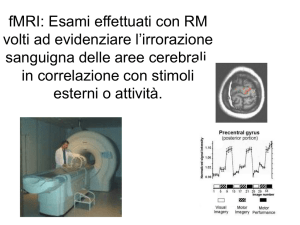
La risonanza magnetica funzionale (fMRI)
rappresenta una modalità di approccio
morfologico-funzionale in grado di rilevare, in
modo non invasivo e con elevata risoluzione
spaziale, le modificazioni di segnale del tessuto
encefalico indotte dalle variazioni perfusionali e
di ossigenazione che si verificano nella sostanza
grigia durante differenti stati funzionali
(riposo/attività)
La fMRI rileva le modificazioni di segnale del
tessuto encefalico grazie alle variazioni che il
transito nel letto vascolare encefalico di una
sostanza paramagnetica la desossi-emoglobina,
è in grado di indurre sul rilassamento trasversale
T2 degli spin protonici tissutali in prossimità dei
capillari, mediante l’impiego di sequenze GE
T2*-pesate o eco-planari (EPI)
Fenomeni di fRMI:
a) Uno, più complesso, richiede l’iniezione di
Gadolinio ed il monitoraggio, medianti sequenze
eco-planari, del suo primo passaggio nel letto
capillare encefalico
(Perfusione) (magneti ad alto campo)
b) La seconda, realizzabile anche con magneti per
uso clinico, utilizza come mdc paramagnetico
endogeno la desossi- emoglobina e registra le
variazioni di ossigenazione ematica correlate allo
stato di attività corticale: (tecnica BOLD)
fMRI
Effetto B.O.L.D.
Blood Oxygen Level Dependent
Effetto Bold
E’ Alla base della f MRI
• Più evidente a c. magnetico elevato (>1.5T)
• Indotto da scarica neuronale sec. a stimolo
• Sfrutta lo stato di ossigenazione dei g. rossi
• Sede: letto capillare
• No mdc e.v. !!
Fisiologia
Scarica Neuronale
Modificazioni del flusso capillare
Modificazione stato di ossigenazione g.rossi
Ossi-emoglobina HbO2
Desossi-emoglobina dHb
Variazioni di segnale locale rilevate da RM
Resting State
A riposo (HbO2) = (dHB) sui due versanti
•
•
HbO2 ha effetto “positivo” sul segnale (lo aumenta)
dHb ha effetto “negativo” sul segnale (lo annulla)
Nessuna variazione di segnale
Stimolo
Risposta fisiologica
Aumento di:
•
CBV = Volume ematico cerebrale
•
CBF = Flusso ematico cerebrale
•
CMRO2 = “Rate” metabolico O2
(tasso estrazione O2)
Activated State
Durante attivazione , per i fenomeni di
flusso descritti, si accumula più ossiHb
di quanta si trasformi in dHb
(HbO2) > (dHB)
Incremento del segnale
Effetto B.O.L.D.
1.
2.
3.
4.
Variazioni flusso e volume ematico
Concentrazione HbO2 > dHb nei capillari
Eccesso HbO2 sul versante venoso
Aumento del segnale locale
Quindi ne deriva che l’effetto di
suscettibilità magnetica esercitato
dalla desossi-emoglobina sul tessuto
si riduce temporaneamente e ciò
determina un incremento del segnale
nelle immagini T2* pesate
Risposta BOLD positiva
Risposta BOLD %
Aumento continuo
del flusso
Continua attività neuronale
Fase di riposo neuronale
Rilevamento
iniziale
Massimo flusso
Tempo
Scarica neuronale
e aumento CBV
Stimolo
Riduzione continua di flusso
nel letto capillare
Terminologia
Paradigma (Task)
•
• Stimolo
ü
ü
ü
ü
ü
•
sensitivo
motorio
visivo
verbale
Cognitivo
Aree funzionali
La fMRI ci consente di conoscere e
localizzare le risposte agli stimoli
correlando l’immagine morfologica
con quella funzionale
Risposta BOLD %
PARDIGMA
Brain Mapping
Tempo
Stimolo
Riposo
Stimolo
Riposo
Stimolo
Riposo
Paradigmi
Funzione Motoria
ü
“Finger tapping”
ü
Apertura-chiusura mano
ü
Flesso-estensione piede
Funzione Verbale
ü
Fluenza semantica
ü
Produzione di parole
ü
Lettura di parole
ü
Denominazione di oggetti
Funzione sensitiva
ü
stimolazione passiva mano
Funzione Motoria: Adeguato
utilizzo e scelta degli stimoli
Motorio Semplice
Compito Motorio Semplice
Mano sinistra
Motorio Semplice
Sensitivo//Mot.Passivo
Stimolo Sensitivo Mano sn
Motorio Semplice
Sensitivo/Mot.Passivo
Compito Motorio Complesso
Motorio Complesso
Mano sn
Funzione Verbale
•
•
•
Localizzare le aree del linguaggio
(Broca e Wernicke)
Determinare dominanza emisferica
Valutare plasticità e sue modificazioni
Considerazioni
Collaborazione del Paziente è essenziale
•
“Training” pre fMRI intensivo
•
Tests neuropsicologici
•
Apparecchiature dedicate
(stimolazione visiva, acustica …)
•
f MRI nella Patologia
Tumorale
f MRI nel Recupero
Post-Ischemico
•
•
•
L’ictus provoca nell’80% dei pazienti una
emiparesi.
Il recupero funzionale avviene in genere nei
successivi 2-5 mesi, è di grado variabile e
dipende dalla gravità iniziale del deficit.
Diversi studi hanno dimostrato che la ripresa
è associata alla riorganizzazione delle vie del
SNC.
Ad oggi sono stati utilizzati
diversi strumenti per cercare
di capire come avvenga il
recupero funzionale:
•
- esame neurologico
•
- esami neurofisiologici
•
- PET
•
- fMRI
TC in Acuto
TC 36 ore
DWI a 2 ore
Neuroradiologia Dis-Funzionale
Neuroradiologia
FUNZIONALE
La fMRI ha dimostrato un reclutamento:
•
nella corteccia immediatamente adiacente alla
lesione ictale lungo le aree corticali sane
•
nella corteccia dell’emisfero controlesionato
non danneggiato
(Chollet, Ann Neurol, 1991), (Cramer, Nelles –
Stroke, 1997)
Lo schema di reclutamento dipende:
•
•
•
dalla severità del danno
dalla sede della lesione
dal tempo trascorso dall’ictus
(Ward, Brain, 2003), (Luft, NeuroImage, 2004)
Il recupero del danno motorio dopo un ictus
pone due problemi:
•
•
capire sotto il profilo speculativo come
avviene
se possiamo applicare queste conoscenze per
programmare o migliorare l’intervento
terapeutico riabilitativo
In letteratura, nel corso degli ultimi
anni, sono stati esaminati vari gruppi di
pazienti con lesioni ischemiche aventi
differenti sede e morfologia, con
diverse metodiche di analisi.
Tombari – NeuroImage 2004
Ha eseguito uno studio longitudinale in 8 pz. durante la fase
acuta, subacuta e cronica, confrontandoli con soggetti sani, con
una serie di fMRI, rispettivamente, dopo 20 gg., 4 mesi e 12 mesi
dall’ictus. Il compito eseguito durante ogni sessione era passivo
(flesso-estensione della mano paretica) e attivo (flesso-estensione
delle dita della mano paretica).
I risultati ottenuti evidenziavano una precoce riorganizzazione
con super-attivazione della corteccia sensitivo-motoria S1M1
controlesionale e, secondariamente, una riorganizzazione
all’interno della ipsilesionale S1M1, suggerendo una rete
evolutiva compensatoria a sostegno della ripresa.
Ward – The American Society of Neurorhabilitation – 2006
•
•
•
•
•
Ha studiato 2 pz. con ictus motorio puro; il primo presentava un danno
corticale e il secondo un danno sottocorticale.
Sono stati eseguiti per ciascun pz. 6 controlli dopo i primi 4 mesi dall’ictus
con successivo confronto con soggetti sani. Il compito eseguito durante
ogni sessione era un movimento passivo del polso (sia del polso sano che
quello danneggiato dall’ictus).
Il buon recupero del pz. col danno corticale è stato correlato ad una
aumentata attività nelle aree motorie ipsilesionali.
Il minor recupero del pz. col danno sottocorticale è stato correlato ad una
maggior attivazione nell’emisfero controlesionale, con aree di attivazione
anche nella corteccia parietale inferiore e una minore attività nelle aree
motorie ipsilesionali.
Si evidenziava quindi che la sede del danno ha un differente impatto sui
conseguenti schemi di ripresa.
Luft – JAMA - 2004
•
•
•
•
•
Ha esaminato 21 pz. con residua paresi all’arto superiore dopo circa 50
mesi da un ictus emiparetico.
I pz. sono stati a caso assegnati a due differenti programmi di recupero
a) BATRAC (bilateral arm training rhythmic auditory cueing)
b) DMTE (standardized dose matched therapeutic excercises)
Il compito eseguito durante la fMRI consisteva in un movimento del
gomito.
Le misurazioni furono eseguite due settimane prima e dopo il trattamento
terapeutico.
I risultati dello studio hanno evidenziato che il BATRAC può indurre una
riorganizzazione nelle zone del cervello coinvolte nel controllo motorio,
ma principalmente nell’emisfero controlesionato (giro pre- e post-centrale)
e nel cervelletto ipsilesionato fornendo una spiegazione biologica per un
training ripetitivo di entrambe le braccia come potenziale terapia per una
riabilitazione in pz. in fase cronica.
KIM - Neurology - 2006
•
•
•
•
•
Ha indagato le modificazioni della riorganizzazione della via motoria alla
base della ripresa funzionale nel post-ictus in 10 pz. dalla fase sub-acuta
(4-5 sett. dopo ictus) alla fase cronica (dopo 6 mesi dall’ictus)
confrontandoli con soggetti sani.
Lo stimolo rilevato alla fMRI e’ il movimento della gamba.
Utilizzando per confronto I.L.(consiste in una misura dei pixel da un lato
del cervello rispetto all’altro).
Passando dalla fase acuta alla fase cronica è stata osservata la comparsa
inizialmente di aree di attivazione a livello di S1 ipsilesionale e un aumento
dell’attività in S1M1 nell’emisfero non lesionato mentre nella fase cronica
si rilevava una diminuzione dell’attività nell’emisfero non lesionato ed un
aumento nell’emisfero ipsilesionale.
L’attivazione di S1M1 passava dall’emisfero non colpito a quello colpito
associandosi ad una ripresa funzionale.
CAO-American Heart Association-1998
•
Evidenzia il ruolo dell’emisfero non infartuato
nella ripresa della funzione motoria, attraverso
un reclutamento della via motoria non
crociata
CASISTICA
Abbiamo valutato con fRMI 8 pazienti dopo
ictus in fase cronica con stimolo dell’arto
superiore rappresentato da un movimento di
flesso-estensione del gomito sul piano
orizzontale
Pz. n. 1 C.F.
Ictus ischemico nel 2004 in sede frontotemporo-insulare sn.
Alla fRMI durante stimolo dx si associano aree
di attivazione in regione cerebellare e prerolandica ipsilesionale.
Pz. n. 2 F.R.
Ictus-emorragico emisferico dx nel 2005.
Alla fRMI durante stimolo sn sono rilevabili
aree di attivazione nell’emisfero ipsi e
controlesionale a livello della corteccia rolandica
e supplementare motoria.
Pz. n. 3 S.B.
Ictus ischemico sn nel 1987
Alla fRMI durante stimolo dx si rilevano aree
di attivazione a livello della corteccia
retrorolandica ipsilesionale e frontale
controlesionale.
Conclusioni
•
•
•
La fMRI consente di identificare le aree di attivazione rispetto
alla lesione ischemica e di stabilire la loro sede emisferica,
importante per capire quali meccanismi possono essere stati
messi in atto.
La fMRI evidenzia il ruolo dell’emisfero non infartuato nella
ripresa della funzione motoria, attraverso un reclutamento della
via motoria non crociata, tuttavia interpretabile come evento di
passaggio verso una maggiore attivazione dell’emisfero
ipsilesionale.
Inoltre in futuro valutazioni fMRI pre e post-trattamento
potranno essere utili per stabilire l’efficacia di terapie della
spasticità sia farmacologiche, con tossina botulinica, sia di
chirurgia funzionale.
Grazie