Il sistema periodico degli elementi
• Cos’è
Cos’è il sistema periodico ?
• Che informazioni ne possiamo ricavare ?
• Che predizioni possiamo trarne ?
15/10/2012
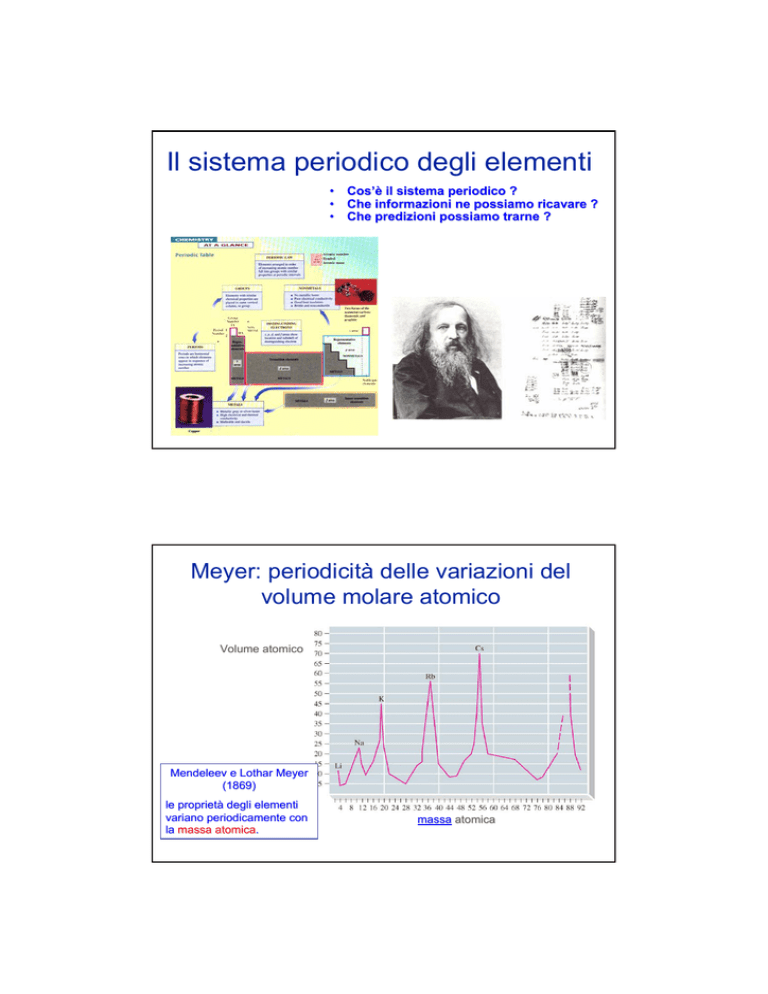
Meyer: periodicità delle variazioni del
volume molare atomico
Volume atomico
Mendeleev e Lothar Meyer
(1869)
le proprietà
proprietà degli elementi
variano periodicamente con
la massa atomica.
atomica.
massa atomica
Mendeleev: la tavola periodica degli elementi
• Mendeleev lasciò vuoti alcuni posti, in corrispondenza di elementi non
ancora scoperti (68 Ga 1871, 44 Sc 1879, 72 Ge 1886), prevedendone alcune
proprietà (massa, densità, colore etc.).
• Previde l’esistenza di un elemento (100) non presente in natura (Tc).
• Non previde invece l’esistenza dei gas nobili.
Ramsay li sistemò in un gruppo 0 tra gli alogeni (VII) e i metalli alcalini (I).
Moseley: il numero atomico come base del
sistema periodico
Moseley (1913) correlò le
frequenze di emissione dei
raggi X di vari elementi con
il loro numero atomico.
ν = A(Z – b)2
Configurazione elettronica dalla
Tavola Periodica
Blocco
Blocco principale
principale
s
p
d
f
La tavola periodica moderna
1
2
3
4
5
6
7
77 “periodi”
“periodi”
La tavola periodica moderna
1 2 3 4 5 6 7 8 9 10 11 12 13 1415 16 17 18
18
18 “gruppi”
“gruppi”
La tavola periodica moderna
I
II
III IV V
VI VII VIII
La tavola periodica moderna
metalli
metalli alcalini
alcalini
metalli
metalli alcalino-terrosi
alcalino-terrosi
gas
gas nobili
nobili
alogeni
alogeni
calcogeni
calcogeni
metalli
metalli di
di transizione
transizione
Lantanidi
Lantanidi
Attinidi
Attinidi
La tavola periodica moderna
nonmetalli
nonmetalli
metalloidi
metalloidi
metalli
metalli
gas
gas nobili
nobili
Qual è la differenza tra metalli e
nonmetalli a livello atomico?
Gas nobili:
configurazione elettronica
ns2 (np6)
Sono molto stabili!
Atomi carichi: gli ioni
• Cosa sono?
– Atomi o gruppi di atomi con
una carica elettrica
Cationi: si formano perdendo elettroni
sono carichi (+)
A+
+ e−
Catione
A
A-
Anione
+ e−
sono carichi (-)
Anioni: si formano catturando elettroni
La tavola periodica moderna
Z = 10
Z = 11
[Ne] 3s1
Na
−1e
[Ne] 3s1
Na+
[Ne]
La tavola periodica moderna
Z = 18
3s2 3p6
Z = 16
[Ne] 3s2 3p4
S
[Ne] 3s2 3p4
+2e
S2[Ne] 3s23p4
[Ar]
I metalli tendono a formare cationi
I nonmetalli tendono a formare anioni
E’ possibile spiegare il diagramma di
Meyer?
Volume atomico
Si preferisce oggi
parlare di raggio
atomico
Numero atomico
Vari tipi di raggi atomici
Metà della distanza tra atomi
identici legati da un legame
covalente singolo.
Metà della distanza tra atomi a
contatto nel reticolo cristallino.
Non ci possono essere specie
identiche!
Si stabilisce che r ionico di O2sia 140 pm (1.40 Å)
Raggi atomici in funzione di Z
Raggio covalente
(pm)
Piccin Nuova Libraria S.p.A.
Numero atomico Z
Raggio atomico
(pm)
Numero atomico Z
Variazione r.a. lungo un gruppo.
All’aumentare di n la densità radiale si estende sempre più lontano dal nucleo.
Aumenta la dimensione dell’atomo
Zeff
Variazione r.a. lungo un periodo.
• gli elettroni aggiunti riempiono progressivamente lo stesso guscio di valenza
• questi elettroni si schermano fra loro poco efficacemente.
Aumenta l’attrazione del nucleo e il raggio atomico diminuisce.
Raggio atomico
(pm)
Numero atomico
Numero atomico Z
Variazione r.a. lungo un gruppo.
per Z bassi l’effetto è forte (es.: Li → Na → K)
per Z alti più debole (K → Rb → Cs): perché?
Raggio atomico
(pm)
Numero atomico
Numero atomico Z
dal K in poi si riempiono gli orbitali d e f , che schermano meno
efficacemente di s e p gli elettroni esterni.
Variazione di r. a. per gli elementi di transizione.
Negli elementi di transizione gli elettroni entrano in livelli (n - 1)d, ossia con n
inferiore agli elettroni ns che determinano il raggio del nucleo.
il raggio atomico resta costante.
Raggio anionico vs. raggio atomico
Raggi cationici di specie isoelettroniche
Z=11
Z=12
-14%
Piccin Nuova Libraria S.p.A.
-27%
FIGURA 1010-8 Un confronto tra alcuni raggi atomici e ionici
⇒
⇒Tra
Traspecie
specieisoelettroniche,
isoelettroniche,ilil
raggio
diminuisce
raggio diminuiscecon
conililvalore
valoredidiZZ
Piccin Nuova Libraria S.p.A.
15/10/2012
27
Energia di ionizzazione primaria I1 (o IE1)
(o “primo potenziale di ionizzazione”)
e affinità elettronica EA
I1 è l’energia che si deve fornire per strappare un elettrone da una specie
(atomica) in fase gassosa:
X(g) → X+(g) + e−
I1 = E [X+] – E [X]
(si esprime in eV o kJ/mol)
sempre >0 !
1eV = 96.49 kJ/mol
In prima approssimazione I1 = – E [orbitale occupato meno stabile]
Si possono definire quantità analoghe In:
X(n-1)+ (g) → Xn+(g) + e−
In = E [Xn+] – E [X(n-1)+]
EA corrisponde alla variazione di energia che si osserva quando una specie
atomica acquista un elettrone in fase gassosa:
X(g) + e− → X− (g)
EA = ΔE = E [X−] – E [X]
può essere >0, 0, <0
Attenzione! spesso EA = - ΔE
(non nel Petrucci)
Energie di ionizzazione degli orbitali
atomici in funzione di Z
15/10/2012
I1 in funzione di Z
FIGURA 1010-9 Energie di prima ionizazione in funzione del numero atomico
I1 in funzione di Z
FIGURA 1010-9 Energie di prima ionizazione in funzione del numero atomico
I1 diminuisce lungo un gruppo:
2
En,l ∝ – Zeff
/n 2
l’aumento di Zeff non compensa l’aumento di n.
I1 in funzione di Z
FIGURA 1010-9 Energie di prima ionizazione in funzione del numero atomico
I1 aumenta lungo un periodo.
2
En,l ∝ – Zeff
/n 2
n non cambia, Zeff aumenta.
15/10/2012
I1I (kJ/mol)
(kJ/mol)
1
Na
Na
496
496
Mg
Mg
738
738
Al
Al
577
577
Si
Si
786
786
PP
SS
1012
1012 999
999
Cl
Ar
Cl
Ar
1251
1251 1521
1521
Confronto I1 tra Mg e Al (qualitativo!)
Energia
n = ∞
I1(Mg)
I1(Al)
n = 3
Mg
Al
La ionizzazione dello zolfo
S = [Ne] 3s2 3p4
S+ = [Ne] 3s2 3p3
I1 = E [S+] – E [S]
Più lo ione è stabile, più bassa è l’energia di ionizzazione
s2p2
s2p3
Piccin Nuova Libraria S.p.A.
O(g)
O-(g)
O−
(g)
O2 −(g)
EA = −141 kJ/mol
EA = + 744 kJ/mol !!
Dal volume: Petrucci “Chimica Generale”
L’esistenza di O2- gassoso è estremamente
improbabile. O2- esiste allo stato solido, dove
la sua formazione è dovuta ad altri processi
energeticamente favorevoli.
Piccin Nuova Libraria S.p.A.
Valori assoluti di EA crescenti
Valori assoluti di EA crescenti
15/10/2012
37
15/10/2012
38
15/10/2012
39









