Riproduzione e ciclo cellulare
La capacità di riprodursi è carattere fondamentale dei viventi.
Gli organismi unicellulari più semplici (es batteri ma anche eucarioti
unicellulari) si riproducono per divisione cellulare.
Negli eucarioti ci sono 2 tipi divisione cellulare: mitosi e meiosi.
la mitosi si verifica in tutti I tipi cellulari, la meiosi invece avviene solo nelle
cellule progenitrici dei gameti
Negli organismi pluricellulari molte divisioni cellulari successive (mitosi) sono
necessarie per:
•Sviluppo di organismo complesso a partire da un’unica cell uovo
•accrescimento
•Omeostasi dei tessuti (rigenerazione, sostituzione cellule morte, riparazione
lesioni e danni tissutali)
Il “ciclo cellulare“ procariotico è relativamente
semplice e rapido
Nei procarioti la divisione cellulare puo’ essere molto
rapida (anche 20-30 min);
durante questo arco di tempo duplicazione del
cromosoma circolare adeso a membrana, estensione
cellulareà distacco delle due copie del cromosoma e
divisione della cellula
Colorizzata TEM 32
500´
Cromosomi batterici
Un tipico ciclo di divisione cellulare prevede fasi di:
vAccrescimento cellulare (aumento di volume e duplicazione
di organelli)
vDuplicazione del DNA
vSeparazione e distribuzione del materiale genetico
vDivisione cellulare
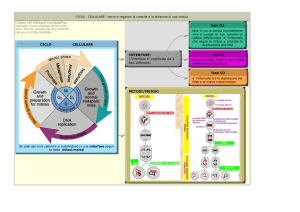
Il ciclo cellulare eucariotico è una serie ordinata di eventi che si ripete allo stesso
modo (conservato durante l’evoluzione) e scandisce la vita cellulare terminando in
genere con la divisione.
Il ciclo è un’alternanza tra mitosi (divisione ) ed interfase.
•Interfase: cellula cresce di volume, svolge attività, interagisce con ambiente est. e si
prepara a divisione (circa 95% del ciclo)
•Divisione: evento cruciale, il più radicale ed evidente del ciclo
La mitosi è l’unico evento chiaramente riconoscibile al microscopio otticoà
cambiamenti drastici:
si sfalda nucleo, si condensano i cromosomi, si forma struttura
citoscheletrica complessa (fuso mitotico)
L’interfase è suddivisa in periodi in cui si svolgono specifiche attività cellulari
•G1: cellula metabolicamente attiva e in accrescimento, integra segnali interni ed esterni
per decidere se proliferare e quindi procedere in fase S oppure entrare in quiescenza (G0)
(max parte dei tessuti in q fase)
•S: duplicazione del materiale genetico
•G2: continua accrescimento e prepaparazione a divisione
•M: mitosi (divisione nucleare)+ citochinesi (divisione citoplasma)
Durata delle varie fasi
Fasi S ed M hanno durata abbastanza
costante per un certo organismo
Es nell’uomo S : 8-10 ore; M: 1 ora
Fasi G1 e G2 variabili secondo tipo
cellulare
Per un fibroblasto in coltura in vitro
durata tot ciclo circa 24 ore
Nelle prime fasi di sviluppo embrionale spesso cicli rapidi con G1 e G2 quasi assenti: solo
veloce alternanaza tra replicazione DNA e mitosi (oganelli, macromolecole e strutture
cellulari già presenti perchè precedentemente accumulate in cell uovo)
In alcuni casi numerose endoreplicazioni del DNA (senza successiva divisione)à cromosomi
giganti
Negli adulti ci sono tessuti stabili e tessuti sottoposti a continuo ricambio
Neuroni e cell muscolo : cell. molto
specializzate in G0, hanno perso capacità di
dividersi
Fibroblasti e epatociti in G0 ma possono
rientrare in ciclo
(riparazione/rigenerazione in risposta a
determinati stimoli)
Tessuti dinamici: continuo ricambio per
attività proliferante di cell staminali e morte
delle cell differenziate
La divisione della cell. staminale è asimmetrica
Il destino delle cell figlie influenzato da ambiente esterno: contatto con lamina basale
Le cellule che iniziano percorso diffrenziativo perdono quasi del tutto capacità di dividersi
e sono destinate a morte programmata
Metodi per lo studio del ciclo cellulare
Citofluorimetria e analisi del contenuto di DNA/cellula (per cellule diploidi varia da 2n a 4n)
•Colorante fluorescente per DNA
•Popolazione cellulare analizzata al citofluorimetro (sensore misura fluoresecenza delle singole
cellule, una ad una)
àFrazione di cellule con DNA 2n (G1)
àFrazione di cellule con DNA 4n (G2)
àe frazione con quantità intermedia (S)
L’altezza del picco indicativa della durata della fase
Un profilo a 2 picchi indica cellule proliferanti (non sincronizzate)
Un singolo picco (DNA 2n) indica cellule non proliferanti (es ferme in G0 o colte tutte
in G1 perchè sincrone)
MIcroscopia e traccianti del DNA
A) Uso di traccianti radioattivi: es timidina tritiata (precursore del DNA) incorporata
in fase S; radioattività passa da strato basale ad apicale epitelio intestinale
B) Marcatura di cellule in fase S
con BrdU (precursore del DNA
al posto della timidina) e
anticorpi per BrdUà
microscopia a fluorescenza
Uso di strategie/farmaci bloccanti per sincronizzare il ciclo di cellule in
colturaà blocco reversibile in modo da ottenere popolazioni
sincronizzate
Es
•nocodazolo: impedisce formazione microtubuli e quindi fuso
mitoticoà blocco in M
•Rimozione fattori di crescitaà arresto in G0
•Aggiunta di inbitori sintesi nucleotidià arresto in fase S
Modelli sperimentali per lo studio del ciclo cellulare
Lievito: analisi dei geni coinvolti nel controllo del ciclo; uova di anfibio, di
molluschi o di riccio di mare à studi biochimici
(Nurse, Hartwell e Hunt- Nobel Medicina, 2001 per studi sul ciclo cellulare)
La progressione del ciclo è sottoposta a rigido/raffinato sistema di controllo: transizione
da fase a successiva solo dopo verifica segnali boichimici indicativi di condizioni sia
intracellulari che esterne (controlli intrinseci ed estrinseci)
In organismi unicellulari conta soprattutto condiz ambientale (nutrienti) in multicellulari
anche segnali chimici da altre cellule (fattori solubili quali mitogeni, fattori di crescita, di
sopravvivenza,…)
3 principali checkpoint
il non superamento del checkpoint
G1àS determina uscita dal ciclo ed
ingresso in G0
Le transizioni avvengono solo se sono soddisfatte alcune condizioni
•Monitoraggio fattori nutrienti e di crescita,
•Controllo sullo stato del DNA (danno/riparazione, completamento replicazione)
•Dimensione/volume cellulare
•Allineamento cromosomi/aggancio sul fuso
Se condizioni non soddisfatte à
blocco del ciclo
Il macchinario molecolare che regola il ciclo cell. eucariotico si basa
sull’interazione di 2 processi:
1) Orologio molecolare indipendente che segue le varie fasi del ciclo e si basa sul
ritmico alternarsi di sintesi e degradazione delle “cicline”. Le cicline
associandosi ad enzimi CdK (complessi ciclina-cdk) formano complessi che,
grazie a loro attività enzimatica, permettono superamento dei checkpoint
2) Processo regola l’orologio in base a segnali intra- ed extra-cellulari avvalendosi
di proteine/enzimi che + o – direttamente modulano attività di cicline e CdK
NB: Il macchinario molecolare che regola il ciclo cell. eucariotico è molto
conservato.
Diversi approcci sperimentali hanno contribuito a definire il
complesso di interruttori molecolari coinvolto nel controllo del
ciclo
Anni ’70: esperimenti di fusione cellulare tra cell di
mammifero in diverse fasi del ciclo
Esistenza di “fattori” in grado di:
- indurre ingresso in mitosi
- e replicazione del DNA (solo su cellule G1)
Effetto della fusione cellulare. La fusione di cellule in mitosi con cell in G1 e G2
induce la condensazione cromatinica; con cell in S, cromosomi sensibili si spezzano e
si “polverizzano”
(Rao e Johnson)
Risultati poi confermati da studi biochimici su oociti di anfibio
Microiniezione di estratti proteici ottenuti da oociti in divisione (meiosi) induce meiosi
Nel citoplasma di una cellula
mitotica esiste un MPF
(meiosis/maturation promoting
factor)
di natura proteica e diffusibile in
grado di indurre la maturazione di
oociti
Studi genetici su lievito: mutanti cdc (cell division cycle) temperatura sensibili
A temperatura non permissiva i mutanti si
bloccano in una particolare fase del ciclo
Es: mut cdc28 (S. cerevisiae) si blocca in G1
cdc2 (S. pombe) si blocca in G1 e G2
I genicdc 28 e cdc2 codificano per enzimi-chinasi simili tra loroà ortologhi trovati
anche nell’uomo
Saggi di complementazione: gene umano introdotto in lievito mutante ripristina
normale ciclo à forte conservazione evolutiva del sistema di controllo del ciclo
Analisi proteica di estratti da uova di riccio di mare
à scoperta delle “cicline”
Proteine con concentrazione citosolica oscillante /fluttuante legata ai vari stadi del
ciclo
I diversi approcci hanno permesso identificazione biochimica di MPF (isolato da uova di
anfibio)
MPF è un enzima proteina-chinasi dimerico:
- subunità catalitica (ortologo a cdc28 e cdc2 di lievito)à CDK1
- e subunità regolatrice (ciclina B, mitotica) necessaria per sua attivitàà ciclina
C’è corrispondenza tra variazione di
1) fase nel ciclo cellulare
2) Attività di MPF
2) Concentrazione di ciclina
Infatti la chinasi (CDK1) dipende per la sua attività dalla ciclina (ecco perchè si chiama
Cdk: cyclin dependent kinase)
L’attività kinasi quindi riflette andamento ciclico della ciclina B ma non perfettamente:
infatti la cdk si attiva repentinamente solo dopo che ciclina ha iniziato ad accumularsi
da un bel po’!... Come mai??
In effetti l’attività di CDK dipende:
-da un lato dai livelli di ciclina
-dall’altro da un complesso pattern di fosforilazionedefosforilazione sulla CDK stessa (altri enzimi kinasi
e fosfatasi sono coinvolti in q. sistema di
regolazione).
L’attivazione completa è favorita con meccanismo a
feedback positivo innescato dalla formazione stessa
del complesso cdk-ciclinaà aumento
esplosivo/rapido dell’attività chinasica di cdk.
La kinasi Wee1 inibisce
il complesso CDK-ciclina
mentre la fosfatasi cdc25 stimola il complesso
Infatti in lievito
mutazione di wee1 àcellule piccole (mitosi
prematura)
Mutazione di cdc25à cellule lunghe (mitosi
ritardata)
L’attività di CDK1 è spenta dalla degradazione ubiquitina-proteasoma-dipendente della
ciclina
La ubiquitinazione della ciclina è indotta dal complesso APC (anaphase promoting
complex) a sua volta indotto dalla stessa CDK
à funzionalità di CDK quindi è limitata ad una precisa finestra temporale e CDK
contribuisce al proprio spegnimento (feedback negativo)
Una volta attivata la CDK1 (MPF) fosforila proteine target cruciali per ingresso e
progressione in fase M
(CDK è una serina-treonina chinasi)
Esempio
- fosforila lamìne nuclearià disgreagazione
dell’involucro nucleare
- Fosforilazione delle MAP (microtubule
associated protein)àRiorganizzazione dei
microtubuli e formazione del fuso
- Fosforilazione di enzimi condensine (?)à
compattamento della cromatina
- In lievito la stessa chinasi (gene cdc28) associandosi a diverse cicline riconosce diversi
substrati e quindi regola transizione tra varie fasi del ciclo
- Negli organismi multicellulari invece esistono diverse cdk e diversi complessi cdk-ciclina che
regolano diverse fasi del ciclo cellulare
I complessi attivi cdk-ciclina
fosforilano proteine che + o –
direttamente presiedono ad
attività/strutture necessarie
per passaggio a nuova fase del
ciclo
Le diverse cicline dei mammiferi operano in fasi diverse del ciclo
I vari complessi cdk-ciclina subiscono stesso schema di regolazione
Oltre che dalle cicline e dalla fosforilazion/defosforilazione le CDK sono controllate anche
dal legame con inibitori CKI (cdk inhibitors)
Il livello dei CKI risente di segnali interni (lesioni al DNA) ed extracellulari (ormoni, fattori
di crescita, contatto fisico con altre celule)
anche i CKI sono degradati dal sistema ubiquitina-proteasoma
I CKI impediscono assemblaggio e/o attività dei complessi CDK-ciclina
2 gruppi principali di inibitori
Gruppo I: inibitori che agiscono a livello di transizione G1àS e G2àM
Gruppo II: inibitori che agiscono solo a livello di transizione G1àS
•Aumento densità di popolazione induce p27à fenomeno inibizione da contatto
•Fattore TGF-β induce differenziamento e ingresso in G0à inducendo p15
Effetto della mutazione su p27 (un CKI)
Nel complesso esistono ben 4 livelli di regolazione sulle
CDK!!
La degradazione delle proteine regolative (cicline ed inibitori CKI) garantisce
irreversibilità e unidirezionalità del passaggio da fase ad altra del ciclo
La degradazione è ubiquitina-proteasoma dipendente
Controllo transizione G1àS
La cellula di lievito che non supera precise condizioni (danno al DNA, nutrienti, dimensioni) si
arresta al punto “start”
Analogamente la cellula di mammifero (danno DNA, contatto con cellule, fattori crescita,
dimensioni, bilancio energetico) si arresta al “punto di restrizione”
Controllo transizione G1àS nei mammiferi
In assenza di opportuni segnali esterni (es fattori di
crescita) à pRb si lega a fattore trascrizionale E2F e
gli impedisce di attivare trascrizione di geni
necessari a transizione G1àS (es geni per
duplicazione DNA, ciclina E e E2F stesso)
L’inattivazione trascrizionale è assicurata dal
compattamento della cromatina (induce
deacetilazione)
Presenza di fattori di crescitaà trasduzione del
segnaleà complessi CDK-ciclineD (E ed A)
fosforilano pRbà distacco da E2Fà attivazione di
geni utili a passaggio di fase
pRb è gene oncosoppressore, cioè frena la crescita
cellulare
Se pRb muta e/o non funzionaà neoplasia
(retinoblastoma)
Presenza di fatttori di crescita
àI ondata di espressione genica: risposta immediata precoce (vari fattori
trascrizionali es proto-oncogeni c-myc, c-fos; proteine citoscheletro, …)
àII ondata di espressione genica:cilcine Dà formazione dei complessi cdkciclina e progressione ciclo
Assenza fattorià arresto in G0
Importanza dei segnali interni: integrità del DNA
Sensori di danno al DNA innescano cascate
di protein-chinasi che bloccano la cellula
nella fase in cui si trova impedendole di
proseguire e facendo in modo che concentri
energie sulla riparazione del danno.
•Indirettamente inducono blocco della
transizione G2-M (inattivando l’attivatore di
CDK1)
•Attivano p53 e quindi bloccano fase S o
transizione G1-S
Il danno al DNA induce il blocco della transizione
G2-M perchè inattiva cdc25 (la chinasi che a sua
volta attiva CDK1)
P53 è un gene oncosoppressore molto studiato (mutazioni a suo carico nel 50% dei tumori
umani)
È un fattore trascrizionale normalmente presente nella cellula a bassissimi livelli (continua
degradazione ubiquitina dipendente)
Danno al DNAà aumenta livello di p53:
•Alternativa 1: induzione di geni che riparano DNA e bloccano ciclo
•Alternativa 2 induzione di geni che portano a morte cellulare (apoptosi)
Blocco del ciclo mediato da p53
P53 induce la trascrizione del gene p21 codificante
per inibitore CKI di vari complessi CDK-ciclina
Sistema di controllo fa si che DNA sia replicato una sola volta a partire da specifiche origini
replicative
CDK di fase S fosforila proteine complessi pre-replicazione: in
questo stato richiamano enzimi replicazione (inizio sintesi) ma
non possono legarsi ad altre origini replicative.
Restano fosforilate per tutta fase G2 e Mà impossibile nuova
replicazione
In G1 si defosforilanoà riassemblaggio sulle origini replicative
La conoscenza dei meccanismi di controllo del ciclo svela
le basi molecolari del tumore
• In cellule normali: mitogeni (fattori crescita)à transizione G1àS
• In cellule tumorali il punto di restrizione perde funzionalità: cellule
cancerose non hanno bisogno di segnali mitogenici esterni per transitare da
G1 ad S
• In cellule tumorali livelli elevati ed abnormi di cicline D (epressione non
più controllata da fattori esterni come di norma)
• In cellule tumorali mutazioni su geni tumore-soppressori che
normalmente frenano il ciclo (Es. P53, pRb e CKI )