MICROPARTICELLE
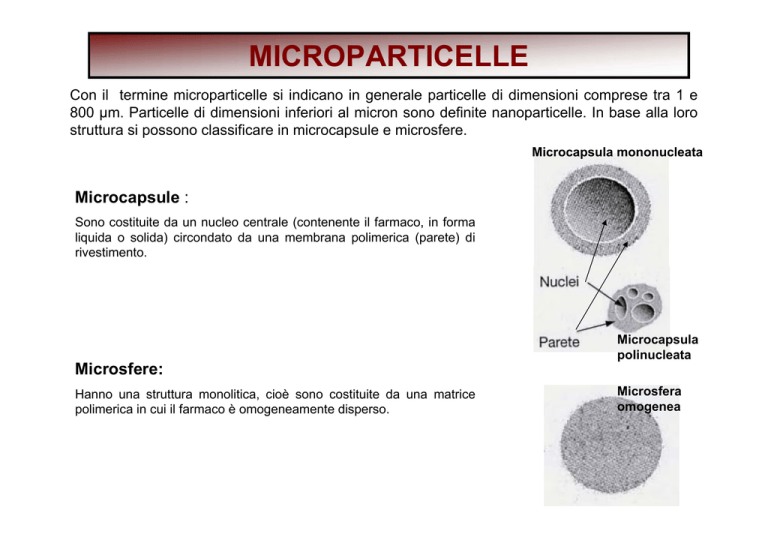
Con il termine microparticelle si indicano in generale particelle di dimensioni comprese tra 1 e
800 µm. Particelle di dimensioni inferiori al micron sono definite nanoparticelle. In base alla loro
struttura si possono classificare in microcapsule e microsfere.
Microcapsula mononucleata
Microcapsule :
Sono costituite da un nucleo centrale (contenente il farmaco, in forma
liquida o solida) circondato da una membrana polimerica (parete) di
rivestimento.
Microcapsula
polinucleata
Microsfere:
Hanno una struttura monolitica, cioè sono costituite da una matrice
polimerica in cui il farmaco è omogeneamente disperso.
Microsfera
omogenea
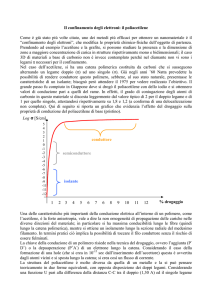
CENNI STORICI
La tecnologia della microincapsulazione nasce a cavallo del 1920-1930. I primi successi riguardano la
microincapsulazione di oli con gomma di acacia e gelatina tramite il processo di coacervazione.
Da un punto di vista industriale il primo vero successo della microincapsulazione è datato 1955, quando al
National Cash Register Company (NCR) di Dayton Ohio venne brevettato un processo di coacervazione
della gelatina in grado di incapsulare un pigmento. Le microcapsule così ottenute erano destinate ad
essere appiccicate sulla superficie di un foglio. In seguito a scrittura sulla superficie libera del foglio la
pressione esercitata rompe le sottile parete di gelatina delle microcapsule liberando il pigmento che colora
un foglio posto sottostante. Era nata la carta “autocopiante” che si usa tuttora, diversa dalla vecchia carta
carbone che usava inchiostro secco e cera.
Dagli anni 50 ad oggi è avvenuto un continuo e crescente sviluppo della tecnologia della
microincapsulazione, oggi ampiamente diffusa in un gran numero di settori industriali:
•Alimentare
•Cosmetico
•Chimico (vernici, adesivi, fertilizzanti, ecc.)
•Elettronico
•Farmaceutico
microparticelle- 2
CLASSIFICAZIONE MORFOLOGICA
le microcapsule sono in genere di forma più o meno sferica, anche se possono essere prodotte particelle
di forma irregolare.
In funzione della struttura interna, le microcapsule sono classificate in:
microparticelle- 3
APPLICAZIONI DEI SISTEMI PARTICELLARI
L’utilizzo dei sistemi particellari permette di modificare e migliorare le caratteristiche morfologiche strutturali e le proprietà chimico-fisiche di una sostanza. La microincapsulazione (intesa come la
preparazione sia di microcapsule che di microsfere) può consentire il cambiamento di colore, forma, volume,
solubilità, reattività, resistenza, stabilità della sostanza intrappolata.
In campo farmaceutico le principali applicazioni della microincapsulazione riguardano:
•Trasformazione di una sostanza liquida in una solida
Quando si incapsula un liquido si ottiene una polvere con le caratteristiche del polimero usato
nell’incapsulamento. La polvere così ottenuta è definita pseudo-solido.
•Riduzione della volatilità
Una sostanza altamente volatile incapsulata all’interno di un sistema particellare può essere conservata per
lunghi periodi di tempo.
•Modifica del volume e densità
Il volume e la densità di una sostanza possono essere alterati attraverso la microincapsulazione, in modo da
formare microcapsule con elevato contenuto d’aria. In questo modo si possono ottenere sostanza capaci di
flottare in acqua (idonee per la preparazione di floating system) o in aria (idonee per la somministrazione in
dry powder inhalation).
microparticelle- 4
•Aumento della stabilità
La microincapsulazione protegge le sostanza dagli agenti ambientali quali umidità, ossigeno e luce.
•Superamento delle incompatibilità
L’incapsulamento determina una separazione fisica del componente incapsulato dall’ambiente che lo
circonda, permettendo la miscelazione di composti che potrebbero essere incompatibili tra loro.
•Mascheramento di odori e sapori sgradevoli
•Ottenimento di sistemi a rilascio controllato
I polimeri utilizzati nella microincapsulazione possono controllare la velocità di rilascio o il sito di rilascio
(polimeri gastroresistenti o mucoadesivi) del farmaco incapsulato.
microparticelle- 5
POLIMERI IMPIEGATI NELLA PREPARAZIONE DEI SISTEMI
PARTICELLARI
Per poter ottenere le caratteristiche precedentemente descritte è necessario selezionare dei polimeri opportuni,
in termini di proprietà chimico-fisiche e tossicologiche, che costituiscono la matrice delle microsfere o la “parete”
delle microcapsule.
I polimeri utilizzabili nella microincapsulazione possono essere, a seconda della loro origine, naturali o sintetici;
inoltre possono essere biodegradabili o non non-biodegradabili. Devono inoltre possedere una serie di specifici
requisiti:
•Chimicamente inerti;
•Non tossici;
•Sterilizzabili;
•Stabili da un punto di vista chimico-fisico;
•Dotati di buona resistenza meccanica;
•Non devono rilasciare impurezze o residui di polimerizzazione.
microparticelle- 6
Polimeri comunemente impiegati per la preparazione di microparticelle
Per applicazioni industriali sono usati
gli stessi polimeri utilizzati nel film
coating o nel rilascio controllato ed i
poliacidi (acido polilattico ed acido
polilattico-glicolico).
In passato sono stati molto utilizzati le
proteine (soprattutto gelatina) e le
gomme
Derivati della cellulosa
Poliacidi
Eudragit
microparticelle- 7
Le proprietà dei polimeri possono essere modulate attraverso l’uso di additivi, quali:
•Plasticizzanti
Aggiunti ai polimeri amorfi ne aumentano la mobilità delle catene, incrementandone la flessibilità e
riducendone la fragilità, migliorandone quindi le proprietà meccaniche. Esempi di plasticizzanti sono vari tipi
di PEG, dietil ftalato, trietil citrato ecc.
•Agenti che modificano la permeabilità
Con Channeling agents si intendono tutte quelle sostanze che aggiunte al polimero ne alterano la porosità
quando questo viene in contatto con i liquidi biologici, aumentando la permeabilità e conseguentemente
accelerando il rilascio del farmaco (es. PEG 4000).
I Sealants sono invece sostanze che agiscono in direzione opposta. In genere si tratta di cere (Paraffina,
carnuba, d’api, ecc) che vengono aggiunte successivamente la formazione del microparticelle.
•Tensioattivi
I tensioattivi possono essere utilizzati in alcuni metodi di preparazione delle microcapsule ( letto fluido ) per
aumentare la bagnabilità del core e favorire il rivestimento con il polimero. Naturalmente tutti i metodi di
microincapsulazione che hanno come base di partenza la formazione di emulsioni richiederanno tensioattivi
come componenti stabilizzanti delle emulsioni stesse.
microparticelle- 8
PREPARAZIONE DELLE MICROPARTICELLE
Sebbene siano note un gran numero di tecniche per la preparazione di microparticelle, solo poche in realtà
hanno una reale applicazione industriale.
La tabella sottostante riporta alcune delle più comuni tecniche di microincapsulazione, classificate a seconda
del tipo di processo impiegato.
Processi chimici
Processi chimicofisici
Processi meccanici
Polimerizzazione
interfacciale
Coacervazione
Spray drying / spray
chilling
Tecniche in
emulsione
Letto fluido/Bassina
microparticelle- 9
La scelta del processo da applicare dipende dalla valutazione di una serie di fattori:
•Natura del materiale da incapsulare
Stato fisico (solido o liquido), idrofilia/lipofilia, stabilità termica o pH dipendente.
•Natura del mezzo di incapsulazione
Solventi organici o acquosi, gas.
•Struttura delle microparticelle da ottenere
Microsfere, microcapsule mononucleo, multinucleo, ecc.
•Motivazioni economiche
Rapporto costo/beneficio, esistenza di brevetti, apparecchiature e/o tecnologia disponibile, ecc.
La taglia delle microcapsule dipende da quella del materiale che andrà a formare il core. Per core
solidi, se le dimensioni del materiale di partenza non risultano idonee è necessario provvedere a riduzione
della taglia tramite processi di micronizzazione.
I materiali solidi da incapsulare devono essere anche finemente suddivisi. Nel caso di agglomerazione si
dovrà intervenire tramite setacciatura o selezione delle migliori condizioni di conservazione (umidità,
temperatura).
microparticelle-10
La maggior parte dei processi di incapsulazione (no quelli basati su processi di tipo meccanico) può
essere schematizzata come segue
Dispersione omogenea del
materiale del core nel medium
di incapsulazione.
Aggiunta
del
materiale
polimerico che formerà il
rivestimento o la matrice.
Condensazione del materiale
polimerico attorno al core o a
costituire la matrice in cui è
disperso il principio attivo.
Stabilizzazione del materiale
polimerico.
microparticelle-11
Microincapsulazione mediante polimerizzazione interfacciale
Le tecniche di polimerizzazione interfacciale riguardano tutti quei processi in cui all’interfaccia tra due
liquidi immiscibili si forma chimicamente il polimero del rivestimento (che dovrà essere insolubile in
entrambi le fasi).
SI distinguono tecniche di polimerizzazione interfacciale per condensazione, tecniche di
polimerizzazione interfacciale per addizione (originano a microcapsule con un core liquido) e tecniche
di complessazione interfacciale (originano microsfere).
Nella polimerizzazione interfacciale per condensazione il polimero si forma da due diversi tipi di
monomeri che reagiscono all’interfaccia tra una fase acquosa ed una fase organica. I due monomeri sono
solubili uno nella fase organica ed uno in quella acquosa. Farmaco e monomero A sono disciolti nel
solvente A, che viene poi mescolato con il solvente B. Per agitazione meccanica si suddivide il solvente A
in goccioline di taglia opportuna (si prepara una emulsione), quindi si aggiunge il monomero B solubile
nel solvente B. Il monomero B reagisce con quello A all’interfaccia formando un polimero insolubile che
incapsula il solvente A con il farmaco
Solvente A + farmaco+
monomero A che non ha
reagito
Solvente B + monomero
B che non ha reagito
Solvente A + farmaco+
monomero A
Solvente B
B
B
A
A
B
A
B
A
B
Monomero B
Polimero –(A-B)n-
microparticelle-12
Un esempio di incapsulazione tramite polimerizzazione interfacciale per condensazione è rappresentato
dalla produzione di microcapsule con core contente proteine, anticorpi o enzimi e membrana di
poliammide (nylon 6,10).
Il nylon è un copolimero che si forma per reazione di una diammina alifatica ed il cloruro di un acido
dicarbossilico. La sigla 6,10 indica che l’ammina ha 6 carboni e l’acido 10.
In questo caso il cloruro
dell’acido è quasi insolubile in
acqua. L’ammina è invece
solubile in acqua, ma avendo un
coefficiente di partizione di circa
1 può diffondere nella fase
organica.
Nylon 6,10
Si scioglie l’attivo e l’ammina in
acqua e si prepara una
emulsione W/O con la fase
organica in cui il cloruro del
dell’acido
è
stato
precedentemente sciolto. Poiché
l’ammina tende a diffondere
verso la fase organica, la
polimerizzazione
avverrà
all’interfaccia (la velocità di
reazione è maggiore di quella di
diffusione).
microparticelle-13
Nella polimerizzazione interfacciale per addizione (detta anche polimerizzazione in situ) il polimero si
forma per reazione tra un monomero ed un catalizzatore della reazione di polimerizzazione. Monomero e
catalizzatore sono solubili in due solventi differenti e la reazione avverrà all’interfaccia tra una fase acquosa
ed una fase organica. Il processo è simile al precedente, ma il monomero B è sostituito dal catalizzatore.
Naturalmente il polimero che si forma risulta insolubile nei due solventi alle condizioni di preparazione.
Solvente A + farmaco+
monomero A
Solvente A + farmaco+
monomero A che non ha
reagito
Solvente B + catalizzatore
in eccesso
Solvente B
A
A
catalizzatore
A
A
Polimero –(A)n-
Ad esempio gli alchilcianoacrilati polimerizzano in
presenza di ioni idrossili. In questo caso si crea
una emulsione O/W dove il monomero e il
farmaco sono contenuti nella fase oleosa. Per
aggiunta di NaOH nella fase acquosa esterna si
avrà polimerizzazione interfacciale.
microparticelle-14
Nelle tecniche di complessazione interfacciale si sfrutta la formazione di legami crociati tra molecole
polimeriche preformate ad opera di cationi bivalenti.
Questo processo è realizzato tipicamente con gli alginati, polisaccaridi (derivati dalla parete cellulare delle
alghe brune) solubili in acqua che gelificano in presenza di ioni Ca. In genere si realizza facendo gocciolare
una soluzione acquosa di alginato di sodio e farmaco in una soluzione acquosa di cloruro di calcio. Quando
la goccia della soluzione di alginato tocca la soluzione di CaCl2 si formano delle microsfere gelificate.
Il calcio coordina due distinte unità lungo la
catena degli alginati, generando dei legami
crociati intercatena e intracatena. Le catene
di alginato così bloccate perdono flessibilità,
si forma un network che imprigiona il
solvente formando una sorta di gel molto
compatto. Le microsfere sono poi filtrare ed
essiccate.
microparticelle-15
Microincapsulazione mediante coacervazione
La coacervazione è un processo fisico di separazione di fase tipico delle dispersioni polimeriche (e dei
sistemi colloidali stabili più in generale). In seguito all’aggiunta di un terzo componente o la variazione di
parametri fisici in una soluzione polimerica si formano due fasi distinte, una ricca di polimero (coacervato)
e l’altra costituita prevalentemente da solvente. Continuando ad applicare le condizioni che determinano la
coacervazione si ha completa separazione di fase e precipitazione del polimero.
La coacervazione può avvenire tramite 3 meccanismi:
1.Desolvatazione del polimero (in sistemi binari o ternari);
2.Repulsione tra 2 diversi polimeri disciolti in un solvente comune (sistema ternario);
3.Interazioni tra un polimero poliionico con contro-ioni (o con un polimero di carica opposta);
In ogni caso la coacervazione è sempre una diretta conseguenza del cambiamento delle interazioni
polimero-polimero (polimero della stessa specie) e polimero-solvente. Ogni evento che riduce o
elimina il guscio di solvatazione del polimero favorisce le interazioni polimeriche inter ed intracatena e
conseguentemente la coacervazione.
La coacervazione rappresenta la tecnica utilizzata agli albori della microincapsulazione. I primi processi
erano condotti principalmente con gelatina. Costituisce ancora uno degli approcci microincapsulativi più
comuni a livello industriale specie utilizzando etilcellulosa (garantisce la preparazione di microcapsule a
rilascio controllato) come polimero.
microparticelle-16
La coacervazione può essere indotta da:
•VARIAZIONE DI TEMPERATURA
Sfrutta la diversa solubilità del polimero a varie temperature.
L’esempio classico è quello dell’etilcellulosa in cicloesano, dove un
abbassamento della temperatura induce la coacervazione del
polimero. In genere si riscalda la dispersione ad 80°C e si raffredda
in maniera controllata. È comune l’aggiunta di poliisobutadiene sia
come agente che induce la coacervazione sia per migliorare la
qualità del prodotto finale (minore aggregazione).
KCl ricoperto da etilcellulosa
•VARIAZIONE DI pH
Sfrutta la diversa solubilità del polimero a vari pH.
•AGGIUNTA DI SALI
Il sale sottrae acqua al polimero, generalmente una proteina, facendola coacervare e poi precipitare (salting
out). L’esempio classico è quello della coacervazione di una soluzione di gelatina indotta da solfato di
sodio.
microparticelle-17
•AGGIUNTA DI UN NON SOLVENTE
Si aggiunge alla miscela solvente + polimero un solvente miscibile col solvente usato per sciogliere il
polimero ma nel quale il polimero è insolubile. La gelatina coacerva se alla sua soluzione acquosa è
aggiunto etanolo.
Anche l’etilcellulosa (EC) può essere coacervata in questo modo. l’EC è solubile in toluene o in cicloesano
caldo. Per aggiunta di cicloesano ad una soluzione a temperatura ambiente di EC in toluene si otterrà la
coacervazione dell’EC.
•ADDIZIONE DI UN POLIMERO INCOMPATIBILE
Si basa sull’aggiunta di un polimero incompatibile a quello che
costituirà la membrana. i due polimeri sono disciolti nello
stesso solvente. Mescolando le soluzioni dei due polimeri
questi uno di questi coacerva. Di conseguenza solo un
polimero formerà la membrana.
PDMS
PLA in
CH2Cl2
Con questo metodo sono state preparate microcapsule di PLA
(acido polilattico) o PLGA (acido polilattico glicolico).
Il PLA/PLGA è dissolto in diclorometano o etilacetato e
coacervato per aggiunta di olio di silicone (PDMS, polidimetil
siloxano, liquido a temperatura ambiente). Una volta che le
goccioline di coacervato si depositano sul core insolubile, la
membrana di PLA/PLGA viene “indurita” per aggiunta un non
solvente come ad esempio l’esano o l’eptano, dove però il
polimero incompatibile, il PDMS è solubile.
microparticelle-18
•COACERVAZIONE COMPLESSA
Si utilizzano due polimeri, uno anionico e uno
cationico, che reagiscono formando un
complesso che si separa dalla soluzione.
Entrambi i polimeri saranno parte integrante
della ricopertura delle capsule. L’esempio
classico è quello della gelatina (cationica) e la
gomma arabica (anionica). La gelatina al di
sotto del suo punto isoelettrico (pH 8,9) ha una
carica netta positiva, mentre la gomma arabica
è carica negativamente.
In opportune
condizioni di pH e temperatura si forma un
complesso che tende a coacervare.
In questo esempio il complesso gomma
arabica-gelatina che si deposita sul core
è stabilizzato tramite legami crociati
formati tramite ponti di glutaraldeide.
Nel caso della coacervazione complessa
entrambi i polimeri formano la membrana,
mentre nel caso della coacervazione per
aggiunta di un polimero incompatibile la
membrana è costituita da un solo polimero
(quello che coacerva)
microparticelle-19
Nell’incapsulamento per coacervazione si prepara una dispersione di farmaco (il farmaco deve essere
insolubile nel solvente scelto) in una soluzione del polimero prescelto; si induce poi la coacervazione del
sistema, si separa una fase liquida arricchita di materiale polimerico che va a depositarsi sulle particelle di
farmaco. Successivamente si ha coalescenza del coacervato sulla superficie del farmaco e la sua
solidificazione attraverso raffreddamento, desolvatazione o reticolazione, in modo da ottenere una
membrana rigida e resistente attorno alle particelle del farmaco sospeso. Le microparticelle si recuperano
poi per filtrazione.
Tramite coacervazione si ottengono microcapsule con taglia simile a quella dei materiali che costituiscono il
core.
Soluzione polimerica
(polimero + solvente)
Coacervato
Farmaco
A. Il materiale del core viene disperso nel medium.
B. Si induce la coacervazione.
C. Le microgoccioline di coacervato si addensano attorno al materiale del core.
D. Si ha coalescenza delle goccioline ha formare uno strato continuo attorno al core.
microparticelle-20
Microincapsulazione mediante evaporazione del solvente
Si basa sull’evaporazione, sotto continua agitazione, della fase interna (solvente organico volatile) di una
emulsione olio in acqua (O/W).
Inizialmente, il materiale polimerico e il farmaco vengono solubilizzati in un solvente volatile, e la soluzione
così formata è emulsionata con la fase disperdente (nella quale il polimero non è solubile), contenente un
appropriato agente emulsionante. Si procede al riscaldamento per evaporare il solvente, con conseguente
precipitazione del polimero (non è solubile in acqua). Se l’attivo si trova in forma grossolanamente dispersa
(è insolubile) nella fase organica, l’evaporazione del solvente farà depositare il polimero attorno a particelle
grossolane con formazione di microcapsule polinucleate, mentre se l’attivo è disciolto o finemente disperso
nella soluzione polimerica, si otterranno delle microsfere.
Questa tecnica è adatta per farmaci lipofili.
microparticelle-21
Principi attivi idrofili possono essere incapsulati tramite evaporazione di solvente utilizzando la tecnica
dell’emulsione multipla. Questa metodologia prevede la formazione di una emulsione multipla W1/O/W2. Il
principio attivo da incapsulare è inizialmente solubilizzato in una soluzione acquosa che viene poi
emulsionata nella fase organica, costituita da solvente e polimero (solubile solo nella fase organica). Si
ottiene in tal modo un’emulsione primaria W1/O. Questa è quindi a sua volta aggiunta alla fase acquosa
esterna per formare una doppia emulsione del tipo W1/O/W2. La fase organica agisce come barriera tra i
due compartimenti acquosi prevenendo la diffusione del principio attivo verso la fase acquosa esterna. Per
evaporazione della fase organica il polimero precipita rivestendo la fase acquosa interna. Si ottengono
microcapsule.
Questa tecnica è ideale per soluti ad elevata solubilità acquosa e basso coefficiente di ripartizione (non
diffondono nella fase organica).
microparticelle-22
Nel caso di microincapsulazione mediante evaporazione del solvente i polimeri maggiormente utilizzati
come matrice delle microsfere o membrana delle microcapsule sono dei poliesteri, in particolare i polimeri
dell’acido lattico (PLA, polilattidi), quelli dell’acido glicolico (PGA, poliglicolidi) ed i copolimeri dell’acido
lattico e glicolico (PLGA polilattidi-glicolidi).
Questi polimeri sono materiali idrofobici non tossici ed
altamente biocompatibili.
I farmaci contenuti nelle
microparticelle di PLA o PLGA sono rilasciate per
erosione del polimero ad opera di reazioni di tipo
idrolitico con formazione di acido lattico e glicolico, due
normali metaboliti fisiologici.
Microsfera
di
PLA
contenete
somatostina (preparata da CHCl2)
microparticelle-23
Microincapsulazione mediante spray drying
Permette di ottenere sia microsfere che microcapsule:
9Il farmaco viene disperso (attivo non solubile) o emulsionato nella soluzione del polimero sciolto in un
opportuno solvente, acqua o miscela idroalcoliche. In seguito ad atomizzazione il solvente viene eliminato per
evaporazione in corrente di aria calda e il polimero si addensa e coalesce sulla superficie delle particelle di
farmaco formando la membrana. Si ottengono microcapsule sferiche di diametro inferiore ai 100 µm.
9Il farmaco viene sciolto (attivo solubile) nella soluzione solvente+polimero. In seguito ad atomizzazione il
solvente viene eliminato per evaporazione in corrente di aria calda ed i soluti (attivo e polimero) solidificano
insieme formando una struttura matriciale. Si ottengono microsfere sferiche di diametro inferiore ai 100 mm.
I vantaggi di questa tecnica riguardano la rapidità, la riproducibilità e la scalabilità del processo, che non risulta
particolarmente oneroso.
Presenta però anche una serie di svantaggi, come, la perdita di eventuali sostanze volatili ed una limitata
scelta dei polimeri (solubili in acqua ma non eccessivamente viscosizzanti).
Attualmente l’unico farmaco sul mercato contenete microcapsule ottenute per spray drying è la bromocriptina
(Parloder LAR, Sandoz).
Microincapsulazione mediante spray chilling (o spray congealing)
Tecnica simile allo spray drying, con l’eccezione che la soluzione non è atomizzata in corrente di aria calda ma
di aria fredda. In questo caso il farmaco è disperso allo stato solido o liquido nella miscela fusa del materiale di
rivestimento che viene poi nebulizzazione ad una temperatura molto più bassa di quella di fusione dei
componenti del rivestimento. Si ottengono microsfere o microcapsule in funzione della solubilità dell’attivo nel
polimero fuso.
I materiali usati per il rivestimento sono in genere cere, acidi o alcoli grassi, o polimeri cristallini a bassa
temperatura di fusione. La temperatura di fusione dei materiali deve essere è in genere tra i 30-70°C.
microparticelle-24
Microincapsulazione mediante letto fluido
Particelle o cristalli di principio attivo sono sospese in una corrente d’aria (letto fluido) che si muove dal
basso verso l’alto. La ricopertura avviene nebulizzando sulle particelle una dispersione, acquosa o
organica, del materiale polimerico che costituirà la parete delle microcapsule. La temperatura della corrente
d’aria che sospende le particelle provvede all’evaporazione del solvente che conseguentemente determina
la deposizione del film intorno alle particelle.
La nebulizzazione può avvenire nelle configurazioni top spray, bottom spray o bottom spray con colonna
Wurster.
Il letto fluido è idoneo solamente se le particelle da incapsulare hanno un diametro di almeno 75-100
µm.
Top spray
Bottom spray con
colonna Wurster
microparticelle-25
SOMMINISTRAZIONE DI MICROPARTICELLE
Allo stato attuale i sistemi microparticellari sono idonei o potenzialmente idonei alla somministrazione
tramite diverse vie:
•Oculare
Il rilascio oculare di farmaci rappresenta ancora una sfida nel campo del drug delivery. Il principale
problema è rappresentato dalla lacrimazione, indotta dall’applicazione delle classiche formulazioni (gocce
oculari), che rimuove velocemente le molecole di principio attivo (l’emivita precorneale di attivi somministrati
tramite formulazioni convenzionali è di circa 1-3 min). La somministrazione di attivi attraverso vettori micro e
nanoparticellare rappresenta una interessante novità al momento ancora in fase di indagine. Studi finora
condotti mostrano un notevole miglioramento dell’emivita dei farmaci grazie all’adesione dei sistemi
particellari (preparati con polimeri bioadesivi) alla cornea.
La taglia ideale delle particelle è risultata inferiore ai 10 µm, poiché particelle di diametro superiore
inducono prurito all’occhio (taglie di 20-40 µm hanno dato risultati anche migliori in termini di permanenza
nell’occhio).
•Inalatoria
Microparticelle di diametro aerodinamico inferiore ai 6 µm sono interessanti candidati alla somministrazione
di farmaci tramite DPI.
•Nasale
La via nasale è utilizzata per il trattamento di patologie locale quali riniti, allergie o infiammazioni.
Attualmente la somministrazione di farmaci per via nasale sta riscuotendo una certa attenzione come via di
somministrazione sistemica ed ultimamente anche come via somministrazione di attivi diretti al cervello. In
particolare si è scoperto l’esistenza di un trasporto diretto tra la regione olfattiva ed il liquido cerebrospinale
che permetterebbe di evitare la barriera emato-encefalica. Sono attualmente in fase di studio numerose
formulazioni di microparticelle (diametro compreso tra i 50 ed 200µm per poter essere somministrate per
via nasale) volte al rilascio prolungato di farmaci tramite la via nasale.
microparticelle-26
•Orale
I sistemi microparticellari sono utilizzati principalmente per somministrazione orale, soprattutto in
formulazioni sviluppate per ottenere rilascio prolungato, ritardato o sito-specifico.
Alcune formulazioni contenenti microparticelle approvate in USA
microparticelle-27
Alcune formulazioni contenenti microparticelle
THEO-DUR®: è una formulazione a base di teofillina a rilascio programmato, destinata al trattamento
dell'asma bronchiale, bronchite cronica e enfisema polmonare.
L'azione programmata di rilascio della teofillina è dovuta ad un sistema di rilascio a due stadi, realizzato con
una matrice idrofila di cellulosa acetoftalato in cui sono dispersi numerosi piccoli nuclei.
La matrice idrofila assicura un rilascio della teofillina nelle prime ore dopo la somministrazione; i nuclei,
costituiti da una microcapsula inerte che fornisce il supporto ad alcuni strati dei teofillina separati da una
particolare membrana, che lascia passare liberamente l'acqua ma rallenta la cessione delle molecole di
teofillina, assicurano un rilascio continuo e costante, la cui cinetica di pseudo ordine zero permette di
mantenere stabili (nell'intervallo terapeutico ottimale) per circa 24 h i livelli ematici di teofillina.
microparticelle-28
Tecnologia microcaps®: Aptalis Pharmaceutical
microparticelle-29
CIBALGINA DUE FAST
Una compressa gastroresistente contiene - Principio attivo: ibuprofene 200 mg –
Eccipienti: Etilcellulosa; cellulosa acetoftalato; amido di mais; cellulosa microcristallina;
saccarina; sodio croscarmellosio; aroma fragola; acido fumarico; silice colloidale; magnesio
stearato; calcio fosfato dibasico anidro.
Posologia / dosaggio Cibalgina Due Fast (24 Compresse )
Adulti e ragazzi oltre i 12 anni: 1-2 cpr 2-3 volte al dì. Non superare la dose di 6 cpr al giorno.
Anziani: attenersi ai dosaggi minimi sopraindicati. Le cpr non vanno deglutite intere, ma
premute con la lingua contro il palato: in questo modo si dissolvono velocemente senza
lasciare sapore sgradevole in bocca. Fare seguire, se del caso, un bicchiere d’acqua. Non è
necessario assumere il farmaco a stomaco pieno, poiché nelle cpr il principio attivo è
contenuto in microcapsule gastroresistenti. Dopo 2-3 giorni di trattamento senza risultati
apprezzabili consultare il medico.
microparticelle-30