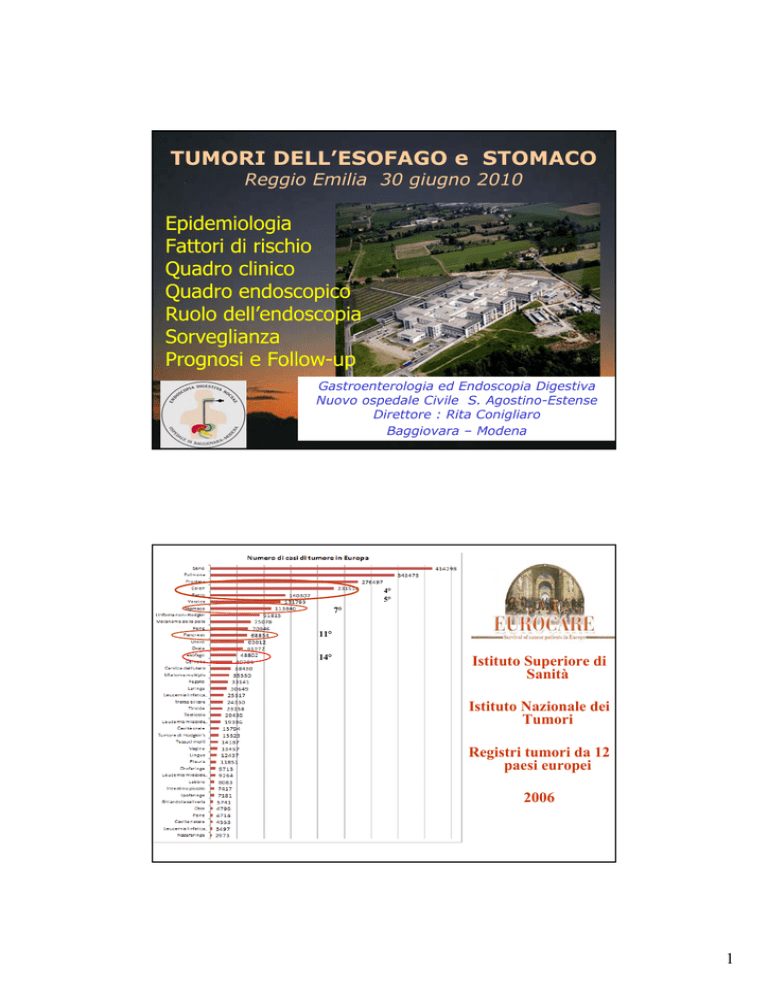
TUMORI DELL’ESOFAGO e STOMACO
Reggio Emilia 30 giugno 2010
Epidemiologia
Fattori di rischio
Quadro clinico
Quadro endoscopico
Ruolo dell’endoscopia
Sorveglianza
Prognosi e Follow-up
Gastroenterologia ed Endoscopia Digestiva
Nuovo ospedale Civile S. Agostino-Estense
Direttore : Rita Conigliaro
Baggiovara – Modena
4°
5°
7°
11°
14°
Istituto Superiore di
Sanità
Istituto Nazionale dei
Tumori
Registri tumori da 12
paesi europei
2006
1
Istituto Superiore di
Sanità
Istituto Nazionale dei
Tumori
Registri tumori da 12
paesi europei
2006
TUMORE DELLO STOMACO Uomini
2008
Numero
Tasso
AREA
Donne
Casi
grezzo
Tasso
std
540
27
16
296
14
14
25
16
8
14
7
1574
37
24
1082
24
13
Trentino Alto Adige
136
30
22
74
16
9
Veneto
538
25
17
360
16
9
Friuli Venezia Giulia
174
33
19
133
24
11
Liguria
188
27
14
118
16
6
708
39
22
449
24
11
Toscana
647
40
22
426
25
11
Umbria
188
49
28
111
28
13
Marche
278
41
24
188
27
13
Lazio
785
32
22
450
17
9
Abruzzo
180
30
20
99
16
8
46
30
20
26
16
8
Campania
674
23
21
422
14
11
Puglia
Piemonte
Valle d'Aosta
Lombardia
Emilia Romagna
Molise
Numero
Casi
Tasso
grezzo
Tasso std
7
379
19
15
278
13
9
Basilicata
83
28
20
46
15
9
Calabria
266
27
20
148
14
9
Sicilia
463
19
15
301
12
8
Sardegna
116
15
11
76
9
5
7823
29
20
4800
17
9
ITALIA
Tasso Grezzo :casi/popolazione/100.000ab Tasso Standard : tasso corretto per età utilizzando come standard la popolazione europea . Istituto Sup Sanità (ISS)
2
LESIONI NEOPLASTICHE
DEL TRATTO GASTROENTERICO SUPERIORE
Sintomi di allarme
J anemia, dimagramento , FOBT pos (aspecifico)
J esofago : disfagia : sintomo tardivo, rigurgito,
vomito
J stomaco- duodeno : epigastralgia, vomito
recidivo
TUMORI DELL’ESOFAGO
Eziologia / Fattori di rischio
J Acool : aumenta il rischio per il Ca squamoso
J Fumo : aumenta il rischio da 5 a 10 volte
JAlcool + Fumo: aumenta il rischio fino a 100 volte
3
TUMORI DELL’ESOFAGO
Fattori
genetici
J Tilosi : patologia autosomica dominante :
Ipercheratosi palmo-plantare e papillomi esofagei
Il 95% di questi pazienti sviluppano ca esofageo
prima dei 65 anni
TUMORI DELL’ ESOFAGO
Precedente patologia esofagea
• Sindrome di Plummer Vinson : esofagite ,
anemia ferropriva , cheilosi , coilonichia,
glossite- il 10% di qs soggetti sviluppa ca
esofageo o dell’ipofaringe
• Acalasia : mancato rilasciamento del LES , circa il
14-16% di qs soggetti sviluppa ca esofageo
dopo circa 20 anni
• Lesioni da caustici : 1-7 % di qs pazienti
sviluppa ca esofageo, dopo circa 30-40 anni
• Esofago di Barrett : dallo 0,2 all’1,3 % di qs
pazienti sviluppa ca esofageo in particolare
ADK .
4
Esofago di Barrett
prevalenza ed evoluzione neoplastica
9Studio prospettico, 623 EGDS per 135 pazienti
9Follow-up medio 5.2 +/- 2.3 anni
9Progressione del quadro:
ADK in 2 pazienti con LSB
Regressione del Barrett nel 20.7%
9Bassa progressione verso ADK, con rischio annuale pari al
0.21%
Martinek J, Endoscopy 2008
Esofago di Barrett
prevalenza ed evoluzione neoplastica
✔Selezionati 47 studi: 11.279 pazienti (47.496/anno)
✔Età media: 59,6 (disponibile in 35 studi)
✔Maschi 68% (sesso disponibile in 27 studi)
✔Adenocarcinoma insorti nei follow-up: 209
✔Incidenza media di ADK: 6.1/1.000/anno
5
Esofago di Barrett
prevalenza ed evoluzione neoplastica
✔Popolazione aderente/totale: 1033 (51.1 maschi)/6332
✔Importanti bias di selezione
✔Popolazione relativamente ristretta
✔Consenso alla procedura (ruolo dei sintomi?)
✔Età media: maschi 59,7, donne 57,7
✔Prevalenza totale casi: 1,3%
Gut 2008;57;1354-1359
ESOFAGO DI BARRETT
FATTORI DIETETICI
Vegetable and fruit intakes and risk of
Barrett’s esophagus in men and women
172 pz con nuova diagnosi
vs
180 pz controllo
Il maggior uso di verdure e frutta è associato
ad un minor rischio di EB (W Washington State)
Thompson OA, Am J Clin Nutr 2009
6
IDENTIKIT DEL PAZIENTE
A RISCHIO
• Uomo
• 60 -72 anni
• razza bianca
• BMI > 30
• affetto da GERD
• Fumatore
• Scarso consumatore di frutta e verdura
• Con altri famigliari affetti
DIAGNOSI ENDOSCOPICA
NEO-ESOFAGEO
NORMALE
7
SEQUELA
Squamous
Mucosa
PRENEOPLASTICA
Cardiac type
Mucosa
Intestinal
Metaplasia
Invasive
Carcinoma
Dysplasia
Time + Reflux
Lymphnode metastasis in esophageal adenocarcinoma
LN mets
1-3%
m1
m2
25%
m3
sm1
sm2
sm3
Epithelium
EMR
Lamina propria
Muscularis mucosae
1,0
0,9
Cumulative Proportion Surviving
0,8
???
SURGERY
Submucosa
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0
0
10
20
30
40
50
60
70
80
90
100
N0
N+
Time (months)
Larghi & Waxman, Gastrointest Endosc Clin N Am, 2005
8
TUMORI DELL’ESOFAGO
sistema TNM
• Tis Displasia grave
• T 0 neg l’esame sul pezzo
operatorio
• T 1 : invade la lamina
propria anche fino alla
sottomucosa
• T 2 :invade e non supera la
muscolare propria
• T 3: invade il tessuto
paraesofageo
• T4 : invade le strutture
adiacenti
T
• N 0 : assenza di meta
linfonodali
• N 1 : presenza di LFN
meta regionali (esclusi i
LFN celiaci)
• Metastasi
• Mx non valutabile
• M 0 assenza di meta
• M1 meta estese ai LFN
cervicali o celiaci
staging old classification
HDG = Displasia di alto grado
9
T
staging new classification
7° Edition of the AJCC Cancer Staging Manual - 2010
T4a=resectable
T4b=unresectable
Rice TW, Ann Surg Oncol 2010
TUMORI DELL’ESOFAGO
tecniche di stadiazione
• TAC
• Ecoendoscopia (EUS)
• Tomografia ad emissione di positroni (PET)
10
EUS NEI TUMORI DELL’ESOFAGO
razionale
• 1) TNM staging
preoperatorio
• 2) ha un’accuratezza
superiore a tutte le altre
metodiche per il T
• 3) forte correlazione fra
strategia
EUSguidata e sopravvivenza
• 4) utile nel Restaging
tramite la misura della
“cross-sectional area”
• 5) decisiva nella
diagnosi precoce delle
recidive postoperatorie
EUS : distingue i 5 strati di parete
11
EUS NEI TUMORI DELL’ESOFAGO
accuratezza nella stadiazione preoperatoria :
T stage in funzione di T
•
•
•
•
T1 : 75- 82%
T2 : 64- 85%
T3 : 89 - 94%
T4 : 88 - 100%
T stage se il lume è invalicabile
• Si riduce l’accuratezza fino al 47% se non si arriva
alla regione celiaca
• Circa il 90% dei tumori invalicabili sono allo Stadio
III (T3N1M0) o IV
Rice T.W . : Chest Surg Clin N Am 2000
EUS NEI TUMORI DELL’ESOFAGO
accuratezza nella stadiazione preoperatoria
TUMORI INVALICABILI
81 (30,3 %)
267 TEs
TInvalicabile
69 pz
dilatazione
Complicanze = 0
T2 14,8%
T3 56,8%
T4 21 %
EUS
N0 14,6%
N1 75,3%
M1 9,9%
Pfau R. et al : Am J Gastroenterol 2000
12
T1
m
T1 sm1
T1 sm3
EUS NEI TUMORI DELL’ESOFAGO
accuratezza nella stadiazione preoperatoria
N staging con EUS - FNA
Staging accuracy of esophageal cancer by endoscopic
ultrasound: A meta-analysis and systematic review
Srinivas R Puli, Jyotsna BK Reddy, Matthew L Bechtold, Daphne Antillon,
Jamal A Ibdah, Mainor R Antillon
Columbia, Missouri 65212, United States
47 studies
2558
pz
With Fine Needle Aspiration (FNA), sensitivity of EUS to diagnose N stage
improved from 84.7% (95% CI: 82.9-86.4) to 96.7% (95% CI: 92.4-98.9). The P
value for the χ 2 test of heterogeneity for all pooled estimates was > 0.10.
CONCLUSION:
EUS has excellent sensitivity and specificity in accurately diagnosing the TN stage of esophageal cancer.
EUS performs better with advanced (T4) than early (T1) disease. FNA substantially improves the sensitivity and specificity of EUS in
evaluating N stage disease. EUS should be strongly considered for staging esophageal cancer.
World J Gastroenterol 2008 March 14; 14(10): 1479-1490
13
TUMORI DELL’ESOFAGO
accuratezza nella stadiazione preoperatoria
Ruolo della FDG-PET
• Nel T staging : non permette una definizione di
parete : non serve nella definizione del T
• Nell’ N staging : non può differenziare l’N1 dal
tumore primitivo
• Nell’ M staging : è superiore alla TAC ( accuratezza
dell’84 % anche per meta < 2cm). Nell’M staging :
PET +
TAC = accuratezza 80-92%, evitando una non necessaria chirurgia
nel 90 % dei casi
Luketich JD, et al : Ann Thorac Surg 1999
Ruolo della FDG-PET
Limiti
Il tumore primitivo e i
linfonodi regionali
appaiono come un’ unica
massa
Non individua metastasi
inferiori a 1 cm
14
ESOFAGO
DI BARRETT
(Short Barrett ?)
Endoscopic suspected
esophageal metaplasia
ESEM
identifica un fondato sospetto
in attesa di esame istologico
Criteri di Montreal
ENDOSCOPIA DIGESTIVA NOCSE - MODENA
ENDOSCOPIC
BARRETT’S
ESOPHAGUS
Praga Classification
of this
Barrett’s esophagus :
C2 M5
C : extention of circumferential metaplasia = 2 cm.
M : maximal extention of the metaplasia = 5 cm. ( C plus a distal “tongue” of 3 cm ).
15
Rappresentazione diagrammatica di una visione
endoscopica di Esofago di Barrett classificato come C2M5
16
Figure 4. Video still of endoscopic Barrett’s esophagus showing an
area classified as C2M5. C: extent of circumferential metaplasia; M:
maximal extent of the metaplasia (C plus a distal “tongue” of 3 cm).
ESOFAGO di BARRETT
SENZA METAPLASIA
INTESTINALE
CON METAPLASIA
INTESTINALE
NO
uso tecniche di “Enhanced
imaging”
: NBI, FICE, Cromoendo,Cellvizio
Confocale ...
DISPLASIA
Biopsie ogni 2-3-5 anni
in LLSBE, LSBE, SSBE
NO BARRETT
BASSO
GRADO
SI
ALTO GRADO
17
ESOFAGO di BARRETT
DISPLASIA
ALTO GRADO
BASSO GRADO
EMR per conferma istologica
CANCRO
BASSO GRADO
TERAPIA CON PPI
ALTO GRADO/ EEC INVASIVO
ARRUOLAMENTO IN UN TRIAL
ABLAZIONE
ENDOSCOPIA
ANNUALE
EMR completa del
segmento di BE
se C< 3, M<5 (Praga)
EMR + ABLAZIONE
per C>3, M>5
CHIRURGIA
Sharma P GIE 2007, 66: 469-474
Confocal laser Endomicroscopy
(pCLE)- Mauna Kea Tech.
Barrett’s esophagus: Goblet cells
18
BARRETT’S ESOPHAGUS SURVEILLANCE
ENDOSCOPY
(SFED Guideline, Endoscopy, 2007)
Intestinal metaplasia required, extension > 5 mm
• SSBE (< 3 cm): 5 years
No dysplasia
• LSBE (3-6 cm): 3 years
• LSBE (> 6 cm): 2 years
LGD
• 2 months (PPI b.d.)
• If confirmed 6 months,
then yearly
HGD
• 1-2 months (PPI b.d.)
• If confirmed, endoscopic or
surgical treatment
PROTOCOLLO NOCSAE
Sorveglianza esofago di Barrett (> 5 mm)
DISPLASIA assente
DISPLASIA indeterminata
9 BARRETT CORTO (< 3 cm), metaplasia
gastrica: 5 anni
9BARRETT CORTO (< 3 cm), metaplasia
intestinale: 3 anni
9BARRETT ESTESO (3-6 cm), metaplasia
gastrica o intestinale: 3 anni
9BARRETT MOLTO ESTESO (> 6cm),
metaplasia gastrica o intestinale: 2 anni
9 Controllo a 6 mesi
(indefinita)
DISPLASIA di basso grado
DISPLASIA di alto grado
9Controllo dopo 2 mesi
9Controllo dopo 6 mesi
9Controllo dopo 12 mesi
9Controllo ogni 12 mesi a lungo
termine
Mucosectomia o dissezione
endoscopica, eventualmente
esofagectomia chirurgica
19
Esofago umano
Il controllo
della
profondità di
target dell’ablazione
Muscularis mucosae
(spessore del target dell’ablazione)
Sottomucosa con ghiandole esofagee
G
G
Tonaca muscolare
ABLATION AND RESECTION
TARGETS
ablazione e resezione
mucosa
previene le stenosi
Profondita’
della
dissezione
endoscopica
Profondità
chirurgica
39
E.B. : TECNICHE DI ABLAZIONE ENDOSCOPICA
INDICAZIONI CONSOLIDATE
( DOPO STADIAZIONE CON EUS):
PAZIENTI CON
METAPLASIA INTESTINALE
ASSOCIATA A DISPLASIA ALTO GRADO
NEL “ SHORT BARRETT “ = M < 5
PAZIENTI CON
METAPLASIA INTESTINALE ANCHE
NON ASSOCIATA A DISPLASIA GRAVE
NEL “ LONG BARRETT ” = M > 5
20
E.B.: TECNICHE DI ABLAZIONE
ENDOSCOPICA
TERMICA
•
ELETTROCOAGULAZIONE
MULTIPOLARE
•
TERMOCOAGULAZIONE CON ARGON PLASMA
•
RADIOFREQUENZA (HALO)
•
FOTOABLAZIONE
LASER
FOTOCHIMICA
•
TERAPIA
FOTODINAMICA
MECCANICA
•
MUCOSECTOMIA
ENDOSCOPICA
•
DISSEZIONE SOTTOMUCOSA
E.B.: TECNICHE DI ABLAZIONE ENDOSCOPICA
ELETTROCOAGULAZIONE MULTIPOLARE
ELETTROCOAGULAZIONE
MULTIPOLARE
Si pratica usando una Golden probe da 10 fr a 60 W di
sorgente di energia (ERBE USA Inc) a un setting di 20
W in potere continuo con forza tangenziale media
partendo dalla giunzione in senso caudo-craniale
SI APPLICA IN PIU’ SEDUTE OGNI 4-8 SETTIMANE FINO
AD ERADICAZIONE
21
GOLDEN PROBE ABLATION
• Hand-held “Point and Shoot”
• Technically demanding to achieve
proper effect
• Non-uniform ablation
• Uncontrolled power delivery
• Visual endpoint for completing
session
• Anatomy of distal esophagus
not considered, its not round
• Repeat therapy is the rule
E.B.: TECNICHE DI ABLAZIONE
ENDOSCOPICA ELETTROCOAGULAZIONE
MULTIPOLARE
CONCLUSIONI
CON l’ELETTROCOAGULAZIONE MULTIPOLARE (MPEC) SONO SEGNALATE PIU’
COMPLICANZE : STENOSI ED E’ PIU’ A RISCHIO DI PERFORAZIONE MA NON IN
MODO STATISTICAMENTE SIGNIFICATIVO RISPETTO AGLI ALTRI METODI DI
ABLAZIONE TERMICA
IN UN TRIAL RANDOMIZZATO RECENTE E’ STATO CONFRONTATO CON L’APC :
16 MPEC
75 % ERADICAZIONE
19 APC
63 % ERADICAZIONE
A 12 MESI 1 STENOSI
35 pazienti
con BE di 3 cm in media
A 12 MESI
Sharma P et al : Gut 2006 ; 55: 1233-39
22
E.B. : TERMOCOAGULAZIONE CON ARGON
PLASMA
INDICAZIONI
PAZIENTI CON
METAPLASIA INTESTINALE
ASSOCIATA A DISPLASIA GRAVE
NEL “ SHORT BARRETT ”
( DOPO STADIAZIONE CON EUS)
PAZIENTI CON
METAPLASIA INTESTINALE ANCHE
NON ASSOCIATA A DISPLASIA GRAVE
NEL “ LONG BARRETT ” con intento radicale!!!
EB : TERMOCOAGULAZIONE ARGON
PLASMA
• Tecnica piu’ comune per Metaplasia
Intestinale senza displasia
• E’ tecnicamente difficile trattare
l’IM per intero, sono richiesti piu’
trattamenti.
• Buried glands e punti residuali
rimangono un problema
Pereira-Lima JC, Am J Gastroenterol 2000; 95:1661-8
Kahaleh M, Endoscopy 2002; 34:950-5.
46
23
Axial
Side-fire
ARGON PLASMA COAGULATOR
E.B. : TERMOCOAGULAZIONE CON ARGON
PLASMA
CONCLUSIONI ATTUALI
LA TERMOCOAGULAZIONE CON ARGON PLASMA
( ASSOCIATA A TERAPIA CON IPP )
PUO’ ERADICARE LA MUCOSA DI BARRETT
CON RIEPITELIZZAZIONE SQUAMOCELLULARE .
AD 1 ANNO DI DISTANZA SONO FREQUENTI
LE RECIDIVE SE PUR NON ESTESE ( fino al 40 %)
Barr H , Shepherd NA., BSG Guideline 2005
24
E.B. : ABLAZIONE CON RADIOFREQUENZA
NUOVO METODO : HALO 360- 90
PREVEDE UN GENERATORE DI RADIOFREQUENZA
IN COMUNICAZIONE CON UN PALLONE O CON UN ACCESSORIO
DEDICATO CHE TRASMETTONO IN < 1 SECONDO UNA
PREDETERMINATA QUOTA DI ENERGIA (J/cm2) AD UN
MINIELETTRODO BIPOLARE CHE PER UNA LUNGHEZZA DI 3 CM
LA TRASMETTE ALLA PARETE ESOFAGEA PROVOCANDO NECROSI
TISSUTALE SUPERFICIALE FINO ALLA MUSCOLARIS MUCOSA.
ERADICAZIONE DEL 90 % CON MANTENIMENTO AD
1 ANNO DEL 71 %
“A welcome step in right
direction”
Weston AP. GIE 2007
Roorda AK., Dis Esophagus 2007
SISTEMA
HALO360
• Ablazione endoscopica con
palloncino
• Terapia ablativa circonferenziale
• Profondita’ controllata
– Densita’ di energia, geometria degli
elettrodi
• Molteplici studi su IM +/- displasia
• Studi effettuati su segmenti lunghi
e corti
50
25
SISTEMA
HALO90
• Piastrina montata sullo strumento
• Terapia ablativa focale
• Profondita’ controllata
– Densita’ di energia, geometria degli
elettrodi
• Terapia primaria per Barrett a
segmento corto
51
52
26
53
54
27
55
56
28
HALO360 SYSTEM
Baseline , M 4 cm
Immediata pulitura
57
Baseline Endoscopy
58
29
Baseline Ablation
59
4
months
60
30
HALO360 SYSTEM
6 months
biopsy
100%
Response
No IM
61
9
months
62
31
EB: TERAPIA
FOTODINAMICA
SI BASA SULLA FOTOSENSIBILIZZAZIONE DI AREE
DI DISPLASIA O DI TUMORE SUPERFICIALE
DA PARTE DEL 5-ALA ( precursore Endogeno) (dopo
ingestione orale ) O DEL mTHPC (Esogeno)(mtetrahydroxyphenylchlorin dopo somm.ne e.v.) o il PORFIRIUM SODIUM
(Photofrin) E SUCCESSIVA IRRADIAZIONE CON ARGON DYE
LASER , LASER LIGHT O Nd : YAG LASER che provoca una necrosi
di circa 6 mm per il metodo esogeno e 2 mm per quello
Problemi : > 30 % può sviluppare stenosi , può
indursi una fotosensibilità cutanea
CONCLUSIONI : ERADICAZIONE DEL 90% ,
ERADICAZIONE A 5 ANNI 481 - 77 2 %
COSTO ELEVATO
endogeno
1.Sharma P. GIE 2007, 66:469-74, 2.Overholt BF. GIE 2007, 66:
Photodynamic Therapy: Theory
• Approved for HGD
• Photosensitizer given IV (sodium
porfimer) or orally (5-ALA)
• Affected esophagus exposed to nonablative laser light for ~12 minutes
• Oxygen free radicals induced in high
light dose areas
• Free radicals induce cell death
• Strictures, chest pain, effusions remain
issues
32
POSSIBILITA’ DELL’ENDOSCOPIA
Lesione T1
EB: RESEZIONE ENDOSCOPICA DELLA MUCOSA
33
EB: RESEZIONE ENDOSCOPICA DELLA
MUCOSA
Step 1: Injection of Target Lesion
Indicazioni
• Lesioni sporgenti
• Area focale di displasia
• Sospetto di malignita’
• Esofago di Barrett con displasia
Step 2: Positioning the Snare
Step 3: Suction and Snare of
Lesion
Ell C, Gastroenterology 2000; 118:670-7.
67
MUCOSECTOMIA DELL’ESOFAGO
34
Early Esophageal Cancer
Q : How about is the extent and depth of this lesion ?
Marking
35
Mucosal Cutting and Submucosal Dissection
EB: DISSEZIONE SOTTOMUCOSA dell’
ESOFAGO DI BARRETT/ EARLY ESOPHAGEAL
CANCER
marking
Gastrointest Endosc. 2008
Feb;67(2):202-9.
Clinical impact of endoscopic
submucosal dissection for
superficial adenocarcinoma located
at the esophagogastric junction.
Yoshinaga S, Gotoda T, Kusano C,
Oda I, Nakamura K, Takayanagi R.
Resection rate 100% RR = 77%
Submucosal Dissection
72
36
E.B. : TECNICHE DI ABLAZIONE
ENDOSCOPICA
CONCLUSIONI
• ELETTROCOAGULAZIONE MULTIPOLARE : più
elevata la percentuale di complicanze
• TERMOCOAGULAZIONE CON ARGON PLASMA : sicura,
poco costosa troppo frequenti le recidive
• FOTOABLAZIONE LASER : troppo costosa
• TERAPIA FOTODINAMICA : indaginosa , costosa con
effetti collaterali
• RADIOFREQUENZA (RF) A 360 ° /90° Molto
promettente
• MUCOSECTOMIA ENDOSCOPICA : radicale ,
valutazione complessa , resta da indicare bene
quando e come ?
• DISSEZIONE SOTTOMUCOSA : solo in mani esperte
Van den Boogert J Am J Gastroenterol 2001
Sampliner RE, Clin Gastroenterol Hepatol 2009
TUMORI DELLO STOMACO
Eziologia / Fattori di rischio
• L'alimentazione gioca un ruolo importante: una dieta ricca di
amidi, grassi e cibi affumicati o salati (che contengono nitriti e
nitrati precursori di cancerogeni come le nitrosamine)
• Acool e Fumo
• Importante il ruolo svolto dall'Helicobacter pylori,
• Esiste una predisposizione familiare che contribuisce alla
genesi della malattia
•
;
alcune alterazioni a carico di determinati geni (tra i quali p53
e APC) sono causa dell'insorgenza di tumori in diversi organi, tra
i quali lo stomaco (si parla, in questi casi, di sindrome di Linch
di tipo II).
37
DIAGNOSI ENDOSCOPICA
tumori gastrici
EGC
EGC
EGC
LINITE
M-linfoma
GIST
LNH
EUS NEI TUMORI GASTRICI
Systematic review of staging performance of
EUS in Gastro-oesophageal carcinoma
•
•
•
•
T staging
SEDE
stomaco
Giunzione esofago-gastrica
Q*
0,93
0,91
95 % CI
0,91 - 0,95
0,89 - 0,93
• Q* è il valore che bilancia la sensibilità e la specificità
• N staging
• Q* 0,79 ( 95% CI : 0,75 -0,83 )
Review eseguita su 13 lavori primari per ca gastrico e su 4 per ca della giunzione
Conclusione: l’EUS è molto efficace per discriminare T1-2 versus T3-4
Kelly S .et al Gut 2001
38
EUS : LINITE GASTRICA
EUS NEL CARCINOMA GASTRICO
Strategia terapeutica
•Stadio 0-I
Resezione endoscopica
•Stadio II-III
Chirurgia
CRITERI PER ERADICAZIONE ENDOSCOPICA di EGC
1. Lesioni tipo protrudente o piatto (tipo I, IIa, IIb)
2. Lesioni di qualsiasi diametro
3. Lesioni con scarsa tendenza alla invasione linfatica
(istologia - EUS)
Yamao T : Cancer 2006
39
EUS : CARCINOMA GASTRICO
EGC T1
T2
T3
CLASSIFICAZIONE uTNM
T4 N1
EUS nei LINFOMI
LNH GASTRICO
LNH GASTRICO
• La maggior parte dei linfomi B è di derivazione MALT
(Mucosa Associated Lymphoid Tessue)
•L’Helicobacter pylori sarebbe in grado di indurre la proliferazione B
linfocitaria monoclonale attraverso una stimolazione T linfocitaria.
Accuratezza EUS:
89% sensibilità
97% specificità
95% accuratezza
complessiva Tstage
Caletti G. GIE 2002
40
EUS nei LINFOMI
LNH GASTRICO
Quanto è vero che la tecnica è operatore-dipendente?
Studio multicentrico italiano di concordanza interosservatore nei
MALT-omi eseguito su 54 pazienti:
Concordanza su T :
buona sia prima che dopo trattamento (k = 0.38/0.37)
Migliore prima trattamento che dopo ( k = 0.63/0.34)
Minore concordanza su T1sm e T2
Fusaroli GIE 2002
EUS nei LINFOMI
LNH GASTRICO - CONCLUSIONI
ECOENDOSCOPIA è DECISIVA per :
•valutare gli strati interessati dall’infiltrato ai fini
di stabilire il piano terapeutico (Tstage )
• valutare il diametro dei linfonodi peri gastrici e
mediastinici (N-Stage)
• valutare la risposta alla terapia (restaging)
• effettuare il follow up della malattia negli anni.
41
EUS nei LINFOMI
LNH GASTRICO
Ispessimento di parete , della sottomucosa , metastasi
EUS nei TUMORI SOTTOMUCOSI
•diagnosi di formazione sottomucosa ( accuratezza
del 92%)
•differenzia da compressione ab-extriseco
•pianifica la terapia ( resezione o follow-up) in
particolare con FNA associata
42
EUS: LESIONI SOTTOMUCOSE
LEIOMIOMA
LEIOMIOMA
LIPOMA
EUS : GIST
• Gastro Intestinal Stromal Tumors
• Tumori mesenchimali del tratto
gastrointestinale che originano dalle pareti
intestinali, dal mesentere, dall’omento o dal
retroperitoneo
• All’immunoistochimica sono positivi alla c-kit
CD34 e non alla desmina e per questo si
distinguono dai leiomiomi o dai
leiomiosarcomi
Connolly E.M et al .Br J Surg 2003
43
EUS : GIST
EUS : GIST
• Gastro Intestinal Stromal Tumors
• Non è facile definirli benigni o maligni vengono quindi
considerate neoplasie a basso potenziale maligno
•
•
•
•
•
•
• I CARATTERI CHE NE DEFINISCONO L’APPROCCIO SONO:
la dimensione :
rischio molto basso : < 2 cm
basso rischio :
2-5 cm
rischio intermedio
< 5 cm
alto rischio
> 5-10 cm
l’indice mitotico ( quando si è fatto un prelievo di tessuto o cells)
Fletcher CD, et al : Diagnosis of GIST: a Consensus approach. Hum Pathol 2002
44
ESD GASTRICA
Efficacy and Safety of Endoscopic
Submucosal Dissection for
Early Gastric Cancer in Patients
with Comorbid Diseases
Beom Jin Kim*, Tae Hoon Chang†, Jae J. Kim†, ByungHoon Min†, Jun Haeng Lee†, Hee Jung Son†,
Poong-Lyul Rhee†, Jong Chul Rhee†, Kyung Mee Kim‡,
and Chul Keun Park‡
*Department of Internal Medicine, Chung-Ang University
College of Medicine, Departments of †Medicine and
‡Pathology, Samsung Medical
Center, Sungkyunkwan University School of Medicine,
Seoul, Korea
CONCLUSIONS
ESD may be a safe and effective
Treatment for early gastric cancer
Gut and Liver, Vol. 4, No. 2, June 2010, pp. 186-191
OUTCOMES - ESD
Therapeutic outcomes of endoscopic submucosal dissection
of undifferentiated-type intramucosal gastric cancer
without ulceration and preoperatively diagnosed as 20
millimetres or less in diameter.
Yamamoto Y et al
Department of Gastroenterology, Cancer Institute Hospital, Tokyo.
58 patients between September 2003 and August 2008
ESD was technically feasible for expanded-indication
lesions of undifferentiated-type EGC. We achieved a
high rate of curative resection by the markings at sites
5 mm beyond the preoperatively determined lesion
area. Factors responsible for non-curative resection
were most commonly submucosal invasions. We should
diagnose the depth of such lesions more carefully.
Dig Endosc 2010 Apr;22(2):112-8.
45
Gli STRATI della PARETE del TUBO DIGERENTE
epitelio
mucosa
tonaca propria
muscolaris mucosae
superficiale
m
sottomucosa
intermedia
sm
profonda
muscolatura circolare
muscolare
mp
propria
muscolatura longitud.
sierosa
sierosa
s
LESIONI NEOPLASTICHE
DEL TRATTO DIGESTIVO
m
mucosa
•
•
•
•
POLIPI IPERPLASTICI
AMARTOMI
ADENOMI
CARCINOMI
• LIPOMI
• G.I.S.T.
• CARCINOIDI
sm
sottomucosa
mp
muscolare
propria
• LEIOMIOMI
sierosa
• LESIONI METASTATICHE
s
46
LESIONI NEOPLASTICHE
DEL TRATTO GASTROENTERICO
INDICAZIONI
GENERALI AL
TRATTAMENTO
J PRESENZA DI UN PROBLEMA CLINICO
(sanguinamento, ostruzione, perforazione, …)
J PREMALIGNITA’ O MALIGNITA’
(necessità comunque di diagnosi istologica)
J RIDOTTI RISCHI DI COMPLICANZE
IATROGENE ESCISSIONALI
APPROPRIATEZZA DELLA EGDS SEQUENZIALE
O PERIODICA
( FOLLOW-UP)
•
follow-up di pazienti con varici esofagee o gastriche
(in particolare se trattate)
•
sorveglianza periodica dell’esofago di Barrett
•
il controllo delle ulcere esofagee, delle esofagiti
croniche associate ad acalasia scompensata, delle
ulcere gastriche per verificarne la benignità o la
guarigione
•
controllo dei fattori di rischio e condizioni
precancerose del cancro gastrico in situazioni definite
EPAGE 2008
47
FATTORI DI RISCHIO PER
ADENOCARCINOMA
DEFINITI
CON
SORVEGLIANZA
SUGGERITA
DEFINITI
PROBABILI
Displasia grave
Metaplasia
intestinale
Resezione
gastrica
da oltre 20 anni
FAP
Gastrite cronica
atrofica
Anemia
perniciosa
Adenomi
Infezione da
H. Pylori
( EGDS SEQUENZIALE
APPROPRIATA )
HNPCC (Lynch II)
EGDS E FATTORI DI RISCHIO PER
ADK
SI
Appropriata
• soggetti con gastrite cronica atrofica (con o senza metaplasia intestinale)
solo se l’ultima gastroscopia ha dimostrato displasia
• soggetti gastroresecati (per p. benigna) solo se l’ultima gastroscopia ha
dimostrato displasia
• soggetti con precedenti polipi adenomatosi se l’ultima gastro è stata
eseguita > 2 anni
• soggetti con FAP se l’ultima gastro è stata eseguita > 2 anni
NO
Inappropriata
• soggetti con anemia perniciosa di età < 50 anni
• soggetti con anemia perniciosa di età > 50 anni (incerta)
• soggetti gastroresecati (per p. benigna) se l’ultima gastro non ha dimostrato
displasia
• soggetti con polipi non adenomatosi (amartomi, iperplastici…) in assenza di
poliposi familiare
48
EGDS E FATTORI DI RISCHIO PER
ADK
EGDS necessaria
• soggetti con gastrite atrofica con displasia se l’ultima gastroscopia è
stata eseguita > 2 anni
• soggetti gastroresecati da oltre 15 anni (per p. benigna) e l’ultima
gastro è stata eseguita > 2 anni
• soggetti con precedente riscontro di polipi adenomatosi e incompleta
asportazione
• soggetti con FAP con polipi gastroduodenali e l’ultima gastro è stata
eseguita > 2 anni
Is the diagnostic yield of GI endoscopy improved
by the use of explicit panel-base
appropriateness criteria?
•
Appropriated:
46 %
•
Uncertained:
15%
•
Inappropriated:
39%
•
In multivariate analyses the diagnostic yield was significanly influenced
by appropriateness
•
Conclusions: the use of EPAGE criteria improves patients selection for
EGDS and can contribute to enhancing the quality and efficiency of
care
1681 EGDS
Froehlich F. GIE 2000; 52, 333
49
Grazie per ora !!!
Digestive Endoscopy Unit
Nuovo Ospedale Civile S. Agostino Estense
Baggiovara, Modena
Dir. Rita Conigliaro
50