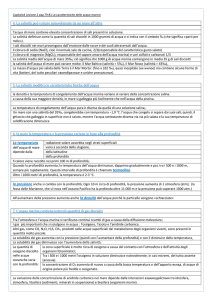
SALINITA’ PRATICA
Compendio delle definizioni nel tempo
1899 - Prima definizione di Martin Knudsen: “Deve definirsi salinità il peso dei sali inorganici
in un chilogrammo di acqua di mare, quando tutti i bromuri e gli ioduri vengano sostituiti con
una quantità equivalente di cloruri e tutti i carbonati da una quantità equivalente di ossidi”
1902 - Dal principio della costanza dei rapporti ionici. Viene definità la clorinità, cioè “il
cloruro equivalente alla concentrazione totale di alogenuri, espresso in parti per mille in peso
e misurato per titolazione con una soluzione di nitrato d’argento”. Si ottiene la prima relazione
empirica fra salinità (S ‰) e clorinità (Cl ‰), enunciata da Forch et al.:
S ‰ = 1,805 Cl ‰ + 0,030
1937 - Dopo la ridefinizione dei pesi atomici, si ridefinisce la clorinità in modo da escludere
la variabilità associata alle revisioni periodiche dei pesi atomici: “Il valore della clorinità per
mille in un campione di acqua di mare è per definizione uguale al valore della massa di
Argento purissimo espressa in grammi necessaria a precipitare gli alogeni in 0,3285234 kg di
un campione di acqua di mare”
1966 - Durante gli anni ‘60 si procede ad una nuova indagine sulle relazioni tra i parametri
principali (clorinità, rapporto di conducibilità, indice di rifrazione)e con i parametri derivati
fondamentali, cioè salinità e gravità specifica. Ne deriva una nuova relazione (JPOTS UNESCO) che sostitusce quella di Sorensen:
S ‰ = 1,80655 Cl ‰
1981 - Il JPOTS (Joint Panel on Oceanographic Tables and Standards) stabilisce l'adozione
di una scala pratica di salinità per la quale la calibrazione viene fatta con una soluzione di
cloruro di potassio. Salinità pratica (S) = f(K15) dove
Conducibilità campione acqua di mare (15°C, 1atm)
K15 = ────────────────────────────────────
Conducibilità KCl (32,4356 g/kg, 15° C, 1 atm)
Per K15 = 1 sarà S = 35.
La salinità per un campione generico si otterrà dall’equazione seguente:
S = 0.0080 - 0.1692 K151/2 + 25.3851 K15 + 14.0941 K153/2 - 7.0261 K152 + 2.7081
K155/2
(Link: storia della SALINITA’)
SALINITA’
PRATICA
Nel 1871 la British Royal Society offrì un finanziamento del governo
inglese per una spedizione che facesse indagini scientifiche sui seguenti
obiettivi:
1. Le condizioni fisiche delle acque più profonde dei bacini oceanici.
2. La composizione chimica dell’acqua di mare a tutte le profondità .
3. Le caratteristiche fisiche e chimiche dei depositi dei fondi marini e la loro
origine.
4. La distribuzione di organismi viventi a tutte le profondità del mare e sul fondo.
Con queste finalita’ sei scienziati, sotto la direzione di C. Wyville
Thompson, si imbarcarono sulla H.M.S. Challenger (link al Report della
Challenger) una corvetta di 2.306 tonnellate attrezzata per indagini scientifiche,
per un viaggio di circa 4 anni (dal dicembre 1872 al maggio 1876). La crociera
dello Challenger percorse 127.500 km attraverso gli oceani Atlantico e Pacifico,
effettuando 492 saggi di acque profonde, 133 dragaggi di fondo, 151
campionamenti in mare aperto e 236 misure in serie di temperatura delle
acque, inoltre furono classificate 4.717 nuove specie di organismi marini e si
giunse a misurare una profondità di 8.185 m nei dintorni della Fossa delle
Marianne.
Per quel che riguarda l’acqua di mare 77 campioni raccolti durante la
spedizione, furono studiati nel 1884 da William Dittmar ed analizzati con le
tecniche chimiche più raffinate messe a punto all’epoca.
Dai risultati delle prime analisi quantitative dei componenti principali.
scaturì il principio fondamentale di costanza dei rapporti tra gli ioni
principali, cioe’ acque con salinita’ diverse mantengono pero’ lo stesso
rapporto fra gli ioni principali.
Nel 1899 si costitui’ una Commissione Internazionale per lo studio degli
oceani, sotto la guida del Prof. Martin Knudsen, che propose una prima
definizione generale della salinita’:
“Deve definirsi salinità il peso dei sali inorganici in un chilogrammo di acqua di
mare, quando tutti i bromuri e gli ioduri vengano sostituiti con una quantità
equivalente di cloruri e tutti i carbonati da una quantità equivalente di ossidi”
2
La definizione risulta complessa perchè molte sono le difficoltà che si
incontrano nel determinare gravimetricamente, cioè per pesata, il contenuto di
sali di un campione sottoposto ad evaporazione. Durante questo processo si
verificano perdite per volatilizzazione di alcuni componenti, come il cloruro in
forma di acido cloridrico, e la formazione di composti idratati, per cui risulta
difficoltosa l’eliminazione completa dell’acqua.
Per il principio della costanza dei rapporti ionici: attraverso la
misura di uno dei costituenti principali, può essere determinato uno
qualsiasi degli altri componenti come pure la quantità totale di sali.
Lo ione cloruro, fra i costituenti principali dell’acqua di mare, offriva
analiticamente le migliori opportunità già con le tecniche chimiche disponibili nei
primi del novecento. Venne perciò definita un nuovo parametro: la clorinità.
Si definisce clorinità, il cloruro equivalente alla concentrazione totale di
alogenuri, espresso in parti per mille in peso, e misurato per titolazione con una
soluzione di nitrato d’argento.
(link: determinazione della clorinità con pesata del campione o
volumetrica)
La Commissione Internazionale affidò a Sorensen l’incarico di analizzare
un gruppo di nove campioni di varia salinità sia per i sali totali, con il metodo
gravimetrico, sia per i cloruri, con il metodo titrimetrico, cioè per titolazione con
nitrato d’argento. Si potè così ottenere la prima relazione empirica fra salinità
(S%o) e clorinità (Cl%o) che fu enunciata da Forch et al. nel 1902:
S%o = 1,805 Cl%o + 0,030
Questa definizione pratica della salinità condusse all’adozione della
determinazione della clorinità per ottenere la salinità, e subentrò alla prima
definizione di Knudsen, data su basi gravimetriche.
Negli anni ’60 la ridefinizione del peso atomico degli elementi chimici e
l’adozione dell’unità unificata di massa atomica, pose il problema della
continuità fra i valori di salinità precedenti e quelli successivi, poichè la
determinazione della clorinità coinvolgeva, nel procedimento, il passaggio da
unità chimiche (moli od equivalenti) ad unità fisiche (kg) attraverso il peso
atomico del cloruro. Si cercò allora di ridefinire la clorinità in modo da escludere
la variabilità associata alle revisioni periodiche dei pesi atomici, e nel 1937
venne formulato l’enunciato seguente:
“Il valore della clorinità per mille in un campione di acqua di mare è per
definizione uguale al valore della massa di Argento purissimo espressa in
grammi necessaria a precipitare gli alogeni in 0,3285234 kg di un campione di
acqua di mare”
3
L’argento puro (Atomgewichtssilber) a cui si fa riferimento nella
definizione è il campione di argento preparato dal Prof. Honigschmidt nel 1938
per la rideterminazione dei pesi atomici. Un campione da 100 g di questo
argento venne affidato al Laboratorio Danese di Idrografia come standard per il
futuro, e comunque lo smarrimento di questo standard non costituirebbe un
problema, in quanto è codificato il procedimento per preparare un campione di
argento con le stesse caratteristiche.
Per uniformare il più possibile la determinazione della clorinità in tutti i
laboratori che se ne interessano è stato adottato fin dall’inizio uno Standard di
Acqua di Mare, la cosiddetta Acqua Normale (Eau de mer normale), all'inizio
preparato presso i Laboratori Idrografici di Copenhagen (Danimarca),
attualmente dallo I.A.P.S.O. Standard Sea Water Service (Wormley, Inghilterra)
e distribuito in tutte le istituzioni oceanografiche.
In origine l'Acqua Normale era acqua di mare la cui clorinità veniva
regolata a circa 19,4ppt e determinata accuratamente per comparazione diretta
o indiretta con lo standard originale preparato nel 1902. Per rendere la clorinità
di tutte le partite di fiale preparate indipendente dai cambiamenti dei pesi
atomici, venne preparato nel 1937 un nuovo standard primario (Urnormal-1937)
che servì a stabilire la clorinità di nuove partite di fiale di Acqua Normale
(Jacobsen e Knudsen, 1940). La nuova serie di Acqua Normale, paragonata
con il vecchio standard, aveva una clorinità di 19,381 ppt. Lo standard primario
del 1937 venne preparato applicando la nuova definizione, col rapporto di
0.3285233 fra l’argento puro, impiegato per la titolazione, e la clorinità.
Nella chimica dell'acqua di mare, altre sostanze sono determinate e
riportate su base volumetrica, è quindi utile introdurre anche il concetto di
clorosità.
La clorosità, è la proprietà corrispondente alla clorinità espressa come
grammi/litro a 20°C e si ottiene moltiplicando la clorinità di un campione di
acqua per la sua densità a 20°C.
A questo scopo ci sono apposite tabulazioni da cui, data la clorosità, si
può ricavare la clorinità corrispondente.
A partire dalla metà degli anni ‘50 lo sviluppo della conduttimetria
introdusse un altro metodo, stavolta fisico, per determinare la salinità. Fu
ridiscussa la relazione salinità-clorinità codificata da Sorensen, concludendo
che i nove campioni da lui esaminati, comprendenti più campioni del Mar
Baltico, non erano statisticamente abbastanza rappresentativi per definire la
relazione.
Durante gli anni ‘60 si procedette ad una nuova indagine sulle
relazioni tra i parametri principali (clorinità, rapporto di conducibilità, indice di
rifrazione) e con i parametri derivati fondamentali, cioè salinità e gravità
4
specifica. Venne esaminato un congruo numero di campioni, statisticamente
significativo e rappresentativo delle acque oceaniche di tutto il globo,
determinandone la composizione chimica, la clorinità ed il rapporto di
conducibilità, oltre che l’indice di rifrazione e la gravità specifica.
A seguito di questo lavoro di revisione e nell’ambito dell’UNESCO, un
Gruppo Internazionale (Joint Panel on Oceanographic Tables and Standards),
in cui erano rappresentate le maggiori organizzazioni oceanografiche di vari
paesi, sostituì alla relazione di Sorensen la seguente:
S%o = 1,80655 Cl%o
utilizzata dalla metà del 1960 fino all'inizio degli anni '80. In questo periodo le
fiale di acqua standard recavano il titolo espresso come clorinità, e servivano
nel contempo come riferimento per le misure conduttimetriche di salinità. Con i
dati sperimentali venne calcolato un polinomiale che metteva in relazione la
salinità con il rapporto di conducibilità a 15°C e furono elaborate tabelle
nell’ambito 0-40 %o di salinità pubblicate a cura dell’UNESCO (1966).
Dal 1981 il JPOTS (Joint Panel on Oceanographic Tables and
Standards) ha stabilito l'adozione di una scala pratica di salinità per la quale la
calibrazione viene fatta con una soluzione di cloruro di potassio.
La salinità pratica (S) di un campione di acqua di mare, viene definita come “il
rapporto K15 di conducibilità elettrica fra un campione di acqua di mare, alla
temperatura di 15°C ed alla pressione di un'atmosfera, e una soluzione di
cloruro di potassio di concentrazione 32.4356 g/kg di soluzione alla stessa
temperatura e pressione”.
Il valore di K15 pari a 1 corrisponde per definizione ad una salinità pratica
di 35.
Il seguente polinomiale definisce la salinità pratica in funzione del
rapporto K15:
S = 0.0080 - 0.1692 K151/2 + 25.3851 K15 + 14.0941 K153/2 - 7.0261 K152 +
2.7081 K155/2
Poichè la definizione dà un valore derivante da un rapporto fra due
conducibilità, quindi adimensionale, la salinità viene indicata
semplicemente come un numero, tuttavia corrispondente al valore in
grammi/chilogrammo o parti per mille in peso.
Con la nuova definizione ed il nuovo standard sono state approntate e
pubblicate dall’UNESCO nuove Tabelle di conversione da conducibilità a
salinità.
5
(a)
(b)
(c)
Figura 1. (a) Standard IAPSO, anteriore agli anni ’80, dato come clorinità, per la
determinazione argentometrica (metodo Mohr-Knudsen); (b) Standard IAPSO attuale,
dato come rapporto di conducibilità con Potassio Cloruro (c) Salinometro da banco
Guildline
6
EQUAZIONE INTERNAZIONALE DI STATO DELL'ACQUA DI MARE (EOS80)
Densità
La densità dell'acqua di mare dipende da:
1)
2)
3)
4)
5)
salinità pratica
temperatura
pressione
composizione isotopica
contenuto dei gas atmosferici disciolti.
Considerando praticamente costante la composizione isotopica per le
acque oceaniche e misurando la densità in condizioni di saturazione dei gas
atmosferici disciolti, la dipendenza si riduce ai primi tre fattori.
La densità (r, Kg m-3) dell'acqua di mare ad un'atmosfera standard (p = 0)
viene calcolata dalla salinità pratica (S) e dalla temperatura (t°C) con
l'equazione seguente:
r (S, t, 0) = rw + (a0 + a1t + a2t2 + a3t3+ a4t4 )S + (b0 + b1t + b2t2 )S3/2 + c0 S2
in cui rw è la densità della Standard Mean Oceanic Water (SMOW),
presa come riferimento per l'acqua pura e consistente in acqua oceanica
distillata, a ben definita composizione isotopica, conservata e distribuita
dalla Agenzia Internazionale per l'Energia Atomica (IAEA).
Il valore di densità massima per la SMOW attualmente accettato è pari a
3
999.975 kg/m .
Questa equazione è valida per salinità pratiche comprese fra 0 e 42 e per
temperature fra -2 e 40°C. Per pressioni diverse da zero l'equazione
precedente viene così modificata:
r (S, t, p)= r (S, t, 0) / (1 - p / K(S, t, p))
ed è valida per pressioni da 0 a 1000bars.
Anomalia di densità.
Fino al 1980 è stata messa in relazione alla densità specifica ed indicata
come parametro di Knudsen (1901) secondo la seguente formulazione:
(S, t, 0) = (r (S, t, 0) / r (0, tmax, 0) - 1)x 1000
7
in cui tmax è la temperatura di massima densità dell'acqua pura alla pressione
atmosferica. L'anomalia così espressa è un numero puro, adimensionale
perché ricavato relativamente alla densità dell'acqua pura.
Dal 1980 con l'introduzione della nuova equazione di stato (EOS 80) nella
quale figura la densità assoluta, l'anomalia di densità risulta una quantità
dimensionale (kg m-3) per la quale è stato proposto un simbolo diverso ()
per distinguerla dalla vecchia formulazione.
Secondo la nuova definizione si ha la seguente corrispondenza:
(S, t, p) = r(S, t, p) - 1000
Tuttavia il nuovo simbolo non è entrato ancora nell'uso comune fra gli
oceanografi ed è quindi abituale trovare il simbolo per indicare l'anomalia di
densità anche per la nuova formulazione EOS80. Per questo è opportuno
chiarire quando lo si usa con la nuova definizione, indicando espressamente
che non è inteso come parametro di Knudsen.
Volume specifico
Definito come l'inverso della densità, 1/r, con le dimensioni m3/kg, ha la
seguente formulazione:
V(S, t, p) = V(S, t, p) (1 - p/K(S, t, p))
Anomalia di volume specifico
E' una quantità derivata dal volume specifico espressa in unità di 10-8m3/kg e
definita nel modo seguente:
d = V(S, t, p) - V(35, 0, p)
Viene impiegata per la misura della struttura baroclina e viene anche
denominata anomalia sterica.
8
RAPPRESENTAZIONI GRAFICHE DEI PARAMETRI OCEANOGRAFICI
L’andamento
dei
principali
parametri oceanografici può essere
rappresentato come singolo profilo,
quando si consideri una sola stazione di
campionamento con diverse quote alle
quali e’ stato effettuato il prelievo
oppure con un profilatore a sensori che
rilevano in continuo i dati principali
(salinità, temperatura, ossigeno disciolto,
pH).
Con più stazioni disposte lungo un
allineamento si può avere una
rappresentazione per sezione di una
determinata proprietà, il cui andamento
viene espresso con isolinee, ricavate
dalla matrice spaziale dei dati rilevati ad
ogni stazione dell’allineamento.
A
seconda
del
parametro
rappresentato si parla di isoterme per la
temperatura, isoaline per la salinità e
isopicne per la densità.
Fig. 2 – Esempi di profili verticali (in alto) e di sezioni verticali (in basso)
9
Analogamente si possono avere rappresentazioni tridimensionali per
un’area esaminata.
Fig. 3 – Esempio di diagramma T-S : osservazioni fra 150m e 5000m a 9°S di latitudine
nell’Oceano Atlantico. I punti rappresentano campioni singoli di acqua di mare. I
numeri indicano i metri di profondità espressi in centinaia. I riquadri rossi individuano
le principali masse d’acqua per l’Atlantico oltre i 1000m.: AABW = Antarctic Bottom
Water; NADW = North Atlantic Deep Water; AAIW = Antarctic Intermediate Water.
Una rappresentazione particolare si ottiene con i cosiddetti grafici T-S,
utili per l’analisi delle masse d’acqua.
Ogni coppia di valori (temperatura-salinità) associata ad un punto di
campionamento viene rappresentata in un grafico che porta in ordinate la
temperatura ed in ascisse la salinità.
Spesso sul grafico e’ riportato un reticolo di base costituito dalle isopicne
possibili nel campo di rappresentazione, in genere con intervallo di un’unita’,
per identificare più rapidamente le caratteristiche delle acque nei punti di
campionamento.
Le rappresentazioni T-S possono riferirsi sia a distribuzioni spaziali e
permettere l’identificazione delle masse d’acqua e dei rapporti che intercorrono
fra esse (grado di mescolamento, stabilità, ecc.), sia a distribuzioni temporali
che indicano l’evolversi delle masse d’acqua secondo cicli temporali (stagionali,
annuali, serie storiche, ecc)
10
TEMPERATURA E SALINITA’ DEGLI OCEANI
Figura 4 – Temperatura e salinità media degli oceani
11
La distribuzione globale della temperatura riflette la distribuzione
dell’energia che arriva sulla superficie terrestre con i massimi centrati sulla
fascia equatoriale e modellati dalle correnti. Per la salinità il bilancio fra
evaporazione e precipitazioni determina i massimi rilevati ai tropici. L’influenza
dei ghiaccio marino determina invece i minimi nelle aree polari.
Figura 5 – Precipitazioni, evaporazione e salinità media in funzione della latitudine
L’andamento verticale della temperatura è legato all’estensione della
circolazione termoalina, quindi allo spessore dello strato di mescolamento
(mixing layer). L’entità della variazione di temperatura per unità lineare di
profondità permette di individuare la zona dove questa è massima
(termoclino). Di conseguenza si ha una variazione massima di densità
(picnoclino), cioè una stratificazione che incrementa la stabilità verticale di
colonna. Anche una variazione verticale della salinità (aloclino) può creare
stratificazioni di densità.
La latitudine ha l’influenza maggiore sull’escursione termica annuale
durante l’evoluzione stagionale. La formazione di un termoclino stagionale
12
che distingue lo strato di mixing superficiale dalle acque sottostanti, è ridotta a
basse latitudini dove si verificano temperature elevate tutto l’anno.
La massima escursione stagionale si ha nelle zone temperate, che
presentano l’evoluzione di maggior ampiezza del termoclino stagionale. Nelle
zone polari si verificano invece le condizioni per un mixing che può raggiungere
il fondo degli oceani, originato però dall’intenso raffreddamento invernale.
Figura 6 – Andamento verticale della temperatura con la latitudine (in alto) ed
variazione stagionale del termoclino nella zona temperata (in basso)
L’influenza del mixing superficiale non si estende però oltre i 400m anche
dove l’escursione stagionale è massima. Il termoclino permanente che si
osserva alle basse ed alle medie latitudini, è perciò un elemento di separazione
fra le acque oceaniche superficiali che subiscono gli effetti climatici e quelle
sottostanti, intermedie e profonde. Queste ultime si sono formate in superficie
ad alte latitudini, ma una volta raggiunte profondità al di sotto del termoclino
permanente, non sono più influenzate dai fattori climatici. Le correnti profonde
le muovono, poi diffondendole per tutti gli oceani.
Le sezioni verticali degli oceani mettono in luce la stratificazione
determinata dal gradiente di temperature che si sviluppa dalla superficie al
13
fondo. Nelle acque profonde o prossime al fondo le temperature sono inferiori a
5°C e in alcune zone inferiori a 0°C. Facendo la media delle temperature su
tutta la colonna d’acqua dalla superficie al fondo per una media di 5000m, si
ottengono valori prossimi a 4,9°C anche all’equatore. Perciò sul volume
complessivo delle acque oceaniche predomina il volume di acque a bassa
temperatura, cioè termicamente la condizione dominante per gli oceani.
L’effetto della temperatura sulla densità e quindi sulla stabilità della
stratificazione delle acque è preponderante. Anche la salinità influisce sulla
densità ma l’escursione di valori è molto più piccola che non per i valori di
temperatura. Lo si può rilevare osservando le scale di misura accanto ai grafici
delle sezioni di seguito riportate, nello specifico per l’Oceano Atlantico, ma
esemplificative anche per gli altri oceani.
Fig. 7 – Sezioni verticali per temperatura e salinità dell’Oceano Atlantico
14
TEMPERATURA POTENZIALE
(“Theta T”)
Scendendo in profondità la pressione esercita una compressione
dell’acqua, cioè compie un lavoro sull’acqua che si manifesta con un
innalzamento della temperatura. Il processo può considerarsi adiabatico in
quanto lo scambio di calore è lentissimo. L’incremento del riscaldamento è
piccolo (ca. 0,1°C/1000m di profondità), perciò la correzione delle temperature
misurate in situ, per eliminare l’effetto compressione, è significativa solo a
profondità maggiori di 1000m.
Fig. 8 – Temperature reali (T) misurate e temperature potenziali ()
corrispondenti calcolate. E’ evidente il divario crescente coll’aumentare della
profondità e quindi della pressione.
La correzione delle temperature in situ viene effettuata con un’equazione
internazionale che consente di ricavare le temperature potenziali, ovvero i
valori di temperatura che le acque avrebbero se venissero riportate in superficie
alla pressione di 1 atmosfera, in condizioni adiabatiche, cioè senza scambiare
calore con le acque circostanti.
Nei grafici T-S viene spesso rappresentata la temperatura potenziale
invece delle temperature in situ, per confrontare correttamente la stratificazione
delle masse d’acqua specialmente con piccole differenze nelle proprietà
fondamentali.
15
Un esempio viene illustrato di seguito considerando la circolazione del
Mare Artico e i tipi d’acqua che si formano nella sua area di influenza.
Fig 9 - Oceano Artico: schema di (a) circolazione, (b) stratificazione delle masse
d’acqua e punti di trasformazione, (c) disposizione delle masse d’acqua in un grafico
Θ-S. (Aagaard et al. 2005, riveduto dall’originale di Schlichtholz and Houssais 2002)
16