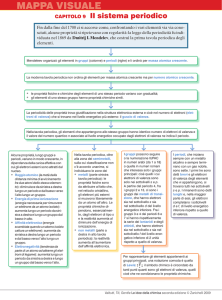
Il modello atomico
La costruzione dei primi modelli atomici risale alla fine del 1800, in concomitanza con
l’identificazione della carica elettrica. Essa viene definita una proprietà temporanea dei corpi, che si
manifesta in seguito ad una sollecitazione di tipo meccanico (ad esempio strofinio) o chimico
(coinvolgimento in reazioni chimiche). La manifestazione si prolunga per tutta la durata della
sollecitazione, fino a ripristinare lo stato di quiete iniziale.
Per convenzione gli stati elettrici possibili sono 2: carica di segno positivo (+) e carica di segno
negativo (-). Tra i due stati si instaurano forze di tipo attrattivo o repulsivo: due cariche concordi si
respingono, due cariche opposte si attraggono. Coulomb dimostrò come la forza che si genera tra
due cariche sia analoga alla forza di attrazione gravitazionale di Newton, secondo la formula:
Coulomb nomina questa forza elettrostatica.
Alla fine del 1800 molti studi furono orientati alla misurazione della carica elettrica dei corpi, e ben
presto ci si rese conto che sono gli atomi a caricarsi, se sollecitati opportunamente.
Thomson dimostrò l’esistenza all’interno dell’atomo di cariche sia positive che negative, in uguale
numero, supponendo così che in condizioni di quiete un atomo sia stabile. Nel 1897 propose il
primo modello atomico, detto “a panettone” (Ing: plum pudding model), nel quale ipotizzò che
cariche positive e negative si unissero in maniera casuale in una sfera.
Validità del modello:
- il numero delle cariche + sono uguali al numero delle cariche -;
- le cariche – vengono definite elettroni; le cariche + protoni. Essi vengono definiti particelle
subatomiche, considerate sempre porzioni di materia;
- l’atomo non è più la particella più piccola che compone la materia.
Questo modello ebbe vita breve, poiché nuovi esperimenti dimostrarono che tra le cariche positive e
le cariche negative appartenenti allo stesso atomo vi è dello spazio “vuoto”, anche considerevole.
Rutherford, nel 1911, propose un nuovo modello, detto “planetario”, immaginando un nucleo in cui
si trovano tutti i protoni (le cariche positive) e gli elettroni che orbitano intorno ad esso, seguendo
orbite ellittiche (da Keplero).
Validità del modello:
- Rutherford mantiene l’idea che in condizioni di quiete il numero di cariche + sia uguale al
numero di cariche -;
- Disloca la carica negativa su orbite ellittiche a distanze diverse, ma casuali, dal nucleo;
- La forza di attrazione elettrostatica che agisce su un singolo elettrone è data dalla somma di
tutte le cariche positive, poiché concentrate nel nucleo; la forza diminuisce allontanandosi
dal nucleo.
- L’elettrone, per sconfiggere la forza elettrostatica, ruota anche su se stesso, secondo un moto
di spin.
Con il crescente sviluppo della fisica quantistica, il modello di Rutherford comincia ad indebolirsi,
poiché non può descrivere situazioni di stabilità: gli elettroni ruotando continuamente intorno al
nucleo dovrebbero emettere energia, fino a cadere sul nucleo e a decretare la fine dell’atomo stesso.
Pochi anni dopo il fisico Bohr riprende e modifica l’atomo planetario, rettificando il concetto di
orbita con l’idea che gli elettroni si dispongono intorno al nucleo a distanze ben precise, in cui
l’elettrone non emette né assorbe energia. Questo stato viene definito fondamentale.
1
Assorbendo energia gli elettroni possono spostarsi alla distanza successiva (stato eccitato);
terminata la fonte di energia gli elettroni ritornano alla stato fondamentale emettendo una radiazione
elettromagnetica. Maggiore è la fonte di energia, e saranno gli elettroni più interni che si eccitano.
Fornendo il giusto valore di energia, l’elettrone più lontano dal nucleo può allontanarsi e non subire
più attrazione dal nucleo, rendendo l’atomo carico positivamente (ione positivo o catione).
Na + E Na+ + 1eCa + E Ca+ + 1eCa+ + E Ca2+ + 2eLa configurazione elettronica
L’energia fornita ad un atomo per eliminare l’elettrone più lontano viene detta di ionizzazione.
È possibile calcolare l’energia di ionizzazione valida per ogni elettrone e risalire così alla struttura
elettronica (disposizione degli atomi) secondo le distanze dello stato fondamentale teorizzate da
Bohr.
Gli elettroni si dispongono intorno al nucleo occupando livelli di energia ben definiti, per ogni
atomo. Il valore ottenuto di Ei può essere anche definito il valore energetico, o livello energetico di
quell’elettrone posto a quella distanza.
Continuando a fornire E, rimuovendo così tutti gli elettroni dall’atomo, si giunge a definire la
configurazione elettronica, e aumentando il numero atomico si riscontrano delle regolarità nella
definizione dei livelli.
I° livello: max 2 elettroni
II° livello: max 8 elettroni, suddivisi in 2 sottolivelli (2 + 6)
III° livello: max 8 elettroni, suddivisi in 2 sottolivelli (2 + 6)
IV° livello: max 18 elettroni, suddivisi in 3 sottolivelli (2 + 10 + 6)
A partire dallo Sc si nota che il terzo elettrone che perde l’atomo si posiziona tra le nuove posizioni
e il livello precedente. Si ipotizza dunque che questi elementi possiedano un livello energetico
compreso tra il IV e il III.
V° livello: max 18 elettroni, suddivisi in 3 sottolivelli (2 + 10 + 6)
VI° livello: max 32 elettroni, suddivisi in 4 sottolivelli (2 + 14 + 10 + 6)
A partire dal La si nota che il terzo elettrone che perde l’atomo si posiziona tra le nuove posizioni e
due livelli precedenti. Si ipotizza dunque che questi elementi possiedano un livello energetico
compreso tra il VI e il IV livello, oltre che un livello tra il VI e il V.
VII° livello: max 32 elettroni, suddivisi in 4 sottolivelli (2 + 14 + 10 + 6)
I sottolivelli che si completano con 2 elettroni vengono definiti s.
I sottolivelli che si completano con 6 elettroni vengono definiti p. Si riconoscono due ulteriori
sottolivelli (3 + 3)
I sottolivelli che si completano con 10 elettroni vengono definiti d. Si riconoscono due ulteriori
sottolivelli (5 + 5)
I sottolivelli che si completano con 14 elettroni vengono definiti f. Si riconoscono due ulteriori
sottolivelli (7 + 7)
Dunque, tenendo conto delle regolarità:
- il I livello contiene solo 2 elettroni 1s
2
-
-
-
il II livello contiene 8 elettroni (2 + 6) 2s 2p
il III livello contiene 8 elettroni + 10 che si completano dopo aver iniziato il livello
successivo (IV) 3s 3p 3d
il IV livello contiene 8 elettroni + 10 che si completano dopo aver iniziato il livello
successivo (V) + 14 che si completano dopo aver iniziato due livelli successivi (VI) 4s 4p
4d 4f
il V livello contiene 8 elettroni + 10 che si completano dopo aver iniziato il livello
successivo (VI) + 14 che si completano dopo aver iniziato due livelli successivi (VII) 5s
5p 5d 5f
il VI livello contiene 8 elettroni + 10 che si completano dopo aver iniziato il livello
successivo (VII) 6s 6p 6d
il VII contiene 8 elettroni 7s 7p
Nell’ordine, i livelli si completano come segue:
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
Possiamo definire la configurazione elettronica una proprietà periodica, che varia secondo il
seguente andamento:
- lungo il periodo aumenta il numero atomico
- nel gruppo aumenta il livello energetico. Gli atomi appartenenti allo stesso gruppo hanno gli
ultimi elettroni che occupano sempre lo stesso tipo di sottolivello
- Gli elementi di transizione occupano il sottolivello s del livello successivo e il sottolivello d
del livello corrente
- I lantanidi (57/70) e Attinidi (89/102) occupano il sottolivello s successivo, il sottolivello f
del livello precedente e il sottolivello d del livello corrente.
Elettroni terminali
Gruppo 1: 1 elettrone nel sottolivello s (n s1, dove n sta per numero del livello energetico corrente)
Gruppo 2: 2 elettroni nel sottolivello s (n s2)
Gruppo 3: 1 elettrone nel sottolivello d (n s2 n-1 d1) non valido per La e Ac, valido per Lu e Lr
Gruppo 4: 2 elettroni nel sottolivello d (n s2 n-1 d2)
Gruppo 5: 3 elettroni nel sottolivello d (n s2 n-1 d3)
Gruppo 6: 4 elettroni nel sottolivello d (n s2 n-1 d4)
Gruppo 7: 5 elettroni nel sottolivello d (n s2 n-1 d5)
Gruppo 8: 6 elettroni nel sottolivello d (n s2 n-1 d6)
Gruppo 9: 7 elettroni nel sottolivello d (n s2 n-1 d7)
Gruppo 10: 8 elettroni nel sottolivello d (n s2 n-1 d8)
Gruppo 11: 9 elettroni nel sottolivello d (n s2 n-1 d9)
Gruppo 12: 10 elettroni nel sottolivello d (n s2 n-1 d10)
Gruppo 13: 1 elettrone nel sottolivello p (n p1)
Gruppo 14: 2 elettroni nel sottolivello p (n p2)
Gruppo 15: 3 elettroni nel sottolivello p (n p3)
Gruppo 16: 4 elettroni nel sottolivello p (n p4)
Gruppo 17: 5 elettroni nel sottolivello p (n p5)
Gruppo 18: 6 elettroni nel sottolivello p (n p6)
3
Lantanidi e Attinidi: da 1 a 14 elettroni nel sottolivello f (n p2 n-2 f e, e = elettroni)
Configurazione elettronica di Rn Z = 86
(Xe) 6s2 4f14 5d10 6p6
U Z = 92
(Rn) 7s2 5f4
4