SACCHAROMYCES CEREVISIAE
La cellula
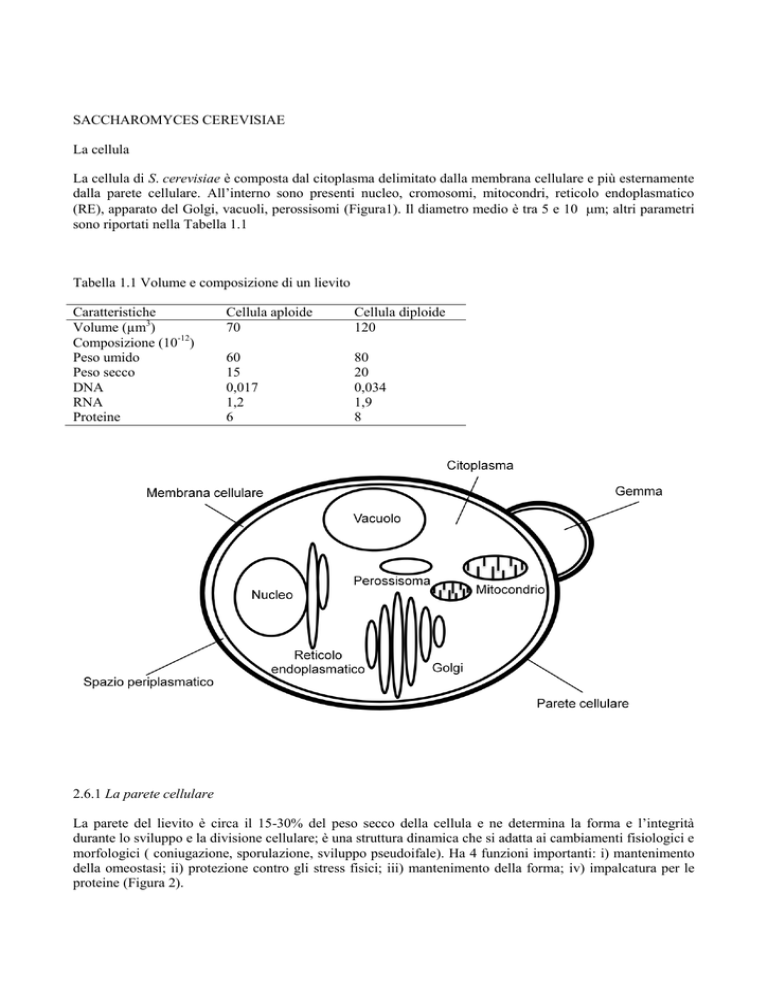
La cellula di S. cerevisiae è composta dal citoplasma delimitato dalla membrana cellulare e più esternamente
dalla parete cellulare. All’interno sono presenti nucleo, cromosomi, mitocondri, reticolo endoplasmatico
(RE), apparato del Golgi, vacuoli, perossisomi (Figura1). Il diametro medio è tra 5 e 10 m; altri parametri
sono riportati nella Tabella 1.1
Tabella 1.1 Volume e composizione di un lievito
Caratteristiche
Volume (µm3)
Composizione (10-12)
Peso umido
Peso secco
DNA
RNA
Proteine
Cellula aploide
70
Cellula diploide
120
60
15
0,017
1,2
6
80
20
0,034
1,9
8
2.6.1 La parete cellulare
La parete del lievito è circa il 15-30% del peso secco della cellula e ne determina la forma e l’integrità
durante lo sviluppo e la divisione cellulare; è una struttura dinamica che si adatta ai cambiamenti fisiologici e
morfologici ( coniugazione, sporulazione, sviluppo pseudoifale). Ha 4 funzioni importanti: i) mantenimento
della omeostasi; ii) protezione contro gli stress fisici; iii) mantenimento della forma; iv) impalcatura per le
proteine (Figura 2).
Struttura della parete cellulare Figura 2
E’ costituita principalmente da polisaccaridi, polimeri del mannosio (mannoproteine, circa il 40% del peso
secco della parete), polimeri del glucosio (-glucano, circa il 60% del peso secco della parete) e polimeri di
N-acetilglucosamina (chitina, circa il 2% del peso secco della parete). A seconda di come si lega al glucosio
il glucano può formare lunghe catene (85%) di unità di 1,3 glucosio e catene più corte (15%) di 1,6
glucosio. Questo polimero sebbene costituisca solo una piccola parte della parete ha un ruolo importante nel
formare legami incrociati con le altre componenti. Inoltre è coinvolto in legami covalenti con il 1,3
glucano, mannoproteine e chitina e questi legami incrociati contribuiscono alla struttura modulare della
parete cellulare. Infatti lo strato esterno è costituito da mannoproteine connesse ad una matrice amorfa di
1,3 glucano e dallo strato interno di 1,3 glucano fibroso su piccole quantità di chitina. Il 1,6 glucano
lega i due strati (Tabella 2).
Tabella 2. Principali macromolecole della parete cellulare in S. cerevisiae
(Modificato da Klis et al. 2006).
Macromolecole
% della massa
Peso molecolare
della parete
medio
(kDa)
Mannoproteine
30-40
100-200
Chitina
1-6
25
β-1,6-Glucano
5-10
24
β-1,3-Glucano
30-50
240
MANNOPROTEINE
Le mannoproteine hanno un peso molecolare che varia da 20.000 a 450.000 Da e sono costituite da mannosio
( circa il 90%) e, a seconda del ceppo e della fase di sviluppo, da N-acetilglucosamina e mannosilfosfato. In
S.cerevisiae sono state descritte 4 forme di glicosilazione, che non devono necessariamente coesistere nella
stessa mannoproteina. Le mannoproteine sono liberate dalla parete cellulare durante le prime fasi
fermentative; infatti le cellule durante le prime fasi di sviluppo producono -glucanasi e altri enzimi che
parzialmente degradano il complesso intreccio costituito dal -1,3 e -1,6 glucano e permettono la divisione
cellulare, la gemmazione o il mating. Nella fase stazionaria le pareti diventano più spesse e più resistenti alle
-glucanasi. Questi enzimi possono mantenere una certa attività anche dopo la morte cellulare. Queste
glicoproteine hanno un’importante funzione protettiva, limitando la permeabilità della parete a
macromolecole esterne e controllando lo scambio di molecole tra lo spazio periplasmatico e l’ambiente.
Inoltre le proteine della parete rendono la cellula in grado di crescere sotto forma pseudoifale e invasiva, di
flocculare, di formare biofilm; aiutano, inoltre, le cellule a trattenere il ferro e a favorire l’assorbimento degli
steroli e sono richieste per la crescita in condizioni anaerobiche. Tra queste proteine, le adesine sono tra le
più studiate; sono localizzate sulla superficie della parete cellulare e qui intervengono come mediatori fra la
cellula e l’ambiente esterno. In particolare sono coinvolte nel mating, nella flocculazione e nella formazione
di biofilm. La chitina, un polimero lineare di N-acetil-glucosamina, è poco rappresentata nella parete dei
lieviti (1-2%) e si trova soprattutto nell’anello cicatriziale di distacco della gemma.
Lo strato periplasmatico è uno strato sottile (35-45A°) compreso tra la parete cellulare e la membrana
plasmatica e contiene mannoproteine incapaci di permeare la parete cellulare ma che svolgono importanti
funzioni. Tra queste vi sono numerosi enzimi come l’invertasi che catalizza l’idrolisi di saccarosio in
glucosio e fruttosio, la fosfatasi acida che libera il fosfato dai composti organici, -glucosidasi, trealasi,
melibiasi, aminopetidasi, esterasi. Altre attività importanti da riferire alla presenza di mannoproteine sono la
flocculazione, la formazione di veli “flor”.
2.6.2 La membrana plasmatica
La membrana plasmatica è spessa circa 7 nm, con alcune invaginazioni nel citoplasma. Come altre
membrane è formata da un doppio strato lipidico di molecole amfipatiche, fosfolipidi e sfingolipidi, la cui
fase apolare è costituita da acidi grassi. La composizione lipidica della membrana comprende soprattutto
fosfatidilcolina e fosfatidiletanolammina e meno fosfatidilinositolo, fosfatidilserina e fosfatidilglicerolo. Gli
acidi grassi di S. cerevisiae sono prevalentemente grassi insaturi, soprattutto acidi oleico (18:1) e
palmitoleico (16:1) insieme ad acidi saturi, come il palmitico (16:0) e stearico (18:0). Gli acidi grassi a media
catena (da C6 a C14) sono presenti in minore proporzione ma la loro concentrazione aumenta con lo
sviluppo anaerobico e man mano che procede la fermentazione. Gli steroli, in particolare l’ergosterolo,
rappresentano i più importanti lipidi della membrana e sono sintetizzati da S. cervisiae nei mitocondri in
aerobiosi, durante la fase di sviluppo del lievito. La fluidità della membrana è regolata dalla composizione in
acidi grassi e dal loro contenuto in steroli, che costituiscono una barriera tra il citoplasma e l’ambiente
circostante la cellula. Oltre ai lipidi (40%), la membrana contiene circa un 50% di proteine e piccole quantità
di mannani e glucani. Le proteine inserite in questo strato lo attraversano come proteine intrinseche o
transmembranarie con funzioni diverse. Le proteine della membrana del lievito includono: ancore del
citoscheletro, enzimi per la sintesi della parete cellulare, proteine per la trasduzione di segnali, proteine per il
trasporto di soluti (permeasi, ATPasi); facilitatori di trasporto come le proteine ABC (ATP binding cassette).
Tra le funzioni principali della membrana vi è quindi la permeabilità selettiva, cioè controllare ciò che entra
e ciò che esce dal citoplasma, regolando con le proteine di membrana la nutrizione del lievito. Altre
importanti funzioni sono la risposta agli stress e la sporulazione.
2.6.3. Citoplasma e citoscheletro
Il citoplasma di S. cerevisiae ha un pH acido (pH 5,25) e contiene organuli (RE, apparato di Golgi, vacuoli,
mitocondri e ribosomi 80S). Contiene soprattutto ioni e composti organici a basso o medio peso molecolare,
e macromolecole solubili come il glicogeno. Gli enzimi citosolici includono quelli della via glicolitica,
enzimi per la biosintesi delle proteine, il complesso per la sintesi di acidi grassi e la trealasi, enzima che
catalizza l’idrolisi del trealosio, carboidrato di riserva. Il citoscheletro fornisce l’organizzazione strutturale e
la stabilità della cellula attraverso un fitto intreccio di microtubuli e microfilamenti, che sono strutture
dinamiche e servono per l’assemblaggio e la demolizione delle proteine, il movimento degli organelli, la
meiosi e la mitosi.
2.6.4 Reticolo endoplasmatico e vacuoli
Il reticolo endoplasmatico è il più grande organello legato alla membrana nelle cellule eucariotiche e può
essere diviso in tre domini strutturalmente distinti: RE associato alla membrana plasmatica, RE cisterna
centrale e RE tubulare. Svolge diverse funzioni tra cui la traslocazione e ripiegamento delle proteine, sintesi
lipidica (ad esempio glicerolipidi e fosfolipidi di membrana) e omeostasi del calcio. Dal RE le proteine sono
dirette verso l’apparato del Golgi con delle vescicole dove le proteine subiscono modificazioni quali
glicosilazioni o mannosilazioni, con produzione di glicolipidi e glicoproteine. Le destinazioni di queste
proteine sono differenti, ad esempio i vacuoli, la membrana plasmatica, il periplasma.
Il vacuolo di S. cerevisiae è molto importante per la fisiologia di questo organismo. Tra i ruoli principali di
questi organelli vi sono il pH e l’osmoregolazione, la degradazione delle proteine (autofagia), stoccaggio
degli aminoacidi (un quarto del pool amminoacidico della cellula), piccoli ioni e polifosfati. L’energia
necessaria per stoccare questi composti contro il gradiente di concentrazione avviene tramite una specifica
ATPasi.
2.6.5 Mitocondri e perossisomi
I mitocondri dei lieviti sono simili a quelli degli altri eucarioti, ma svolgono diverse importanti funzioni che
sono assenti negli altri organismi superiori. Sono considerati dei veri organuli respiratori per S. cerevisiae.
Svolgono una serie di processi metabolici tra cui la reazione del ciclo degli acidi tricarbossilici e la biosintesi
di molti metaboliti cellulari. La funzione principale è fornire la cellula di energia generata da fosforilazione
ossidativa. Saccharomyces cerevisiae è un lievito anaerobio facoltativo che è in grado di soddisfare la
richiesta di energia con ATP generato dalla fermentazione, per cui poche proteine mitocondriali sono
essenziali per la vitalità cellulare. In aerobiosi la cellula di lievito contiene circa 50 mitocondri, che in
anaerobiosi degenerano ad un pro-mitocondrio non strutturato; in condizioni di aerobiosi i mitocondri
riacquistano il loro aspetto normale. I mitocondri possiedono una molecola di DNA (mtDNA) di 75-150 kb,
che contiene geni codificanti per la sintesi di enzimi respiratori e dei ribosomi. Circa 65 anni fa sono state
scoperte delle mutanti mitocondriali incapaci di respirare, dette “petite”, con ampie delezioni nel mtDNA () o mancanti completamente del genoma mitocondriale (0). Queste mutanti sono incapaci di sviluppare in
mezzi che contengono solo fonti di carbonio non-fermentabili, come glicerolo ed etanolo, e formano piccole
colonie quando crescono in anaerobiosi in terreni contenenti una fonte di carbonio fermentabile come il
glucosio. Al riguardo i lieviti possono essere divisi in due gruppi a seconda che siano in grado o meno di
produrre mutanti “petite” (spontaneamente o indotte), il primo con fenotipo petite-positivo tipico di S.
cerevisiae e l’altro, petite-negativo che comprende la maggior parte dei lieviti, come Schizosaccharomyces
pombe e Kluyveromyces lactis. Strutturalmente il mitocondrio del lievito è costituito da una membrana
esterna con enzimi coinvolti nel metabolismo lipidico, uno spazio intermembrana, una membrana interna con
i componenti della catena respiratoria, ATP sintetasi ed altri enzimi. La matrice mitocodriale contiene
mtDNA, ribosomi 60S, tRNA mitocondriali, enzimi per l’ossidazione degli acidi grassi. Tuttavia in S.
cerevisiae ha molte altre funzioni tra le quali ne ricordiamo solo alcune come la sintesi e desaturazione degli
acidi grassi e lipidi, sintesi di ergosterolo, adattamento e risposta agli stress, e la mobilizzazione del
glicogeno. I perossisomi sono organelli specializzati per catalizzare reazioni ossidative e nella matrice
contengono numerosi enzimi. Svolgono principalmente reazioni di ossidazione che portano alla produzione
di perossido d’ idrogeno, che è tossico per la cellula e viene degradato dall’enzima catalasi ad acqua o viene
utilizzato per ossidare un altro composto organico, come ad esempio acido urico, aminoacidi e acidi grassi.
2.6.6 Il nucleo
Il nucleo è delimitato da una doppia membrana chiamata membrana nucleare che si continua nel reticolo
endoplasmatico. La membrana nucleare separa la cromatina dal citoplasma e fornisce l’ancoraggio per
diverse strutture nucleari e cromosomiche. Un complesso di circa 200 pori nucleari permette scambi tra il
nucleoplasma e il citoplasma, con la libera diffusione di piccole molecole che regolano il trasporto di
macromolecole. Il nucleolo è un compartimento subnucleare ed è il sito dell’ RNA polimerasi I che media la
trascrizione dell’ rDNA e dell’assemblaggio delle subunità ribosomiali; è come una fabbrica dedicata alla
biogenesi dei ribosomi.
2.7 Genoma di Saccharomyces cerevisiae
Negli ultimi anni è stato riconosciuto che S. cerevisiae occupa numerosi habitat, le cui popolazioni mostrano
importanti variazioni genetiche. Vi è quindi un crescente interesse per la comprensione delle forze evolutive
che agiscono sul genoma del lievito. Inoltre, la dettagliata conoscenza del genoma del lievito, combinata con
la notevole tracciabilità della genetica e della biologia molecolare, ha inserito S. cerevisiae al centro dei
programmi di ricerca che vanno dallo studio di geni delle malattie umane, all’evoluzione sperimentale e agli
studi di biologia dei sistemi.
Le dimensioni del genoma di S. cerevisiae sono circa 3 volte più grandi di quello del batterio Escherichia
coli, ma 260 volte più piccole del genoma dell’uomo ed è costituito da circa 6300 geni distribuiti tra i 16
cromosomi lineari le cui dimensioni variano da 200 a 2200 kilobasi (kb). Il genoma è relativamente ricco di
coppie G+C (39-41%) ed è molto più compatto rispetto a quello delle altre cellule eucariote.
Il sequenziamento completo del genoma ha rivelato la presenza di 5885 geni che codificano per proteine,
circa 140 geni che codificano per l’rRNA e 275 per il RNA di trasporto (tRNA). La maggior parte di questi
geni è presente in singola copia, mentre quelli per l’RNA ribosomiale sono altamente ripetuti (circa 100
copie).
Materiale extracromosomico
Il nucleo di S. cerevisiae contiene approssimativamente 35-55 copie di retrotrasposoni (Ty elements),
elementi mobili in grado di spostarsi da un cromosoma all’altro o lungo lo stesso cromosoma. Il loro nome
deriva dal fatto che sono in grado di retro trascriversi e assemblarsi e sono ereditati come i cromosomi di cui
fanno parte. E’ presente anche un plasmide detto 2 m con un numero di copie per cellula che varia da 50 a
100 e rappresenta il 5% del genoma totale. Ha una dimensione di 6,3 kb ed è ereditato in maniera nonmendeliana. La sua funzione biologica non è nota anche in luce del fatto che ceppi mancanti (detti cir°) del
plasmide non mostrano differenze rilevanti. Il plasmide codifica 4 geni FLP (A), REP1 (B) e REP 2 (C) e
(D), una origine di replicazione, un locus STP e due sequenze di 599 bp ripetute e invertite. E’ il vettore più
utilizzato in ingegneria genetica. Altri lieviti, come K.lactis o alcune specie di Zygosaccharomyces
contengono plasmidi ma diversi da quello 2 m e non sono molto usati come vettori.
Nel citoplasma di alcuni ceppi è possibile riscontrare la presenza di molecole di RNA virale a doppio
filamento che conferiscono il fenotipo killer. Altri elementi genetici extra-cromosomali che possono essere
presenti nel citoplasma sono i prioni denominati PSI (ψ), ETA (η) e URE3, che segregano in maniera non
mendeliana. I prioni PSI (ψ) e ETA (η) aumentano il numero di mutazioni per scivolamento (frameshift) e la
soppressione del codone UAA (non codificante per nessun amminoacido) conferendo alla colonia un colore
ocra. Il prione URE3, extranucleare e regolatore del metabolismo dell’azoto, in presenza di alte
concentrazioni di ammoniaca, rende le cellule di lievito incapaci di utilizzare ureidosuccinato.
Il DNA mitocondriale è fra i più grandi rispetto a tutti gli altri organismi ed è presente in copie multiple nel
mitocondrio. E’ caratterizzato da un elevato contenuto percentuale in AT e da una bassa densità genica. Esso
codifica per poche componenti essenziali e per parte degli enzimi del metabolismo ossidativo aerobio e, a
differenza del DNA nucleare, la sua replicazione avviene durante tutto il ciclo cellulare. A differenza delle
altre cellule eucariotiche, S. cerevisiae può sopravvivere senza mtDNA. La mtDNA polimerasi manca
dell’attività di correzione degli errori durante la replicazione del mtDNA, detta proofreading, con la
conseguenza di una velocità di mutazione molto più elevata del mtDNA rispetto ai geni nucleari e quindi di
una evoluzione estremamente rapida. Le differenze nel mtDNA tra i singoli ceppi di S. cerevisiae è tale da
caratterizzarli in maniera univoca e sono rilevabili attraverso l’analisi di restrizione. Tali diversità
corrispondo anche a diverse caratteristiche fenotipiche come grado di flocculazione, metabolismo lipidico,
produzione di alcol superiori e formazione di composti aromatici.
Tutti i lieviti contengono virus (ds RNA) che costituiscono circa lo 0.1 % del totale dell’acido nucelico.
Sono stati divisi in tre categorie L-A, L-BC e M. I virus M dsRNA codificano una tossina, e L-A codifica per
la proteina capsidica e per i componenti richiesti per la replicazione virale (anche l’RNA polimerasi RNA
dipendente virale) e il mantenimento di M. Queste particelle sono trasmesse attraverso il citoplasma durante
lo sviluppo vegetativo e la coniugazione. L’attività killer è svolta da alcuni ceppi di lievito, chiamati killer, e
consiste nel secernere nel mezzo una tossina che provoca la morte di altri ceppi. Molti generi di lievito
posseggono questo fattore che è stato rilevato soprattutto in S.cerevisiae. Altri generi mostrano attività killer
come Pichia, Candida, Kloeckera, Hanseniaspora, Kluyveromyces, Debaryomyces, Torulopsis,
Cryptococcus .Ceppi killer di Saccharomyces sono stati individuati in lieviti da birra, del sakè ed anche in
quelli da vino. Sono stati determinati quattro fenotipi: killer (K), sensibile (S), neutro (N) e killer-sensibile
(K-S). I lieviti con quest’ultimo fenotipo formano il fattore killer ma sono sensibili ad altri lieviti killer.
Basandosi sulla proprietà della tossina tali lieviti sono stati classificati in almeno 11 gruppi (K1-K11).
Cinque dei quali (K1, K2, K3, KT28 e K3GR1) sono specifici per S. cerevisiae , ma solo tre (K1, K2 e K28)
sono stati chiaramente definiti e differenziati con analisi genetiche e molecolari. Tutte le tossine secrete sono
in grado di esercitare la loro azione su cellule vegetative sensibili mediante un legame spontaneo (non
richiede energia) a un recettore specifico sulla membrana della cellula bersaglio
Dalla comparazione tra ceppi industriali e di laboratorio è evidente che i fattori ambientali influenzano la
struttura genomica e si è riusciti anche ad individuare le regioni coinvolte direttamente nella diversificazione
e nella specializzazione dei ceppi. Ad esempio, geni codificanti per proteine coinvolte nel metabolismo del
carbonio e dell’azoto, nel trasporto cellulare e nella risposta allo stress sono stati individuati in studi di
genomica comparativa tra il ceppo vinario EC1118 e il ceppo di laboratorio S288c dimostrando come
l’ambiente possa influenzare in maniera determinante la struttura del genoma.
Generalmente i ceppi di S. cerevisiae utilizzati in laboratorio sono aploidi o diploidi ed hanno un profilo
cromosomico costante. I ceppi industriali sono diploidi, aneuploidi (mancanza di cromosomi) e
occasionalmente poliploidi, anche se non è ancora chiaro se la poliploidia conferisca un vantaggio effettivo
ai ceppi che ne sono portatori. Il genoma è caratterizzato da corte unità ripetute, definite microsatelliti, con
dimensioni comprese tra 10 e 100 nucleotidi, che mostrano variazione nel numero delle ripetizioni.
L’espansione e la contrazione di queste regioni genera polimorfismi genetici che possono essere utilizzati per
la tipizzazione dei ceppi ed è utile per discriminare i lieviti .
I nuovi arrangiamenti si verificano generalmente per formazione di nuove combinazioni di alleli tra
cromosomi o sequenze omologhe, e sono tipicamente costituiti da delezioni, duplicazioni, inversioni o
traslocazioni di sequenze del cromosoma. La presenza di questi eventi di ricombinazione indicano la grande
propensione all’instabilità genetica dei lieviti e sono probabilmente lo strumento privilegiato per il loro
adattamento alle condizioni ambientali offrendo vantaggi derivanti dall’acquisizione di caratteri intermedi
alle specie coinvolte nell’ibridazione.
Appare evidente che il genoma di S. cerevisiae si caratterizza per una notevole plasticità che favorisce
diversità genetica su cui i meccanismi di selezione naturale possono operare. Il vino è un ambiente
estremamente selettivo che esercita una forte pressione tanto da poter spiegare il motivo per cui i ceppi vinari
abbiano arrangiamenti genici e proprietà genomiche differenti da ceppi isolati in altre nicchie.
Sviluppo e ciclo vitale di Saccharomyces cerevisiae
In condizioni ottimali di crescita S. cerevisiae raddoppia la sua massa ogni 90 minuti. Il suo sviluppo avviene
per gemmazione multilaterale, cioè la cellula madre dà origine a una gemma, la cellula figlia di dimensioni
più piccole che dopo essersi staccata dalla cellula madre continuerà il suo accrescimento. La cicatrice che si
forma sulla parete della cellula madre contiene chitina e in quel punto non si formeranno più altre gemme;
ogni cellula madre può formare da 20 a 30 gemme. La gemmazione è un processo di sviluppo molto diverso
dalla scissione, che consiste nell’ingrossamento della cellula e nella sua divisione in due cellule figlie, come
avviene nel genere Schizosaccharomyces. Certi ceppi di S. cerevisiae possono avere una morfologia della
colonia e cellulare diversa durante lo sviluppo, chiamata pseudomicelio. La formazione dello pseudomicelio
(per differenziarlo dal micelio vero o ifale dei funghi filamentosi) avviene quando le cellule, generalmente
più allungate, non si staccano dalla cellula madre formando una catena che può essere lineare o ramificata.
Le colonie appaiono così sfrangiate e in mezzi liquidi formano veli estesi e spessi. Il ciclo di divisione
cellulare di S. cerevisiae è rappresentato nella Figura 2 e consiste di quattro fasi: la fase M corrisponde alla
mitosi, G1 alla preparazione della duplicazione del DNA, S alla duplicazione del DNA e G2 alla
preparazione della mitosi. Le cellule che arrestano il loro sviluppo per diversi motivi, per esempio mancanza
di nutrienti, si trovano nella fase G1 del ciclo cellulare, dove possono riprendere la crescita al ritorno di
condizioni normali.
Ciclo cellulare di S. cerevisiae. Il diagramma descrive le quattro fasi
del ciclo ( G1, S, G2, M) rappresentate in modo proporzionale alla loro durata. Nella fase G1 la cellula
monitora le sue dimensioni e l’ambiente esterno e sintetizza RNA e proteine. Nella fase S avviene la
replicazione dei cromosomi. Nella fase G2 la cellula controlla l’avvenuta replicazione di tutti i cromosomi e
si prepara alla mitosi. La fase M è a sua volta composta da due processi, strettamente collegati: la mitosi,
durante la quale i cromosomi della cellula sono divisi tra le due cellule figlie e la citocinesi, che comporta la
divisione del citoplasma della cellula. Modificato da Herskowitz (1988).
I ceppi di S. cerevisiae possono essere stabilmente aploidi (con 16 cromosomi) o diploidi (con 16x2
cromosomi): entrambi i tipi sono in grado di sporificare (riproduzione sessuale). Le cellule aploidi possono
essere di due tipi sessuali (mating types) chiamati MATa e MAT. Le cellule di MAT producono un peptide
di 13 aminoacidi, il fattore , mentre le cellule di MATa, producono il fattore sessuale a, peptide di 12
aminoacidi. I fattori sessuali arrestano lo sviluppo cellulare nella fase G1, appena prima dell’inizio della
sintesi di DNA così che la fusione cellulare e nucleare delle due cellule a e avviene quando le singole
cellule hanno una copia di ciascun cromosoma e quindi si ha la formazione di un diploide a/, che non può
formare ferormoni e accoppiarsi, ma può sporificare (Fig.3). Questo diploide in buone condizioni
nutrizionali continuerà a svilupparsi e dividersi mantenendo il suo stato di diploide. In condizioni di carenza
nutrizionale la cellula diploide MATa/MAT farà la meiosi e formerà 4 ascospore 2 MATa e 2 MAT,
all’interno dell’asco. Una volta mature e liberate dall’asco le spore germinano e cominciano di nuovo un
ciclo vitale aploide. I ceppi che mantengono il loro stato aploide sono detti eterotallici. I termini omotallismo
ed eterotallismo nei funghi descrivono due diversi tipi di ciclo vitale. Nel ciclo omotallico, una singola
cellula aploide (spora) dà origine a una progenie diploide che è capace di meiosi. In un ciclo eterotallico la
progenie diploide si forma solo al momento dell’accoppiamento di due spore con opposto MAT. I ceppi
omotallici differiscono dagli eterotallici per la presenza di un gene per l’omotallismo (HO), mentre gli
eterotallici hanno la versione non funzionante di questo gene (ho).
Nei ceppi HO, il locus MAT cambia da MATa a MAT a ogni divisione cellulare, cioè producono cellule
con entrambi i mating types, e sono detti autodipolidizzanti. Perché questo possa avvenire le cellule devono
cambiare l’informazione al locus MAT. Una cellula omotallica a (che ha un locus MATa) dà origine a una
progenie che ha un locus e fenotipo (Figura 2.8). Questo cambiamento nel locus MAT è in relazione a
una programmazione che prevede l’attivazione di informazioni genetiche silenti attraverso il loro
spostamento da una parte del genoma ad un’altra.
Figura 3. Transizioni nel ciclo vitale di S. cerevisiae. Le cellule di lievito aploidi sono in grado di accoppiarsi
con un'altra cellula aploide di tipo sesso opposto generando una cellula diploide stabile (a/). In presenza di
condizioni ambientali sfavorevoli quest’ultima può andare incontro a meiosi formando aschi con 4 spore
aploidi, due di tipo sessuale a e due di tipo . Una volta mature e liberate dall’asco le spore germinano e
cominciano di nuovo un ciclo vitale aploide. Modificato da Herskowitz (1988).
Nel locus MAT, che si trova sul cromosoma III, vi sono i due alleli dello stesso gene, chiamati,
rispettivamente, MATa e MAT. Saccharomyces cerevisiae contiene altri due loci genetici (HML e HMR)
che contengono le informazioni silenti di MAT. Nella maggior parte dei ceppi, il locus HML (situato a 200
kb a sinistra del locus MAT) contiene l’informazione silente equivalente a quella espressa al locus MAT,
allele HLM, mentre il locus HMR contiene l’informazione silente equivalente a quella espressa al locus
MATa, allele HMRa. Il cambiamento nel locus MAT avviene attraverso un riarrangiamento genico
programmato nel quale le informazioni silenti diventano attive attraverso lo spostamento da HLM o HMR a
MAT. Il movimento dell’informazione della casetta genetica da HML o HMR è catalizzata dal prodotto del
gene HO, che codifica per una endonucleasi sitospecifica e che inizia la interconversione del mating type. La
maggior parte dei ceppi che si trovano in natura sono omotallici, mentre quelli eterotallici sono varianti di
laboratorio. L’omotallismo con il cambiamento di sessualità porta all’accoppiamento e a una rapida
diploidizzazione dei discendenti delle ascospore, utile risposta a condizioni ambientali sfavorevoli.
FIGURA 4 Modello a cassetta del cambio del mating type in S. cerevisiae. Il sesso del lievito S. cerevisiae è
controllato dal locus MAT localizzato sul cromosoma III. Esistono due alleli dello stesso gene chiamati,
rispettivamente, MATa e MAT. Inoltre, sono presenti altri due loci genetici denominati HML (Hidden Mat
Left , che contiene una copia non codificante di MAT) e HMR (Hidden Mat Right, che presenta una copia
silente dell'allele MATa) che contengono le informazioni silenti di MAT. L’ interconversione del mating type
è indotta da una endonucleasi sito specifica (HO) che distrugge l'informazione genetica contenuta nel locus
MAT e induce un evento di trasposizione. Pertanto, la sequenza presente in HML o HMR viene prima
duplicata e poi traslocata sul locus MAT stesso, fornendo un nuovo allele attivo alla cellula e determinando il
cambiamento del sesso. Modificato da Pretorius e van der Westhuizen (1991).
Trealosio e glicogeno non solo prodotti di riserva
Il trealosio è un disaccaride non riducente che fino a poco tempo fa era considerato un carboidrato solo di
riserva come il glicogeno che si accumula durante la fase stazionaria dello sviluppo e si trova in batteri,
funghi, piante e insetti. In S. cerevisiae, in condizioni di stress e di carenze nutrizionali può accumularsi fino
al 15% del peso secco della cellula, protegge la cellula contro la disidratazione, il congelamento o shock da
calore, osmotico o generato da composti tossici come etanolo, radicali dell’ossigeno e metalli pesanti. Il suo
accumulo è molto importante durante la sporulazione, la riattivazione dello sviluppo, la mancanza di
nutrienti. In particolare il contenuto di trealosio nella cellula è sicuramente uno dei fattori che le permettono
di resistere all’essiccamento e alla reidratazione. Questa molecola ha proprietà straordinarie nella protezione
delle membrane biologiche, tanto che si può pensare a un duplice ruolo che il trealosio può giocare in S.
cerevisiae come riserva di carbonio e di energia, e come protezione anti-stress. Il trealosio è prodotto in un
processo a due tappe, il cui substrato è il glucosio, che è convertito in glucosio 6-fosfato e insieme con il
glucosio uridina 6-difosfato (UDPG) porta alla formazione di trealosio 6-fosfato (T6P) e poi a trealosio,
biosintesi catalizzata dagli enzimi trealosio-6-fosfato sintetasi e trealosio-6-fosfato
fosfatasi. La
degradazione del trealosio è mediata da due trealasi che mettono in circolo nuovamente il glucosio (Figura5).
Figura 5 Biosintesi e degradazione del trealosio e del glicogeno. In S. cerevisiae il trealosio può essere
sintetizzato sia a partire dal glucosio 6-fosfato che dall’UDP glucosio dagli enzimi TPS1 e TPS2. La sintesi e
degradazione di questo composto è regolata da un meccanismo di fosforilazione AMP ciclico dipendente. Il
glicogeno è un carboidrato di riserva e la sua sintesi è mediata dalla glicogeno sintasi. Saccharomyces
cerevisae presenta due glicogeno sintasi denominate Gsy1p e Gsy2p. La prima è espressa in maniera
costitutiva, mentre la seconda si attiva alla fine della fase esponenziale di crescita quando la concentrazione
di glicogeno aumenta. La degradazione del glicogeno al termine fermentazione induce la sintesi di steroli che
sono essenziali per garantire la vitalità del lievito. Modificato da Pretorius (2000).
Il contenuto di trealosio nei lieviti secchi attivi starter (ADY) varia a seconda del ceppo, dal 10 al 20% circa
e quello di glicogeno dal 4 al 15 % del peso secco. Non vi è nessuna relazione tra la concentrazione dei due
carboidrati. Quando ADY sono sospesi in acqua per la reidratazione il trealosio viene rapidamente anche se
parzialmente solubilizzato nel mezzo e nella maggior parte dei casi viene subito utilizzato dalle cellule di
lievito. I lieviti in grado di metabolizzare velocemente il trealosio presente nel mezzo saranno quelli che
raggiungeranno più rapidamente la massima velocità fermentativa. Quindi per un rapido avvio della
fermentazione è più importante la velocità di consumo del trealosio durante la reidratazione che la sua
concentrazione cellulare negli ADY.
Il glicogeno è il più importante polimero di riserva intracellulare dei lieviti e consiste di subunità 1,4
glucosio ramificato con 1,6 glucosio, con una catena di 11-12 residui e un diametro di circa 20nm. Si forma
quando la cellula di lievito si trova in carenza di carbonio, azoto, fosforo o zolfo. Durante la sporulazione
significative quantità di glicogeno sono sintetizzate e degradate. Questa molecola ha poco effetto sulla
pressione osmotica interna della cellula, mentre è molto importante sulla sopravvivenza della cellula durante
prolungate carenze nutrizionali. La sintesi di glicogeno richiede le attività di glicogenina e glicogeno
sintetasi, che è l’enzima ramificante che introduce le ramificazioni caratteristiche del polisaccaride maturo.
Sia glicogenina che glicogeno sintetasi usano UDP-glucosio come donatore di glucosio. Ci sono due forme
di glicogeno sintetasi in S. cerevisiae, una codifica dal gene GSY1, espresso a basso livello costitutivamente
e GSY2 il cui livello incrementa alla fine della fase esponenziale della crescita, quando il glicogeno si
accumula. La degradazione del glicogeno, catalizzata dall’enzima glicogeno fosforilasi, inizia velocemente
in corrispondenza della carenza di nutrienti e si accompagna alla sintesi di steroli. Poiché gli steroli sono
importanti per la vitalità del lievito, un basso accumulo di glicogeno in ceppi starter, eventualmente anche
ceppi ADY, ha come risultato una loro scarsa vitalità e performance fermentativa una volta inoculati.
Risposta di Saccharomyces cerevisiae ai cambiamenti ambientali
Tutte le cellule sono sottoposte a cambiamenti ambientali chiamati stress che compromettono la capacità di
sviluppo e di sopravvivenza delle stesse. Dal momento in cui S. cerevisiae si trova a dover affrontare la
fermentazione alcolica, le sue cellule sono sottoposte a una serie di stress simultanei o in successione. Il
mettere in atto una serie di rapidi meccanismi di risposta e di adattamento a questi cambiamenti ambientali è
essenziale per mantenere la capacità di sopravvivenza e la moltiplicazione cellulare. Nel tempo si sono
evolute diverse vie molecolari per assicurare alla cellula di lievito di rispondere efficacemente a questi
cambiamenti, meccanismo che viene definito come “risposta allo stress”, mentre la capacità di resistere a
condizioni ambientali sfavorevoli è definita come “resistenza o tolleranza allo stress”. La resistenza allo
stress nei lieviti da vino è di grande interesse perché l’incapacità dei ceppi a rispondere o adattarsi a
condizioni sfavorevoli di crescita può provocare rallentamenti o arresti di fermentazione.
I ceppi di lievito rispondono spesso in modo diverso ai cambiamenti, per cui la tolleranza agli stress è
diventata una caratteristica importante nella selezione dei lieviti starter (Figura 6). In S. cerevisiae la via più
nota è quella HSR “heat shock response”, che è stata la prima via studiata in dettaglio, non solo in S.
cerevisiae, cioè la produzione di un set di proteine definite proteine da shock termico (Hsps), la cui
produzione è incrementata dopo esposizione ad un improvviso aumento di temperatura. Tuttavia molte di
queste proteine Hsps sono prodotte anche in risposta a molte altre condizioni di stress, per cui potrebbero
essere considerate come proteine di risposta generale allo stress.
Figura 6 Rappresentazione schematica di natura temporale e sequenziale di potenziali stress che possono
riscontrarsi nel corso della fermentazione. Modificato da Gibson et al. (2007).
Un’altra importante via di risposta è la risposta generale allo stress (GSR, “general stress response”) detta
anche risposta allo stress ambientale (ESR, Environmental Stress Response), che comprende stress ossidativi,
al calore, osmotici e carenza nutritiva. La via GSR è considerata un adattamento evolutivo che permette al
lievito di rispondere alle condizioni avverse in maniera non specifica, con la sovraregolazione di circa 200
geni e delle loro corrispondenti proteine che sono coinvolte in diverse funzioni cellulari. L’esposizione a una
condizione di stress a dosi sub-letali conferisce protezione non solo contro dosi più elevate dello stesso stress
ma anche contro altri. Questo effetto è noto anche come protezione incrociata (CP, “cross protection”).
Come riportato precedentemente il disaccaride trealosio è uno dei maggiori agenti protettivi contro diversi
stress, insieme al glicogeno. Gli stress più importanti nella fermentazione: (i) stress iperosmotico (elevato
contenuto iniziale di zuccheri); (ii) stress da etanolo; (iii) stress da temperature estreme; (iv) carenza di
nutrienti (azoto, minerali e vitamine, ossigeno). Tuttavia anche la presenza di elevate concentrazioni di
anidride carbonica e anidride solforosa o altri composti tossici, la presenza di micotossine e la competizione
con altri microorganismi possono essere causa di disturbo per la cellula. A questi stress S. cerevisiae
risponde attraverso meccanismi molecolari che sono richiesti per proteggere la cellula durante la
fermentazione.












