Motilità e contrattilità
cellulare
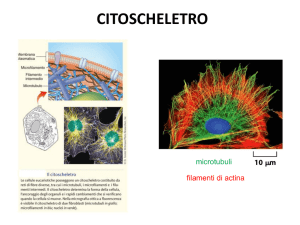
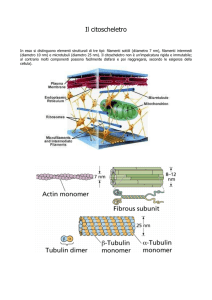
Citoscheletro: complessa rete di filamenti e tubuli proteici che si estende nel
citosol, dal nucleo alla faccia interna della membrana citoplasmatica
Funzioni:
•sostegno strutturale
•Mantenimento forma cellulare
•Movimento cell. ed organuli
•Adesione e segnalazione cell.
•Divisione cellulare
•Associazione con enzimi citosolici?
3 Elementi strutturali principali, diversi per struttura, dimensione, distribuzione
diametro
monomeri-struttura
funzione
Microtubuli
25-15 nm Tubulina α e β
Tubo cavo di 13
protofilamenti
Motilità cell. (ciglia e flagelli), forma
cell., movimento intracell. di
cromosomi e organelli, vescicole
Microfilamenti
7 nm
Actina G→actina F
2 catene di actina F
intrecciate
Contraz. muscolo, ciclosi,
movimento ameboide, divisione
cell, forma
Filamenti
intermedi
8-12 nm
Varie proteine
8 protofilamenti dimerici
associati
Sostegno, forma cell., lamina
nucleare,
componenti del citoscheletro e proprietà meccaniche
•microfilamenti (actina) - Flessibilità
•Microtubuli (tubulina) - Rigidità- resistenza a compressione
•filamenti intermedi (varie proteine) - Flessibilità- estensibilità
- assonemali: strutt. stabili associate al movimento→ciglia,flagelli
microtubuli
- citoplasmatici:strutt.dinamiche→forma, movimento di vescicole e
cromosomi, polarità assone
I microtubuli sono cilindri cavi con pareti formate da 13 polimeri lineari
(:protofilamenti) di eterodimeri di tubulina (α + β); orientamento
specifico→polarità intrinseca
MICROFILAMENTI
Coinvolti nei cambi di forma cell; adesioni
cell-cell e matrice; moto ameboide; ciclosi;
solco di clivaggio in citocinesi; “corteccia
cellulare”; contraz. muscolare.
Il costituente fondamentale
microfilamenti è l’actina
dei
Più molecole di actina G (globulare)
polimerizzano per dare actina F
(filamentosa)
L’orientamento dei monomeri è
specifico→polarità del
microfilamento
Molte e varie proteine possono
associarsi ai filamenti di actina
modulandone la funzione
Filamenti intermedi
I filamenti intermedi (diametro 8-12 nm) sono le strutture più stabili del
citoscheletro
•funzione di sostegno meccanico (es desmosomi, lamina nucleare,
collegamento tra organuli)
•Tessuto-specifici (importanza diagnostica→tumori e test prenatali)
•Proteine costituenti i FI sono divise in classi
Cheratine (epitelio); vimentine (connettivi); desmine (muscolo); neurofilamenti (cell.
nervose); lamìne nucleari (trama interna involucro nucleo)
I microtubuli e I microfilamenti sono strutture polari
Lo studio del citoscheletro e della motilità associata si avvale di moderne
tecniche (microscopia fluorescenza e videomicroscopia) e dell’uso di farmaci
specifici
(Es: colchicina e taxolo→microtubuli; citocalasina D e falloidina→microfilamenti)
Il movimento può avvenire a livello:
-Subcellulare→ es cromosomi in mitosi; correnti citoplasma,trasporto vescicole
-Cellulare →protozoi ciliati, spermatozoi, migrazioni morfogenetiche, metastasi
- di tessuto e/o organismo pluricellulare →muscolo scheletrico, cuore
L’energia per il movimento proviene dall’ idrolisi di ATP che determina cambi
conformazionali in speciali proteine motrici
Negli eucarioti il movimento dipende dall’interazione di questi motori molecolari
con un’impalcatura di base formata da:
-MICROTUBULI o
-MICROFILAMENTI
•Movimento basato su microtubuli: interazione tra microtubuli e le MAP motrici:
dineine citoplasmatiche e assonemali, chinesine (movimenti intracellulari e di
appendici esterne).
•Movimento basato su microfilamenti: interazione tra microfilamenti di actina e le
miosine (contrazione muscolare e movimenti non muscolari)
Motilità basata su microtubuli: movimenti intracellulari
I microtubuli sono le vie preferenziali su cui viaggiano vescicole
chinesina e dineina sono MAP motrici responsabili del moto grazie a
idrolisi di ATP;
•Chinesina→trasporto anterogrado (vs polo +, lontano dal MTCO)
•Dineina →trasporto retrogrado (vs polo – e MTCO)
Chinesine
Le chinesine hanno tre domini:
1)testa globulare che lega microtubulo e
idrolizza ATP
2) regione ad elica
3) regione di interazione con altre proteine e
organelli
Le teste globulari funzionano come “piedi”
per camminare lungo microtubulo (vs
estremità +)
Dineine citoplasmatiche
Formate da associazione di diverse
catene; le catene pesanti formano le
teste globulari che interagiscono con il
microtubulo
Si muovono vs estremità (-)
Interazione con vescicole è indiretta,
mediata dal complesso proteico della
dinactina
Traffico vescicolare
Le vescicole sono trasportate dalle MAP motrici su vie costituite da
microtubuli
definisce la polarità cellulare, struttura e distribuzione del RE,
Golgi, lisosomi, vescicole secrezione
Trasporto assonale
Le proteine motrici trasportano organelli e vescicole dal corpo cellulare verso
estremità e viceversa sfruttando i microtubuli come “piste”
Motilità basata su microtubuli
1. Movimento intracellulare
2. Movimento di appendici mobili (ciglia e flagelli)
In organismi unicell. moto e
raccolta cibo→ es protozoi ciliati
tipo Paramecium
In org. multicell. movimento
ambiente circostante o cell.
sessuali specializzate → es
epitelio vie respiratorie per
raccolta muco-polvere
Ciglia, in genere numerose,
“battito a remo”
Flagelli, più lunghi e radi,
movimento ondulatorio (da forza
propulsiva in ambiente fluido)
la struttura portante di ciglia e flagelli è un assonema (sistema cilindrico di
microtubuli di 0.25µm diametro) rivestito di membrana plasmatica e connesso al
corpo basale, che funziona come MTCO
assonema
Corpo basale= 9 triplette di mt disposte
a cerchio (mt completi)
ha la stessa struttura di centriolo (=9
triplette in cerchio);
funziona da centro di nucleazione per l’
assonema sovrastante
z. transizione
Assonema= 9+2
9 coppie di mt periferiche e 1 centrale
Nelle coppie periferiche un mt (A)
completo ed uno addossato incompleto
(B)
corpo basale
Zona transizione ha organizzazione
intermedia tra assonema e corpo basale
Da ciascun tubulo A delle doppiette esterne partono 2 bracci laterali (interno ed est) di
dineina assonemale, che contatta il tubulo B della doppietta accanto; i bracci sono disposti
a intervalli regolari nel senso longitudinale.
Nexina nei legami interdoppietta; bracci radiali collegano le doppiette alla coppia centrale
La forza meccanica per scorrimento dei mt data da idrolisi di ATP e cambi
conformazionali della dineina che fa scivolare 2 doppiette periferiche una
sull’altra: lo scorrimento diventa flessione locale dell’assonema
Movimento basato sull’interazione tra actine e miosine
Le miosine coinvolte in processi diversi come la
contrazione muscolare, moto cell., fagocitosi,
strutture udititive, trasporto melanina, etc.
Super-famiglia delle miosine
Tutte hanno almeno una catena pesante
organizzata in zona globulare (testa) che lega
actina e idrolizza ATP e regione fibrosa variabile
(coda) per interazione con altre molecole
Sul collo catene leggere con fzne regolatrice
Miosine tipo II, più note, nel muscolo liscio e
scheletrico, miocardio e cell non muscolari
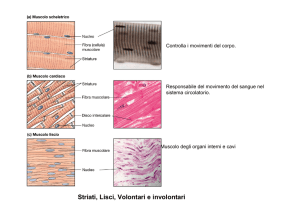
Organizzazione strutturale del muscolo scheletrico
muscolo→ fasci di fibre muscolari→ fibre (sincizi multinucleati)→ miofibrille (2µm
diametro, lunghe quanto fibra)→ sarcomero= unità strutturale-funzionale
composta da filamenti spessi (miosina) e filamenti sottili (actina)
Striatura tipica di miocardio e m. scheletrico riflette allineamento regolare ed in
registro dei filamenti; bande scure A, chiare I
Nei sarcomeri c’è una disposizione ordinata di actina, miosina e
proteine accessorie
I filamenti sottili sono disposti ad esagono attorno al f. spesso
a)
b)
a) Il sarcomero è l’unità contrattile: si estende tra due linee Z ed è suddiviso in
bande A, scura, e I, chiara, e zona H (regione chiara dentro la banda A).
b) Ogni filamento spesso (15nm diametro) è formato da molte molecole di miosina
associate con orientamento opposto e teste sporgenti sfalsate; la zona centrale
del filamento contiene solo le code fibrose.
I filamenti sottili (7nm diametro) sono interdigitati con i filamenti spessi ed
ancorati alla linea Z
Il filamento sottile contiene actina F intrecciata con tropomiosina (fibrosa) e
associata con troponina (3 subunità)
Il complesso troponina e tropomiosina funziona da interruttore molecolare
sensibile al Ca2+
La contrazione è spiegata dal modello dello scorrimento dei filamenti :
I filamenti spessi “camminano” su quelli sottili trainadoli vs centro del
sarcomero→ si contrae sarcomero e banda I;
i filamenti non si accorciano, aumenta invece la loro sovrapposizione!
Lo scorrimento delle miosine sui filamenti sottili dipende dalla formazione di
ponti traversi transitori tra le teste gobulari di miosina e le actine G dei filamenti
sottili.
I ponti si formano e dissociano ripetutamente durante la contrazione
muscolare. La contrazione è il risultato della successione di cicli di formazione
e rottura dei ponti.
Un ciclo completo di contrazione consiste in 4 fasi in cui:
1) La testa della miosina energizzata lega l’actina debolmente
2) Il legame si rinsalda con perdita di ADP e cambio conformazionale→scorrimento del
filamento sottile
3) Legame dell’ATP e distacco dall’actina
4) Idrolisi dell ATP e flessione della testa della miosina
In assenza di ATP, le fibre restano
contratte!!→rigor mortis
I muscoli hanno riserve di ATP
sottoforma di creatina fosfato e
grazie a enzima miochinasi
(2ADP→ATP+AMP)
La contrazione è regolata dalla [Ca2+]
La [Ca2+] regola la disponibiltà dei siti di legame per la miosina
sull’actina
Il livello di Ca2+ intracellulare è finemente controllato nelle fibre muscolari
e varia in risposta a stimoli nervosi
Struture specializzate caratteristiche delle fibre muscolari:
•Il reticolo sarcoplasmatico (SR) è un sistema di sacchi membranosi intracellulari
che funziona da deposito per il Ca e avvolge in modo capillare le miofibrillle. L’SR
accumula e rilascia rapidamente Ca in risposta a impulso nervoso.
•I tubuli T sono invaginazioni intracellulari della membrana plasmatica
(sarcolemma) che prendono contatto stretto con il reticolo sarcoplasmatico.
A livello della giunzione neuromuscolare il rilascio del neurotrasmettitore
e quindi il suo legame su recettori specifici del sarcolemma inducono un
potenziale di azione che è trasmesso lungo la membrana fino ai tubuli T→
da qui l’impulso viene trasmesso al reticolo scarcoplasmatico inducendo
l’apertura dei canali per il Ca e quindi la contrazione.
Cessato lo stimolo, la [Ca2+] citosolica scende rapidamente grazie alle pompe
ATPasi per il Ca che lo risequestrano dal citosol dentro le cisterne del SR.
Regolazione della contrazione nel muscolo liscio
•Il muscolo liscio è coinvolto in contrazioni
involontarie (vasi sanguigni, intestino, utero)
•Contrazione lenta e prolungata, innescata
da stimolo nervoso o ormonale
•Cellule fusiformi e singole (non fuse in
sincizio come nello scheletrico)
•Filamenti spessi e sottili non organizzati in
miofibrille
Come nel m. scheletrico anche in quello
liscio la contrazione è regolata dal Ca2+ ma
con meccanismo diverso:
L’interazione actina-miosina è coinvolta non solo nella contrazione muscolare ma anche in
molti tipi di movimento non muscolare: es citocinesi, movimento cellulare strisciante
(ameboide e filopodi), chemiotassi, correnti citoplasmatiche
Movimento strisciante mediante emissione di speciali prolungamenti
citoplasmatici : lamellipodi e/o filipodi
Tappe di un movimeto strisciante:
Emissione di una protusione all’ estremità guida→adesione al subtrato→tensione nei
filamenti di actina e ritrazione della “coda”.
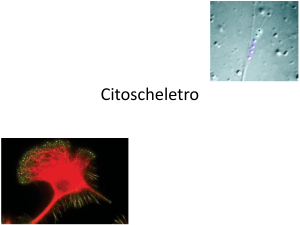
Miosine ed actine sono coinvolte nel movimento strisciante
La micrografia evidenzia le due molecole nell’estremità guida di un
fibroblasto
Il movimento strisciante mediato da filopodi è tipico dei fibroblasti e delle
migrazioni cellulari embrionali
I filopodi emergono evidenti dalla superficie cellulare, dentro I filopodi si
trovano fasci paralleli di actina
L’adesione al substrato è
fondamentale per il movimento
netto
Le miosine “tirano dietro” i
microfilamenti di actina che man
mano si allungano all’estremità (+)
per polimerizzazione.
In seguito ad adesione salda al
substrato, mediata da proteine
integrine, la polimerizzazione dei mf
comporta un allungamento netto
con spostamento in avanti della
protusione
Il movimento ameboide
Il movimento strisciante di tipo ameboide è tipico di alcuni protozoi, funghi e
leucociti (funzione di motilità, nutrimento-fagocitosi, difesa)
Si basa su:
-emissione di protusioni citoplasmatiche dette pseudopodi
-alternanza di transizioni gel-fluido nello stato del citoplasma
Correnti fluide si muovono vs pseudopodio e solidificano sulla punta mentre, al
margine posteriore, l’ectoplasma fluidifica e scorre vs protusione
Citocinesi in una cellula animale
Il solco di clivaggio è una “strozzatura” dovuta ad un anello contrattile di microfilamenti: I
filamenti di actina scorrono su f. di miosina (consumo ATP)
Fasci di actina e miosina nelle stereociglia delle cellule della coclea