CONTRIBUTI ORIGINALI
Secondi tumori in pazienti con neoplasie
maligne dell’apparato digerente.
Studio retrospettivo su 2406 casi
Ann. Ital. Chir., 2005; 76: 467-472
Francesco Minni, Riccardo Casadei, Nicola Marrano, Enrico Guerra, Lida Piccoli,
Silvia Pagogna, Daniela Rega
Istituto di I Clinica Chirurgica, Dipartimento di Scienze Chirurgiche e Anestesiologiche, Università di Bologna.
Second tumours in patients with malignant neoplasms of the digestive apparatus. A retrospective study on 2406
cases
BACKGROUND: Incidence of a second tumor is elevated, between 2-10%, in patients previously affected by another tumour.
Second tumor may concern the same organ, as a synchronous or metachronous way, or different organs.
The present work is based on 4286 patients who underwent surgical treatment for gastric, small bowel, colon-rectal or
pancreatic cancer at Surgical Unit I- Minni- Bologna University and regards multiple primitive malignant tumour
(T.M.M.P.) of the II type (Möertel classification), such as different organs or tissues based second tumours; it also analyses overall incidence, sites, lesion number, latency period, and main association in our series.
PATIENTS AND METHODS: 1742 patients with colon-rectal carcinoma, 1418 patients with gastric cancer, 91 patients with
malignant tumour of small bowel, 867 patients with pancreatic cancer and 68 with hepatocellular carcinoma have been
included in the present study. A careful history, aimed at checking the presence of a previous tumour in a different site,
was taken. One hundred eighty one patients (82 male and 99 female) reported a second type ’s tumour. Eleven cases
of synchronous tumour and 170 cases of metachronous tumours were found, at a distance of 1-39 years from each other.
Moreover 7 patients reported more than a second tumour. Female genital tract tumours (37 cases), hematopoietic system
tumours (34 cases), breast cancer (29 cases), and cutaneous tumour (20 cases) 9 were the most observed previous tumour.
Incidence of a second tumour was more elevated in patients with small bowel neoplasms (18/91, 19.8%) than in patients
with others tumours of gastrointestinal tract.
CONCLUSIONS: Present study, although win part retrospective, point out an overall incidence of 4.3% of second tumours
of the II type.
Incidence of second tumours in patients with small bowel neoplasm, is particularly high; this confirm that small bowel
plays a possible immunoprotective role and the immunodepression characterise patients with tumours in this site.
KEY WORDS: Immunodepression, Malignant tumours of gastrointestinal tract, Multiple primitive malignant tumour,
Retrospective study, Small bowel tumours.
Introduzione
L’incidenza di un secondo tumore è elevata nei pazienti con storia neoplastica, con un incidenza compresa fra
il 2 e il 10% 1,2.
Il secondo tumore, sincrono o metacrono rispetto alla
prima neoplasia diagnosticata, può interessare lo stesso
Lavoro pervenuto in Redazione Marzo 2005. Accettato per la pubblicazione Luglio 2005.
Per la corrispondenza: Prof. Francesco Minni, Via Rino Pancaldi 2,
40138 Bologna (e-mail: [email protected])
organo oppure organi o tessuti differenti 3-10. Il presente studio retrospettivo, condotto su 4186 pazienti portatori di neoplasia maligna a carico dello stomaco, del
tenue mesenteriale, del colon-retto, del pancreas e del
fegato operati presso la I Clinica Chirurgica dell’Università di Bologna, prende in considerazione unicamente i
tumori maligni multipli primitivi (T.M.M.P.) del 2° tipo
della Classificazione di Möertel 1, cioè i secondi tumori
insorti in organi o tessuti differenti dalla neoplasia iniziale, ed analizza l’incidenza cumulativa, il numero di
lesioni, il periodo di latenza, la sede e le principali associazioni riscontrate nella casistica.
Sono stati inoltre esclusi dal presente studio i tumori
Ann. Ital. Chir., 76, 5 2005
467
F. Minni et al
metacroni dello stesso distretto e i tumori multipli in
pazienti con sindromi a trasmissione genetica.
Nella casistica esaminata l’incidenza di un secondo tumore del 2° tipo della classificazione di Möertel è risultata
pari al 4,3%, con valori particolarmente elevati nei portatori di neoplasie del tenue mesenteriale rispetto a tutti gli altri pazienti analizzati (19,8%).
Materiali e metodi
Dal 1984 al 2004 presso la I Clinica Chirurgica dell’Università di Bologna sono stati ricoverati 4186 pazienti portatori di neoplasie maligne dell’apparato gastrointestinale.
In 1742 casi la neoplasia si localizzava a livello colo-rettale (40,6%), in 1418 allo stomaco (33,1%), in 867 al
pancreas (20,2%), in 68 al fegato (3,9%) e in 91 al
tenue mesenteriale (2,1%).
La ricerca anamnestica di un secondo tumore associato
alla neoplasia causa del ricovero è stata eseguita mediante questionario diretto al momento dell’ammissione in
reparto in 1426 pazienti, ricoverati nel periodo compreso tra il 1998 e il 2004.
In 2760 pazienti, ricoverati prima dell’inizio di tale indagine, in un periodo cioè compreso tra il 1984 e il 1997,
lo studio è stato retrospettivo, tramite il riesame delle
cartelle cliniche.
Un tumore del 2° tipo della classificazione di Möertel è
stato rilevato in 181 casi (4.3%): 82 di sesso maschile,
99 di sesso femminile, con un età media di 57,4 anni
(range 38-91 anni).
L’incidenza di un secondo tumore è risultata pari al
19,8% nei pazienti portatori di neoplasia del tenue
(18/91), al 5,6% nei pazienti con cancro del colon
(97/1742), al 4,4% dei pazienti con neoplasia epatica
primitiva (3/68), al 3,6% nei pazienti con cancro gastrico (51/1418) e all’1,4% nei pazienti con cancro del pancreas (12/867). Tale dato appare statisticamente significativo (p. 0,001).
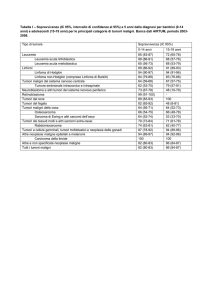
Sette dei 181 pazienti con un TMMP (3,9%) presentavano un’anamnesi positiva per più di un secondo tumore, sino ad un massimo di 3 secondi tumori, per un
totale di 189 neoplasie (Tab. I).
Tumori sincroni erano presenti in 11 pazienti (6,1%),
metacroni nei restanti 170 (93,9%), con un intervallo
di tempo tra primo e secondo tumore compreso tra 1
e 39 anni: la latenza è risultata in media superiore nei
pazienti con neoplasia del tenue (15 anni e 3 mesi), del
colon (12 anni e 9 mesi) e del pancreas (10 anni e 7
mesi) rispetto ai pazienti con cancro gastrico (7 anni e
6 mesi) o fegato (7 anni e 1 mese).
I secondi tumori più frequentemente rilevati sono risultati quelli dell’apparato genitale femminile (37 casi:
19,6%), quelli del sistema emopoietico (34 casi: 18%),
della mammella (29 casi: 15,3%) e della cute (20 casi:
10,6% ). Seguono con percentuali inferiori le neoplasie
del colon (12 casi: 6,3%) e del polmone (11 casi: 5,8%).
Altre sedi di 2° tumore sono invece episodiche.
In particolare in ambito digestivo i secondi tumori più frequenti sono risultati quelli colo-rettali (6,3%), seguiti da
quelli gastrici (8 casi: 4,2%); per quanto concerne i secondi tumori extradigestivi, dopo quelli dell’apparato genitale
femminile, del sistema emopoietico, della mammella e della cute, si segnalano i tumori del polmone (11 casi: 5,8%)
e della tiroide (8 casi: 4,2%), seguiti da quelli renali e prostatici (7 casi: 3,7%) e vescicali (4 casi: 2,1%) (Tab. II).
TAB. I – Casistica globale e incidenza di TMMP
Casistica Globale
Stomaco
Tenue mesenteriale
Colon-retto
Pancreas
Fegato
1418
33,1%
51
3,6
55
3,9
91
2,1%
18
19,8
21
23,1
1742
40,6%
97
5,6
98
5,7
867
20,2%
12
1,4
12
1,5
68
3,9%
3
4,8
3
4,8
4186
100%
Pz. con TMMP (181)
%
N° TMMP (189)
%
*10 Pz. con anamnesi positiva per più di un TMMP.
TAB. II – Sede di insorgenza di un secondo Tumore
Sede del 2°
TMMP
Utero/Ovaio
Sede del 1°T
Stomaco (55)
Tenue (21)
Colon (98)
Pancreas (12)
Fegato (3)
Totale casi (189)
468
11
2
20
4
37
Sistema Mammella
Emolinf.
11
5
18
34
Ann. Ital. Chir., 76, 5, 2005
10
1
16
2
29
Cute
Colon
4
5
10
1
20
9
2
1
12
Polmone Tiroide
3
1
7
11
3
3
1
1
8
Stomaco
Rene
Prostata
Altre sedi
1
7
8
3
3
1
7
1
1
5
7
3
9
4
16
Secondi tumori in pazienti con neoplasie maligne dell’apparato digerente
A) TMMP IN PAZIENTI PORTATORI DI NEOPLASIA GASTRICA
In 51 dei 1418 pazienti con neoplasia gastrica (21 M e
30 F) sono stati osservati TMMP, per un totale di 55
tumori; 52 TMMP erano metacroni e 3 sincroni: questi ultimi erano a livello del colon, del rene e della vescica. Due pazienti presentavano una anamnesi positiva per
altri 2 tumori, uno per 3. Undici dei secondi tumori
erano a carico dell’apparato genitale femminile e del sistema emolinfopoietico, 10 a livello mammario, 9 del colon,
4 della cute, 3 del polmone e del rene, 1 della prostata, della parotide, del laringe e della vescica.
B) TMMP IN PAZIENTI PORTATORI DI NEOPLASIA DEL TENUE
In 18 dei 91 pazienti con neoplasia del tenue mesenteriale (10 M e 8 F) sono stati osservati TMMP, per un
totale di 21 tumori: 18 TMMP erano metacroni e 3
sincroni. In 3 soggetti sono stati evidenziati tumori tripli: in un caso un carcinoma mammario sincrono e un
pregresso (8 anni) cistosarcoma ovarico; un altro paziente, 2 e 39 anni prima, era stato sottoposto ad intervento chirurgico per l’asportazione di un adenocarcinoma
bronchiale e di un melanoma cutaneo, un terzo paziente presentava un’anamnesi positiva per pregresso linfoma
e carcinoma del colon (12 e 9 anni prima). I TMMP
associati a tumori del tenue si localizzavano alla cute e
al sistema emolinfopoietico in 5 casi, alla tiroide in 3
casi, all’apparato genitale femminile e al colon in 2 casi
rispettivamente, alla mammella, allo stomaco, al polmone e alla prostata in 1 caso.
C) TMMP IN PAZIENTI PORTATORI DI NEOPLASIA DEL
COLON-RETTO
In 97 (46 M e 51 F) dei 1742 pazienti con neoplasia
del colon-retto sono stati complessivamente rilevati 98
TMMP, di cui 95 metacroni e 3 sincroni (allo stomaco, alla mammella e all’esofago). Tre TMMP erano presenti in un solo caso (carcinoma colico, gastrico e epitelioma spinocellulare paziente). I secondi tumori associati a tumori del colon hanno interessato l’apparato genitale femminile in 20 casi, il sistema emolinfopoietico in
18, la mammella in 16, la cute in 10, lo stomaco e il
polmone in 7, la prostata in 5, il rene e la tiroide in
3, la laringe e l’intestino tenue in 2, il pancreas, la parotide, la vescica, il retroperitoneo e l’esofago in 1 caso.
D) TMMP IN PAZIENTI PORTATORI DI NEOPLASIA PANCREATICA
In 12 degli 867 pazienti ricoverati con diagnosi di neoplasia pancreatica (3 M e 9 F) si sono osservati TMMP,
di cui 10 metacroni e 2 sincroni. I secondi tumori associati a tumori pancreatici hanno interessato l’apparato
genitale femminile in 4 casi, la vescica in 3, la mammella in 2, il surrene, il colon e la tiroide in 1 caso
rispettivamente.
E) TMMP IN PAZIENTI PORTATORI DI NEOPLASIA EPATICA
In 3 dei 68 pazienti (2M e 1 F) sottoposti ad intervento chirurgico per epatocarcinoma primitivo erano
anamnesticamente rilevabili TMMP, tutti metacroni e
unici. I tumori erano a carico della cute, del rene e della tiroide.
Discussione
I T.M.M.P. sono neoplasie maligne che derivano da organi o tessuti differenti, caratterizzate dalla reciproca indipendenza istologica e topografica; una lesione non deve
inoltre essere espressione di ripetizione metastatica
dell’altra.
Tali tumori si definiscono sincroni se diagnosticate contemporaneamente o entro 6 mesi dal trattamento della
precedente neoplasia, metacroni se diagnosticate oltre tale
periodo.
Considerati fino a poco tempo fa rilievi occasionali, i
T.M.M.P. rappresentano oggi un fenomeno statisticamente rilevante, con un tasso d’incidenza che varia, nelle diverse statistiche, dal 2 al 10% di tutte le neoplasie
maligne osservate 11-14.
Pur con i limiti di una indagine retrospettiva, anche la
nostra serie conferma il particolare rilievo statistico di
tali tumori.
In letteratura il sesso maschile risulta colpito con una
frequenza leggermente superiore, pari a circa il 4% a 10
anni (6.1-10.5% vs. 2.2-6%) 14. Nella presente serie è
stata rilevata una lieve predominanza del sesso femminile, ma tale dato non sembra avere valore statistico in
considerazione del numero dei casi riscontrati.
Nella grande maggioranza dei casi i tumori presenti nella storia clinica di questi pazienti sono in numero di
due, mentre i tumori tripli incidono per il 4-5%; pazienti con 4 o 5 tumori rappresentano casi del tutto eccezionali 15,16.
La prima definizione di TMMP si ebbe nel 1889 ad
opera di Billroth che cercò di identificare i TMMP come
un’entità clinica autonoma stabilendo i seguenti criteri
d’identificazione:
1) ciascun tumore deve avere un differente aspetto istologico;
2) ogni tumore deve avere una differente localizzazione;
3) ciascun tumore deve dare proprie metastasi.
Da allora diversi sono stati i tentativi di definizione dei
TMMP 1,17-21, attualmente la classificazione più seguita
è quella di Möertel del 1961 2 che distingue i tumori
maligni multipli, sincroni o metacroni, in:
– TIPO I: neoplasie maligne multicentriche di uno stesso organo, di uno stesso tessuto in organi pari o di un
tessuto comune in organi diversi dello stesso apparato;
– TIPO II: neoplasie maligne di organi o tessuti differenti;
– TIPO III: neoplasie maligne multicentriche associate
a lesioni di un organo o tessuto differente.
Dal punto di vista patogenetico è invece possibile distinguere 4 categorie di T.M.M.P.:
a) i tumori multipli occasionali;
b) i tumori multipli che costituiscono un affezione genetica;
c) i tumori multipli che complicano un affezione genetica;
d) la sindrome cancerosa familiare.
Ann. Ital. Chir., 76, 5 2005
469
F. Minni et al
Fra i tumori multipli per i quali è ben evidenziabile una
componente genetica, ricordiamo la neurofibromatosi di
Von Reklinghausen e le associazioni retinoblastoma familiare-osteosarcoma 22,23, tumore di Wilms-epatoblastoma
o altre neoplasie maligne del sistema nervoso centrale o
periferico 22, carcinoma midollare della tiroide-feocromocitoma nella Sindrome di Sipple. In questo gruppo è
anche possibile includere le Neoplasie Endocrine
Multiple.
Fra i T.M.M.P. che complicano un affezione genetica
ricordiamo anche i tumori che insorgono in corso di
poliposi familiare del colon e il cancro della mammella
e del testicolo nei soggetti con sindrome di Klinefelter.
La sindrome cancerosa familiare, malattia ereditaria a trasmissione autosomica dominante, si caratterizza per l’elevata ricorrenza di neoplasie di utero, mammella e colon
in soggetti dello stesso gruppo familiare 24,25.
I tumori multipli occasionali sono di gran lunga i più
frequenti e si contraddistinguono per l’assenza di evidenti connessioni eziopatologiche fra le diverse neoplasie; non sono correlabili ad alcuna anomalia genetica o
predisposizione familiare ed insorgono presumibilmente
con il concorso di molteplici fattori, compresi quelli
ambientali.
Quando si sviluppano nello stesso apparato, si ritiene
che tali neoplasie siano il risultato di una “field cancerization”, ovvero della crescita multifocale di cloni indipendenti dovuta probabilmente ad una cronica esposizione a carcinogeni ambientali.
A tal proposito sono state chiamate in causa la sorveglianza immunologica 28,14 e la teoria degli oncogeni 22,28,29.
Le associazioni fra le diverse neoplasie riportate in letteratura non sono state statisticamente confermate, ad eccezione del carcinoma della mammella, che è risultato
significativamente correlato con il carcinoma dell’endometrio 30 e con quello del colon-retto 16,27,31-33.
Per quanto riguarda il tratto gastro-intestinale si è evidenziata una maggior incidenza di T.M.M.P. nei pazienti con neoplasie maligne del piccolo intestino: l’incidenza di questi tumori varia, secondo le diverse statistiche,
tra il 10 e il 60% 34,35, con un tasso di neoplasie multiple del 15-20% 22 dei casi.
Questo rilievo contrasta con la ridotta incidenza di neoplasie primitive del tenue, nonostante l’elevata lunghezza di questo segmento intestinale.
Considerata la ricchezza di tessuto linfoide e l’elevata
produzione di immunoglobuline 36,37, in particolare di
IgA secretorie, diversi Autori hanno ipotizzato un possibile ruolo difensivo del sistema immunitario del piccolo
intestino nei confronti delle neoplasie 38.
Tale dato è confermato anche dalla maggior incidenza
di T.M.M.P. nel tratto gastroenterico in soggetti immunodepressi.
L’importanza del controllo immunitario, è stata dimostrata da rilievi sia clinici che sperimentali: la comparsa
di metastasi da carcinoma della mammella in pazienti
470
Ann. Ital. Chir., 76, 5, 2005
sottoposte a terapia con corticosteroidi 37, la maggior frequenza di metastasi ileali da melanoma in pazienti immunodepressi 39,40, l’alta incidenza di linfomi, espressione di
immunodeficienza 41, nell’intestino tenue 42, una maggior incidenza di carcinomi ileali in pazienti con Morbo
di Crohn e in soggetti portatori di una immunodepressione iatrogena 43.
Il presente studio conferma i dati riportati in letteratura sull’elevata frequenza di tumori multipli in pazienti
portatori di neoplasie maligne dell’intestino tenue, con
una differenza nel tasso incidenza rispetto a quelli insorti in pazienti con neoplasie di altri distretti gastrointestinali (23,2% vs 4,2%).
Conclusioni
Lo studio condotto, pur con i limiti legati al carattere
retrospettivo della ricerca, conferma l’elevata incidenza di
tumori multipli in corso di patologia neoplastica del
tenue, in particolare di neoplasie dell’apparato genitale
femminile e della mammella.
Tale dato appare imputabile allo stato di immunodepressione tipico dei pazienti che presentano una neoplasia in tale distretto intestinale.
Riassunto
INTRODUZIONE: L’incidenza di un secondo tumore è elevata nei pazienti con storia neoplastica, con un’incidenza, compresa tra il 2 e il 10%. La neoplasia può interessare lo stesso organo, in maniera sincrona o metacrona, o organi diversi. Il presente studio, condotto su 4286
pazienti portatori di neoplasia a carico dello stomaco,
tenue mesenteriale, colon-retto, fegato e pancreas operati presso la Chirurgia Generale I - Minni dell’Università
di Bologna, prende in considerazione i tumori maligni
multipli primitivi (T.M.M.P.) del 2’ tipo della classificazione di Möertel, cioè i secondi tumori in organi o tessuti differenti, ed analizza l’incidenza cumulativa, il
numero dì lesioni il periodo dì latenza, la sede e le principali associazioni riscontrate nella casistica.
MATERIALI E METODI: 1742 pazienti erano portatori di
neoplasia colo-rettale, 1418 di cancro gastrico, 91 di neoplasia maligna del tenue mesenteriale, 867 di cancro del
pancreas e 68 di epatocarcinoma. Tutti i pazienti sono
stati sottoposti ad una accurata anamnesi, mirata
all’accertamento di un pregresso tumore in una sede differente da quella causa del ricovero. 181 pazienti riferivano un tumore di 2° tipo. 82 pazienti erano di sesso
maschile, 99 di sesso femminile. Tumori sincroni erano
presenti in 11 casi, metacroni nei restanti 170, con un
intervallo compreso tra 1 e 39 anni. Sette pazienti avevano un’anamnesi positiva per più di un secondo tumore per un totale complessivo di 189 neoplasie. I secondi tumori più frequentemente riscontrati sono risultati
Secondi tumori in pazienti con neoplasie maligne dell’apparato digerente
quelli dell’apparato genitale femminile (37 casi), del
sistema emopoietico (34 casi), della mammella (29 casi)
e i tumori cutanei (20 casi). L’incidenza di un secondo tumore è risultata particolarmente elevata nei
pazienti portatori di neoplasia del tenue (18/91:
19,8%) rispetto alle altre neoplasie dell’apparato digerente esaminate.
CONCLUSIONI: Lo studio condotto, pur con i limiti del
carattere in parte retrospettivo, permette di rilevare una
incidenza complessiva di secondi tumori di 2° tipo pari
al 4,3%. Particolarmente elevata è risultata l’incidenza di
secondi tumori in pazienti portatori di neoplasia del
tenue a conferma dell’importante ruolo immunoprotettivo di tale distretto intestinale e dello stato di immunodepressione che verosimilmente caratterizza i portatori di neoplasie in tale ambito.
Bibliografia
1) Warren S, Gates O: Multiple primary malignant tumours: A survey of the literature and statistical study. Am J Cancer, 1932;
16:1358-414.
2) Möertel CG, Dockerty M, Baggenstoss AH: Multiple primary
malignant neoplasms. Cancer, 1961; 14:222.
3) Ueno M, Muto T, Oya M, et al.: Multiple primary cancer: An
experience at the Cancer Institute Hospital with reference to colorectal
cancer. Int J Clin Oncol, 2003; 8:162-67.
4) Knast W, Strutynska-Karpinska M, Rabeczynsky J: Surgical treatment of patients with multiple carcinoma. Med Sci Monit, 2001;
7:1256-326.
5) Brinster DR, Raper SE: Synchronous colon and pancreatic cancer
in a patient with Peutz-Jeghers syndrome. Report of a case and review
of a literature. Surgery, 2004; 135;352-54.
6) Demante CGN, Troyer DA, Miles TP: Multiple primary malignant neoplasms. Am J Clin Oncol, 2001; 26:79-83.
7) Nagasawa S, Onda M, Sasajima K, et al.: Multiple primary malignant neoplasms in patients with esophageal cancer. Dis Esophagus,
2000; 13:2226-30.
8) Mosca F, Stracqualursi A, Lipari G, et al.: Multiple primary malignant neoplasms. Report of a rare case with 5 metachronous tumours.
Chir Ital, 2001; 53:133-39.
9) Tomoda H, Taketomy A, Baba H, et al.: Multiple primary colorectal and gastric carcinoma in Japan. Oncol Rep, 1998; 5:147-49.
10) Kaffes A, Hughes L, Hhollinshead J, et al.: Synchronous primary
adenocarcinoma, mucosa-associated lymphoide tissue lymphoma and a
stromal tumour in a Helicobacter pylory-infected stomach. J Gastroenter
Hepatol, 2002; 17:1033-36.
11) Billroth T: Die Allgemein Chirurgische Pathologie und Therapie
in 51 Vorlesungen: ein Handbuch fur studirende und Artze. XIV edit.
Berlin: G. Reimer 1889, 1889; 908.
12) Sanders FK: Experimental carcinogenesis: Induction of multiple
tumours by viruses. Cancer, 1977; 40:1841-844.
13) Thoma GW: The incidence and significance of multiple primary
malignant tumours. A study of 2346 neoplasias from a cancer research hospital. Am J Med Scì, 1964; 24:7427-434.
14) Shah IA, Alfsen GC: Primary malignant tumors involving the
large bowel. Dis Colon Rectum, 1994; 27:798-802.
15) Cameron JM, Litton A, Lyon DS: Primary carcinoma multiplex.
J Clin Patho, 1961; 14:574-77.
16) Cangemi V, Volpino P, Fiori E, et al.: I tumori maligni multipli primitivi. Chirurgia, 1990; 3:461-66.
17) Major RH: Multiple primary malignant tumours. Bull Hopkins
Hospital, 1918; 29:233.
18) Owen LJ: Multiple primary malignant tumours. JAMA, 1921;
76:1329.
19) Hurt HH, Broders AC: Multiple primary malignant neoplasms.
J Lab Clin Med, 1933; 18:765.
20) Lund CC: Second primary cancer in cases of cancer of buccal
mucosa. Mathematical study of susceptibility to cancer. N Engl J Med,
1932; 209:1147.
21) Goetze: cit. da Slaughter DP: Multiplicity of origin of malignant
tumour: Collective review. Int Abstr Surg, 1994; 79:89.
22) Mulvihill JJ, McKeen EA: Genetic of multiple primary tumours:
A clinical etiologic approach illustrated by three patients. Cancer, 1977;
40:867-871.
23) Hansen MF, Cavence WK: Genetics of cancer predisposition.
Cancer Res, 1987; 43:5518-527.
24) Lynch HT, Hurris RE, Lynch PM, et al.: A role of heredity in
multiple primary cancer. Cancer, 1977; 40:1849-854.
25) Lynch HT, Lynch PM, Albano WA, Lynch JF: The cancer syndrome, A status report. Dis Colon Rectun, 1981; 24:311-22.
26) Schmahal D: Carcinogenic action of anticancer drugs with special
reference to immunosuppression. Cancer, 1977; 40:1927-29.
27) Franchi P, Moro E, Panzera M, et al.: Le neoplasie maligne primitive multiple. Chirurgia, 1989; 2:336-40.
28) Tatosyan AG, Galetzki SA, Kisselyowa NR: Oncogene expression
in human tumours. J Cancer, 1985; 35:731-36.
29) Takebe H, Tatsumi K, Satoh Y: DNA repair and its possible
involvement in the origin of multiple cancer. Jpn J Clin Oncol, 1985;
15:299-305.
30) Shottenfeld D, Berg J: Incidence of multiple primary cancer. IV:
Cancer of female breast and genital organs. J Natl Inst, 1971; 46:16170.
31) Argawal N, Ulahannan M, Mandile MA, et al.: Increased risk of
colorectal cancer following breast cancer. Ann Surg, 1986; 203:307-10.
32) Ifiremen Z, Rozen P, Figer A, Ron E: Colo-rectal tumours screening in women with a past history of breast uterus or ovary malignancies. Gastroenterol, 1985; 88:1384.
33) Lynch HT: Genetic factors in families with combined gastrointestinal and breast cancer. Am J Gastroenterol, 1973; 59:31-40.
34) Silberman H, et al.: Neoplasm of the small bowel. Ann Surg,
1980; 157:1974.
35) Reyes EL, Talley RW: Primary malignant tumours of the small
intestine. Am J Gastroenterol, 1970; 5:30.
36) Amman M, Hong R: Selective IgA deficiency: Presentation of 30
cases and review of the literature. Medicin, 1971; 50:223.
37) Williamson RC, Welch CE, Malt RA: Adenocarcinoma and
lymphoma of the small intestine. Ann Surg, 1983; 197:172.
Ann. Ital. Chir., 76, 5 2005
471
F. Minni et al
38) Marrano D, Minni F: I tumori primitivi dell’intestino tenue
mesenteriale. Padova: Piccin editore, 1997.
41) Dutz W, Ascìvadi S, Sadri S, Kohout E: Intestinal lymphoma
and sprue: A systematic approach. Gut, 1971; 12:804.
39) Fairley GH: Immunological aspects of cancer: II- evidence for antigenicity in human tumours with reference to both melanoma and acute leukaemia. Br Med J, 1970; 4:483.
42) Gatti RA, Good RA: Occurrence of malignancy in immunodeficiency. Cancer, 1971; 28:89.
40) Morton DL, Eilber FR, Joseph WL, et al.: Immunological factors in human sarcomas and melanomas: A basis of immunotherapy.
Ann Surg, 1970; 172:740.
43) Rubio CA, Befritz R, Poppen B, et al.: Crohn’s diseases and
adenocarcinoma of the intestinal tract. Dis Colon Rectum, 1991;
342:17.
472
Ann. Ital. Chir., 76, 5, 2005