CLINICAL CHEMISTRY HIGHLIGHTS
IL MEGLIO DI CLINICAL CHEMISTRY
Microbioma intestinale umano e metabolismo corporeo: implicazioni per obesità
e diabete
Sridevi Devaraj, Peera Hemarajata, James Versalovic
Department of Pathology and Immunology, Baylor College of Medicine and Department of Pathology, Texas Children's
Hospital, Houston, USA
Traduzione a cura di Francesca Avemaria e Andrea Mosca
ABSTRACT
Obesity, metabolic syndrome and type 2 diabetes are major public health challenges. Recently, interest has surged
regarding the possible role of the intestinal microbiota as potential novel contributors to the increased prevalence of
these three disorders. Recent advances in microbial DNA sequencing technologies have resulted in the widespread
application of whole-genome sequencing technologies for metagenomic DNA analysis of complex ecosystems such
as the human gut. Current evidence suggests that the gut microbiota affect nutrient acquisition, energy harvest and
a myriad of host metabolic pathways. Advances in the Human Microbiome Project and human metagenomics
research will lead the way toward a greater understanding of the importance and role of the gut microbiome in
metabolic disorders such as obesity, metabolic syndrome and diabetes.
inTRoduzione
Obesità, sindrome metabolica e diabete di tipo 2
rappresentano le sfide maggiori per la salute pubblica
colpendo, negli Stati Uniti, ~26 milioni tra bambini e
adulti. Più del 8% della popolazione americana soffre di
diabete e 17,9 milioni di persone presentano sindrome
metabolica (1). Durante gli ultimi 20 anni, la prevalenza
dell’obesità è cresciuta esponenzialmente e più di un
americano adulto su tre (36%) e ~12,5 milioni (17%) tra
bambini e adolescenti (con un’età compresa tra 2 e 19
anni) sono obesi (2). Nel 2010, in tutti gli Stati americani
si registrava una prevalenza di obesità >20% (2).
L’eterogeneità di queste patologie è stata dimostrata con
studi antropometrici e genetici. Queste malattie
metaboliche sembrano essere dovute alla combinazione
di suscettibilità genetica e cambiamenti nello stile di vita.
Recentemente, è stata posta molta attenzione su un
possibile ruolo svolto dal microbioma intestinale come
potenziale causa del rapido aumento di prevalenza
dell’obesità (3-5). Questa rassegna pone la sua
attenzione sui recenti sviluppi nella comprensione del
microbioma intestinale e sulle tecniche per valutare le
relazioni tra microbioma e metabolismo umano, obesità,
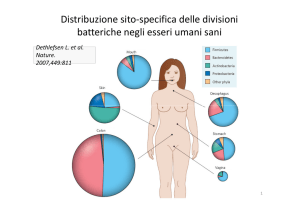
sindrome metabolica e diabete tipo 2 (Figura 1).
iL MiCRoBioMA inTeSTinALe uMAno: gLi
STRuMenTi uTiLizzATi dALLA SCienzA
L’applicazione
sempre
più
diffusa
del
sequenziamento del gene codificante rRNA 16S come
mezzo per rilevare patogeni batterici e studiare l’ecologia
microbica ha fornito una tecnica efficace per valutare la
composizione batterica del microbioma umano. Il
sequenziamento di due “target” principali all’interno dei
geni codificanti rRNA 16S batterico ha prodotto dati
importanti sulla composizione del microbioma fecale
umano di 242 individui adulti sani (6, 7). Nel Progetto
Microbioma Umano sono stati raccolti e sequenziati
campioni provenienti da 18 differenti siti corporei. I
campioni fecali erano il tipo di campione usato per lo
studio del microbioma intestinaie. Studi pubblicati
precedentemente avevano dimostrato che la
composizione del microbioma intestinale cambia nelle
varie sezioni del tratto gastrointestinale in differenti
specie di mammiferi. Per esempio, il sequenziamento del
gene del rRNA 16S è stato impiegato per studiare la
maturazione del microbiota murino dell’intestino ceco e
*Questo articolo è stato tradotto con il permesso dell’American Association for Clinical Chemistry (AACC). AACC non è responsabile
della correttezza della traduzione. Le opinioni presentate sono esclusivamente quelle degli Autori e non necessariamente quelle
dell’AACC o di Clinical Chemistry. Tradotto da Clin Chem 2013;59:617-28 su permesso dell’Editore.
Copyright originale © 2013 American Association for Clinical Chemistry, Inc. In caso di citazione dell’articolo, riferirsi alla pubblicazione
originale in Clinical Chemistry.
biochimica clinica, 2014, vol. 38, n. 6
639
IL MEGLIO DI CLINICAL CHEMISTRY
CLINICAL CHEMISTRY HIGHLIGHTS
Figura 1
L’iperglicemia (HG) e l’aumento degli acidi grassi liberi (FFA), che sono centrali nello sviluppo di obesità, sindrome metabolica e diabete,
combinati a una dieta ad alto contenuto di grassi e zuccheri, possono portare a un’aumentata attivazione del complesso infiammatorio e
all’attivazione dei macrofagi attraverso un’attivazione dei recettori “toll-like” (TLR) e del fattore nucleare κB (NF-κB).
È possibile che si verifichi un aumento dell’endotossiemia metabolica che può attivare il “pathway” TLR4 attraverso la proteina adattatrice,
MyD88, e indurre quindi l’attivazione delle cellule immuni e l’infiammazione. Inoltre, i macrofagi possono infiltrare il tessuto adiposo e
attivare le proteine chinasiche attivate da mitogeni, come la chinasi amminoterminale c-Jun (JNK) e NF-κB, causando un aumento del
“cross-talk” e delle adipochine derivate dal tessuto adiposo. Una dieta ad alto contenuto glicemico e di grassi potrebbe modificare il
microbioma intestinale alterando il contenuto di istidina, glutammato, acidi grassi a catena corta e altri fattori e promuovere una disfunzione
della barriera intestinale e condizioni predominanti nell’obesità, nella sindrome metabolica e nel diabete alterando la risposta dell’ospite.
Tutte queste alterazioni metaboliche si traducono in un aumento dell’infiammazione a livello sistemico, dell’attività dei macrofagi e
dell’attivazione dei TLR contribuendo in questo modo al maggior carico cardio-metabolico tipico dell’obesità, del diabete e della sindrome
metabolica.
questi studi hanno dimostrato l’esistenza di un elevato
numero di batteri non ancora identificati che abitano
l’intestino di mammifero (6). Queste strategie di
sequenziamento, che non dipendono dalle colture, sono
essenziali per determinare la composizione batterica del
microbioma e la sua relativa stabilità e diversità nel
tempo. Pertanto, è essenziale sviluppare un modello
sperimentale robusto del microbioma umano in modo da
riuscire a descrivere gli importanti processi mecanistici
che portano allo sviluppo dello stato di malattia
nell’uomo.
I progressi nelle tecnologie per il sequenziamento
hanno portato alla diffusa applicazione del metodo di
sequenziamento su genoma intero (“whole-genome”:
WG) per l’analisi del DNA metagenomico di ecosistemi
complessi come quello dell’intestino umano (7). La
strategia di sequenziamento WG fornisce informazioni
sia sulla composizione microbica che funzionali. I dati
WG possono essere utilizzati per dedurre la
composizione batterica e possono essere paragonati ai
dati generati dal sequenziamento del gene del rRNA
16S. Le sequenze genomiche di specie microbiche più
abbondanti sono ben rappresentate in una serie di
640
biochimica clinica, 2014, vol. 38, n. 6
sequenziamenti di subporzioni di acidi nucleici, mentre
specie meno abbondanti sono rappresentate da un
numero minore di sequenze generate mediante
sequenziamento “next-generation”. Questa ricchezza
relativa permette una misura esauriente in termini di
composizione delle risposte di un ecosistema ai
cambiamenti nella dieta, a terapie farmacologiche, ad
alterazioni epigenetiche e a perturbazioni ambientali.
Una strategia alternativa prevede invece il
sequenziamento della maggior parte dei geni del
microbioma (di solito ~2000 geni per batterio) per poter
valutare le vie (“pathways”) metaboliche e funzionali in
ogni singolo metagenoma. I dati funzionali del WG
offrono l’opportunità di scoprire quali sono le vie
metaboliche colpite e come il microbioma può contribuire
a stati di salute e malattia. Questa tecnologia comporta
la necessità di gestire grandi numeri di dati. I progressi
nel sequenziamento del DNA con la “next-generation”
hanno prodotto, a partire da un DNA totale di campioni
fecali di 124 adulti europei, 576,7 Gb di dati di sequenza
di DNA microbico, generati con l’analizzatore Illumina
genome (8). Il rapporto tra il microbiota commensale che
compone la flora intestinale e i microrganismi presenti
CLINICAL CHEMISTRY HIGHLIGHTS
nella barriera intestinale è complesso e differisce
spazialmente lungo le diverse zone del tratto intestinale.
La metagenomica dei campioni fecali stima i
cambiamenti dell’ecosistema nelle feci o nell’intestino
distale, ma non è capace di correlare i microbiomi di
differenti regioni dell’intestino. È anche importante
sottolineare che l’analisi metagenomica dei campioni
fecali non prende in considerazione tutte le interazioni
molecolari del tratto gastrointestinale. Turnbaugh et al.
hanno proposto l’idea che esista un nucleo di funzioni
per il microbioma e che gli strumenti di proteomica e
metabolomica possano servire per più approfondite
analisi funzionali (7, 9). Da una prospettiva sistemica, le
analisi metagenomiche potrebbero fornire ulteriori
informazioni su specifici cambiamenti intraindividuali e
quindi avere maggiori ricadute per l’utilizzo di strategie
mediche personalizzate.
La metatrascrittomica, la metaproteomica e la
metabonomica saranno utili per esplorare i vari aspetti
funzionali del microbioma intestinale. L’analisi “real-time”
del microbioma intestinale rappresenta uno strumento
utile per lo sviluppo di approcci per terapie
personalizzate. La metabonomica può essere descritta
come lo studio delle risposte metaboliche ad agenti
chimici, ambientali e a malattie, e comprende l’analisi
computazionale dei dati degli spettri metabolici che forniscono informazioni sui cambiamenti temporali per
specifici metaboliti. Inoltre, la metabonomica dà
informazioni sul profilo metabolico globale di un
individuo in tempo reale. Con questo approccio è
possibile chiarire quali “pathway” e “network” vengono
alterati in specifiche malattie. Lo studio combinato di
metagenomica e profilo metabolico del microbiota
intestinale consente di analizzare in dettaglio il
metabolismo dell’ospite e quello microbico. L’analisi di
queste componenti funzionali del microbioma, che
colpiscono il metabolismo e lo stato di salute nell’uomo,
viene definita come metagenomica funzionale.
La metagenomica e la scienza che studia il
microbioma umano rappresentano un’avanguardia della
biologia grazie agli enormi progressi tecnologici e
concettuali. Il maggiore sviluppo tecnico si è avuto con il
dispiegamento in molti centri delle tecnologie di
sequenziamento del DNA “next-generation” con capacità
notevolmente migliorate per le raccolte di
sequenziamenti di genomi microbici nel metagenoma.
Le nuove tecnologie hanno dato la possibilità di
sviluppare progetti di sequenziamento su larga scala,
difficili da immaginare appena 10 anni fa. La chiave di
sviluppo concettuale è stato il paradigma emergente
della natura essenziale delle comunità microbiche
complesse e della loro importanza per la biologia dei
mammiferi e per lo stato di salute e di malattia dell’uomo.
Il Progetto Microbioma Umano è stato approvato nel
maggio 2007 come una delle due maggiori componenti
(insieme al programma di epigenomica umano) della
“roadmap” del “National Institute of Health” (NIH)
versione 1.5 (ora conosciuto come “Common Fund”).
Recentemente, due rapporti fondamentali emessi dal
consorzio Progetto Microbioma Umano hanno descritto
IL MEGLIO DI CLINICAL CHEMISTRY
studi nei quali, partendo da una popolazione composta
da 242 soggetti adulti sani, sono stati raccolti campioni
da 15 o 18 parti del corpo per fino a tre momenti
temporali diversi (10, 11). Da questi campioni sono stati
generati 5177 profili tassonomici microbiologici
dall’analisi dei geni codificanti rRNA 16S e più di 3,5
Tbasi
di
sequenze
metagenomiche.
Inoltre,
parallelamente, il consorzio Progetto Microbioma Umano
ha sequenziato ~800 genomi di riferimento associati
all’uomo. Questa risorsa metterà a disposizione una
piattaforma per futuri studi sullo stato di malattia e fornirà
un insieme di dati di riferimento per il microbioma
fisiologico umano. Questi dati potranno anche essere
utilizzati per studi futuri sull’epidemiologia e sull’ecologia
del microbioma umano in vari stati di malattia e costituire
la base per lo sviluppo di nuove strategie terapeutiche.
L’utilizzo di approcci di studio sia funzionali che di
composizione ha permesso di delineare la relazione tra
cambiamenti patologici del microbioma intestinale e
molte malattie.
La metabolomica delle urine consente di studiare
l’impatto del microbioma sull’intero metabolismo
corporeo. I vantaggi di utilizzare campioni urinari
comprendono la relativa grande quantità in volume del
campione e la convenienza di un campionamento non
invasivo. Inoltre, i campioni urinari possono essere
utilizzati per stimare la cronologia dei cambiamenti del
metabolismo, rappresentando quindi uno strumento utile
per studiare la patogenesi e la progressione di malattia,
la diagnosi e la valutazione della prognosi. I metodi più
utilizzati per studiare il profilo metabolico delle urine
includono la spettroscopia per risonanza magnetica
nucleare (NMR), la spettrometria di massa accoppiata
alla cromatografia liquida (LC-MS) e alla gas
cromatografia (GC-MS) e la spettrometria di massa-gas
cromatografica TOF (GC-TOFMS). In un recente
articolo, il gruppo di Nicholson ha descritto un metodo
per raccogliere le urine e per la loro conservazione che
enfatizza l’importanza di selezionare il mitto intermedio e
di aggiungere ureasi prima di congelare il campione.
Questo metodo sarà utilizzato per studiare il profilo
metabolico. Prima delle analisi basate su tecniche GCMS, l’attività ureasica deve essere bloccata
aggiungendo etanolo o metanolo e quindi derivatizzata
sottoponendo il campione a ossimazione e trimetilsililazione (12). Dato che il campione è sottoposto a varie
fasi di preparazione, è importante usare campioni
biologici come CQI per controllare la validità dei dati
ottenuti mediante tecniche basate su GC-MS che
utilizzano analisi delle componenti principali. Gli studi
metabolomici basati su tecniche GC-MS prevedono molti
passaggi, come la correzione della linea di base, la
riduzione del rumore di fondo, la deconvoluzione, il
calcolo dell’area del picco e l’allineamento del tempo di
ritenzione, tutte fasi importanti per generare dati
consistenti. Esistono molti “software” commercialmente
disponibili che offrono supporto per tali strategie di
correzione prima dell’analisi dei dati. Inoltre, nel profilo
metabolico urinario è importante normalizzare i dati
(sulla base del volume, del contenuto di creatinina e altri
biochimica clinica, 2014, vol. 38, n. 6
641
IL MEGLIO DI CLINICAL CHEMISTRY
parametri) per ottenere informazioni significative e
minimizzare l’influenza dell’effetto di diluizione.
Utilizzando questo tipo di protocollo, i ricercatori sono
stati capaci di ottenere un ampio profilo metabolico di
~400-600 metaboliti in 120 campioni di urina a
settimana. Le analisi ad alta produttività (“highthroughput”) effettuate mediante spettroscopia NMR o
MS sono strategie di profilo metabolico largamente
utilizzate per offrire una visione d’insieme del
metabolismo umano (13-16). Associati alle analisi
computazionali multivariate, questi metodi forniscono
informazioni approfondite dello stato di malattia e
possono portare alla scoperta di biomarcatori.
Questo approccio facilita la quantificazione delle
influenze ambientali sul genoma dell’ospite e sulla
salute. Questa strategia analitica, essendo parte di studi
clinici su larga scala, è stata applicata con successo a
malattie come ipertensione (17), ischemia cardiaca (18),
diabete (19) e obesità (20).
La metabonomica può essere difficoltosa a causa
dello spazio chimico associato ai metaboliti endogeni
che può risultare altamente diversificato, rendendo
difficile da decifrare, nella sua interezza, un’informazione
metabolica completa per ogni campione. Le tecnologie
analitiche comuni usate in metabolomica e
metabonomica includono la spettroscopia NMR, LC-MS
e GC-MS e anche GC-TOFMS. Queste differenti
tecniche analitiche hanno i loro punti di forza e di
debolezza e sono spesso utilizzate in combinazione in
modo da fornire dati complementari; la scelta di una
particolare tecnica analitica dipende dal tipo di studio
che si vuole affrontare. La tecnica NMR ha il vantaggio
di essere rapida, non danneggia il campione ed è
applicabile a materiale biologico intatto, ottenendo
informazioni chimiche strutturali. NMR richiede una
preparazione minima del campione e può essere
utilizzata per indagare una miscela di diversi metaboliti in
un singolo campione. Tuttavia, le strategie basate sulla
MS hanno il vantaggio di godere di maggiore sensibilità,
accuratezza, precisione e riproducibilità rispetto alla
NMR. Inoltre, l’accoppiamento GC e TOFMS offre una
serie di ulteriori vantaggi, come la riduzione del tempo di
analisi e una maggiore accuratezza per quanto riguarda
il processo di deconvoluzione dei picchi.
iL MiCRoBioMA inTeSTinALe: dALLA
CoMpoSizione ALLo STudio deLLe
Funzioni e deL MeTABoLiSMo
La comunità microbica intestinale include ~1014
batteri, che normalmente risiedono nel tratto
gastrointestinale, un numero che supera di gran lunga
quello di tutte le cellule umane presenti nel corpo. Il
genoma collettivo di questi microrganismi (il microbioma)
contiene milioni di geni (un numero che cresce
rapidamente) rispetto ai ~20.000-25.000 geni del
genoma umano. Questa “fabbrica” microbica
contribuisce a un ampio numero di funzioni biochimiche
e metaboliche che altrimenti il corpo umano non
642
biochimica clinica, 2014, vol. 38, n. 6
CLINICAL CHEMISTRY HIGHLIGHTS
potrebbe
svolgere
(21).
Sebbene
variazioni
nell’alimentazione possano provocare cambiamenti nel
microbiota intestinale in un breve lasso di tempo (1-4
giorni dopo il cambio di dieta), questi sono facilmente
reversibili (22, 23). Nei modelli animali, il rapporto tra i
phyla batterici maggiormente presenti nell’intestino, i
Bacteroidetes e i Firmicutes, si altera in risposta ai
cambiamenti della dieta (22, 23). L’alterazione
dell’equilibrio energetico porta a un aumento di peso.
Studi su modelli murini hanno dimostrato che esiste una
relazione tra equilibrio energetico, dieta e composizione
del microbioma intestinale. Il trapianto del microbioma
intestinale da un donatore obeso si traduce in un
aumento dell’adiposità nel ricevente se viene
paragonato a un trapianto effettuato a partire da un
donatore magro.
Studi recenti suggeriscono che il microbiota
intestinale influisce sull’assorbimento di nutrienti,
sull’accumulo di energia e su una miriade di “pathway”
metabolici umani (24). Emerge anche la possibilità che il
microbiota intestinale possa svolgere un ruolo
importante nella regolazione del peso ed essere
parzialmente responsabile dello sviluppo dell’obesità.
Una prima prova della relazione tra obesità e
microbioma intestinale risale a trent’anni fa, quando è
stata riscontrata un’associazione tra perdita di peso
indotta chirurgicamente attraverso “bypass” gastrico,
aumento di peso dovuto a lesioni del nucleo ipotalamico
ventromediale e cambiamenti nell’ecologia del
microbioma intestinale (25, 26). In questi primi studi
erano utilizzate metodiche coltura-dipendenti, che però
riuscivano a individuare solo una piccola parte dei
microbi presenti nell’intestino. Negli ultimi anni, la
capacità di ottenere un’immagine sempre più accurata
delle comunità microbiche intestinali è migliorata grazie
all’introduzione di tecniche molecolari colturaindipendenti, basate sul sequenziamento del gene del
RNA ribosomale 16S. Jumpertz et al. (27) hanno
misurato il bilancio energetico in 12 soggetti magri e 9
obesi che seguivano due diete differenti per contenuto
calorico per brevi periodi di tempo. In questi pazienti
veniva contemporaneamente monitorato il microbiota
intestinale mediante uno studio di pirosequenziamento
dei geni batterici del rRNA 16S presenti nelle feci e
misurate le calorie ingerite ed escrete mediante
calorimetria. Questo studio ha dimostrato che un alterato
carico di nutrienti (alto contenuto calorico vs. basso
contenuto calorico) è in grado di indurre rapidi
cambiamenti nella composizione del microbiota
intestinale umano e che tali cambiamenti correlano bene
con la perdita calorica fecale nelle persone magre. Un
aumento delle riserve energetiche di ~150 kcal è stato
associato a un aumento della numerosità dei Firmicutes
e una corrispondente diminuzione delle colonie di
Bacteroidetes. Questi dati mettono in risalto l’esistenza
di un forte legame tra composizione del microbioma
intestinale e assorbimento di nutrienti nell’uomo, anche
se queste risultanze dovranno essere confermate da
studi più ampi.
CLINICAL CHEMISTRY HIGHLIGHTS
Il microbioma intestinale è molto importante per il
mantenimento delle funzioni gastrointestinali e immuni,
nonché per la digestione di nutrienti, e ciò è stato
confermato da studi su topi “germ-free” (28-30). Il
microbioma intestinale svolge importanti funzioni
metaboliche tra le quali possiamo annoverare il
catabolismo delle tossine e dei carcinogeni introdotti con
la dieta, la sintesi di micronutrienti, la fermentazione di
sostanze indigeribili presenti negli alimenti e un supporto
per l’assorbimento di elettroliti e minerali. Inoltre, la
produzione di acidi grassi a catena corta (SCFA) da
parte del microbioma intestinale influenza la crescita e la
differenziazione di enterociti e colonociti. Differenze nelle
attività metaboliche del microbioma intestinale possono
poi contribuire alla variazione nell’estrazione di calorie
dalle sostanze ingerite con la dieta, dell’accumulo di
calorie nel tessuto adiposo e della disponibilità
energetica per la proliferazione microbica. Queste
differenze nel microbioma intestinale sono anche
responsabili della variazione nella capacità individuale di
accumulare energia, che potrebbe spiegare alcuni
aspetti dell’obesità. Differenze nella composizione del
microbioma intestinale e nella sua efficienza metabolica
potrebbero infine essere responsabili di una
predisposizione individuale a malattie metaboliche come
obesità e diabete (31).
Il microbioma intestinale può influenzare l’intero
metabolismo corporeo e alterare i parametri fisiologici in
diversi compartimenti corporei (32). In uno studio (33),
topi gnotobiotici presentavano aumentate quantità di
fosfocolina e glicina nel fegato e aumentate quantità di
acidi biliari nell’intestino. Il microbioma intestinale
influenza anche l’omeostasi renale andando a modulare
le quantità di regolatori chiave del volume cellulare come
betaina e colina (33). Uno studio più recente ha mostrato
differenze specifiche nel quadro degli acidi biliari
presenti e ridotta diversità complessiva degli acidi biliari
in ratti “germ-free” rispetto a ratti convenzionali (34).
Infatti, i ratti “germ-free” presentavano aumentate
concentrazioni di acidi biliari coniugati, che possono
accumularsi nel fegato e cuore, rispetto ai ratti controllo.
MiCRoBioMA inTeSTinALe e MeTABoLiSMo
dei CARBoidRATi
I carboidrati costituiscono una fonte nutrizionale
importante per i mammiferi e per il loro microbioma,
compreso il microbiota intestinale. I mammiferi
assorbono gli zuccheri semplici, incluso il galattosio e il
glucosio, nel tratto prossimale del digiuno attraverso
specifici trasportatori. Gli enzimi di mammifero
idrolizzano i dissaccaridi (saccarosio, lattosio, maltosio)
e gli amidi nei loro monosaccaridi costituenti, ma sono
limitati nell’idrolizzare altri polisaccaridi. Come
conseguenza, ogni giorno una grande quantità non
digerita di polisaccaridi di origine vegetale (cellulosa,
xilano e pectina) e amidi parzialmente digeriti arrivano
alle comunità microbiche presenti nell’intestino distale.
Ospitando un microbioma metabolicamente attivo
IL MEGLIO DI CLINICAL CHEMISTRY
capace di idrolizzare carboidrati complessi, i mammiferi
hanno evitato di evolvere enzimi complessi che fossero
capaci di scindere la grande varietà di polisaccaridi
introdotti con la dieta. I microbi presenti nel microbioma
umano, al contrario, contengono molti geni che
codificano una grande quantità di enzimi attivi sui
carboidrati (“carbohydrate-active”, CAzimi) (35). I CAzimi
microbici, che costituiscono l’assortimento dell’ospite nel
mammifero, includono le idrolasi glicosidiche, le esterasi
carboidratiche, le glicosiltransferasi e le liasi
polisaccaridiche (35). I microbi hanno a disposizione
abbondanti fonti di carbonio facilmente fermentabile, che
altrimenti andrebbero perse dall’ospite, e possono
impiegare questi substrati per carboidrati complessi per
sostenere le vitali e funzionalmente robuste comunità
microbiche e per generare segnali bioattivi che possono
influenzare il metabolismo del mammifero.
I tipi batterici intestinali differiscono per la loro
capacità di utilizzare i carboidrati provenienti dalla dieta
o derivanti dall’ospite (componenti del muco) (23, 36). È
stato dimostrato che i Bacteroidetes assimilano
facilmente i carboidrati assunti con l’alimentazione,
perché i batteri appartenenti a questo phylum
possiedono molte vie metaboliche per utilizzare i
carboidrati. In condizioni di mancanza di carboidrati,
però, i batteri intestinali catabolizzano le mucine nel
tratto gastrointestinale come fonte di carboidrati,
compromettendo quindi potenzialmente lo strato di muco
adiacente all’epitelio. Oltre ai Batteroidi, ceppi del
genere Bifidobacterium contengono geni codificanti
enzimi capaci di degradare i glicani, che consentono ai
batteri del microbioma di acquisire nutrienti derivanti dai
glicani dell’ospite (37). Oltre a saper idrolizzare l’amido,
i microbi del microbioma intestinale hanno sviluppato la
capacità di degradare una varietà di glicoconiugati
(glicani), derivanti dall’ospite e da numerose piante, e
glicosamminoglicani, inclusi cellulosa, condroitinsolfato,
acido ialuronico, mucine ed eparina. Gli enzimi catabolici
microbici, come le endoglicosidasi, possono agire sui
substrati della dieta e rilasciare N-glicani complessi da
latte umano e da altre sorgenti di latticini (38).
Fluttuazioni nella dieta possono avere conseguenze
funzionali per i batteri e per l’ospite, con la
“cannibalizzazione” dei carboidrati dell’ospite che può
portare a vantaggi, prevenzione delle malattie o a
predisposizione a differenti stati di malattia. Per
esempio, i bifidobatteri cresciuti sugli oligosaccaridi
umani del latte stabilizzano la formazione delle giunzioni
occludenti nell’epitelio e promuovono la secrezione di
citochine antinfiammatorie, come l’interleuchina-10 (39).
La biogeografia del microbioma potrebbe essere
rilevante perché geni/”pathway” specifici, come i sistemi
fosfotransferasici di trasporto dei carboidrati semplici,
sono molto più abbondanti nell’intestino tenue che nel
colon (40). Studiare quindi le vie metaboliche colpite da
alterazioni nel microbioma intestinale (ad es.,
utilizzazione e immagazzinamento dei carboidrati)
potrebbe portare a una maggiore comprensione del
ruolo dei microbi associati all’uomo nello sviluppo di
biochimica clinica, 2014, vol. 38, n. 6
643
IL MEGLIO DI CLINICAL CHEMISTRY
molti disordini metabolici.
MiCRoBioMA inTeSTinALe e MeTABoLiSMo
degLi ACidi gRASSi
I batteri intestinali inclusi i probiotici producono una
gamma di acidi grassi che potrebbero avere effetti
benefici. I bifidobatteri intestinali producono acido
linoleico coniugato (CLA), che sembra modulare la
composizione degli acidi grassi nel fegato e nel tessuto
adiposo in modelli murini (41). Inoltre, i batteri intestinali
producono anche SCFA (ad es., acetato, butirrato,
propionato) mediante la fermentazione dei carboidrati
presenti nella dieta (fibre), che l’uomo non è in grado di
digerire. Uno studio recente ha dimostrato che topi
“germ-free” non hanno SCFA, indicando l’importanza del
microbioma intestinale per la produzione di SCFA
nell’intestino (42). Il tipo di SCFA dominante nell’uomo è
l’acetato e questo SCFA sembra giocare un ruolo
importante nella modulazione dell’attività della
proteinchinasi 5’AMP-attivata e nell’infiltrazione dei
macrofagi nel tessuto adiposo (43). SCFA come il
propionato possono essere utilizzati per la sintesi de
novo di glucosio o di lipidi e servire come fonte
energetica per l’ospite.
Gli SCFA potrebbero funzionare come segnali
derivanti dai microbi che vanno a influenzare il
metabolismo dei carboidrati e la fisiologia intestinale
stimolando nel mammifero la secrezione di peptidi e
fungendo da fonte di energia per le cellule dell’epitelio
intestinale. Gli SCFA possono stimolare la secrezione
del “glucagon-like peptide 1” (GLP-1) attraverso il
recettore FFAR2 (recettore 2 per gli acidi grassi liberi)
associato alla proteina G, sulla mucosa del colon (44).
Stimolando la secrezione di GLP-1, gli SCFA batterici
mandano un segnale che sopprime la secrezione di
glucagone, induce la secrezione di insulina e promuove
l’omeostasi del glucosio. È stata proposta una “pathway”
enteroendocrinologica nella quale gli SCFA stimolano la
secrezione del peptide YY, un ormone che viene
rilasciato dalle cellule epiteliali dell’ileo e del colon in
risposta all’alimentazione e che sembra sopprimere
l’appetito (45). Una dieta ricca di grassi integrata con
butirrato previene e fa regredire l’insulino-resistenza nei
topi obesi. Al contempo, i batteri che producono butirrato
e lo stesso butirrato nelle feci diminuiscono con una
dieta che contiene un ridotto apporto di carboidrati
specifici (46). Il propionato modula l’omeostasi
energetica promuovendo l’attivazione dei neuroni del
sistema nervoso simpatico mediata da GPR41 (proteina
G associata al recettore 41), contrariamente ai corpi
chetonici (47). L’abilità di modulare la risposta del
sistema simpatico fornisce un altro meccanismo che
collega il microbioma intestinale al sistema nervoso
enterico, al consumo energetico e all’omeostasi
metabolica.
Il bypass gastrico Roux-en-Y (RYGB) è l’intervento
bariatrico maggiormente utilizzato per trattare l’obesità
morbosa. Prima dell’intervento, sono state osservate
quantità aumentate di Bacteroidetes, ma in seguito
644
biochimica clinica, 2014, vol. 38, n. 6
CLINICAL CHEMISTRY HIGHLIGHTS
all’intervento si è registrata una riduzione dei
Bacteroidetes e un aumento dei Proteobatteri (48).
Questi cambiamenti delle popolazioni batteriche
potrebbero modificare i profili metabolici e la quantità
relativa dei differenti acidi grassi, inclusi gli SCFA. Questi
risultati sono supportati da uno studio recente su
modello animale. Ratti non obesi con RYGB
presentavano una quantità minore di Firmicutes e
Bacteroidetes e un aumento significativo di Proteobatteri
(una concentrazione 52 volte maggiore) rispetto ai ratti di
controllo (49). L’obesità è uno stato proinfiammatorio. È
stato dimostrato che l’abbondanza di Faecalibacterium
prausnitzii che produce butirrato è associata
negativamente con i biomarcatori dell’infiammazione
prima e dopo RYGB, indicando che questa specie
batterica potrebbe contribuire al mantenimento dello
stato di salute intestinale (48). Quindi, gli interventi
chirurgici sul tratto gastrointestinale potrebbero avere
effetti marcati sulla composizione del microbioma
intestinale, sulla produzione di SCFA e sul sistema
immunitario di mammifero.
Uno studio recente ha dimostrato che la
somministrazione a livelli sotto-terapeutici di antibiotici
altera la popolazione del microbioma intestinale, come
anche la sua capacità metabolica (50). In questo studio,
i ricercatori hanno somministrato dosi sottoterapeutiche
di antibiotici a topi giovani, causando un aumento
dell’adiposità e dei livelli di incretina GIP-1. Inoltre, i
ricercatori hanno osservato cambiamenti sostanziali
nella tassonomia del microbioma (aumento di
Lachnospiraceae e Firmicutes e diminuzione di
Bacteroidetes), cambiamenti in geni chiave coinvolti nel
metabolismo dei carboidrati per la produzione di SCFA
(aumentati livelli di acetato, propionato e butirrato),
aumento dei livelli di SCFA nel colon e alterazioni nella
regolazione del metabolismo epatico di lipidi e
colesterolo. Quindi, la modulazione dell’omeostasi
metabolica nei topi può essere ottenuta alterando il
microbioma intestinale attraverso trattamenti antibiotici.
MiCRoBioMA inTeSTinALe e MeTABoLiSMo
degLi AMMinoACidi
Alcuni batteri benefici come i bifidobatteri e i
lattobacilli producono composti biologicamente attivi
derivati dagli amminoacidi, incluse numerose ammine
biogeniche. I componenti della dieta includono proteine
e peptidi che possono essere idrolizzati in amminoacidi
da proteinasi e peptidasi presenti nel lume. Gli
amminoacidi che derivano da proteine introdotte con la
dieta possono essere utilizzati come substrati per la
bioconversione effettuata dal microbioma intestinale nel
lume. Diversi enzimi microbici possono contribuire al
metabolismo amminoacidico del mammifero producendo
metaboliti bioattivi nell’intestino. Una classe di tali
enzimi,
le
decarbossilasi
amminoacidiche,
rappresentano gli enzimi prevalenti nel microbioma
intestinale e questi enzimi microbici, quando combinati
con il sistema di trasporto degli amminoacidi, connettono
i composti della dieta con il metabolismo microbico e con
CLINICAL CHEMISTRY HIGHLIGHTS
il “signaling” della mucosa intestinale (Figura 2).
La combinazione delle strategie di metabolomica,
incluse MS, HPLC e NMR, stanno portando
all’identificazione di metaboliti e piccoli composti
derivanti dal microbioma umano. Con l’utilizzo della
cromatografia liquida per interazioni idrofiliche (HILICHPLC) sono state isolate dai microorganismi del
microbioma intestinale svariate molecole bioattive con
proprietà anti-infiammatorie e inibenti il fattore di necrosi
tumorale (TNF). Alcune frazioni HILIC-HPLC sono state
analizzate mediante MS e NMR. Uno di questi segnali
microbici, un’ammina biogenica, l’istamina, è stato
identificato e quantificato in frazioni HILIC-HPLC TNFinibitorie derivanti da Lactobacillus reuteri trovato nel
latte materno e nell’intestino (51). L’istamina è prodotta a
partire da L-istidina da parte dell’istidina decarbossilasi,
che è presente in alcuni batteri fermentanti incluso il
lattobacillo probiotico. Uno dei costituenti il microbioma
intestinale, L. reuteri, è capace di convertire la L-istidina,
componente
della
dieta,
in
un
segnale
immunoregolatorio, l’istamina, che sopprime la
produzione del fattore proinfiammatorio TNF attraverso i
recettori di tipo 2 per l’istamina presenti nell’epitelio
intestinale. Altri esempi del metabolismo amminoacidico
facilitato dai microbi includono la generazione dell’acido
γ-ammino butirrico (GABA) a partire da glutammato da
parte della glutammato decarbossilasi (52) e la
produzione di putrescina da ornitina. L’identificazione di
questi metaboliti batterici bioattivi e dei loro corrispettivi
meccanismi di azione, tenendo in considerazione la
risposta immunomodulatoria, può migliorare le strategie
antiinfiammatorie
per
le
malattie
croniche
immunomediate.
Tali
metaboliti
amminoacidici
antiinfiammatori potrebbero anche migliorare il processo
patologico nell’obesità e nel diabete.
Figura 2.
La flora microbica intestinale può giocare un ruolo importante nelle
interazioni ospite-microbiota attraverso la conversione luminale.
I nutrienti consumati dall’ospite possono essere convertiti dai
microrganismi intestinali in una serie di composti bioattivi che
possono influenzare lo stato di salute o di malattia dell’ospite e
anche del microbiota intestinale.
SCFA, acidi grassi a catena corta. Riprodotta con permesso da
rif. 78.
IL MEGLIO DI CLINICAL CHEMISTRY
MiCRoBioMA inTeSTinALe e MeTABoLiSMo
CoRpoReo: oBeSiTà e inFiAMMAzione
L’incidenza di sovrappeso e obesità ha raggiunto
proporzioni epidemiche. I dati riportati da “Centers of
Disease Control” (CDC) e “National Health and Nutrition
Examination Survey” indicano che, nel 2008, 1,5 miliardi
di adulti erano in sovrappeso e che oltre 200 milioni di
uomini e ~300 milioni di donne erano obese. In generale,
l’obesità nel mondo si è più che duplicata negli ultimi 20
anni, associata a un insieme di malattie metaboliche e
sistemiche come l’insulinoresistenza, il diabete di tipo 2,
la steatosi epatica, l’aterosclerosi e l’ipertensione. La
causa maggiore di obesità è un bilancio energetico
positivo che deriva da un aumento dell’entrata di calorie
con l’alimentazione e una diminuzione del dispendio di
energia associata a una scarsa attività fisica. Non solo lo
squilibrio alimentare e la riduzione dell’attività fisica
portano allo sviluppo dell’obesità, ma anche alcuni tratti
ereditari possono contribuire al suo sviluppo,
provocando differenze nell’accumulo e nel dispendio di
energia. Inoltre, sempre più prove suggeriscono che il
microbioma intestinale contribuisca significativamente
alla risposta dell’ospite ai nutrienti. Lo studio condotto da
Turnbaugh et al. (53) è stato uno dei primi a dimostrare
come il contenuto genico del microbiota potesse
contribuire all’obesità. In tale lavoro sono stati messi a
confronto i microbiomi ottenuti dall’intestino distale di
topi obesi leptina-deficienti (ob/ob) e delle loro
controparti magre (ob/+ e +/+). I ricercatori hanno
riportato che il microbiota presente nei topi ob/ob
conteneva geni che codificano per enzimi che
idrolizzano i polisaccaridi non digeribili introdotti con la
dieta. Infatti, nelle feci dei topi obesi si è trovato un
aumento dei prodotti finali di fermentazione (come
acetato e butirrato) e una diminuzione di calorie. Questi
dati suggerivano che il microbiota intestinale in questi
modelli murini promuove l’estrazione di calorie
addizionali dalla dieta.
La composizione del microbioma intestinale sembra
essere importante per la regolazione del peso corporeo
(54). Per dimostrare ciò, i ricercatori hanno condotto
esperimenti in cui hanno trapiantato il microbiota
intestinale, sia di topi ob/ob che di topi magri, in topi
magri gnotobiotici. Dopo due settimane, i topi che
avevano ricevuto il microbiota dai topi ob/ob erano
capaci di estrarre più calorie dai cibi e mostravano anche
una quantità significativamente maggiore di grasso
rispetto ai topi che avevano ricevuto il microbiota dai topi
magri. Quindi, le differenze nell’estrazione di calorie da
sostanze ingerite con il cibo possono essere largamente
dipendenti dalla composizione del microbiota intestinale.
Questi dati supportano un ruolo fondamentale del
microbiota intestinale nella patogenesi dell’obesità e
delle malattie associate all’obesità.
La manipolazione del microbiota intestinale può
rappresentare un’importante strategia terapeutica per
regolare il bilancio energetico in individui obesi, diabetici
o con diagnosi di sindrome metabolica. In topi
geneticamente obesi ob/ob e nelle loro controparti
biochimica clinica, 2014, vol. 38, n. 6
645
IL MEGLIO DI CLINICAL CHEMISTRY
magre, nutriti con una medesima dieta ricca di
polisaccaridi, Ley et al. (54) hanno analizzato il gene che
codifica per rRNA 16S del microbiota del cieco e visto
che i topi obesi ob/ob hanno meno del 50% di
Bacteroidetes e più Firmicutes rispetto ai topi magri, e
questa differenza non sembrava essere dovuta al
consumo di cibo.
Backhed et al. (55) hanno confermato questi dati e
trovato che i topi giovani, cresciuti in maniera
tradizionale, avevano un contenuto di grasso corporeo
maggiore del 40% e un contenuto di grasso gonadico
superiore del 47% rispetto ai topi “germ-free”, sebbene il
loro consumo di cibo fosse inferiore a quello dei topi
“germ-free”. Quando il microbiota intestinale distale da
topi giovani, allevati in maniera tradizionale, era
trapiantato in topi gnotobiotici si osservava dopo due
settimane un aumento del 60% del grasso corporeo,
senza che aumentasse il consumo di cibo o il dispendio
di energia. Questo aumento di grasso corporeo era
accompagnato da un aumento dell’insulino-resistenza,
dell’ipertrofia adipocitaria e delle concentrazioni di
leptina e glucosio circolanti. Studi mecanistici hanno
dimostrato che il microbiota promuove l’assorbimento
dei monosaccaridi dall’intestino e induce la lipogenesi
epatica
nell’ospite.
Queste
risposte
sono
prevalentemente mediate dall’up-regolazione di due
proteine segnale, ChREBP (“carbohydrate response
element-binding protein”) e SREBP-1 epatica (“sterol
response element-binding protein type-1”). Inoltre, in topi
geneticamente modificati “knockout” per il fattore
adipocitario indotto a digiuno [“fasting-induced adipocyte
factor” (Fiaf)] si è visto che i microbi intestinali
sopprimono il Fiaf intestinale (56).
Diverse ricerche hanno enfatizzato il ruolo
fondamentale dell’infiammazione nei processi metabolici
che portano a sindrome metabolica, obesità e diabete.
Cani et al. (57-59) hanno postulato un altro meccanismo
che collega il microbiota intestinale allo sviluppo
dell’obesità. Gli autori hanno ipotizzato che i
lipopolisaccaridi (LPS) batterici derivati dai batteri Gram
negativi presenti nel microbiota intestinale possano
portare a un aumento dell’infiammazione, come
osservato nella sindrome metabolica indotta da una
dieta ricca di grassi. Attraverso una serie di esperimenti
effettuati su topi sottoposti a una dieta ad alto contenuto
di
grassi,
i
ricercatori
hanno
dimostrato
un’endotossiemia pronunciata, associata a una
riduzione sia dei Gram negativi (Bacteroides-correlati)
sia dei Gram positivi (Eubacterium rectale - Clostridium
coccoides e bifidobatteri), e un aumento del rapporto tra
batteri da Gram negativi e Gram positivi. Gli autori di
questo studio hanno quindi suggerito che
l’endotossiemia metabolica cronica possa indurre
obesità, insulinoresistenza e diabete.
In una serie di esperimenti sull’uomo, Ley et al. (60)
e Ravussin et al. (61) hanno monitorato il microbiota
fecale in 12 individui obesi che hanno partecipato a un
programma di perdita di peso della durata di un anno,
seguendo un regime dietetico a basso contenuto
calorico, con restrizione di grassi o di carboidrati. In
646
biochimica clinica, 2014, vol. 38, n. 6
CLINICAL CHEMISTRY HIGHLIGHTS
modo analogo a ciò che avviene nei topi, è stata
osservata una relativa abbondanza di microbi
appartenenti ai phyla Bacteroidetes e Firmicutes e il
microbiota mostrava una significativa stabilità
intraindividuale nel tempo. Prima di iniziare la dieta a
basso contenuto calorico, era stata osservata una
relativa abbondanza di Firmicutes e una diminuzione dei
Bacteroidetes nei partecipanti obesi se paragonati ai
controlli non obesi. Dopo la perdita di peso è stato
osservato un aumento dei Bacteroidetes (da 3% a 15%)
e una diminuzione dei Firmicutes e tali cambiamenti
erano in relazione alla percentuale di perdita di peso e
non ai cambiamenti nel contenuto calorico della dieta.
Questi studi sull’uomo hanno quindi confermato gli studi
sui modelli animali, suggerendo che l’alterazione della
composizione microbica intestinale possa essere
associata all’obesità. Tuttavia, la precisa relazione tra
causa ed effetto, che lega l’obesità ai cambiamenti della
flora intestinale, è ancora da chiarire. Kalliomäki et al., in
uno studio prospettico effettuato su bambini dalla nascita
a 7 anni di età (62), hanno raccolto campioni fecali a 6 e
12 mesi. Questo studio ha documentato un’abbondanza
del Bifidobacterium e una diminuita proporzione di
Staphylococcus aureus nei bambini che avevano un
peso corporeo entro gli intervalli di riferimento a 7 anni di
età rispetto a quelli sovrappeso o obesi. Sebbene non
siano stati analizzati fattori come dieta e attività fisica,
questo studio ha suggerito che le differenze nella
composizione del microbiota intestinale precedono le
condizioni di sovrappeso e obesità. È stato anche
dimostrato che gli antibiotici agiscono ampiamente sulla
composizione
microbica
intestinale.
Una
somministrazione per 5 giorni di ciproflaxacina per os
diminuisce in modo significativo la diversità della
comunità microbica fecale (63). In questo studio,
sebbene la maggior parte delle comunità microbiche
siano rimaste vitali entro 4 settimane dalla
somministrazione di ciprofloxacina, alcuni generi non
sono più ricomparsi dopo il trattamento antibiotico per
almeno 6 mesi (63).
MiCRoBioMA inTeSTinALe e MeTABoLiSMo:
diABeTe e SindRoMe MeTABoLiCA
I recettori “toll like” (TLR) sono un gruppo di recettori
di riconoscimento importanti nella mediazione
dell’infiammazione e dell’immunità. Pazienti obesi, con
diabete o sindrome metabolica presentano un aumento
dei TLR sulla superficie cellulare (63). Recentemente,
alcuni autori hanno studiato il ruolo del microbioma
intestinale nella regolazione dell’insulinoresistenza
mediata dai recettori TLR. I topi che non hanno un
“pattern” di ricognizione recettoriale microbico TLR5
mostrano iperfagia, diventano obesi e sviluppano segni
di sindrome metabolica, incluse ipertensione,
ipercolesterolemia e insulinoresistenza secondaria ad
alterata regolazione del “signaling” dell’interleuchina-1β
(43). Quando i microbi intestinali di questi topi vengono
trapiantati in topi “germ-free” con il gene per il recettore
“toll like” 5 (TLR5) intatto, i topi riceventi sviluppano
CLINICAL CHEMISTRY HIGHLIGHTS
segni di sindrome metabolica, suggerendo che il
microbioma intestinale possa essere determinante della
malattia. In un altro studio, è stato visto che topi senza
TLR2 sviluppano obesità, insulinoresistenza e
intolleranza al glucosio, e che il microbioma intestinale di
questi topi ha grande abbondanza di Firmicutes e meno
Actinobatteri del genere Bifidobacterium (64). La
somministrazione di una miscela di antibiotici elimina la
maggior parte dei Firmicutes migliorando l’attività
insulinica e la tolleranza al glucosio. Oltre a migliorare
attività insulinica e tolleranza al glucosio, bassi livelli di
Bifidobacterium contribuiscono ad aumentare la
permeabilità intestinale e questo potrebbe causare un
aumento della concentrazione di endotossine circolanti,
come i LPS. Il sistema immunitario riconosce LPS come
componenti microbiche e attiva il “signaling” TLR
scatenando l’infiammazione. Sia obesità che
infiammazione tendono a causare diabete, e quindi la
perdita di TLR2 in questi topi, modificando la
composizione dei loro batteri intestinali, si traduce in un
aumentato rischio di sviluppare diabete mellito. Un
aumento delle quantità di TLR2 è stato osservato nei
monociti di pazienti con sindrome metabolica e con
diabete di tipo 1 e tipo 2 rispetto ai controlli (65-72).
L’assenza di TLR2 in topi diabetici porta a una
diminuzione delle complicanze diabetiche come la
nefropatia (68). Probabilmente, il microbioma intestinale
gioca un ruolo fondamentale nella regolazione delle
vasculopatie diabetiche e questa sarà un’importante
area per studi futuri.
Tenendo in considerazione il ruolo svolto dal
microbioma nella sindrome metabolica e nelle anomalie
associate, studi effettuati su topi “germ-free” hanno
dimostrato che quando questi topi sono sottoposti a una
dieta occidentale ricca di grassi, sono protetti da obesità,
insulinoresistenza, dislipidemia e steatosi epatica (69).
Al contrario, in seguito alla colonizzazione con il
microbiota proveniente da topi allevati in maniera
tradizionale, si assiste a un aumento del 60% in 14 giorni
del contenuto di grasso corporeo nei topi
originariamente “germ-free”. Questo dato è stato
associato a un aumento dell’insulinoresistenza,
nonostante il consumo di cibo fosse ridotto. La sindrome
metabolica colpisce un americano su tre e porta a un
aumento della propensione a sviluppare diabete e
malattie cardiovascolari (70). In un unico studio condotto
sull’uomo, in pazienti con sindrome metabolica,
Zupancic et al. (71) hanno valutato un gruppo di uomini
e donne Amish con diversi indici di massa corporea. In
310 partecipanti allo studio è stato analizzato il
microbiota intestinale mediante pirosequenziamento
profondo di prodotti di “polymerase chain reaction”
(PCR) dalle regioni V1-V3 del gene che codifica per
rRNA 16S. Questa analisi ha portato all’identificazione di
tre comunità batteriche interagenti all’interno del
microbiota intestinale, analoghe agli enterotipi intestinali
precedentemente identificati. L’analisi dei “network”
identificava 22 specie di batteri e 4 unità tassonomiche
operazionali,
correlate
sia
positivamente
sia
inversamente a segni di sindrome metabolica,
IL MEGLIO DI CLINICAL CHEMISTRY
suggerendo la possibilità che alcuni membri del
microbiota intestinale contribuiscano allo sviluppo di tale
sindrome. È importante che gli studi futuri si concentrino
sul definire quelle componenti specifiche del microbioma
intestinale che contribuiscono allo sviluppo di obesità
viscerale, iperglicemia, dislipidemia, ipertensione e
insulinoresistenza in questa patologia (71). La steatosi
epatica non alcolica rappresenta la manifestazione
epatica della sindrome metabolica ed è la causa
preminente dell’epatopatia cronica nel mondo
occidentale. Utilizzando diversi modelli murini privi di
inflammasoma, come topi che non hanno Asc
(“apoptosis-associated speck-like protein containing a
caspase recruitment domain”), NLRP3 (“nucleotidebinding domain, leucine rich family, pyrin containing 3”),
caspasi o interleuchina 18, gli autori hanno dimostrato
un’alterazione significativa del microbiota intestinale,
come evidenziato dall’aumento di Bacteroidetes e dalla
diminuzione di Firmicutes in questi modelli murini. Sono
state osservate una steatosi epatica e un’infiammazione
più severe, come evidenziato dall’aumento dei TLR
(soprattutto TLR4 e 9) e dalla secrezione di TNF-α
epatico. Da sottolineare che gli autori hanno speculato
che l’aumento della steatosi epatica fosse dovuto alla
produzione di batteri intestinali, che agirebbero come
agonisti per TLR4 e 9 ed entrerebbero nel fegato
attraverso la circolazione portale (72). Inoltre, si è visto
che questi cambiamenti patologici esasperano steatosi
epatica e obesità (72) e che quindi l’alterazione delle
interazioni tra microbiota intestinale e ospite, dovuta a un
difetto della sensibilità dell’inflammasoma, potrebbe
controllare la progressione delle molteplici anomalie
associate alla sindrome metabolica.
I microbiomi intestinali sono anche stati studiati in
relazione all’insulinoresistenza in pazienti con diabete di
tipo 2. Utilizzando la tecnica di sequenziamento “deep
tag-encoded”, Larsen et al. hanno visto che in adulti con
diabete di tipo 2 c’è una significativa riduzione di
Firmicutes e Clostridia (73). Inoltre, i rapporti tra
Bacteroidetes e Firmicutes e Bacteroideti-Prevotella e C.
coccidi-Eubacterium rectale erano correlati a un aumento
della glicemia a digiuno in questi pazienti. In questo
studio, Larsen et al. hanno dimostrato che, insieme alla
diminuzione dei Firmicutes, aumentano in modo
significativo i livelli di Bacteroidetes nei pazienti diabetici,
quando confrontati ai controlli non diabetici, e che la loro
abbondanza correla significativamente con le concentrazioni di glucosio plasmatiche (r=0,46, P <0,05)
(73). Questi dati sono molto interessanti e spingono a
chiedersi come la composizione microbica e i rispettivi
metaboliti possano influenzare il metabolismo dell’intero
organismo umano e contribuire all’insulinoresistenza e al
diabete.
È molto interessante il fatto che il microbioma
intestinale possa regolare anche il diabete di tipo 1. Il
diabete di tipo 1 è una malattia autoimmune,
caratterizzata da uno stato di insulinopenia causato dalla
distruzione specifica delle β cellule del pancreas
endocrino deputate alla secrezione di insulina. Il diabete
di tipo 1 predispone anche allo sviluppo di complicanze
biochimica clinica, 2014, vol. 38, n. 6
647
CLINICAL CHEMISTRY HIGHLIGHTS
IL MEGLIO DI CLINICAL CHEMISTRY
microvascolari e macrovascolari. Sono emersi dati sul
ruolo critico svolto dal microbiota gastrointestinale nella
protezione o nello sviluppo del diabete di tipo 1 (74). In
due modelli di diabete, il topo NOD (diabetico non obeso)
e il ratto “biobreeding” (BB), l’incidenza del diabete di tipo
1 spontaneo può essere influenzata sia dall’ambiente
microbico nello stabulario o dall’esposizione a stimoli
microbici (75). Inoltre, l’identificazione di determinanti
batterici presenti nel microbiota intestinale può favorire lo
sviluppo di diabete di tipo 1. I TLR sono recettori del
“pattern” di riconoscimento dell’immunità innata, coinvolti
nella difesa dell’ospite e nel mantenimento dell’integrità
tissutale. Il “signaling” dei TLR è mediato dalla proteina
adattatrice MyD88, e la delezione di MyD88 protegge
dall’ateroscleresi. I topi che non hanno MyD88 sono
protetti dall’insulite (74) e questo fenomeno dipende dai
microbi commensali perché i topi “germ-free” e
“knockout” per MyD88 sviluppano un tipo di diabete
permanente.
Nei ratti BB (un modello di diabete di tipo 1), le specie
di Lactobacillus presenti nelle feci (L. johnsonii e L.
reuteri) sono correlate negativamente allo sviluppo di
diabete di tipo 1 (76), forse attraverso la modulazione
delle proteine della mucosa intestinale e attraverso la
risposta allo stress ossidativo con produzione di basse
quantità di citochine proinfiammatorie, come l’interferone
γ. Quindi, la modulazione terapeutica che mira ad
alterare
il
microbioma
intestinale
potrebbe
beneficamente ritardare lo sviluppo del diabete.
Alterazioni nel microbioma intestinale possono
anche contribuire allo sviluppo di malattie autoimmuni
come il diabete di tipo 1. Sono stati ottenuti dei campioni
fecali da 4 coppie di partecipanti, appaiate in uno studio
caso-controllo (77). Sono state analizzate più di 30
miliardi di basi nucleotidiche da dati metagenomici
ottenuti con Illumina e i risultati hanno mostrato un
significativo aumento delle vie metaboliche e dei moduli
coinvolti nel metabolismo dei carboidrati e nella risposta
allo stress, nei casi rispetto ai controlli. Altre differenze
che sono state riscontrate includevano la quantità
relativa di geni coinvolti nell’adesione, nella motilità e nel
metabolismo dello zolfo, molto più abbondanti nei casi,
mentre i geni coinvolti nel metabolismo del DNA e delle
proteine, nella sintesi degli amminoacidi e nella
respirazione aerobica erano molto più abbondanti nei
soggetti controllo. I dati del rRNA 16S sono stati utilizzati
per avere indicazioni sui cambiamenti della
composizione microbica. A livello di phylum, le quantità
di Actinobacteria, Bacteroidetes e Proteobacteria erano
significativamente aumentate nei casi, mentre
Firmicutes,
Fusobacteria,
Tenericutes
e
Verrucomicrobia erano alti nei controlli (P <0,001). A
livello di genere, la quantità di Bacteroides era molto
maggiore nei casi, mentre Prevotella era molto più
abbondante nei controlli. Inoltre, il numero totale di
batteri che producono acido lattico e butirrato era
maggiore nei controlli rispetto ai casi. Quindi, questi dati
suggeriscono che i batteri che producono lattato e
butirrato possono avere effetti benefici e mantenere in
salute l’intestino, e che il turbamento degli equilibri tra tali
648
biochimica clinica, 2014, vol. 38, n. 6
batteri può portare alla riduzione della sintesi ottimale di
mucina, come riscontrato in individui con malattie
autoimmuni, e contribuire allo sviluppo del diabete di tipo
1. Questi risultati entusiasmanti necessitano comunque
di ulteriori conferme in studi su popolazioni più
numerose.
In conclusione, studi clinici randomizzati dovranno
aiutare a definire le caratteristiche del microbioma
intestinale che contribuiscono allo sviluppo dell’obesità e
del diabete in determinate popolazioni. Inoltre, studi
mecanistici del microbioma umano potrebbero portare a
importanti
ricadute
terapeutiche. Ancora,
gli
avanzamenti delle tecnologie per lo studio delle malattie
metaboliche, come il sequenziamento del rRNA 16S, la
metagenomica WG e la metabolomica, potranno aiutare
i ricercatori a estrarre molti dati utili alla caratterizzazione
delle malattie. Le risorse bioinformatiche e i grandi
“database”, come quelli derivanti dal Progetto
Microbioma Umano, porteranno a una maggiore
comprensione dell’importanza e del ruolo del
microbioma intestinale nello sviluppo di malattie
metaboliche come obesità, sindrome metabolica e
diabete, con sviluppo di strategie terapeutiche per
ridurre l’impatto delle malattie cardiometaboliche nella
popolazione.
gLoSSARio
“germ-free” – Animali senza microorganismi che
vivono dentro o sopra di loro. Sono generalmente
utilizzati nelle ricerche di tipo probiotico, nelle quali è
richiesto un controllo rigoroso dei possibili contaminanti
esterni.
gnotobiotico (“gnotobiotic”) – Il termine fa
riferimento ad animali con microbiota noto, che sono
derivati da animali senza microorganismi. Tali animali
sono utilizzati per studiare le funzioni del microbiota
normale.
inflammasoma (“inflammasome”) – Uno di un
gruppo di complessi multiproteici citosolici (NALP1,
NALP2/3) che mediano una risposta proinfiammatoria
attraverso
l’attivazione
dell’interleuchina-1β
e
dell’interleuchina 18. Come i recettori “toll-like”, si ritiene
che gli inflammasomi riconoscano specifici modelli
molecolari associati ai patogeni.
Meccanistico (“Mechanistic”) – Fondato sul
meccanicismo. In generale, concezione di tipo
materialistico che tende a spiegare le proprietà degli
oggetti e dei processi del mondo fisico in termini
esclusivamente meccanici, cioè sulla base di concetti
connessi con la materia e il movimento.
Metabonomica (“Metabonomics”) – Può essere
definita come una determinazione sistematica, completa
e simultanea delle concentrazioni di metaboliti presenti
in un organismo e della loro variazione temporale, come
conseguenza di stimoli, quali modifiche genetiche o
fisiologiche, che possono provenire da diverse fonti:
dieta, stile di vita, stato dell'ambiente, assunzione di
farmaci. Principalmente è basata sullo studio di biofluidi
e tessuti. La definizione di metabonomica fa riferimento
IL MEGLIO DI CLINICAL CHEMISTRY
CLINICAL CHEMISTRY HIGHLIGHTS
non solo a tecniche analitiche specifiche, quali la MS o
la spettroscopia NMR, ma anche all'impiego di
metodologie multivariate di analisi dei dati
(chemiometria).
19.
ConFLiTTo di inTeReSSi
20.
Nessuno.
BiBLiogRAFiA
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
Cowie CC, Rust KF, Ford ES, et al. Full accounting of
diabetes and pre-diabetes in the U.S. population in 19881994 and 2005-2006. Diabetes Care 2009;32:287–94.
D'Adamo E, Santoro N, Caprio S. Metabolic syndrome in
pediatrics: old concepts revised, new concepts discussed.
Pediatr Clin North Am 2011;58:1241–55.
Backhed F. Host responses to the human microbiome.
Nutr Rev 2012;70(suppl 1):S147.
Tehrani AB, Nezami BG, Gewirtz A, et al. Obesity and its
associated
disease:
a
role
for
microbiota?
Neurogastroenterol Motil 2012;24:305–11.
Harris K, Kassis A, Major G, et al. Is the gut microbiota a
new factor contributing to obesity and its metabolic
disorders? J Obes 2012;2012:879151.
Kibe R, Sakamoto M, Hayashi H, et al. Maturation of the
murine cecal microbiota as revealed by terminal restriction
fragment length polymorphism and 16S rRNA gene clone
libraries. FEMS Microbiol Lett 2004;235:139–46.
Turnbaugh PJ, Gordon JI. The core gut microbiome,
energy balance and obesity. J Physiol 2009;587:4153–8.
Caporaso JG, Lauber CL, Walters WA, et al. Global
patterns of 16S rRNA diversity at a depth of millions of
sequences per sample. Proc Natl Acad Sci USA
2010;108(suppl 1):4516–22.
Turnbaugh PJ, Hamady M, Yatsunenko T, et al. A core gut
microbiome in obese and lean twins. Nature
2009;457:480–4.
The Human Microbiome Project Consortium. Structure,
function and diversity of the healthy human microbiome.
Nature 2012;486:207–14.
The Human Microbiome Project Consortium. A framework
for
human
microbiome
research.
Nature
2012;486:215–21.
Chan EC, Pasikanti KK, Nicholson JK. Global urinary
metabolic profiling procedures using gas chromatographymass spectrometry. Nat Protoc 2011;6:1483–99.
Verberkmoes NC, Russell AL, Shah M, et al. Shotgun
metaproteomics of the human distal gut microbiota. ISME
J 2009;3:179–89.
Nicholson JK, Lindon JC, Holmes E. ‘Metabonomics’:
understanding the metabolic responses of living systems
to pathophysiological stimuli via multivariate statistical
analysis of biological NMR spectroscopic data.
Xenobiotica 1999;29:1181–9.
Wikoff WR, Anfora AT, Liu J, et al. Metabolomics analysis
reveals large effects of gut microflora on mammalian
blood metabolites. Proc Natl Acad Sci USA
2009;106:3698–703.
Nicholson JK, Connelly J, Lindon JC, et al. Metabonomics:
a platform for studying drug toxicity and gene function. Nat
Rev Drug Discov 2002;1:153–61.
Holmes E, Loo RL, Stamler J, et al. Human metabolic
phenotype diversity and its association with diet and blood
pressure. Nature 2008;453:396–400.
Brindle JT, Antti H, Holmes E, et al. Rapid and noninvasive
diagnosis of the presence and severity of coronary heart
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
disease using 1H-NMR-based metabonomics. Nat Med
2002;8:1439–44.
Dumas ME, Wilder SP, Bihoreau MT, et al. Direct
quantitative trait locus mapping of mammalian metabolic
phenotypes in diabetic and normoglycemic rat models.
Nat Genet 2007;39:666–72.
Stella C, Beckwith-Hall B, Cloarec O, et al. Susceptibility
of human metabolic phenotypes to dietary modulation. J
Proteome Res 2006;5:2780–8.
Neish AS. Microbes in gastrointestinal health and disease.
Gastroenterology 2009;136:65–80.
Hooper LV, Gordon JI. Commensal host-bacterial
relationships in the gut. Science 2001;292:1115–8.
Sonnenburg ED, Zheng H, Joglekar P, et al. Specificity of
polysaccharide use in intestinal bacteroides species
determines diet-induced microbiota alterations. Cell
2010;141:1241–52.
Nicholson JK, Holmes E, Kinross J, et al. Host-gut
microbiota
metabolic
interactions.
Science
2012;336:1262–7.
Clement K. Bariatric surgery, adipose tissue and gut
microbiota. Int J Obes 2011;35(suppl 3):S7–15.
Calvani R, Miccheli A, Capuani G, et al. Gut microbiomederived metabolites characterize a peculiar obese urinary
metabotype. Int J Obes 2010;34:1095–8.
Jumpertz R, Le DS, Turnbaugh PJ, et al. Energy-balance
studies reveal associations between gut microbes, caloric
load, and nutrient absorption in humans. Am J Clin Nutr
2011;94:58–65.
Gravitz L. Microbiome: the critters within. Nature
2012;485:S12–3.
Tilg H, Kaser A. Gut microbiome, obesity, and metabolic
dysfunction. J Clin Invest 2011;121:2126–32.
Faith JJ, McNulty NP, Rey FE, et al. Predicting a human
gut microbiota's response to diet in gnotobiotic mice.
Science 2011;333:101–4.
Kallus SJ, Brandt LJ. The intestinal microbiota and
obesity. J Clin Gastroenterol 2011;46:16–24.
Zhao L, Shen J. Whole-body systems approaches for gut
microbiota-targeted, preventive healthcare. J Biotechnol
2010;149:183–90.
Claus SP, Tsang TM, Wang Y, et al. Systemic
multicompartmental effects of the gut microbiome on
mouse metabolic phenotypes. Mol Syst Biol 2008;4:219.
Swann JR, Want EJ, Geier FM, et al. Systemic gut
microbial modulation of bile acid metabolism in host tissue
compartments. Proc Natl Acad Sci USA 2010;108(suppl
1):4523–30.
Cantarel BL, Lombard V, Henrissat B. Complex
carbohydrate utilization by the healthy human
microbiome. PLoS One 2012;7:e28742.
Sonnenburg JL, Xu J, Leip DD, et al. Glycan foraging in
vivo by an intestine-adapted bacterial symbiont. Science
2005;307:1955–9.
Turroni F, Bottacini F, Foroni E, et al. Genome analysis of
Bifidobacterium bifidum PRL2010 reveals metabolic
pathways for host-derived glycan foraging. Proc Natl Acad
Sci USA 2010;107:19514–9.
Garrido D, Nwosu C, Ruiz-Moyano S, et al. Endo-beta-Nacetylglucosaminidases from infant-gut associated
bifidobacteria release complex N-glycans from human
milk glycoproteins. Mol Cell Proteomics 2012;11:775–85.
Chichlowski M, De Lartigue G, German JB, et al.
Bifidobacteria isolated from infants and cultured on human
milk oligosaccharides affect intestinal epithelial function. J
Pediatr Gastroenterol Nutr 2012;55:321–7.
Zoetendal EG, Raes J, van den Bogert B, et al. The
human small intestinal microbiota is driven by rapid uptake
biochimica clinica, 2014, vol. 38, n. 6
649
CLINICAL CHEMISTRY HIGHLIGHTS
IL MEGLIO DI CLINICAL CHEMISTRY
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
650
and conversion of simple carbohydrates. ISME J
2012;6:1415–26.
O'Shea EF, Cotter PD, Stanton C, et al. Production of
bioactive substances by intestinal bacteria as a basis for
explaining probiotic mechanisms: bacteriocins and
conjugated linoleic acid. Int J Food Microbiol
2012;152:189–205.
Martin FP, Wang Y, Sprenger N, et al. Probiotic modulation
of symbiotic gut microbial-host metabolic interactions in a
humanized microbiome mouse model. Mol Syst Biol
2008;4:157.
Carvalho BM, Guadagnini D, Tsukumo DM, et al.
Modulation of gut microbiota by antibiotics improves
insulin signalling in high-fat fed mice. Diabetologia
2012;55:2823–34.
Tolhurst G, Heffron H, Lam YS, et al. Short-chain fatty
acids stimulate glucagon-like peptide-1 secretion via the
G-protein-coupled
receptor
FFAR2.
Diabetes
2012;61:364–71.
Zhou J, Hegsted M, McCutcheon KL, et al. Peptide YY
and proglucagon mRNA expression patterns and
regulation in the gut. Obesity 2006;14:683–9.
Gao Z, Yin J, Zhang J, et al. Butyrate improves insulin
sensitivity and increases energy expenditure in mice.
Diabetes 2009;58:1509–17.
Kimura I, Inoue D, Maeda T, et al. Short-chain fatty acids
and ketones directly regulate sympathetic nervous system
via G protein-coupled receptor 41 (GPR41). Proc Natl
Acad Sci USA 2011;108:8030–5.
Furet JP, Kong LC, Tap J, et al. Differential adaptation of
human gut microbiota to bariatric surgery-induced weight
loss: links with metabolic and low-grade inflammation
markers. Diabetes 2010;59:3049–57.
Li JV, Ashrafian H, Bueter M, et al. Metabolic surgery
profoundly influences gut microbial-host metabolic crosstalk. Gut 2011;60:1214–23.
Cho I, Yamanishi S, Cox L, et al. Antibiotics in early life
alter the murine colonic microbiome and adiposity. Nature
2012;30:621–6.
Thomas CM, Hong T, van Pijkeren JP, et al. Histamine
derived from probiotic lactobacillus reuteri suppresses
TNF via modulation of PKA and ERK signaling. PLoS One
2012;7:e31951.
Kim JY, Chung EJ, Kim JH, et al. Response to steroid
treatment in anti-glutamic acid decarboxylase antibodyassociated cerebellar ataxia, stiff person syndrome and
polyendocrinopathy. Mov Disord 2006;21:2263–4.
Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesityassociated gut microbiome with increased capacity for
energy harvest. Nature 2006;444:1027–31.
Ley RE, Backhed F, Turnbaugh P, et al. Obesity alters gut
microbial ecology. Proc Natl Acad Sci USA
2005;102:11070–5.
Backhed F, Manchester JK, Semenkovich CF, et al.
Mechanisms underlying the resistance to diet-induced
obesity in germ-free mice. Proc Natl Acad Sci USA
2007;104:979–84.
Greiner T, Backhed F. Effects of the gut microbiota on
obesity and glucose homeostasis. Trends Endocrinol
Metab 2011;22:117–23.
Delzenne NM, Neyrinck AM, Backhed F, et al. Targeting
gut microbiota in obesity: effects of prebiotics and
probiotics. Nat Rev Endocrinol 2011;7:639–46.
Cani PD, Delzenne NM. Involvement of the gut microbiota
in the development of low grade inflammation associated
with obesity: focus on this neglected partner. Acta
Gastroenterol Belg 2010;73:267–9.
Cani PD, Delzenne NM. Interplay between obesity and
associated metabolic disorders: new insights into the gut
biochimica clinica, 2014, vol. 38, n. 6
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
microbiota. Curr Opin Pharmacol 2009;9:737–43.
Ley RE. Obesity and the human microbiome. Curr Opin
Gastroenterol 2009;26:5–11.
Ravussin Y, Koren O, Spor A, et al. Responses of gut
microbiota to diet composition and weight loss in lean and
obese mice. Obesity 2011;20:738–47.
Kalliomaki M, Collado MC, Salminen S, et al. Early
differences in fecal microbiota composition in children may
predict overweight. Am J Clin Nutr 2008;87:534–8.
Dethlefsen L, Relman DA. Incomplete recovery and
individualized responses of the human distal gut
microbiota to repeated antibiotic perturbation. Proc Natl
Acad Sci USA 2010;108(suppl 1):4554–61.
Caricilli AM, Picardi PK, de Abreu LL, et al. Gut microbiota
is a key modulator of insulin resistance in TLR 2 knockout
mice. PLoS Biol 2011;9:e1001212.
Dasu MR, Devaraj S, Park S, et al. Increased toll-like
receptor (TLR) activation and TLR ligands in recently
diagnosed type 2 diabetic subjects. Diabetes Care
2010;33:861–8.
Jialal I, Huet BA, Kaur H, et al. Increased toll-like receptor
activity in patients with metabolic syndrome. Diabetes
Care 2012;35:900–4.
Creely SJ, McTernan PG, Kusminski CM, et al.
Lipopolysaccharide activates an innate immune system
response in human adipose tissue in obesity and type 2
diabetes.
Am
J
Physiol
Endocrinol
Metab
2007;292:E740–7.
Devaraj S, Tobias P, Kasinath BS, et al. Knockout of tolllike receptor-2 attenuates both the proinflammatory state
of diabetes and incipient diabetic nephropathy.
Arterioscler Thromb Vasc Biol 2011;31:1796–804.
Frazier TH, DiBaise JK, McClain CJ. Gut microbiota,
intestinal permeability, obesity-induced inflammation, and
liver injury. J Parenter Enteral Nutr 2011;35:14S-20S.
Alberti KG, Eckel RH, Grundy SM, et al. Harmonizing the
metabolic syndrome: a joint interim statement of the
International Diabetes Federation Task Force on
Epidemiology and Prevention; National Heart, Lung, and
Blood Institute; American Heart Association; World Heart
Federation; International Atherosclerosis Society; and
International Association for the Study of Obesity.
Circulation 2009;120:1640–5.
Zupancic ML, Cantarel BL, Liu Z, et al. Analysis of the gut
microbiota in the old order Amish and its relation to the
metabolic syndrome. PLoS One 2012;7:e43052.
Henao-Mejia J, Elinav E, Jin C, et al. Inflammasomemediated dysbiosis regulates progression of NAFLD and
obesity. Nature 2012;482:179–85.
Larsen N, Vogensen FK, van den Berg FW, et al. Gut
microbiota in human adults with type 2 diabetes differs
from non-diabetic adults. PLoS One 2010;5:e9085.
Wen L, Ley RE, Volchkov PY, et al. Innate immunity and
intestinal microbiota in the development of type 1
diabetes. Nature 2008;455:1109–13.
Pozzilli P, Signore A, Williams AJ, et al. NOD mouse
colonies around the world–recent facts and figures.
Immunol Today 1993;14:193–6.
Valladares R, Sankar D, Li N, et al. Lactobacillus johnsonii
N6.2 mitigates the development of type 1 diabetes in BBDP rats. PLoS One 2010;5:e10507.
Brown CT, Davis-Richardson AG, Giongo A, et al. Gut
microbiome metagenomics analysis suggests a functional
model for the development of autoimmunity for type 1
diabetes. PLoS One 2011;6:e25792.
Hemarajata P, Versalovic J. Effects of probiotics on gut
microbiota: mechanisms of intestinal immunomodulation
and neuromodulation. Therap Adv Gastroenterol.
2013;6:39–51.