Decomposizione
bicarbonatodidisodio
sodio
Decomposizione del
del bicarbonato
cd-rom
LAB 03.pdf
in sintesi
1 ora
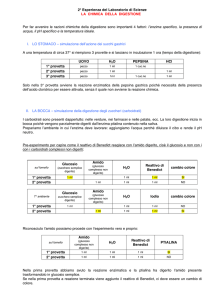
Si riscalda in provetta un campione di NaHCO3 , controllando la perdita
di massa e correlandola alla reazione di decomposizione.
esperienze introduttive
LAB50
3
LAB
a proposito di...
Il riscaldamento di alcune sostanze ne provoca la decomposizione in
sostanze piuÁ semplici. La stechiometria delle possibili reazioni si puoÁ
stabilire attraverso la misura delle variazioni di massa avvenute.
Nel caso di NaHCO3 si osserva che il riscaldamento provoca la formazione di vapori, che condensano sulla parte fredda della provetta,
e di un residuo cristallino bianco. Le ipotesi sulla possibile reazione
di decomposizione sono:
Due di queste reazioni giustificano la condensa dei vapori perche sviluppano acqua, ma resta da scegliere qual eÁ quella che si verifica. Nota la massa iniziale di NaHCO3, si puoÁ prevedere, in base alla diversa
stechiometria delle tre reazioni scritte sopra, la massa del residuo solido derivante da ciascuna di esse. Il confronto col dato effettivamente
ottenuto consente di individuare quale reazione eÁ effettivamente avvenuta.
strumenti di lavoro
Il bunsen va
utilizzato
sempre sotto
cappa aspirante
provette
bilancia
pinze di legno per provette
bunsen
materiali e sostanze
NaHCO3 puro
procedimento
Pesare la provetta vuota, pulita e asciutta.
Pesare nella provetta da 1 a 2 g di NaHCO3 solido.
Riscaldare cautamente il fondo della provetta, tenendola con le
pinze; quando la provetta eÁ ben calda, estendere il riscaldamento a
tutta la provetta in modo da eliminare completamente il liquido
condensato sulla parte superiore.
Osservare i fenomeni che accompagnano le diverse fasi del
riscaldamento.
Lasciare raffreddare all'aria (o meglio, in essiccatore) e determinare
la massa totale.
... per concludere
Calcolare la massa del residuo solido nella provetta.
Calcolare, per ognuna delle reazioni scritte sopra, la massa del solido
che si otterrebbe dalla quantitaÁ iniziale di NaHCO3.
Confrontare i risultati dei calcoli con il valore effettivamente
misurato.
La riproduzione
tramite
fotocopie
eÁ autorizzata
ai soli fini dell'utilizzo nell'attivitaÁ didattica dagli insegnanti che hanno adottato il testo.
Copyright
© 2012
Zanichelli
Editore
SpA, Bologna
Questo file è una estensione online dei corsi di chimica di Rubino, Venzaghi, Cozzi
33
LAB 3 Decomposizione del bicarbonato di sodio
2 NaHCO3 ! Na2O + H2O + 2 CO2
NaHCO3 ! NaOH + CO2
2 NaHCO3 ! Na2CO3 + H2O + CO2