I PRINCIPI DELLA
TERMODINAMICA
Liceo scientifico “ M. Curie”
Savignano s R.
Termodinamica - alcune definizioni
La termodinamica è quella branca della fisica che descrive le
trasformazioni subite da un sistema macroscopico a seguito di
uno scambio di energia con altri sistemi o con l'ambiente. I principi
della termodinamica sono di importanza fondamentale in ogni
campo della scienza e della tecnica.
La termodinamica studia l’evoluzione di sistemi fisico-chimici
tenendo conto degli scambi di energia in tutte le forme che
possono verificarsi fra sistema ed ambiente esterno; fornisce un
bilancio energetico dei fenomeni termici e ne indica il senso di
evoluzione.
La parola 'termodinamica' (da therme [calore] e dynamis
[potenza]), inizialmente coniata per sintetizzare lo sforzo di
trasformare il calore in potenza (lavoro), oggi compendia tutte le
forme dell’energia e le sue trasformazioni; fanno parte
dell’indagine: produzione di potenza, refrigerazione, cambiamenti
di stato di aggregazione della materia, reazioni chimiche...
La termodinamica si basa sul concetto di sistema
macroscopico (o sistema termodinamico), definito come
una porzione di materia geometricamente individuata, che
esiste in un ambiente infinito e imperturbabile. Lo stato di
un sistema macroscopico in equilibrio è specificato dal
valore che assumono determinate grandezze, come
temperatura, pressione e volume, dette variabili
termodinamiche o variabili di stato.
Quando un sistema macroscopico passa da uno stato di
equilibrio a un altro si dice che ha luogo una
trasformazione termodinamica.
Alcune trasformazioni sono reversibili, altre irreversibili.
I principi della termodinamica, scoperti nel XIX secolo,
regolano tutte le trasformazioni termodinamiche e ne
fissano i limiti.
In Termodinamica classica la descrizione dei sistemi non
viene fatta usando variabili quali massa, velocità, quantità
di moto, ecc.. (che caratterizzano lo stato meccanico delle
particelle costituenti i sistemi stessi), ma tramite altre
variabili, chiamate coordinate termodinamiche o
coordinate macroscopiche, quali
VOLUME, TEMPERATURA, PRESSIONE,
ecc...
Sappiamo che in presenza di attriti l’energia non si conserva
Questa energia però non va persa ma la si ritrova sottoforma di
energia interna
La termodinamica studia lo scambio calore – lavoro con
l’ambiente esterno.
Termodinamica
calore
lavoro
Un sistema è un insieme di oggetti
che possono essere separati dal
Calore resto dell’universo da una superficie
ideale chiusa
lavoro
Sistema
termodinamico
Ambiente
Il motore di un’auto, le stelle di una
galassia,il gas contenuto in un recipiente,
il nostro corpo,.. Sono sistemi che
scambiano calore con l’esterno
Definiamo ambiente termodinamico la
materia che non fa parte del sistema e
che, interagendo con esso, ne determina
l'evoluzione fisica.
Definiamo superficie di contorno di un
sistema termodinamico la superficie di
separazione fra il sistema e l'ambiente.
Un sistema termodinamico, a seconda delle
interazioni che può avere o no con i corpi che lo
circondano (cioè con l'ambiente circostante), può
essere:
aperto, se può scambiare sia materia che energia;
chiuso,
se
può
scambiare
solo
energia;
isolato, se non può scambiare nè materia nè
energia.
Tra i sistemi isolati, d'ora in poi chiameremo universo
(senza alcuna implicazione cosmica) l'insieme del sistema e
del suo ambiente, intendendo con questo tutto ciò che ha
interagito (più o meno direttamente) con il sistema stesso.
Sistema e ambiente costituiscono quindi l'universo
termodinamico.
La descrizione di un sistema termodinamico risulterà più o
meno complessa a seconda della sua composizione. I
sistemi più facili da trattare sono i sistemi chiusi e costituiti
da una sola sostanza, omogenea e pura. Tali sistemi
possono essere descritti da tre sole coordinate
macroscopiche.
Esiste sempre un legame fra le
variabili che descrivono un sistema
ovvero l’equazione di stato.
Pertanto il numero delle coordinate
necessarie a descrivere un sistema
semplice si riduce a due (rimanendo
fissato il valore della terza
dall'equazione di stato).
Diremo di conoscere lo
stato termodinamico
di un sistema se conosciamo i valori
(uniformi in tutto il sistema) delle
coordinate macroscopiche che abbiamo
scelto per descrivere il sistema stesso.
Lo stato termodinamico viene detto di
equilibrio se tali valori restano costanti
nel tempo
Sistema termodinamico
E’ un sistema che viene studiato negli scambi di calore e
lavoro.
ES. un cilindro dotato di pistone a tenuta che può
scorrere liberamente oppure bloccato nella sua
posizione
All’interno del cilindro vi è un gas
Le pareti sono isolanti termici perfetti
Il fondo è un conduttore o isolante perfetto di
calore per assorbire o cedere energia termica
Il cilindro è dotato di strumenti di misura per
monitorare pressione temperatura
Un sistema, interagendo con l'ambiente
circostante, può evolvere da uno stato di
equilibrio ad un altro: diremo in tal caso che il
sistema ha compiuto una
trasformazione termodinamica.
Le trasformazioni termodinamiche
sono dunque i processi attraverso cui i sistemi
passano da uno stato termodinamico ad un altro.
EQUILIBRIO TERMODINAMICO
Uno stato di equilibrio è caratterizzato da: pressione P,
volume V, temperatura T
Equilibrio meccanico
La risultante di tutte le forze
agenti sul sistema deve
essere uguale a zero
Equilibrio termico
La temperatura deve essere
uguale in tutto il fluido
Equilibrio chimico
La struttura interna e la
composizione chimica
deve essere la stessa
Principio zero della termodinamica
Corpi A, B, C.
Se
A è in equilibrio termico con C
B è in equilibrio termico con C
A è in equilibrio
termico con C
Assioma provato nelle numerosissime esperienze
Il termometro misura la temperatura basandosi proprio su
questo principio.( Es il termometro è in equilibrio termico col
corpo).
In generale, quando due sistemi interagenti
sono in equilibrio condividono alcune proprietà,
che possono essere misurate assegnando a
esse un preciso valore numerico.
Conseguenza di questo fatto è il principio zero
della termodinamica:
quando due sistemi sono in equilibrio
termico con un terzo sono in equilibrio
termico anche tra loro.
La proprietà condivisa è in questo caso la
temperatura.
Trasformazioni termodinamiche
Un sistema, interagendo con l'ambiente
circostante, può evolvere da uno stato di
equilibrio ad un altro, si ha una
trasformazione termodinamica.
Le trasformazioni termodinamiche sono i
processi attraverso cui i sistemi passano da
uno stato termodinamico ad un altro.
Ad esempio : gas racchiuso in un cilindro è
una trasformazione termodinamica
Quando il gas viene riscaldato esso si
espande e solleva la massa m posta sul
coperchio.
B
A
Un altro esempio di trasformazione
termodinamica:mescolamento di due gas diversi.
(i) stato iniziale
i due gas occupano due vani di
uguale volume separati da una
valvola chiusa;
(f) stato finale
raggiunto a seguito
dell’apertura della valvola e
della mutua diffusione dei gas.
Trasformazioni termodinamiche
Gas perfetto
T
r
a
s
f
o
r
m
a
z
i
o
n
i
Isobare
A
B
p1
Pressione costante
V1
V2
Volume V
Isocòre
Volume costante
p1
A
p2
C
V1
Isoterme
Temperatura
costante
A
p1
B
p2
V1
V2
T
r
a
s
f
o
r
m
a
z
i
o
n
i
adiabatiche
Trasformazione in cui non vi è
scambio di calore tra il sistema
fisico e l’ambiente esterno
cicliche
Lo stato iniziale coincide con lo
stato finale.
Reali
Considero il pistone – cilindro, e il
gas che si trova in equilibrio
termodinamico in A ,
Se di colpo avviene un’espansione
che porta il pistone in B, P e V non
sono più uniformi ma variano da
punto a punto ( vortici ).
Trasformazione reale
B
A
All’interno di un pistone-cilindro modificando
pressione e volume si può avere ad esempio
espansione che fa passare il sistema dallo stato A
allo stato B mantenendo costante la temperatura.
Per fare ciò è necessaria una sorgente di calore,
ovvero un ente fisico che è in grado di mantenere
costante la temperatura.
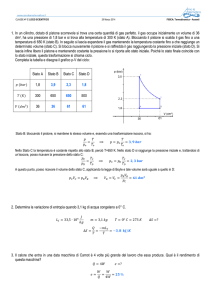
Esempio
Nel cilindro sono contenute 3 moli di gas perfetto.
Effettuiamo una trasformazione ciclica formata da due
isoterme due isocòre. Sia
T1= 300 K; T2= 500 k.
VA= 20 dm3; VB = 50 dm3
Trovare le coordinate dei punti A, B, C, D
nRT2 3 8,314 500
pA
........
3
VA
20 10
p
A
T2
pB ......
pC ......
pD ......
nRT2
A (V A ;
)
VA
B
D
T1
VA
C
VB
V
Le trasformazioni che si studiano in termodinamica sono
trasformazioni costituite da una successione di un numero
molto grande (al limite infinito) di stati di equilibrio, ( con
P,V,t, definite e non soggette a fluttuazioni )
trasformazioni quasistatiche.
trasformazioni
ideali, che non si
possono
realizzare
sperimentalmente
Efficace modello
teorico che permette
di ottenere risultati
di grande
importanza
Infatti una
trasformazione reale
non potrebbe essere
disegnata con una
linea sul diagramma pV
Energia interna di un gas
Lo stato interno di un gas, ovvero l’energia interna di un gas
(potenziale + cinetica) è completamente definita se conosco le
variabili termodinamiche ( p, V, T )
Se il gas è perfetto per conoscere lo stato di un gas è necessaria
la sola temperatura; infatti sappiamo che l’energia interna è
esclusivamente cinetica che a sua volta dipende dalla sola
temperatura.
3
U1 K1 nRT1
2
3
U 2 K1 nRT2
2
3
U K1 U 2 U1 nR(T2 T1 )
2
L’energia interna è una funzione di
stato perché dipende solo dalla T e
non dalla trasformazione che è stata
effettuata.
Le funzioni di stato sono grandezze che dipendono solo dalle
variabili termodinamiche che descrivono lo stato fisico del
sistema
La funzione di stato dipende solo dagli stati iniziale e finale A e
B, e non dal tipo di trasformazione che mi porta da llo stato A
allo stato B.
F(B) – f( A )
SOMMARIO
Fai clic qui per
continuare oppure
scegli un argomento
Guida all’uso della presentazione
Il lavoro nelle trasformazioni termodinamiche
Il primo principio della termodinamica
Le macchine termiche
Il secondo principio della termodinamica
Il rendimento di una macchina termica
Il teorema di Carnot
Il ciclo di Carnot
L’entropia
Il lavoro nelle trasformazioni termodinamiche
lavoro di un gas in una trasformazione isobara.
La forza esercitata dal gas sul pistone è:
F=pS
Il lavoro compiuto dal gas è:
Clic per continuare
iniziare
p=F/S
F
S
W=Fh=pSh
W=p∆V
h
Il lavoro nelle trasformazioni termodinamiche
p
pA
A
La trasformazione isobara dallo stato A allo
stato B, è descritta dal segmento AB. Il lavoro
compiuto in questa trasformazione è dato da
B
W=p∆V
VA
VB
V
Che rappresenta l’area sottesa al segmento AB.
Si può dimostrare che questo risultato vale per qualsiasi tipo di trasformazione reversibile
(meglio quasi statica ):
Il lavoro compiuto da un sistema termodinamico a seguito di una
trasformazione reversibile è dato dall’area sottesa dalla curva
rappresentativa della trasformazione nel piano p-V.
p
p
p
A
A
1
w
B
B
2
W<0
W>0
Espansione
V
compressione
V
Trasformazione ciclica
V
W = w1 + w2
Il lavoro dipende dal percorso quindi non è una funzione di stato
w 1 < w2 < w 3
Come già sottolineato, questo risultato è espressione di un fatto più
generale: anche quando la pressione non rimane costante, il lavoro
compiuto dal sistema nel corso di una trasformazione reversibile
è uguale, in un diagramma pressione-volume, all'area delimitata
dal grafico che rappresenta la trasformazione, dall'asse dei
volumi e da due rette verticali passanti per gli estremi A e B della
trasformazione.
Il lavoro è quindi associato a variazioni di volume.
Consideriamo il caso di un gas racchiuso in un cilindro con una parete
mobile (pistone).
Espansione (aumento del volume) w > 0 (lavoro motore)
il pistone e la massa (forza-peso) sono sollevati dal gas
Compressione (diminuzione di volume) w < 0 (lavoro resistente)
il pistone e la massa scendono
V > 0 w > 0
V < 0 w < 0
Quindi, nel corso di una espansione il lavoro è positivo, mentre durante
una compressione il lavoro deve essere preso con il segno negativo. Si
dice che un sistema esegue un lavoro positivo sull’ambiente tutte le volte
che questo lavoro può essere utilizzato all'esterno (per esempio per
sollevare un peso, per muovere una macchina ecc
Il primo principio della termodinamica
Supponiamo
Il gas assorbeche
dall’ambiente
le pareti delesterno
cilindrouna
e il pistone
quantitàsiano
di calore
perfettamente
Q
Clic
per
continuare
isolanti,
e, conseguentemente,
mentre la basela
del
sua
cilindro
energia
siainterna
un conduttore
aumenta
didi
calore.
una
quantità:
Clic per iniziare
∆U=Q
Nell’espansione, il gas compie un lavoro W sull’ambiente esterno
e, conseguentemente, la sua energia interna diminuisce di una
quantità:
s
∆U= - W
La variazione totale di energia interna del gas sarà dunque:
∆U=Q-W
PRIMO PRINCIPIO DELLA
TERMODINAMICA
F
Il primo principio della termodinamica
generalizziamo questo risultato ad un qualsiasi sistema termodinamico
Q>0
aumenta quando
L’energia interna di un sistema diminuisce
quando
esso:
• cede
calore
all’ambiente
esterno
assorbe
calore
dall’ambiente
esterno
Q<0
Sistema
termodinamico
• compie
sull’ambiente
esterno
subisce lavoro
un lavoro
dall’ambiente
esterno
W<0
L’energia interna di un sistema diminuisce quando
esso:
• cede calore all’ambiente esterno
• compie lavoro sull’ambiente esterno
∆U=Q-W
PRIMO PRINCIPIO DELLA
TERMODINAMICA
W>0
Da un punto microscopico il primo principio rappresenta la
legge di conservazione dell’energia meccanica, espressa
mediante grandezze termodinamiche macroscopiche.
Quando a metà ‘800, fu enunciato per la prima volta il primo
principio della termodinamica, fu dato come un risultato
sperimentale e non come conseguenza della conservazione
dell’energia meccanica, perché ancora il calore non era visto
come un aspetto dell’energia.
Applicazioni del primo principio della termodinamica
Bilancio energetico
Gas perfetto trasformazione quasi statica
Isocòre
Volume costante
U = Q
w =pV = 0
p1
B
p2
A
Il pistone è fissato e forniamo calore
Isobare
Pressione costante
VA= VB
A
B
p1
Pistone libero di muoversi
pV + U = Q
L’energia assorbita serve per compiere lavoro e per
aumentare l’energia interna
V1
V2
Volume V
Calore specifico
Solidi
Q
cP
m
T
isobara
c
Q
m T
Gas ??
Sappiamo che se
la trasformazione
è isobara si ha:
Sappiamo che se
la trasformazione
è isocòra si ha:
pV + U = Q
U = Q
pV U
cP
mT isobara
U
cV
m
T
isocòra
liquidi
Q
cV
m
T
isocòra
cP > cV
c P cV
pV U U
pV
mT
mT mT
c P cV
R
M
c P cV
cp > cV
L’energia interna di
un gas monoatomico
è:
3
U nRT
2
Nel caso di un gas
perfetto monoatomico
si ha:
U
cV
m
T
isocòra
pV nRΔT
nR
R
mT mT n M M
(relazione di Mayer)
m = massa totale gas
M = massa molecolare
n=m/M
3 nRT 3 nR 3 nR 3 R
cV
2 mT 2 m 2 nM 2 M
c P cV
R 3 R R 5 R
M 2M M 2M
cmv= 3/2R
calore molare a pressione costante cmp è definito da
cmp = Mcp
[ Calore Molare a pressione costante]
Quindi nel caso di gas monoatomico
3 R
cV
2 M
cP
c mv
5 R
2M
Sostanza
gas monoatomico
gas biatomico
gas poliatomico
3
R
2
5
c mp R
2
Cv
3
R
2
5
R
2
7
R
2
Cp
5
R
2
7
R
2
9
R
2
= Cp/Cv
5
3
7
5
9
7
ESERCIZIO 1
Considero di avere un recipiente, contenente 100 l d’acqua, costituito
da un bidone completamente avvolto da materiale isolante e dotato
di un mescolatore azionato da un motore elettrico di potenza 0,5 CV; il
motore viene tenuto in funzione per un periodo di tempo pari a t = 20
minuti.
Calcolare la variazione di energia interna U e l’incremento di
temperatura T del sistema.
calore specifico dell’acqua : cp (H2O) = 4.186 J / Kg K
il motore ha potenza P=0,5 CV = 368 W (1CV = 736 W )
20 min. = 20. 60=1200 s
Soluzione
Dal primo principio della termodinamica: U2-U1= Q - w
Poiché non avviene scambio di calore con l’esterno Q = 0,
w = P × t = 368 W × 1200 s = - 441.600 J (lavoro sul sistema)
U = -w U = + 441.600 J (variazione di energia interna).
U= - w
Variazione di temperatura T
Q = m × c × (T2-T1)
m =100 Kg
c = 4.186 J/Kg× K.
Sostituendo i valori ottengo
T2-T1 = 441.600/100 × 4187= 1,05 K
Trasformazione adiabatica
Se il sistema è termodinamicamente isolato dall'ambiente, ossia se
non vi sono scambi di calore con l'esterno, si può scrivere:
U w
In questo caso tutto il lavoro compiuto dal gas va a discapito della sua
energia interna.
Si può anche dimostrare che in una trasformazione adiabatica
quasistatica pressione e volume in un gas perfetto sono legati da una
relazione esponenziale del tipo:
pV p0V0
dove è definito come il rapporto tra il calore specifico a pressione
costante e quello a volume costante.
cP
cV
Se considero l’equazione di stato dei gas perfetti,
p1 V1 nRT
pV p0V0
Può assumere un’espressione diversa.
nRT1
p1
V1
p2
T1 V1 1 T2V2 1
nRT2
V2
Trasformazione isoterma
T = 0
PV = nRT
V
w nRT ln 2
V1
U = 0
Q=w
V
Q nRT ln 2
V1
Trasformazione ciclica
U = 0
Nella trasformazione ciclica il lavoro totale compiuto dal sistema
è uguale alla somma algebrica di tutti i calori scambiati dal
sistema con l’ambiente esterno.
Le macchine termiche
La macchina termica è un dispositivo capace di trasformare in modo continuativo in lavoro
il calore assorbito da una sorgente.
Per funzionare, una macchina termica deve lavorare con almeno due sorgenti di calore:
preleva calore dalla sorgente a temperatura maggiore (caldaia), mentre alla sorgente a
temperatura minore (refrigerante) cede la quantità di calore non trasformata in lavoro.
macchina a vapore
motore
vapore
condensatore
acqua
sorgente
di calore
In questo schema
di macchina a
vapore, la caldaia
è la fiamma che
produce vapore,
mentre il
refrigerante è il
condensatore che
riporta il vapore
allo stato liquido,
in modo che il
ciclo possa
iniziare da capo.
Il calore Q2 che il sistema assorbe dalla sorgente a temperatura maggiore solo in parte
viene trasformato in lavoro w. Il resto, cioè la quantità di calore Q1, deve necessariamente
essere ceduto al refrigerante, e va quindi sprecato.
W=Q2-Q1
Esempio di macchina termica
La macchina è costituita da un cilindro metallico un
poco di acqua.
Il pistone superiore è spinto verso il basso in modo da
essere a contatto con l'acqua (l'aria che è nel cilindro
fuoriesce da un piccolo foro lasciato nel pistone, foro che si
richiuderà quando il pistone sarà sceso completamente).
Si accende un focolare al di sotto del cilindro; il vapor
d'acqua, vincendo la pressione atmosferica, solleva il pistone
fino alla sommità del cilindro.
In alto il pistone è bloccato da appositi ingranaggi per permettere di togliere il focolare con le
seguenti successive conseguenze: raffreddamento del vapore, sua condensazione fino a
tornare acqua, creazione del vuoto sopra la superficie dell'acqua. A questo punto si libera il
pistone prima bloccato in alto. Esso scenderà violentemente risucchiato dal vuoto. A questo
punto si rimette il focolare sotto il cilindro e tutto procede di nuovo come precedentemente.
La forza [il termine energia entrerà nella letteratura scientifica molto oltre, nell'Ottocento] che
si genera dipenderà dalle dimensioni in gioco ed in particolare dal diametro del cilindro ma
anche dalla tenuta tra pistone e cilindro. Nella figura vi è una animazione che illustra il
principio di funzionamento di una macchina di Papin.
Papin si era inoltre reso conto che era necessario separare la caldaia, nella quale si
generava il vapore, dal cilindro e, nel 1706, pubblicò un suo progetto.
EVOLUZIONE DELLA MACCHINA A VAPORE
Il vapore proveniente da una caldaia (edificio in muratura)
era inviato, mediante un tubo, dentro un recipiente
ellissoidale pieno d'acqua con l'effetto di espellere l’acqua
stessa verso l'alto, mediante un altro tubo.
Successivamente il recipiente veniva raffreddato mediante
un getto d'acqua dall'esterno. A seguito di ciò il vapore ivi
presente (che aveva sostituito l'acqua precedentemente
presente) condensava provocando il vuoto. In tal modo, la
pressione atmosferica agente sull'acqua da sollevare in
fondo al pozzo, poteva spingerla nel recipiente vuoto.
A questo punto un nuovo getto di vapore proveniente dalla caldaia faceva defluire l'acqua
verso l'alto.Per realizzare tutto questo occorreva aprire e chiudere alternativamente rubinetti
e valvole; tali operazioni venivano fatte manualmente. La macchina aveva il limite di
sollevare l'acqua non oltre i circa 10 metri (limite torricelliano). Per risolvere tale problema
Savery spinse sulla pressione, portandola alle circa 10 atmosfere (se si pensa che non vi
erano valvole di sicurezza ci si rende conto che tali macchine erano delle potenziali bombe);
la qual cosa, nelle previsioni teoriche, avrebbe moltiplicato per 10 il normale sollevamento ad
una sola atmosfera, portandolo a circa 100 metri. Il tutto però avveniva con grande consumo
di combustibile (carbone e legna), circa 20 volte quello di una normale macchina a vapore di
alcuni anni dopo. Ultima notazione è relativa al fatto che tale macchina non metteva in moto
altri meccanismi, funzionava in modo statico. La figura fa vedere un'animazione della
macchina di Savery.
La macchina di Newcomen
La macchina di Newcomen fu la prima ad avere successo di
vendite. Essa adottava cilindro e stantuffo di Papin e
lavorava, contrariamente a Savery, a bassa pressione
(quella atmosferica), fatto che la rendeva di molto più facile
costruzione.
Era poi molto affidabile per l'abilità artigiana di costruzione
(dati gli standard piuttosto insoddisfacenti dell'epoca), per il
fatto che Newcomen aveva esperienza di miniere e perché
lavorava con un abile idraulico, Calley.
Un fornello alimentava la caldaia che produceva vapore alla pressione atmosferica. Tale
vapore veniva immesso dal basso nel cilindro e, aiutato da un bilanciere che manteneva
inizialmente in equilibrio l'asta della pompa posta ad estremità opposta del bilanciere rispetto
all'asta dello stantuffo, faceva sollevare lo stantuffo medesimo. Appena il vapore aveva
riempito il cilindro, mediante una valvola, si immetteva in esso dell'acqua fredda che
originava la condensazione del vapore. In tal modo lo stantuffo precipitava verso il basso
spinto dalla pressione atmosferica. In tal modo il bilanciere oscillava alternativamente da una
parte e dall'altra, provocando la messa in funzione della pompa, situata a sinistra del
bilanciere, che sollevava l'acqua dal basso. I sistemi di apertura e chiusura delle valvole per
l'immissione e lo scarico del vapore (ed acqua) erano automatizzati
La macchina di Watt
Watt realizza una macchina che mette in azione macchinari rotanti, mediante
l’accoppiamento pistone - ruota (biella-manovella). Essa fu però brevettata da un operaio di
Watt (1780), Pickard.
Watt allora escogita ( 1782 ) un sistema a doppio effetto che raddoppiava la potenza della
macchina semplice a parità di cilindrata. Si tratta di immettere il vapore alternativamente
sulle due facce dello stantuffo. In tal modo si abbandona l'intervento diretto della pressione
per far scendere lo stantuffo medesimo e si apre alla possibilità di macchine con cilindro non
più necessariamente verticale. I problemi con il doppio effetto erano legati al trasferimento
del moto al bilanciere Watt lo risolve con un sistema di leve detto parallelogrammo articolato.
Il secondo principio della termodinamica
Mentre la trasformazione di lavoro in calore è sempre possibile (per esempio, le forze
d’attrito fanno proprio questo), il processo inverso è possibile solo se vengono rispettate
alcune condizioni, stabilite dal secondo principio della termodinamica, una legge che si
può esprimere in modi diversi. I due più noti enunciati di tale principio sono quelli di Kelvin e
di Clausius.
ENUNCIATO DI KELVIN
È impossibile realizzare una trasformazione il cui
unico risultato sia quello di convertire in lavoro
tutto il calore assorbito da una sola sorgente.
T2
Q2
macchina
termica
W=Q2-Q1
ENUNCIATO DI CLAUSIUS
È impossibile realizzare una trasformazione il cui
unico risultato sia quello di trasferire calore da un
corpo ad un altro avente una temperatura
maggiore o uguale a quella del primo.
Q1
T1<T2
I diversi enunciati del secondo principio della termodinamica sono tutti equivalenti tra loro
ENUNCIATO DI KELVIN
È impossibile realizzare una trasformazione il cui
unico risultato sia quello di convertire in lavoro
tutto il calore assorbito da una sola sorgente.
T2
Q
macchina
termica
MACCHINA
IMPOSSIBILE!
W=Q
Non è possibile realizzare una macchina termica ciclica come
quella schematizzata in figura, cioè una macchina che abbia come
unico effetto la totale trasformazione in lavoro L del calore Q
assorbito da un’unica sorgente. Una tale macchina violerebbe
l’enunciato di Kelvin del secondo principio della termodinamica.
ENUNCIATO DI KELVIN
È impossibile realizzare una trasformazione il cui
unico risultato sia quello di convertire in lavoro
tutto il calore assorbito da una sola sorgente.
T2
Q2
MACCHINA
PERMESSA!
macchina
termica
W=Q2-Q1
Q1
T1<T2
Per funzionare ciclicamente, la macchina assorbe calore da una
sorgente a temperatura maggiore e ne cede una parte ad una
sorgente a temperatura minore. La differenza tra l’energia assorbita
e quella ceduta è uguale al lavoro utile compiuto dalla macchina.
ENUNCIATO DI CLAUSIUS
È impossibile realizzare una trasformazione il cui
unico risultato sia quello di trasferire calore da un
corpo ad un altro avente una temperatura
maggiore o uguale a quella del primo.
T2
Q
MACCHINA
IMPOSSIBILE!
macchina
termica
Q
T1<T2
Non è possibile realizzare una macchina ciclica come quella schematizzata in
figura, cioè una macchina che abbia come unico effetto il passaggio di una
certa quantità di calore Q da un corpo ad un altro avente una temperatura
maggiore o uguale a quella del primo. Una tale macchina violerebbe
l’enunciato di Clausius del secondo principio della termodinamica.
ENUNCIATO DI CLAUSIUS
È impossibile realizzare una trasformazione il cui
unico risultato sia quello di trasferire calore da un
corpo ad un altro avente una temperatura
maggiore o uguale a quella del primo.
T2
Q2=Q1+W
L
MACCHINA
PERMESSA!
macchina
termica
Q1
T1<T2
Un passaggio di calore da un corpo più freddo ad uno più
caldo può essere realizzato mediante una macchina
solamente a spese di un lavoro fornito dall’ambiente esterno
(come nel caso del frigorifero, che assorbe energia elettrica).
Se l’enunciato di Kelvin fosse falso, allora …
T2
T2
Q2=Q1+Q
M1
W=Q
=
M2
Q1
Q
macchina
termica
Q1+Q
T1<T2
T1<T2
Macchina che viola
l’enunciato di Kelvin
Q1+Q
Macchina frigorifera
… sarebbe falso anche l’enunciato di Clausius.
Macchina che viola
l’enunciato di Clausius
Se l’enunciato di Clausius fosse falso, allora …
T2
T2
Q2
Q2-Q1
Q1
+
M1
M2
=
W=Q2-Q1
macchina
termica
Q1
Q1
T1<T2
Macchina che viola
l’enunciato di Clausius
Macchina termica
… sarebbe falso anche l’enunciato di Kelvin.
Macchina che viola
l’enunciato di Kelvin
W=Q2-Q1
Il rendimento di una macchina termica
Il rendimento di una motore termico è definito
come il rapporto tra il lavoro prodotto dalla
macchina termica e il calore assorbito dal
motore stesso.
W
Qass
Per un motore automobilistico = 30%
Per una centrale termoelettrica = 45%
Rendimenti di altre macchine
Efficienza di una macchina
Il teorema di Carnot
Nessuna macchina che lavori tra due serbatoi può avere un rendimento
superiore a quello di una macchina di Carnot che lavori tra i medesimi serbatoi.
Questo risultato, a cui pervenne Carnot intorno al 1825, è noto come teorema di
Carnot. Per questo teorema sarà sempre:
T2
reale Carnot
Q2
macchina
termica
Q1
T1<T2
W=Q2-Q1
1
Carnot
2
Il Ciclo di Carnot
Tra tutte le macchine che scambiano calore con due soli serbatoi, chiamiamo
Macchina di Carnot una macchina che compie un ciclo reversibile (detto Ciclo di
Carnot) costituito in successione da una espansione isoterma, una espansione
adiabatica, una compressione isoterma ed una compressione adiabatica.
Caratteristica peculiare di una tale macchina è che il suo rendimento non dipende
dalla sostanza termodinamica che compie il ciclo, ma solo dalle temperature delle
due sorgenti con le quali scambia il calore.
La macchina è costituita:
da un cilindro chiuso con un pistone
con le pareti isolate adiabaticamente
contenente del gas perfetto che può scambiare calore solo attraverso il fondo
del pistone
T2
Q2
macchina
termica
Q1
T1<T2
W=Q2-Q1
1
Carnot
2
Il Ciclo di Carnot
Analizziamo le varie trasformazioni:
Espansione Isotermica: il cilindro inizialmente in contatto con la sorgente calda per
raggiungere la temperatura di quest’ultima, rimane in contatto con questa finchè il gas
non si espande e il pistone raggiunge la posizione B.
Clic per iniziare
B
A
T2
Il Ciclo di Carnot
Espansione Adiabatica: il cilindro viene allontanato dalla sorgente calda e isolato
termicamente, il gas continua la sua espansione fino alla posizione C. L’espansione
continuerà finchè il gas non raggiungerà la temperatura della sorgente fredda.
C
B
T2
Il Ciclo di Carnot
Compressione Isotermica: il cilindro viene posto in contatto con la sorgente
fredda, il gas subisce una compressione che porterà il pistone a raggiungere la
posizione D.
C
D
T1
Il Ciclo di Carnot
Compressione Adiabatica: il cilindro viene allontanato dalla sorgente fredda e
isolato termicamente; la compressione del gas continuerà finchè il pistone non
occuperà di nuovo la posizione A. Riportandosi alle condizioni iniziali la macchina sarà
pronta per iniziare un nuovo ciclo.
D
A
T1
Il Ciclo di Carnot
CICLO DI CARNOT
Uno degli studiosi francesi che anticipa
l'interesse per le macchine reali è Lazare Carnot (il
fine dichiarato di Lazare era: "reinserire nella
meccanica la scienza delle macchine, che ne era
rimasta separata"). Egli, nella sua opera Essai sur
les Machines en Général (1783), studia i rendimenti
delle macchine idrauliche in modo analogo a quanto
aveva fatto Smeaton in Gran Bretagna. Lazare
Carnot, che avrà un ruolo di primo piano nella
Rivoluzione, nel Direttorio e nei governi napoleonici,
aprirà la strada …….. Principi della termodinamica
Rendimenti di diversi tipi di macchine
Macchina
Schema
Motore
elettrico
Ee
Mel
L
Energia fornita
Energia utile
Rendimento
Elettrica
Lavoro
meccanico
= L/ Ee
Calore
sottratto alla
sorgente
calda
Lavoro
meccanico
Lavoro
meccanico
Calore
sottratto alla
sorgente
fredda
cop =Q2/( Q1-Q2)
Lavoro
meccanico
Calore
trasferito
alla
sorgente
calda
cop= Q1/( Q1-Q2)
Rendimento
limite
1
Q
Motore
termico
T1
Q1
Mt
Q2
Frigorifero
Pompa di
calore
T1
L
T2
T1
L
T2
T2
Q1
F
Q2
Q1
P
Q2
=( Q1-Q2)/Q1
rev=(T1-T2)/T1
rev=T2/(T1-T2)
rev=T1/(T1-T2)
Efficienza
Per capire quanto un motore reale sia vicino alla macchina termica ideale
corrispondente si ricorre al concetto di efficienza o di rendimento del secondo
principio, definita come il rapporto tra il rendimento della macchina reale e
quello della macchina ideale
rev
L’entropia
Storicamente il concetto di entropia fu introdotto per la
prima volta da Clausius nel 1865, L'entropia è una
grandezza nota sempre a meno di una costante additiva
arbitraria. Questo fatto tuttavia non è molto rilevante
perché quello che interessa conoscere di un sistema è la
variazione di entropia fra due stati, non il valore della sua
entropia in un certo stato.
L'entropia è anche una grandezza additiva, il che significa
che la variazione di entropia di un sistema costituito da più
parti è uguale alla somma delle variazioni di entropia delle
sue singole parti.
L’entropia: alcune considerazioni
Nel linguaggio corrente spesso vengono utilizzate frasi del tipo:
L'umanità 'consuma' energia, oppure:
Le risorse energetiche sulla Terra vanno 'esaurendosi' e simili.
Eppure noi sappiamo che l'energia di un sistema isolato (per il I Principio della
Termodinamica) si conserva sempre. Come abbiamo già ricordato l'energia si
trasforma da una forma ad un'altra, si trasferisce da un corpo ad un altro, può
essere accumulata o liberata, ma si mantiene costante.
Quando si parla impropriamente di 'consumo di energia', di 'diminuzione di
energia', in realtà si intende parlare di un altro fenomeno che accompagna tutti i
fenomeni irreversibili: la 'degradazione' dell'energia.
Immaginiamo ad esempio di bruciare una certa quantità di combustibile e di
raccogliere tutti i prodotti della combustione (calore, fumo, ceneri, ecc...) : in base
al I Principio possiamo affermare che essi contengono esattamente la stessa
quantità di energia che era contenuta nel combustibile di partenza.
Eppure è indubbio che se la quantità di energia è la stessa, la qualità è
cambiata.
FINE