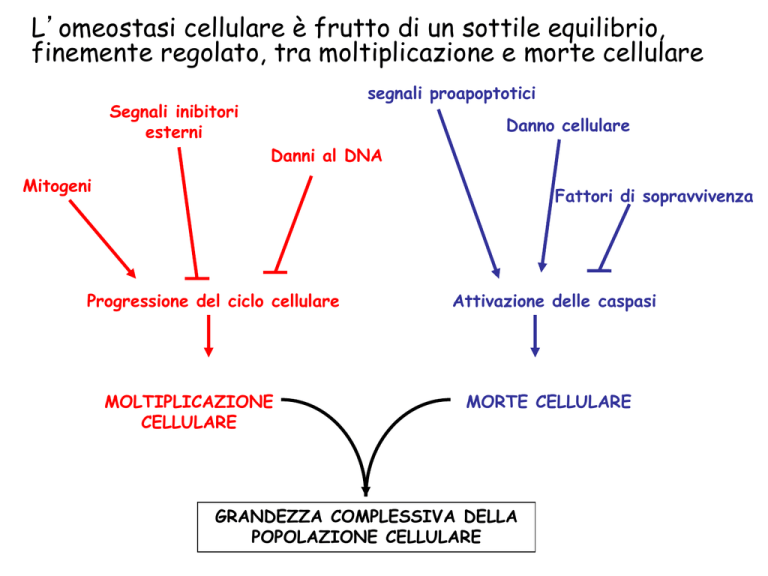
L’omeostasi cellulare è frutto di un sottile equilibrio,
finemente regolato, tra moltiplicazione e morte cellulare
segnali proapoptotici
Segnali inibitori
esterni
Danno cellulare
Danni al DNA
Mitogeni
Fattori di sopravvivenza
Progressione del ciclo cellulare
MOLTIPLICAZIONE
CELLULARE
Attivazione delle caspasi
MORTE CELLULARE
GRANDEZZA COMPLESSIVA DELLA
POPOLAZIONE CELLULARE
ALCUNE PROPRIETA’ DELLE CELLULE TUMORALI
- Non rispettano i segnali interni ed esterni che regolano la
proliferazione cellulare
- Aggirano le limitazioni programmate alla proliferazione
sfuggendo alla senescenza replicativa ed evitando il
differenziamento
- Sono meno propense, rispetto alle cellule normali, ad
andare in apoptosi
- Inducono la collaborazione di cellule normali presenti nel
loro microambiente
- Sfuggono al tessuto dove risiedono (sono invasive)
- Sopravvivono e proliferano in siti estranei (metastatizzano)
La crescita tumorale è il risultato di mutazioni somatiche
Cellule normali
Una cellula isolata va
incontro a mutazione
Le cellule mutanti
crescono in un grande
clone di cellule
Prove a sostegno dell’origine monoclonale del cancro
Le cellule di un tumore hanno in comune un’alterazione genetica (o
epigenetica) che le distingue dalle cellule normali che le circondano
La prova derivata da mosaici di inattivazione del cromosoma X
Prove a sostegno del ruolo delle mutazioni somatiche
nell’insorgenza del cancro
Molti agenti noti come mutageni sono anche cancerogeni
Difetti genetici nei meccanismi di riparazione del DNA
provocano una forte suscettibilità al cancro
MUTAZIONI COINVOLTE NELL’ONCOGENESI
Mutazioni che fanno aumentare
la capacità proliferativa
Mutazioni che fanno diminuire
la sensibilità all’apoptosi
Mutazioni che incrementano
l’instabilità genomica
Incremento di funzione di proteine che
promuovono la progressione del ciclo cellulare
Perdita di funzione di proteine che
inibiscono la progressione del ciclo cellulare
Incremento di funzione di proteine che
inibiscono l’apoptosi
Perdita di funzione di proteine che
promuovono l’apoptosi
Perdita di funzione di proteine coinvolte
nella riparazione del DNA
DUE CLASSI DI GENI CRITICI PER IL CANCRO
Proto-oncogèni: geni che codificano per proteine che
favoriscono la proliferazione cellulare:
- promuovendo la progressione del ciclo cellulare
- inibendo la morte cellulare
Oncosoppressori: geni che codificano per proteine che
contrastano la proliferazione cellulare:
- inibendo la progressione del ciclo cellulare
- promuovendo la morte cellulare
DUE CLASSI DI GENI CRITICI PER IL CANCRO
Proto-oncogèni: geni il cui incremento di funzione
conduce verso il cancro. Le forme mutanti iperattive
sono chiamate oncogèni
Oncosoppressori: geni la cui perdita di funzione conduce
verso il cancro
ONCOGENI
ONCOSOPPRESSORI
Effetto sulla
proliferazione
stimolazione
inibizione
Tipo di mutazione
Acquisto di
funzione
Perdita di funzione
analogia
Acceleratore
bloccato
Freno non
funzionante
Gli alleli mutanti dei proto-oncogeni (gli oncogeni) sono in genere
dominanti (l’iperattività è un guadagno di funzione: è sufficiente una
sola copia per indurre un eccesso di proliferazione cellulare)
Una mutazione trasforma un allele del
proto-oncogene in oncogene
Cellula normale
Cellula che prolifera
in modo anomalo
Gli alleli mutanti degli oncosoppressori sono in genere recessivi
(l’ipoattività è una perdita di funzione: entrambi devono essere mutati
per indurre un eccesso di proliferazione)
Una mutazione inattiva una
copia di un oncosoppressore
Cellula normale
Una seconda mutazione
inattiva la seconda copia
Nessun effetto
Cellula che prolifera
in modo anomalo
ONCOSOPPRESSORI
Geni che codificano per proteine che inibiscono la
proliferazione o favoriscono l’apoptosi
Le mutazioni che provocano il cancro sono
mutazioni che portano alla perdita di funzione
Per portare alla crescita tumorale devono in genere
essere inattivati allo stato omozigote
Sono coinvolti nell’ereditarietà della
predisposizione ad alcuni tumori
Geni Oncosoppressori
The Two-Hit Hypothesis
(L’ipotesi dei due colpi)
Knudson, 1971
PRIMO COLPO
Mutazione in un allele
SECONDO COLPO
Mutazione nell’altro allele
CANCRO
L’ipotesi dei due colpi nei Tumori Ereditari
(retinoblastoma)
Negli individui che sviluppano questi tipi di tumori,
il 1° colpo viene ereditato come mutazione
germinale e il 2 colpo si verifica in una cellula
somatica
1° colpo
2° colpo
Il gene per la suscettibilità al retinoblastoma (Rb)
è il prototipo degli oncosoppressori
La proteina Rb agisce da freno nella fase G1
Proteina Rb
fosforilata
Segnale di un fattore
di crescita
Ciclina-cdk
Nelle cellule in G1 non sono
trascritti i geni necessari per
l’entrata in fase S
Bersagli trascrizionali di E2F
-Ciclina E
-Ciclina A
-Enzimi per la biosintesi dei
nucleotidi
-Subunità della DNA polimerasi
trascrizione
proteine necessarie per la fase S
G1
S
In assenza della funzione di Rb l’attività di
E2F è indipendente dalla presenza di mitogeni
G1
S
Repressione coinvolge la metilazione
della lisina9 dell’istone H3 che regola la
struttura della cromatina
I meccanismi genetici alla base del retinoblastoma
INDIVIDUO NORMALE SANO
RETINOBLASTOMA EREDITARIO
RETINOBLASTOMA SPORADICO
Una cellula
inattiva uno
dei suoi geni
Rb funzionanti
Gene Rb
mutante
ereditato
Una cellula inattiva uno
dei suoi geni Rb
funzionanti
In una cellula si
inattiva la sua sola
copia funzionante
di Rb
RETINOBLASTOMA
La seconda copia di Rb
è inattivata molto
raramente nella stessa
linea di cellule
RETINOBLASTOMA
NESSUN TUMORE
LA MAGGIOR PARTE (90%) DELLE
PERSONE CON LA MUTAZIONE
EREDITATA SVILUPPA IL TUMORE
SOLTANTO UNA PERSONA
NORMALE SU 30.000 SVILUPPA
IL TUMORE
Cellula non tumorale con una sola copia normale di Rb
Mutazione di Rb nel
cromosoma materno
Rb normale nel
cromosoma paterno
POSSIBILI MODI IN CUI L’ALLELE NORMALE DI Rb PUO’ ESSERE ELIMINATO
Non-disgiunzione Duplicazione del
causa la perdita cromosoma con
del cromosoma
la mutazione
normale
Ricombinazione
mitotica
Conversione
genica
Delezione
Mutazione
puntiforme
La forma ereditaria del retinoblastoma è trasmessa
come un carattere autosomico dominante
+/-
+/-
+/-
+/-
+/-
L’individuo che sviluppa il retinoblastoma è eterozigote
Le cellule del tumore sono omozigoti
Gli individui affetti da forma ereditaria di retinoblastomi sono a
rischio di sviluppare anche altri tipi di tumore, come sarcomi dei
tessuti molli. La mutazione di RB si riscontra spesso in diversi tumori
(mammella, prostata, polmone) in individui che hanno ereditato alleli
RB normali
Il gene oncosoppressore p53:
il guardiano del genoma
La proteina p53 si accumula in risposta al danno del DNA o a segnali
iperproliferativi e provoca l’arresto del ciclo cellulare o l’apoptosi
Danno al DNA
Iperproliferazione
p53
Arresto in G1
Apoptosi
DNA
DANNEGGIATO
Aumenta il livello
intranucleare di p53
Trascrizione
trascrizione
trascrizione
Bax
APOPTOSI
Eliminazione di
cellule danneggiate
irreparabilmente
p21
ARRESTO DEL CICLO CELLULARE
Riparazione del DNA
p53 è fortemente indotto in una cellula sana da un danno
genetico, come l’esposizione a luce ultravioletta
p53 induce l’espressione di BAX, iniziatore dell’apoptosi.
p53 lega BAX sulla membrana mitocondriale esterna, inducendo la
permeabilizzazione della membrana e il rilascio di fattori
apoptotici
p53 lega direttamente diversi membri della famiglia BCL2
inibendoli e favorendo l’apoptosi
p53 e tumori umani
• mutazioni somatiche di p53 sono state identificate in più
del 50% dei tumori umani
• è nota, però, soltanto una condizione ereditaria causata da
mutazioni germinali di p53, la sindrome di Li-Fraumeni, una
rara forma di predisposizione allo sviluppo di tumori multipli
In molti casi le mutazioni di p53 si comportano come
dominanti negative
Normalmente p53 è
attiva come tetramero
Anche con 1/4 di p53 mutante
l’intero tetramero è inattivo
BRCA 1 e BRCA 2 sono responsabili della maggior parte dei casi ereditari
di tumore della mammella
Danno al DNA
BRCA1
BRCA-1 e -2 fanno parte di grandi
complessi proteici che rispondono al
danno al DNA e ne attivano il riparo
Tramite ricombinazione omologa
BRCA1
BRCA2
BRCA2
Riparazione
zione di p53
MDM2 lega p53 e ne favorisce
l’esporto nel citoplasma e la successiva
ubiquitinilazione.
La fosforilazione di p53 da parte di
ATM blocca l’interazione con MDM2
Arresto del ciclo cellulare
Apoptosi
Esempi di oncosoppressori
BRCA2
Una singola mutazione non è sufficiente a provocare il cancro
N. di divisioni cellulari in un corpo umano nell’arco della vita: ≈ 1016
N. di mutazioni spontanee per gene per divisione cellulare: ≈ 1/106
Ogni gene subisce mutazioni in circa 1010 occasioni
Incidenza del cancro in funzione dell’età
Evoluzione clonale
un tumore si sviluppa tramite
cicli ripetuti di mutazione e
proliferazione
Ipotesi della sequenza di alterazioni genetiche nello sviluppo del
carcinoma colorettale
Ciascun tumore contiene generalmente una serie
diversa di alterazioni genetiche
Oltre alle mutazioni, anche le alterazioni epigenetiche sono
comuni nel cancro
INATTIVAZIONE GENETICA
Cambiamento nella
sequenza del DNA
INATTIVAZIONE EPIGENETICA
Formazione di
eterocromatina
INATTIVAZIONE EPIGENETICA
Metilazione del DNA
Cellula che si
amplifica in transito
Cellula staminale normale
autorinnovamento
Mutazioni o cambiamenti epigenetici
provocano l’acquisizione di proprietà
di cellule staminali
Mutazioni e cambiamenti epigenetici
Cellula
staminale del
cancro maligna
Molti tumori sono
sostenuti da una piccola
popolazione di cellule
staminali cancerose
autorinnovamento
Crescita continua
Cellula staminale
del cancro
TUMORE
Cellula cancerosa
che si amplifica in
transito
VIRUS ONCOGENI
I virus oncogeni ad RNA appartengono alla
famiglia dei retrovirus
Un retrovirus
Il comportamento dell’acido nucleico di
un retrovirus in una cellula infettata
Il ciclo vitale di un retrovirus
I retrovirus oncogeni attivano protooncogeni
cellulari
Meccanismi di attivazione di proto-oncogeni
da parte di virus oncogeni a RNA
Trasduzione di un proto-oncogene cellulare
Attivazione di un proto-oncogene cellulare mediante
mutagenesi inserzionale
Trans-attivazione di proto-oncogeni cellulari mediante
proteine virali che regolano la trascrizione
Complessi meccanismi indiretti
ORGANIZZAZIONE GENETICA DEI RETROVIRUS
Sequenze fiancheggianti
(Long Terminal Repeats)
Retrovirus semplici
gag
pol
env
LTR
LTR
Proteine
strutturali
del virione
Trascrittasi
inversa
Glicoproteine
dell’involucro
Retrovirus che trasducono un proto-oncogene cellulare (c-onc)
gag
LTR
pol
env
v-onc
LTR
Esempi di retrovirus che trasducono proto-oncogeni cellulari
Virus
Specie
Oncogene
virale
Protooncogene
cellulare
Sarcoma di Rous (RSV)
Pollo
v-src
c-src
Sarcoma di Harvey (Ha-MuSV)
Ratto
v-ras
c-ras
Mielocitomatosi aviaria (MC29)
Pollo
v-myc
c-myc
Leucemia di Abelson (MuLV)
Topo
v-abl
c-abl
Eritroblastosi aviaria (AEV)
Pollo
v-erbB
EGFR
Sarcoma della scimmia (SSV)
Scimmia
v-sis
PDGF
Sarcoma felino (FeSV)
Gatto
v-fms
c-fms
Possibile meccanismo di mutagenesi durante la cattura di un proto-oncogene
da parte di un retrovirus
Nella proteina oncogenica virale Raf, il dominio regolativo è stato deleto e
sostituito dalle sequenze Gag virali, col risultato che il dominio chinasico è
costitutivamente attivo
Possibile meccanismo di mutagenesi inserzionale
Influenza
dell’enhancer
virale
Sintesi del trascritto
potenziata
RETROVIRUS ASSOCIATI A TUMORI NELL’UOMO
Virus
Tumori associati
Virus di tipo I della leucemia
umana a cellule T (HTLV-I)
Leucemia dell’adulto a cellule T
Virus dell’immunodeficienza
umana (HIV)
Sarcoma di Kaposi (cancro
delle cellule endoteliali)
(HTLV-1)
TRANSATTIVATORI
gag
env
LTR
pol
X-II
X-I
X-III
X-V X-IV
LTR
I virus oncogeni a DNA inducono
la trasformazione cellulare
quando si integrano nel genoma
dell’ospite
Nella trasformazione sono
generalmente espresse solo le
proteine precoci
Meccanismi di trasformazione utilizzati dai virus oncogeni a DNA
Inattivazione di proteine codificate da oncosoppressori
da parte di proteine virali
Attivazione di proteine codificate da proto-oncogeni cellulari da
parte di proteine virali
Attivazione di proto-oncogeni cellulari mediante mutagenesi
inserzionale
Trans-attivazione di proto-oncogeni cellulari mediante proteine virali
che regolano la trascrizione
Complessi meccanismi indiretti
Le proteine E6 e E7 del
virus del papilloma
inattivano Rb e p53
La proteina E5 del virus del papilloma attiva il
recettore del PDGF
VIRUS ONCOGENI A DNA ASSOCIATI A TUMORI NELL’UOMO
Virus
Tumori associati
Famiglia dei Papovavirus
Papillomavirus (HPV)
Verruche benigne
Carcinoma della cervice uterina
Famiglia degli Herpesvirus
Virus di Epstein-Barr (EBV)
Linfoma di Burkitt
Famiglia degli Hepadnavirus
Virus dell’epatite B (HBV)
Carcinoma epatocellulare
CLASSI PRINCIPALI
DI PROTO-ONCOGENI
Fattori di crescita
Recettori di fattori di crescita
Proteine
di trasduzione del segnale
Proteine che controllano
il ciclo cellulare
Proteine che
inibiscono l’apoptosi
Fattori trascrizionali
Gli oncogeni si identificano tramite la loro capacità
di indurre la “trasformazione cellulare”
Gli oncogeni sono dei proto-oncogèni modificati da
mutazioni spontanee o provocate da agenti esogeni
(chimici, fisici e virali).
L’attivazione di un proto-oncogene può essere quantitativa
e/o qualitativa
MUTAZIONI CHE PROVOCANO
L’IPERATTIVITA’ DEI PROTO-ONCOGENI
- Mutazioni puntiformi
- Piccole delezioni
- Amplificazione genica
- Riarrangiamenti cromosomici
- Attivazione da parte di retrovirus
Meccanismi di conversione dei proto-oncogeni in oncogeni
Proto-oncogene
ATTIVAZIONE
ONCOGENICA DI RAS
(mutazione puntiforme)
Ras inattiva
Attività GTPasica
intrinseca
L’attivazione di un recettore
stimola lo scambio GTP/GDP
Ras attiva
Ras resta bloccata
nello stato attivo
Attiva la cascata delle MAP chinasi
Il segnale a valle diventa continuo
ATTIVAZIONE ONCOGENICA DEL RECETTORE
DELL’EGF MEDIANTE DELEZIONE
EGFR
ErbB
Il recettore codificato dall’oncogene
segnala indipendentemente dal ligando
ATTIVAZIONE ONCOGENICA DEL GENE myc
(AMPLIFICAZIONE DEL NUMERO DI COPIE)
Ibridazione in situ
Regione che si colora
omogeneamente
cromosomi
doppi minuti
Replicazione aberrante
cromosoma A
cromosoma B
ATTIVAZIONE ONCOGENICA DEL GENE myc
(traslocazione cromosomica) nei linfociti che
danno origine al linfoma di Burkitt
ATTIVAZIONE
ONCOGENICA DEL GENE
ANTIAPOPTOTICO BCL-2
(traslocazione cromosomica)
in un linfoma delle cellule B
IgH
Bcl-2
18
Enhancer dell’IgH
IgH
Bcl-2
14/18
14
Punto di rottura
Cromosoma 14
Gene Bcl2 inattivo
Cromosoma 18
Riunione
delle rotture
Punto di rottura
Gene Bcl2 iperattivo nei linfociti B
Traslocazione
14/ 18
B cell lymphoma
La traslocazione tra i cromosomi 9 e 22 responsabile della leucemia mieloide cronica
Gene Bcr sul cromosoma 22
Gene Abl sul cromosoma 9
Cromosoma
Philadelphia
La proteina di fusione Bcr-Abl è una chinasi iperattiva
Sviluppo di farmaci antitumorali che agiscono attraverso
targeting molecolare
- Gleevec
- Herceptin
Una molecola di piccole dimensioni, il farmaco chiamato Gleevec, è stata
appositamente sintetizzata per bloccare l’attività della chinasi oncogena Bcr-Abl
Un anticorpo monoclonale chiamato Herceptin, specifico per il recettore HER2 è
stato appositamente prodotto per bloccare la crescita di tumori HER2-positivi
nucleus












