Fondamenti di Chimica Farmaceutica
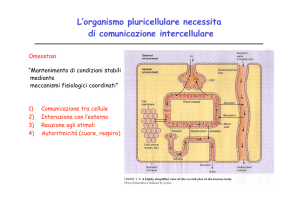
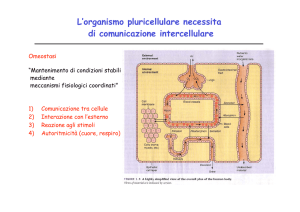
Recettori
Recettori
In biochimica, un recettore è
transmembrana o intracellulare, che
specifico ligando, causando nel
variazione conformazionale in seguito
un effetto biologico.
una proteina,
si lega ad uno
recettore una
alla quale si ha
In farmacologia invece il recettore è una molecola
qualsiasi, bersaglio di un farmaco.
La definizione di recettore assume in ambito farmacologico un
significato più ampio: viene infatti definito recettore qualsiasi
struttura biologica che diviene bersaglio del farmaco (proteine,
enzimi, lipidi ed acidi nucleici possono essere dei recettori.
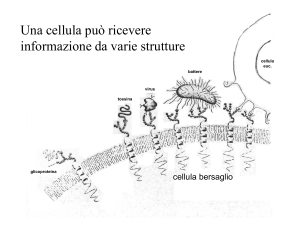
Recettori
Recettori
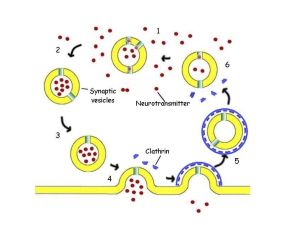
Neurotrasmettitori ed ormoni
Ione Ca+2
Lipidi (es. prostaglandine,
anandamide)
Purine (adenosina, ATP)
Neuropeptidi (endorfine, enkefaline)
Ormoni peptidici (angiotensina,
bradichinina
Enzimi (trombina)
Recettori
Attivazione dei recettori
Attivazione dei recettori
Tipi e sottotipi di recettori
Un recettore prende il nome dallo specifico
neurotrasmettitore
(nor)adrenalina recettore adrenergico
adrenergico
-adrenergico
1
2
RECETTORE
-adrenergico
TIPI
1
SOTTOTIPI
2
3
Tipi e sottotipi di recettori
Un recettore prende il nome dallo specifico
neurotrasmettitore
(nor)adrenalina recettore adrenergico
Di uno stesso recettore ne possono esistere vari tipi e
sottotipi.
La suddivisione di un recettore in tipi e sottotipi è
dimostrata farmacologicamente quando si dispone di
un ligando che mostra selettività tra i diversi tipi e
sottotipi.
Da un punto di vista biochimico due diversi sottotipi
di recettore hanno sequenza primaria differente.
Recettori
I recettori possono essere suddivisi in due grandi
famiglie, a seconda della loro localizzazione cellulare:
• recettori di membrana
• recettori intracellulari
I recettori di membrana, sono una classe di recettori
che possiede domini extracellulari, transmembrana ed
intracellulari.
I recettori intracellulari a seconda della
localizzazione si dividono in citosolici e nucleari.
loro
Recettori di membrana
Spazio extracellulare
Membrana cellulare
Spazio intracellulare
Questa classe di recettori è suddivisibile in due
differenti classi: ionotropici e metabotropici.
Recettori ionotropici
I recettori ionotropici sono detti anche recettoricanale perché, una volta legato il ligando,
permettono il flusso ionico attraverso la
membrana.
I recettori ionotropici racchiudono un poro
attraverso il quale avviene il flusso di ioni.
I canali, in assenza di legame, sono presenti in una
conformazione strutturale che ostruisce il poro,
impedendo il flusso di ioni.
Quando il legando si lega al recettore, questo
cambia la conformazione strutturale, aprendosi e
permettendo agli ioni di attraversare la
membrana.
Recettori canale
Recettori ionotropici
I recettori ionotropici si suddividono in pentamerici,
tetramerici e trimerici a seconda del numero di
subunità che li costituiscono.
Un esempio di recettori ionotropici pentamerici è il
recettore nicotinico (I) formato da 2 unità Alfa, 1 Beta,
1 Gamma ed 1 Delta). Un altro esempio è ilrecettore
della Glicina (II) formato da 3 unità Alfa e due Beta.
Recettori ionotropici
Tutte le subunità Alfa, Beta, Gamma e Delta sono in
realtà delle glicoproteine che hanno 4 eliche nella
porzione transmembranale.
La regione di legame corrisponde alla TM2 (la seconda
elica transmembranale).
Recettore nicotinico
PDB 1UV6
Recettore nicotinico
Recettore della glicina
PDB 2M6I
Recettori canale
Recettori canale
Recettori metabotropici
Al contrario dei recettori ionotropici il cui legame con
il ligando causa l'apertura del canale, il recettore
metabotropico, una volta legato il ligando, avvia una
serie di reazioni a cascata intracellulari mediata da
un secondo messaggero ed alla base della
trasduzione del segnale.
Come i recettori ionotropici, i recettori metabotropici
sono
localizzati
a
livello
della
membrana
citoplasmatica
e
sono
perciò
recettori
transmembrana.
Recettori metabotropici
I recettori metabotropici sono strutturalmente
eterogenei e possono essere suddivisi in quattro
principali tipologie strutturali e funzionali:
• recettori accoppiati alle proteine G (GPCR)
• recettori tirosin-chinasici
• recettori accoppiati a chinasi
• recettori guanilil-ciclasi
Recettori accoppiati a proteine G
I GPCR sono costituiti da una singola catena
polipeptidica.
La caratteristica strutturale è la presenza di 7
-eliche
transmembrana
con
un
dominio
extracellulare N-terminale di lunghezza variabile e un
dominio intracellulare C-terminale.
Recettori accoppiati a proteine G
I recettori accoppiati a proteine G (GPCRS) sono il
target di quasi la metà dei farmaci in commercio.
recettore metabotropico del glutammato
recettore muscarinico
recettore adrenergico
recettore GABA B
recettore della serotonina
recettore della dopamina
recettore dei cannabinoidi
recettore dell'angiotensina
recettore dei leucotrieni
recettore degli oppiodi
recettore della rodopsina
Recettori accoppiati a proteine G
L’albero evoluzionistico dei GPCR indica tra quali tipi
c’è maggiore similarità e questo è importante nella
progettazione di un farmaco
Recettori accoppiati a proteine G
I GPCR vengono divisi in tre distinte famiglie
che differiscono principalmente per la
lunghezza della sequenza N-terminale e la
localizzazione del sito di legame per
l'agonista.
La famiglia A, a cui appartiene la rodopsina, è
di gran lunga la più numerosa e comprende la
maggior parte dei recettori per le monoamine
e i neuropeptidi.
La famiglia B è costituita dai recettori della
secretina, del glucagone e della calcitonina.
La famiglia C è costituita principalmente dai
recettori metabotropici del glutammato e dai
recettori sensibili al Ca+2.
Recettori accoppiati a proteine G
La proteina G si lega al terzo lungo loop
citoplasmatico.
Modifiche di questa porzione della proteina
determinano la formazione di recettori ancora
in grado di legare i propri ligandi, ma incapaci
di accoppiarsi alle proteine G e di determinare
i conseguenti effetti.
Recettori accoppiati a proteine G
Allo stato di riposo, la proteina G si trova in forma di
trimero ed ha una molecola di GDP legato ad un
sito specifico della subunità .
Recettori accoppiati a proteine G
L'interazione del recettore con una molecola
di agonista determina un cambiamento
conformazionale, che si estende al dominio
citoplasmatico del recettore e si trasmette alla
proteina G. Questo determina il rilascio del
GDP legato e la sua sostituzione con il GTP.
Recettori accoppiati a proteine G
Questa modificazione, a sua volta, causa la
dissociazione il distacco dal trimero della subunità
complessata dal GTP.
Recettori accoppiati a proteine G
La -GDP che così si forma, si dissocia dall'effettore
e si combina con , completando in tal modo il
ciclo.
Recettori accoppiati a proteine G
PDB: 3NS6
Recettori accoppiati a proteine G
Le forme attive della proteina G possono legarsi con
enzimi e canali ionici, causandone, l'attivazione o
l'inattivazione. Il processo termina con l'idrolisi del
GTP a GDP da parte della subunità .
Recettori accoppiati a proteine G
I principali bersagli delle proteine G, attraverso i
quali i GPCR controllano diversi aspetti delle
funzioni cellulari:
• adenil ciclasi: l'enzima responsabile della
formazione del cAMP;
• fosfolipasi
C:
l'enzima
responsabile
della
formazione
dell'inositolo
trifosfato
e
del
diacilglicerolo;
• canali ionici: in particolare i canali del calcio e del
potassio.
Recettori accoppiati a proteine G
Il meccanismo porta a un'amplificazione del segnale:
un singolo complesso agonista-recettore può attivare
parecchie proteine G per volta;
ogni proteina G può rimanere associata con l'enzima
effettore per tempi sufficientemente lunghi da
determinare la formazione di molte molecole di
prodotto;
questo
prodotto
è solitamente
un
"secondo
messaggero", per cui si verifica un'ulteriore
amplificazione della risposta cellulare finale.
Recettori accoppiati a proteine G
Attivazione dell’adenilato ciclasi
Recettori accoppiati a proteine G
Attivazione di chinasi
Recettori accoppiati a proteine G
Effetti della fosforilazione
Recettori accoppiati a proteine G
Ci sono tre principali classi di proteine G
strutturalmente e funzionalmente differenti:(Gs, Gi e
Gq), selettive sia per i recettori che per gli effettori con
i quali si accoppiano:
le proteine Gs attivano l’enzima adenil ciclasi;
le proteine Gi inibiscono l'enzima adenil ciclasi;
le proteine Gq controllano la fosfolipasi C.
Recettori tirosin chinasici
I Recettori tirosin chinasici agiscono fosforilando
residui di tirosina in una proteina bersaglio.
Sono costituiti da un dominio extracellulare che
possiede un sito di legame per il ligando specifico, e
un dominio intracellulare che possiede un sito di
attacco per l'ATP e uno per le proteine bersaglio.
Recettori tirosin chinasici
Recettori tirosin chinasici
Il recettore dell’insulina
PDB: 3LOH
Recettori associati a chinasi
I recettori associati a chinasi (tirosin chinasi) hanno
una funzione simile a quella dei recettori chinasici,
ma non possiedono l’unità catalitica, vi si legano e
l’attivano dopo che si sono legati al ligando
specifico.
Recettori intracellulari
Il recettore intracellulare è una struttura recettoriale di
natura proteica localizzata a livello intracellulare.
I recettori intracellulari interagiscono con ligandi di
natura ormonale o molecole lipofile specifiche.
Il complesso ligando-recettore funziona da fattore di
trascrizione, migra nel nucleo cellulare e regola
l'espressione genica.
Recettori intracellulari
I recettori intracellulari possono essere suddivisi in:
recettori
citosolici
e
recettori
nucleari
e
successivamente in altre sottoclassi recettoriali.
Recettori citosolici
Recettori dei glucocorticoidi
Recettori dei mineralcorticoidi
Recettori nucleari
Recettori degli estrogeni
Recettori del progesterone
Recettore degli androgeni
Recettore degli ormoni tiroidei
Recettore della vitamina D
Recettori dell' acido retinoico
Recettori intracellulari
I recettori intracellulari sono costituiti da una sola
sequenza che varia da 400 a 1000 amminoacidi.
Ogni recettore è costituito da 3 regioni funzionali:
porzione -NH2 terminale
porzione centrale
porzione -COOH terminale
Recettori intracellulari
Gli steroidi (es. testosterone,
estradiolo,
progesterone),
dovendo
attraversare
la
membrana, sono molecole
idrofobiche
Recettori intracellulari