Infezioni delle vie respiratorie
Giovanni Di Bonaventura, Ph.D.
CI Medicina di Laboratorio
CL Medicina e Chirurgia
Università “G. d’Annunzio” di Chieti-Pescara
AA 2011-2012
Difese
• Sistema delle vie respiratorie
• Flora normale (commensale)
• Protezione “meccanica”
2
Sistema delle vie respiratorie
• Principale via di ingresso
per le infezioni
• Vie superiori
– Bocca, naso, cavità
nasale, seni, gola,
epiglottide e laringe
• Vie inferiori (basse)
– Trachea, bronchi e
bronchioli nei polmoni
3
Flora normale
•
•
•
•
•
Commensali
Limitata al tratto superiore
Principalmente Gram+
Antagonismo microbico (competizione)
Immunocompromessi a rischio
4
Protezione
•
•
•
•
•
•
Peli del naso
Cilia (mucosa tracheale)
Bronchi
Muco
Risposte involontarie (tosse, starnuti)
Cellule del sistema immune
5
Infezioni respiratorie
• Alte vie
respiratorie
• Alte e basse vie
respiratorie
• Basse vie
respiratorie
6
Infezioni delle
Alte vie respiratorie
•
•
•
•
•
Raffreddore comune
Sinusiti
Infezioni dell’orecchio
Faringiti
Difterite
7
Raffreddore comune
(rinite)
• Eziologia:
– generalmente virale (oltre 200 virus)
– possibili infezioni secondarie batteriche
•
•
•
•
•
Prevalente nella popolazione umana
Trasmissione: per contatto indiretto o per via aerogena
Diagnosi: non necessaria
Non esistono vaccini
Non richiede chemioterapia (solo terapia sintomatica)
8
Sinusite
• Infiammazione dei seni paranasali
• Eziologia:
– generalmente batterica (Streptococcus pneumoniae, quindi
Haemophilus influenzae, Moraxella catharralis, Streptococcus
spp.; spesso infezioni miste)
– anche virale
– raramente fungina (soprattutto nei pz immunocompromessi)
• Trasmissione:
– endogena (opportunismo) o traumatica (funghi)
• Diagnosi:
– su base clinica (e/o diagnostica per immagini)
– coltura generalmente non necessaria
• Terapia:
– antibiotici ad ampio spettro
– rimozione agente fungino
9
Infezione dell’orecchio
•
•
•
•
•
Infezione batterica
Otite media acuta
Comunemente secondaria a rinite
Presenza di effusione (liquido di natura infiammatoria)
Biofilm batterici possono essere associati alle otiti medie
croniche
• Diagnosi:
– clinica, mediante esame otoscopico e timpanometria
• Terapia:
– antibiotica ad ampio spettro (in assenza di diagnosi eziologica):
amoxicillina, ampicillina, SXT, ceftriaxone
10
I batteri possono migrare attraverso la tuba di Eustachio dalle vie respiratorie
superiori. L’accumulo di muco e fluidi può causare infiammazione ed effusione
11
Faringite
• Infiammazione del faringe, ipofaringe, ugole e tonsille
• Trasmissione per droplet e/o contatto diretto
• Infezione virale (sintomi nasali o faringei)
– Adenovirus, Rhinovirus virus parainfluenzali, EBV
• Infezione batterica (solo sintomi faringei)
– Streptococcus pyogenes (gruppo A), causa più comune di faringite
• Portatori sani: 20% nei bambini, % minore negli adulti
– Streptococchi gruppo C, di origine animale: Streptoccocus equi subsp.
zooepidemicus e subsp. equi, Streptococcus dysgalactiae subsp. dysgalactiae
e subsp. equisimilis, Streptococcus constellatus susp pharyngis
– Streptococchi gruppo G (Streptococcus anginosus)
12
Streptococcus pyogenes
•
•
•
•
Gruppo A di Lancefield
Streptolisine (emolisine)
Fattori di diffusione tessutale
Acidi lipoteicoici
– adesine
• Proteina M
– Antifagocitaria
• Tossina eritrogenica
• Tossine possono agire come “superantigeni”
– Iperstimolazione dei linfociti T
• Iperespressione di citochine (es. TNF-alfa)
Difterite
• Infezione batterica causata da ceppi tossigeni di
Corynebacterium diphtheriae (dei quali sono noti 4 biotipi –
gravis, mitis, intermedius, e belfanti) ed alcuni ceppi tossigeni di
Corynebacterium ulcerans e Corynebacterium
pseudotuberculosis
• Trasmissione per contatto diretto/indiretto con fomites
contaminati, droplets
• Esotossina difterica A-B
• Formazione di membrana su tonsille o faringe (in alcuni casi
anche sulla trachea – croup respiratorio)
• Vaccino (tossoide difterico, parte di DTaP)
• Terapia: antitossina + penicillina o eritromicina
14
Segni caratteristici di difterite: faringe e tonsille infiammati caratterizzati
dalla presenza di una (pseudo)membrana (cotenna) formata dai fibrina,
leucociti e detriti cellulari.
15
Meccanismo di azione della
tossina A-B di Corynebacterium
diphtheriae.
16
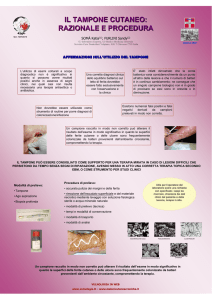
Tampone faringeo-tonsillare
(faringotonsillite, difterite, angina Vincent, pertosse, infezioni virali)
PRELIEVO DEL CAMPIONE
•
MODALITA’ DI PRELIEVO
– Utilizzando un abbassalingua, comprimere
delicatamente la lingua sul pavimento della
bocca.
– Inserire il tampone tra le tonsille, al disotto
della ugola, evitando di toccare la mucosa
delle guance, la lingua, l'ugola e le labbra che
sono fortemente colonizzate dalla flora
commensale.
– Strofinare o ruotare vigorosamente il tampone
sul retrofaringe.
– Utilizzare tamponi in dacron, evitando il
cotone (tossico per alcune specie microbiche)
o l’alginato di calcio (inibitori PCR)
– Non eseguire mai il tampone faringeo se vi è
un sospetto di epiglottidite acuta perché può
indurre una grave ostruzione delle vie aeree
superiori. La diagnosi di tale malattia è
esclusivamente clinica.
Tampone faringeo-tonsillare
(faringotonsillite, difterite, angina Vincent, pertosse, infezioni virali)
•
PERIODO DI ESECUZIONE
– All’insorgenza dei sintomi.
– E' preferibile effettuare il prelievo a digiuno; va evitato l'uso di disinfettanti
locali, antimicotici e antibiotici nei 3-5 giorni precedenti il prelievo.
TRASPORTO E CONSERVAZIONE DEL CAMPIONE
•
•
TEMPO FRA PRELIEVO DEL CAMPIONE E PROCEDURA ANALITICA
– I campioni devono essere trasportati e processati il rapidamente possibile.
– Per la ricerca di N. gonorrhoeae/meningitidis la condizione ottimale si
raggiunge con la semina diretta dei campioni sui terreni al momento del
prelievo ed incubazione senza ritardi. Il tempo di trasporto deve essere il più
breve possibile.
ACCORGIMENTI SPECIALI PER RIDURRE IL DETERIORAMENTO
– I tamponi devono essere inviati in terreno di trasporto (Amies o Stuart).
– Se la semina è ritardata, si preferisce la conservazione refrigerata a quella a
temperatura ambiente.
– La conservazione protratta (>48 h) a
temperatura controllata è, tuttavia,
sconsigliata perché alcune specie patogene
soffrono la refrigerazione (pneumococco,
Haemophilus).
Tampone faringeo-tonsillare
PROCEDURA SUL CAMPIONE
•
•
ESAME MICROSCOPICO
– La microscopia è patognomonica soltanto per la angina di Vincent (ricerca di
Borrelia vincentii e Fusobacterium spp.)
– Non ha senso eseguirla routinariamente nella diagnosi di laboratorio delle
infezioni delle alte vie respiratorie per la massiccia presenza di batteri
commensali non patogeni.
COLTURA E RICERCHE
– Inoculare ciascuna piastra di agar con il tampone
Tampone faringeo: POS (Procedure Operative Standard)
TERRENI DI COLTURA, CONDIZIONI E MICRORGANISMI
(Health Protection Agency UK, 2005-2008)
Tampone faringeo
Ricerca di Streptococcus pyogenes
L’isolamento colturale è il GOLD STANDARD. Tuttavia, è possibile porre diagnosi
rapida mediante ricerca antigenica (agglutinazione al lattice) nel campione.
• SEMINA
– Il tampone viene inoculato per strisciamento su piastre al sangue non- o selettive
(Columbia CNA agar, contenente colistina ed acido nalidixico vs Gram-).
– Le piastre vengono incubate in atmosfera al 5-10% di CO2 od in anaerobiosi ad una
temperatura di 37 °C per 16-24 h.
•
ASPETTO COLONIE
– Piccole dimensioni (diametro: 0.5 mm), cupoliformi, con margine continuo, secche (o
raramente mucose); può essere difficile prelevare le colonie dalla piastra.
– La beta-emolisi (lisi completa dei globuli rossi con formazione di un alone di
chiarificazione del sangue attorno alla colonia) è più evidente in condizioni
anaerobiche perché le emolisine sono più stabili in assenza di ossigeno.
•
ASPETTO MICROSCOPICO
– Colorazione Gram: cocchi Gram+, disposti in corte o lunghe catenelle, talvolta a
grappolo.
•
TESTS BIOCHIMICI
– Catalasi-negativo (vs stafilococchi, catalasi+)
– La sensibilità alla bacitracina a bassa concentrazione è stata utilizzata come metodo
di screening, ma i risultati non sono attendibili. E’ stata segnalata resistenza alla
benzilpenicillina.
– Positività alla prova della pyrrolidonyl arylamidasi (PYR), sebbene anche alcuni ceppi
dei gruppi C e G isolati dall’uomo siano positivi.
– Sensibilità alla bile
Tipizzazione di Lancefield
Strept. pyogenes: catalasi neg
Staph. aureus: catalasi pos
23
PYR rapid test
Tampone faringeo
Ricerca di Streptococchi beta-emolitici gruppi C-G-B
•
•
La presenza di Streptococchi β-emolitici di gruppo C o G (Streptococcus
anginosus) deve essere riesaminata se in carica medio-bassa, per escludere
l'eventualità di una contaminazione transitoria.
E’ opportuno segnalare la presenza di Streptococchi β-emolitici di gruppo B (S.
agalactiae) nei neonati per consentire la valutazione della contaminazione del
bambino in seguito al parto e il rischio di sviluppo di meningite o sepsi in età
perinatale (fino al 1° mese).
Tampone faringeo
Ricerche particolari su richiesta specifica
A. Tampone faringeo, tampone rino-faringeo per la diagnosi di DIFTERITE
• Il tampone viene inoculato su terreno di Tinsdale/Hoyle (agar tellurito) e
incubato a 37°C in atmosfera di CO2 al 5 % per 24-48 ore.
• Colonie sospette per C. diphtheriae: ∅: 1-3 mm, colore grigio-nerastro.
• Tests biochimici: catalasi positive.
• Dalle colonie con morfologia sospetta si può eseguire una colorazione di
Gram per verificare le presenza di bastoncelli Gram+, da tipizzare poi
biochimicamente.
• L’isolato positivo deve essere testato per la produzione della esotossina
difterica, mediante reazione di immunoprecipitazione in agar.
• Esame negativo: assenza di C. diphtheriae
• Esame positivo: presenza di C. diphtheriae produttore di esotossina
difterica.
Crescita su agar tellurito (Hoyle agar). I corinebatteri metabolizzano il tellurito di
potassio presente nel terreno riducendolo a metallo (tellurio), la cui precipitazione
conferisce una colorazione grigio-nerastra alle colonie.
Corynebacterium dyphtheriae può crescere su questo terreno in tre diverse
varianti coloniali: gravis (colonie grandi, piatte, grigio-nerastre); mitis (colonie più
piccole, lucide e cupoliformi); intermedius (colonie molto piccole, lucide o meno).
Corynebacterium diphtheriae, mitis,
produttore di H2S su Tinsdale agar
Corynebacterium xerosis, non
produttore di H2S su Tinsdale agar
Crescita su agar tellurito-cisteina (Tinsdale agar). Questo terreno contiene,
oltre al tellurito, anche cisteina. Alcune specie di Corynebacterium sono capaci di
produrre H2S, formatosi per reazione tra cisteina e tellurito, producendo un alone
marrone diffuso attorno alle colonie nerastre contenenti tellurio.
Corynebacterium diphtheriae, agente eziologico di difterite, è un bacillo
Gram-positivo che può assumere caratteristiche disposizioni: a “lettere
cinesi”, a palizzata, a “V”.
Evidente è la presenza di inclusioni (globoidi e periferiche), formate
da polifosfati e chiamate granuli metacromatici (volutina).
Tampone faringeo
Ricerche particolari su richiesta specifica
B. Esame microscopico per l'angina di Vincent
• Il tampone faringeo viene strisciato su vetrino portaoggetti, colorato
con colorazione di Gram (o Ziehl-Nielsen) ed esaminato a massimo
ingrandimento (x 1.000).
• Esame negativo: presenza di morfotipi propri della flora commensale
(cocchi Gram+ e Gram-, bastoncelli Gram+ e/o Gram-, miceti).
• Esame positivo: presenza di fusobatteri (Fusobacterium spp) o spirilli
Gram- (Borrelia spp), normalmente assenti nella flora orofaringea.
Borrelia burdorferi
Fusobacterium spp.
Tampone faringeo
Ricerche particolari su richiesta specifica
D. Tampone (rino)faringeo, tampone nasale per diagnosi di infezione VIRALE
• Entrambi questi materiali sono idonei per la diagnosi di infezione virale perché
i virus, contrariamente ai batteri, sono presenti in fase di replicazione attiva
sia a livello delle basse che delle alte vie respiratorie.
• Il tampone viene strisciato su appositi vetrini.
• I vetrini vengono quindi fissati con acetone e testati con anticorpi polispecifici
(screening) o monospecifici (conferma) fluoresceinati.
• Il preparato viene letto al microscopio a fluorescenza.
• Ricerca routinaria per: virus influenzali A/B, virus parainfluenzali 1/2/3, Virus
Respiratorio Sinciziale, Adenovirus, Coronavirus.
Esame negativo: assenza di fluorescenza specifica
Esame positivo: presenza di fluorescenza specifica.
NOTA: la diagnosi di faringite da Epstein-Barr virus viene comunemente posta
mediante indagine sierologica e/o ricerca virale diretta su tampone faringeo
con tecniche molecolari (PCR).
Tampone nasale
MODALITA’ DI PRELIEVO DEL CAMPIONE:
• Invitare il paziente ad assumere una posizione eretta con la testa
leggermente china all’indietro
• Inserire il tampone nella narice e spingerlo accuratamente lungo il
pavimento della coana nasale per circa 2.5 cm
• Ruotare il tampone più volte per raccogliere il campione biologico
• Rimuovere il tampone ed inserirlo nel terreno di trasporto
• Effettuare il prelievo in entrambe le narici
TRASPORTO E CONSERVAZIONE DEL CAMPIONE
• Mantenere i campioni a temperatura ambiente (terreno di
trasporto) o refrigerare per la ricerca del genoma virale
• Inviare al laboratorio appena possibile (non oltre le 24h)
Tampone rino-faringeo
MODALITA’ DI PRELIEVO DEL CAMPIONE:
• Dopo aver immobilizzato la testa del paziente, inserire con cautela
il tampone sottile in una narice fino a raggiungere la parete
posteriore del rinofaringe
• Mantenere il tampone “in situ” per qualche secondo prima di
estrarlo.
• Ripetere l’operazione con un altro tampone per l’altra narice
TRASPORTO E CONSERVAZIONE DEL CAMPIONE
• Mantenere i campioni a temperatura ambiente (terreno di
trasporto) o refrigerare per ricerca virale
• Inviare al laboratorio il prima possibile (non oltre le 24h)
Epiglottidite
• Infezione batterica (Haemophilus influenzae tipo B nell’85% dei casi)
nei bambini al di sotto dei 5 anni
• Frequentemente, è presente una concomitante infezione virale
• Esordio improvviso: febbre, ansietà, estensione del collo nel tentativo
di aprire le vie aeree
• Epiglottide arrossata ed ingrossata
• Ostruzione completa delle vie respiratorie nei soggetti più piccoli
• Poiché il traumatismo del prelievo mediante tampone faringeo può
aggravare l’ostruzione, questa procedura è vivamente sconsigliata in
tutti i casi di sospetta epiglottidite.
• I tamponi faringei possono essere utili per determinare la
colonizzazione delle vie aeree superiori da H. influenzae tipo b e di
solito sono prelevati solo per studi a carattere epidemiologico.
33
Haemophilus influenzae.
Bacillo Gram-negativo
Haemophilus influenzae. Crescita su agar cioccolato
Infezioni delle
Alte e Basse vie respiratorie
• Pertosse
• Virus respiratorio sinciziale
• Influenza
35
Pertosse
• Infezione batterica (Bordetella pertussis, B. parapertussis)
• Può colpire individui di tutte le età, ma la sua
manifestazione è più frequente nei bambini dai 2 ai 6
anni.
• Fase “catarrale” – sintomatologia lieve
• Fase “parossistica” (convulsiva) – accessi di tosse violenti
(2-4 settimane)
• Fase di convalescenza – danno ciliare
• Tossina
– tox A-B, tropismo tracheale
36
37
Diagnosi di pertosse
TIPOLOGIA DEL CAMPIONE:
• L’aspirato nasofaringeo è il campione raccomandato. In alternativa,
possono essere utilizzati i tamponi nasali e nasofaringei. Si consiglia il
prelievo di 2 tamponi: ricerca Bordetella spp + ricerca virus.
PRELIEVO DEL CAMPIONE:
• La raccolta delle secrezioni nasofaringee nei pazienti con pertosse può
fare insorgere un eccesso parossistico di tosse e determinare
l’ostruzione delle vie aeree. Necessaria la strumentazione per la
rianimazione. Rischio biologico per personale sanitario (non è
raccomandato l’isolamento mediante piastre esposte a colpi di tosse).
• Un tampone transnasale (Dacron TM con filo di supporto flessibile) è
inserito attraverso la narice e fatto penetrare lungo la base del naso fino
a raggiungere il nasofaringe. Mantenere il tampone contro la parete
posteriore del nasofaringe per almeno 30 secondi o fino a quando il
paziente tossisce.
• L’essudato nasofaringeo viene raccolto, mediante catetere da suzione
inserito attraverso il naso, in un contenitore sterile di plastica
Diagnosi di pertosse
TRASPORTO E CONSERVAZIONE DEL CAMPIONE
• I campioni devono essere trasportati e processati il più presto possibile
• Le piastre possono essere seminate al letto del paziente
ESAME COLTURALE
• I materiali campionabili sono seminati su terreni di coltura specifici: BordetJengou o, meglio, Regan-Lowe (RL) Medium (charcoal agar arricchito con
sangue defibrinato di cavallo e addizionato con cefalexina).
• Le piastre vengono incubate a 37 °C in 5% CO2 per 10-12 giorni. Dal 3°- 4°
giorno si può apprezzare lo sviluppo di B. pertussis: colonie piccole,
grigiastre, traslucide, a "goccia di mercurio".
• Caratteristiche biochimiche: scarsissima reattività alle più comuni prove
biochimiche (assenza di crescita su agar sangue, motilità negativa, ureasi
negativa, produzione di nitrati negativa, ossidasi positiva) per cui l’ID delle
colonie viene confermata con antisieri specifici (test di agglutinazione).
Esame negativo: assenza di colonie di B. pertussis
Esame positivo: presenza di colonie di B. pertussis
Virus respiratorio sinciziale umano (RSV)
Caratteristiche della malattia
40
Influenza
• Prevalente durante la stagione invernale
• Infezione virale (Orthomyxovirus)
• Glicoproteine di superficie
– Emoagglutinina (HA):
• specifici epitopi si legano ai residui di acido sialico sulle cellule
della mucosa respiratoria
• soggetta a cambiamenti (antigenic drift, shift)
• causa l’agglutinazione dei globuli rossi
– Neuraminidasi (N):
• cliva i residui di acido sialico
presenti nel muco, favorendo la
liberazione dei virioni
• soggetta a cambiamenti
(antigenic drift, shift)
41
Il fenomeno “antigenic shift” (deriva
antigenica) consiste in uno scambio di
sequenze geniche, codificanti per
glicoproteine virali, tra differenti virus
influenzali (co-infezione del maiale con
virus aviario ed umano), portando alla
formazione di un virus ricombinante
dotato di caratteri antigeni non più
riconosciuti dalla risposta anticorpale
dell’ospite.
E’ responsabile di fenomeni pandemici.
42
Diagnosi di influenza umana
CAMPIONI RESPIRATORI
• Tamponi nasali ed aspirati naso-faringei, maggiormente
sensibili vs tampone faringeo.
• Aspirato tracheale e lavaggio bronchiale, nei pazienti
intubati
• Raccogliere i campioni entro i primi 4 giorni dalla
comparsa dei sintomi (resa maggiore)
CAMPIONI EMATICI
• I campioni di sangue sono raccolti nella fase acuta e
convalescente della malattia (intervallo 14-21 gg) per
dimostrare un aumento significativo (almeno 4-fold) dei
livelli anticorpali specifici
43
Aspirato naso-faringeo
MODALITA’ DI PRELIEVO DEL CAMPIONE:
• Invitare il paziente ad una posizione supina
• Inondare la cavità nasale con 3-5 ml soluzione fisiologica
• Aspirare delicatamente la soluzione di lavaggio mediante
pompetta, siringa o catetere
• Ripetere l’operazione nell’altra narice
TRASPORTO E CONSERVAZIONE DEL CAMPIONE
• Mantenere i campioni refrigerati
• Inviare al laboratorio il prima possibile (non oltre le 24h)
Diagnosi di influenza umana
SIGNIFICATO CLINICO DELLA DIAGNOSI
• Diagnosi rapida importante se prevista terapia precoce
con farmaci antivirali costosi (pz con rischio elevato di
gravi complicanze)
– la diagnosi di influenza nel soggetto anziano allerta il
clinico per il rischio di complicanze infettive batteriche
(S. aureus, H. influenzae, S. pneumoniae)
• Controllo delle infezioni nosocomiali (riduzione della
diffusione dell’infezione tra pazienti e da personale
sanitario a pazienti ad alto rischio)
• Valore prognostico nei giovani adulti, nei quali la malattia
ha un decorso breve e benigno
45
Diagnosi di influenza umana
TESTS DIRETTI (tipizzazione di influenza virus: A / B)
• Test di immunofluorescenza (IF) diretta/indiretta
– Ag virali rivelati da Ab fluorescinati (diretta) o da Ab
anti-Ig fluorescinati (indiretta)
– Influenzati dalla quantità di cell. epiteliali nel campione
• Tests immunoenzimatici (EIA)
– Ag virali rivelati da Ab legati ad un enzima in grado di far
virare il substrato cromogeno
– Rapidi (10-30 min), più costosi di IF
46
Diagnosi di influenza umana
TESTS DIRETTI (tipizzazione di influenza virus: A / B)
• Isolamento virale
– In uova embrionate di pollo (altamente sensibile;
produzione di stock virali per monitoraggio
epidemiologico)
– In colture cellulari (cellule di rene di scimmia o di cane)
• evidenziazione effetti citopatici in 5-14 gg, mediante
emoadsorbimento od immunofluorescenza
– Maggiormente sensibile vs EIA, IF
• RT-PCR (real-time PCR)
– la tecnica più sensibile
– rapida (2-3 ore)
– può inoltre differenziare i sottotipi H ed N
47
Diagnosi di influenza umana
TESTS INDIRETTI
• Esame sierologico
– Identificazione di Ab totali o classe-specifici (IgG, IgM,
IgA) mediante:
•
•
•
•
Inibizione della emoagglutinazione
Fissazione del Complemento
EIA
IF indiretta
– Positività in caso di aumento (≥ 4-fold) del titolo
anticorpale tra la fase acuta e quella di convalescenza
(14-21 gg tra i due prelievi)
– Utile per individuare soggetti con infezione recente
– Consente di valutare la risposta alla vaccinazione
48
49
Infezioni delle
Basse vie respiratorie
• Tubercolosi
• Polmonite
50
Tubercolosi
• Infezione batterica
– Mycobacterium tuberculosis
– Mycobacterium avian
• tubercolosi “disseminata” nei pazienti con AIDS
• Tipologie
– Primaria
– Secondaria
– Disseminata
51
M. tuberculosis
• Lenta crescita (tempo di generazione medio: 15-20 h)
• Acidi micolici e superficie cerosa
• Primaria
– Tubercoli, caseosa, reazione alla tubercolina
• Secondaria (riattivazione)
– Consolidamento
• Disseminazione
– TB extrapolmonare (linfonodi, rene, ossa, tratto genitale, cervello,
meningi)
52
Il tubercolo polmonare consiste in un granuloma formato da
un nucleo centrale di necrosi caseosa contenente batteri
all’interno di macrofagi giganti, e da una parete esterna
formata da fibroblasti, linfociti e neutrofili.
53
Diagnosi di tubercolosi
• FASE INIZIALE:
– Esame radiologico (raggi X)
– Test cutaneo (reazione alla tubercolina o di Mantoux)
• QUINDI:
– Colorazione Ziehl-Neelsen
– Metodiche rapide (IF) + coltura
Esame radiografico (raggi X): infezione tubercolare secondaria.
55
Test cutaneo per la tubercolosi: reazione alla tubercolina
56
Colorazione fluorescente per l’identificazione di
Mycobacterium tuberculosis.
57
Le colonie di M. tuberculosis hanno un caratteristico aspetto
granulare e ceroso, che permette al batterio di sopravvivere
all’interno di macrofagi.
58
Colorazione di Ziehl-Neelsen (acido-resistente) usata per
identificare Mycobacterium tuberculosis.
59
Caratteristiche della tubercolosi.
60
Polmonite
• Infezione:
– Batterica
– Virale
– Fungina
• Infiammazione del polmone con alveoli
ripieni di fluido
• Acquisita in comunità
• Nosocomiale
61
Polmonite batterica
• Streptococcus pneumoniae
• Legionella
• Mycoplasma pneumoniae
62
Streptococcus pneumoniae
• Pneumococco
• 2/3 delle polmoniti viene contratta in comunità
• Non può sopravvivere al di fuori del proprio
habitat
• Alto rischio: anziani, stagionalità, presenza di
infezione virale, diabete, consumo di alcool e/o
stupefacenti
• Variabilità dell’antigene capsulare
• Consolidamento
63
S. pneumoniae. La colorazione di Gram rivela caratteristici
coppie cellulari. La coltura su agar sangue mostra alfa-emolisi.
Streptococcus pneumoniae
64
Il consolidamento consiste nel blocco infiammatorio di
bronchioli ed alveoli, con formazione di essudato.
Polmonite batterica: consolidamento.
Legionella
• Infezione infrequente ma grave
• Sopravvive nell’habitat naturale (acqua di
rubinetto, sorgenti termali, ecc.)
• Malattia opportunistica
66
Legionella è un organismo intracellulare capace di
sopravvivere nelle amebe e nei fagociti umani.
Legionella intracellulari
67
Mycoplasma pneumoniae
• Il più piccolo tra i batteri conosciuti
• Assenza di parete cellulare
• Walking pneumoniae – polmonite atipica
68
Infezione virale
• Hantavirus
– Malattia emergente
– Sindrome respiratoria acuta
• Disseminazione ematica dell’antigene di Hantavirus
• Perdita di fluido dai vasi sanguigni
• Severe Acute Respiratory Syndrome (SARS)associated Coronavirus
– Concentrata in Cina e sud-est asiatico
– Pochi casi in Australia, Canada e USA
– Sintomatologia similare a quella indotta da
influenzavirus e virus sinciziale respiratorio (RSV)
– Il genoma virale è stato interamente sequenziato
69
Infezione fungina
• Histoplasma capsulatum
–
–
–
–
–
Causa la malattia di Darling (o febbre Ohio Valley)
Manifestazione benigna: Benigna o grave, Acuta o cronica
Intracellulare
Pazienti affetti da AIDS sono ad alto rischio
Endemica
• Pneumocystis jiroveci
–
–
–
–
Già denominato Pneumocystis carinii
Infezione opportunistica in pazienti con AIDS
Intracellulare ed extracellulare
Cianosi
70
Polmonite
Diagnosi microbiologica
TIPOLOGIA DEL CAMPIONE
– ESCREATO: per i campioni di escreato (almeno 1 ml) si richiede
che il materiale sia di provenienza dalle vie respiratorie inferiori
ottenuto con colpi di tosse profondi. Quando la tosse è secca,
possono essere utili la fisioterapia, il drenaggio posturale o
l’inalazione di un aerosol prima dell’espettorazione.
– LAVAGGIO BRONCOALVEOLARE (BAL - bronchoalveolar lavage):
Dopo inserzione di un broncoscopio flessibile si ‘lava’ con
soluzione fisiologica sterile (max quantità possibile) un segmento
polmonare, ottenendo in tal modo componenti cellulari e nondella superficie della mucosa del tratto respiratorio inferiore.
– ALTRI CAMPIONI: campioni prelevati broncoscopicamente con
spazzolamento protetto, campioni da spazzolamento bronchiale
“cieco” e lavaggio broncoalveolare non diretto.
71
Polmonite
Diagnosi microbiologica
TRASPORTO E CONSERVAZIONE DEL CAMPIONE
• I campioni devono essere trasportati e processati il più presto
possibile.
• L’escreato può essere refrigerato per 2-3 ore senza una perdita
apprezzabile dei patogeni. Qualsiasi ritardo oltre questo limite di
tempo può consentire la sovracrescita di bacilli Gram- e la mortalità
di Haemophilus e S. pneumoniae.
• Quando il trasporto è difficoltoso, i campioni possono essere
refrigerati e seminati entro 48 ore dal prelievo, ponendo attenzione
all’interpretazione dei risultati.
72
Polmonite
Diagnosi microbiologica
La ricerca e l’isolamento di microrganismi responsabili di
polmonite dipendono da:
– Adeguatezza del campione delle basse vie respiratorie
– Assenza di contaminazione della flora del tratto respiratorio
superiore
– Utilizzo delle tecniche microscopiche e colturali
– Trattamenti antimicrobici recenti in corso
• La differenziazione fra colonizzazione tracheobronchiale e vera
infezione polmonare può risultare difficile.
73
Polmonite
Diagnosi microbiologica
La colorazione di Gram su campioni di escreato può essere utilizzata per:
1. verificare la qualità del campione:
– per le colture sono selezionati campioni purulenti (presenza di PMNs) e
non contaminati con cellule epiteliali squamose;
– gli escreati dei pazienti immunodepressi od ove sussistano difficoltà per
la ripetizione del campione non dovrebbero essere rifiutati.
2.
predire la probabilità di riscontro dei patogeni in funzione delle loro
caratteristiche morfologiche:
– il campione dovrebbe essere osservato prima della sua coltura;
– porre attenzione all’interpretazione del Gram, poiché l’uso di
antimicrobici può rendere non vitali i microrganismi osservati sul vetrino;
– può essere inappropriato identificare i microrganismi in caso di
grossolana contaminazione da flora orofaringea;
– la sensibilità del Gram può variare e spesso dipende da un nuovo
controllo soggettivo del vetrino;
– la colorazione Gram consente l’identificazione di ife di lieviti, ma è di 74
qualità inferiore rispetto all’idrato di potassio ed ai coloranti fluorescenti.
Polmonite
Diagnosi microbiologica
Coloranti fluorescenti
• Nella ricerca dei bacilli acido-alcool resistenti sono preferiti coloranti
quali auramina-fenolo perché più rapidi e sensibili rispetto allo Ziehl
Neelsen (Z-N). Gli strisci auramina positivi possono essere confermati
con una sovra-colorazione con Z-N.
• Calcofluor bianco, ed altri coloranti fluorescenti sono particolarmente
idonei per visualizzare le ife fungine. Sono lievemente più sensibili
delle colorazioni con KOH, e di lettura è più rapida. Forniscono inoltre
informazioni morfologiche più dettagliate rispetto ai coloranti KOH,
sufficienti a riconoscere i Mucorales (grandi ife non settate) da quelle
simil-Aspergillus (sottili, settate, con ramificazioni a 45°).
• I coloranti per Pneumocystis jiroveci, agente causale della polmonite
pneumocistica, sono per lo più fluorescenti.
• Può essere richiesta la microscopia in fluorescenza per Legionella.
75
Calcofluor white staining
Rhizopus
Aspergillus
TERRENI DI COLTURA, CONDIZIONI E
MICRORGANISMI PER CAMPIONI DI ESCREATO
Diagnosi microbiologica
Polmonite
77
TERRENI DI COLTURA, CONDIZIONI E
MICRORGANISMI PER CAMPIONI DI BAL
Diagnosi microbiologica
Polmonite
78
Caratteristiche di polmoniti batteriche, virali e fungine
79