La base di partenza per la maggior parte dei processi produttivi di materiali
ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un
solido (polvere) che diverrà il ceramico, con un solvente (liquido), più alcuni
additivi.
La miscela polvere-solvente può andare incontro a fenomeni di
agglomerazione con formazione di strutture rigide, non deformabili. Oppure
può essere stabilizzata in un sistema plastico e deformabile. Solo in questo
secondo caso si parla propriamente di sospensione.
1
Un solido immerso in un liquido polare si carica elettricamente in superficie. In genere la
carica è negativa (vedi seguito).
Tale carica causa la formazione di una struttura denominata “doppio strato elettrico”. Le
cariche negative superficiali attraggono gli ioni positivi solvatati e orientano le molecole
costituenti il liquido. Ioni e molecole generano quindi un cuscinetto ordinato di cariche sulla
superficie del solido, via via sempre più diffuso verso il resto del liquido. Si distinguono quindi sulla superficie del solido: a) uno strato carico negativamente; b) uno
strato adsorbito di ioni solvatati (strato di Stern); uno strato diffuso di ioni e molecole orientate
(strato di Gouy-Chapman).
Conseguentemente a partire dalla superficie del solido si può seguire l’andamento del
potenziale elettrico. Questo assume un certo valore (y0) sulla superficie (dipendente dalla
carica negativa) e quindi decresce allontanandosi dalla stessa (a causa dell’azione schermante
da parte degli ioni positivi e delle molecole polari orientate). L’andamento esponenziale di y è
stato definito da Goui-Chapman.
La distanza alla quale y = y 0/2.718 è detta lunghezza di Debye(K-1). Essa dà un indice
dell’estensione del doppio strato elettrico. Dipende dalla costante dielettrica del liquido, dalla
temperatura, dalla concentrazione e dalla carica degli ioni.
All’interno del doppio strato elettrico è identificabile anche il piano di scorrimento ovvero la
superficie della porzione di liquido che resta solidale con il solido in caso di movimento dello
stesso. A tale superficie corrisponde il potenziale zeta (z), unico misurabile.
2
Uno ione in soluzione è sempre circondato da strati di molecole di solvente
orientate che costituiscono la nuvola di solvatazione. Questa assume
dimensioni ragguardevoli rispetto allo ione stesso.
Questo spiega anche perché avviene la solubilizzazione dei sali in solventi
polari.
3
4
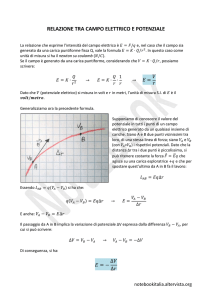
Il potenziale zeta ζ è l’ unico parametro che si può misurare sperimentalmente
mediante prove di elettroforesi (migrazione di polveri in sospensioni soggette a
campo elettrico). In particolare si misura la velocità a diversi valori del campo
elettrico e si calcola il potenziale zeta (potenziale elettrico sulla superficie della
sfera costituita dalla particella di polvere e dello strato adsorbito solidale ad
essa) in funzione della viscosità e della costante elettrica del liquido (vedi
successiva).
Il potenziale zeta indica quanto è esteso il doppio strato elettrico ovvero dà
un’idea del gradiente della curva potenziale.
5
6
L’andamento del potenziale (e quindi il potenziale zeta) dipende dal contenuto
di ioni (molarità) e dalla carica degli stessi. Infatti la presenza di un numero
maggiore di ioni o una carica superiore permette di schermare più agevolmente
la carica sulla superficie del solido a seguito della formazione del doppio strato
elettrico.
7
La carica sulla superficie di un solido in un liquido può avere diverse origini.
Nel caso delle argille (per es. caolinite) alcuni atomi di silicio possono essere
sostituiti isomorficamente da alluminio e magnesio e l’eccesso di carica
negativa viene bilanciato da ioni potassio che si dispongono in posizioni
interlamellari. Una volta poste a contatto con un liquido polare (per es. acqua)
si ha la dissoluzione dello ione potassio che lascia indietro una particella carica
negativamente.
L’adsorbimento di ioni specifici sulla superficie di una particella può annullare
o invertire la carica superficiale inizialmente presente.
8
Tutte le sostanze esistenti mostrano, in superficie, gruppi OH (a parte i metalli
nobili).
In acqua si può avere avere un comportamento acido (rilascio di H+) o basico
(adsorbimento di H+) e, in entrambi i casi, cambia la carica superficiale. La
carica resta nulla solo quando il pH della soluzione è pari al PZC ovvero al
punto isoelettrico (IEP) (le due reazioni avvengono in equilibrio fra loro).
Quando pH = IEP, il potenziale zeta è quindi uguale a zero. 9
Il valore di IEP indica il carattere acido o basico della superficie del solido. La
maggior parte delle sostanze hanno un IEP inferiore a 7. Ciò vuol dire che
sono cariche negativamente e si comportano da acidi.
10
Un esempio è dato da una particella di allumina posta in acqua. Innanzitutto la
superficie si idrata. Quindi a seconda del pH si carica negativamente (se pH >
PZC) o positivamente (se pH < PZC).
Lo stesso vale (a pH diversi) per il quarzo.
11
Le argille debbono la loro “fortuna” alla possibilità di generare in acqua un ben
esteso doppio strato elettrico (in quanto si scindono in macroanioni e cationi K
+) che le rende quindi lavorabili plasticamente.
12
L’estensione del doppio strato elettrico dipende dal tipo di argilla e, in
particolare, dalla quantità di cariche negative presenti e dalla struttura
cristallina. Nella montmorillonite le due facce delle lamelle sono uguali e
questo causa un maggior assorbimento di acqua da cui il comportamento
plastico ed espandente.
13
I solidi possono perciò essere suddivisi in “acidi” o “basici”.
Va detto che normalmente l’aggiunta di una polvere al solvente non modifica
drasticamente il pH (al limite si osservano variazioni di qualche punto al
massimo). Per questo vale il principio della nascita di una carica superficiale al
variare del pH della soluzione di partenza.
14