Rivista Italiana di Genetica e Immunologia Pediatrica - Italian Journal of Genetic and Pediatric Immunology
Anno II numero 4 - ottobre 2010 | direttore scientifico: Carmelo Salpietro - direttore responsabile: Giuseppe Micali
Home page
Norme editoriali | Stampa l'articolo
Motore di ricerca
1 2 3 4 5 6 7 8 9 10
Numeri precedenti
pagina 1 Avanti ►
Il bambino allergico per quadri clinici
1
2
3
4
4
Gian Luigi Marseglia , Mario la Rosa , Michele Miraglia Del Giudice , Giovanna Elisa Calabrò , Carmelo Salpietro
1
2
3
4
Clinica Pediatrica Università di Pavia, Dipartimento di Pediatria Università di Catania, Dipartimento di Pediatria II Università di Napoli, UOC di Genetica ed
Immunologia Pediatrica Università di Messina
Gli argomenti sono stati oggetto di un Corso Interattivo tenutosi a Milano (auditorium Mediolanum) il 15 e 16 Ottobre 2010 e che si ripeterà in diverse altre
sedi italiane.
Introduzione
Le patologie allergiche rappresentano un rilevante problema di salute pubblica per
l’aumento dei casi e per il conseguente aumento della spesa pubblica, non solo per
la diagnosi e la terapia farmacologica, ma anche per la possibile inabilità
temporanea o permanente al lavoro che può causare. I recenti studi epidemiologici
evidenziano come le malattie allergiche interessino circa il 30% della popolazione
occidentale con massimi valori d’incidenza nell'età pediatrica e giovanile. Solo in
Italia il 19%, equivalente a circa 9 milioni di persone, soffre di patologie allergiche.
Nel corso degli ultimi 20 anni, la prevalenza di tali patologie in età pediatrica è
aumentata in maniera considerevole, infatti circa il 25-30% dei bambini soffre di una
malattia allergica con la seguente percentuale: 35% asma, 15% rinite, 10%
congiuntivite, 20% dermatite, 12% orticaria/angioedema, 8% allergia alimentare.
I meccanismi patogenetici responsabili di tali patologie rimangono, ad oggi,
sconosciuti data la complessità e l’eterogeneità dei fattori eziopatogenetici che ne
sono alla base. Tra i fattori individuali, la predisposizione genetica (familiarità) e
l’atopia risultano preminenti nel favorire le manifestazioni cliniche dei disturbi
allergici; ma è l’esposizione ambientale che determina l’emergere di tali affezioni. I
dati epidemiologici disponibili confermano che l’atopia è un importante fattore
costituzionale, predisponente lo sviluppo delle allergie. E’ stato dimostrato che se
entrambi i genitori soffrono di una malattia allergica, il rischio raggiunge il 60 - 80%,
se uno dei genitori è allergico, il rischio sale al 30%, se nessuno dei genitori è
allergico il rischio che un figlio sia allergico è pari al 10 - 15%. Diversi studi, inoltre,
indicano che molti geni sembrano essere coinvolti nella patogenesi dell’asma e delle
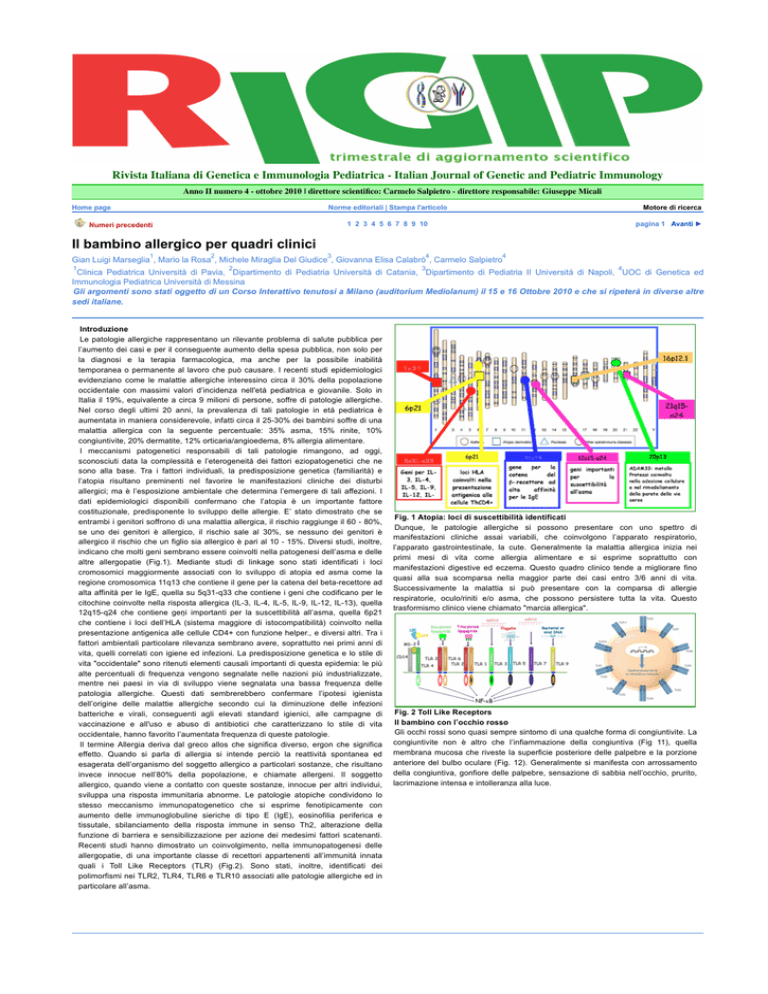
altre allergopatie (Fig.1). Mediante studi di linkage sono stati identificati i loci
cromosomici maggiormente associati con lo sviluppo di atopia ed asma come la
regione cromosomica 11q13 che contiene il gene per la catena del beta-recettore ad
alta affinità per le IgE, quella su 5q31-q33 che contiene i geni che codificano per le
citochine coinvolte nella risposta allergica (IL-3, IL-4, IL-5, IL-9, IL-12, IL-13), quella
12q15-q24 che contiene geni importanti per la suscettibilità all’asma, quella 6p21
che contiene i loci dell’HLA (sistema maggiore di istocompatibilità) coinvolto nella
presentazione antigenica alle cellule CD4+ con funzione helper., e diversi altri. Tra i
fattori ambientali particolare rilevanza sembrano avere, soprattutto nei primi anni di
vita, quelli correlati con igiene ed infezioni. La predisposizione genetica e lo stile di
vita "occidentale" sono ritenuti elementi causali importanti di questa epidemia: le più
alte percentuali di frequenza vengono segnalate nelle nazioni più industrializzate,
mentre nei paesi in via di sviluppo viene segnalata una bassa frequenza delle
patologia allergiche. Questi dati sembrerebbero confermare l’ipotesi igienista
dell’origine delle malattie allergiche secondo cui la diminuzione delle infezioni
batteriche e virali, conseguenti agli elevati standard igienici, alle campagne di
vaccinazione e all'uso e abuso di antibiotici che caratterizzano lo stile di vita
occidentale, hanno favorito l’aumentata frequenza di queste patologie.
Il termine Allergia deriva dal greco allos che significa diverso, ergon che significa
effetto. Quando si parla di allergia si intende perciò la reattività spontanea ed
esagerata dell’organismo del soggetto allergico a particolari sostanze, che risultano
invece innocue nell’80% della popolazione, e chiamate allergeni. Il soggetto
allergico, quando viene a contatto con queste sostanze, innocue per altri individui,
sviluppa una risposta immunitaria abnorme. Le patologie atopiche condividono lo
stesso meccanismo immunopatogenetico che si esprime fenotipicamente con
aumento delle immunoglobuline sieriche di tipo E (IgE), eosinofilia periferica e
tissutale, sbilanciamento della risposta immune in senso Th2, alterazione della
funzione di barriera e sensibilizzazione per azione dei medesimi fattori scatenanti.
Recenti studi hanno dimostrato un coinvolgimento, nella immunopatogenesi delle
allergopatie, di una importante classe di recettori appartenenti all’immunità innata
quali i Toll Like Receptors (TLR) (Fig.2). Sono stati, inoltre, identificati dei
polimorfismi nei TLR2, TLR4, TLR6 e TLR10 associati alle patologie allergiche ed in
particolare all’asma.
Fig. 1 Atopia: loci di suscettibilità identificati
Dunque, le patologie allergiche si possono presentare con uno spettro di
manifestazioni cliniche assai variabili, che coinvolgono l’apparato respiratorio,
l’apparato gastrointestinale, la cute. Generalmente la malattia allergica inizia nei
primi mesi di vita come allergia alimentare e si esprime soprattutto con
manifestazioni digestive ed eczema. Questo quadro clinico tende a migliorare fino
quasi alla sua scomparsa nella maggior parte dei casi entro 3/6 anni di vita.
Successivamente la malattia si può presentare con la comparsa di allergie
respiratorie, oculo/riniti e/o asma, che possono persistere tutta la vita. Questo
trasformismo clinico viene chiamato "marcia allergica".
Fig. 2 Toll Like Receptors
Il bambino con l’occhio rosso
Gli occhi rossi sono quasi sempre sintomo di una qualche forma di congiuntivite. La
congiuntivite non è altro che l’infiammazione della congiuntiva (Fig 11), quella
membrana mucosa che riveste la superficie posteriore delle palpebre e la porzione
anteriore del bulbo oculare (Fig. 12). Generalmente si manifesta con arrossamento
della congiuntiva, gonfiore delle palpebre, sensazione di sabbia nell’occhio, prurito,
lacrimazione intensa e intolleranza alla luce.
Fig. 11 Infiammazione della congiuntiva o congiuntivite Fig. 12: Congiuntiva
(in rosso)
Nei bambini come negli adulti, l’infiammazione della congiuntiva può avere diverse
origini (Fig 13).
Fig. 13 L’occhio rosso (da Bielory 2000, mod.)
Spesso tale processo infiammatorio ha origine infettiva, ed è, in questo caso,
estremamente contagiosa: si trasmette attraverso goccioline o il contatto
occhio-mano, specialmente per contatto diretto tra i familiari o in una comunità
(scuola materna, nido), ma anche attraverso il contatto con biancheria infetta o con
acqua contaminata (per esempio, in piscina o palestra). Per tale motivo deve essere
diagnosticata e trattata tempestivamente. La congiuntivite infettiva, in età pediatrica
può essere, nella maggior parte dei casi, batterica o virale. La congiuntivite batterica
(Fig.14) è provocata generalmente da Staphylococcus aureus, Streptococcus
pneumoniae o Haemophilus influenzae. Si riconosce per una secrezione
abbondante, densa e giallastra, più evidente al risveglio ("palpebre appiccicose" al
mattino), mentre prurito e lacrimazione sono meno frequenti. È altamente
contagiosa. La congiuntivite virale riconosce come agente eziologico più frequente
l'adenovirus ma anche Herpes Simplex e Zoster. Spesso nel bambino è presente
un'infezione del tratto respiratorio superiore o un anamnesi positiva per contatto con
persone già affette da congiuntivite. Si presenta inizialmente in un occhio e nel giro
di pochi giorni coinvolge l'altro. La secrezione è di tipo siero acquoso, le palpebre
sono iperemiche e tumefatte, sono presenti emorragie congiuntivali "a capocchia di
spillo" (Fig. 15), quasi sempre si associa tumefazione dei linfonodi retro auricolari
satelliti. La congiuntivite virale è estremamente contagiosa, e rimane tale per 10-20
giorni dal suo manifestarsi.
Fig.14 Congiuntivite batterica Fig.15: Congiuntivite virale
Negli ultimi anni notevole importanza ha assunto il riscontro dell'aumento della
frequenza delle congiuntiviti allergiche in età pediatrica. I quadri clinici con cui si
presentano sono peraltro ampiamente variabili. Possiamo distinguere 5 forme
principali quali: la congiuntivite allergica stagionale (SAC), la congiuntivite allergica
perenne (PAC), la cheratocongiuntivite Vernal (VKC), la cheratocongiuntivite atopica
(AKC), la congiuntivite gigantopapillare (GPC).
La congiuntivite allergica stagionale (SAC) è la forma più comune di congiuntivite
allergica e rappresenta più del 50% delle congiuntiviti allergiche. È una congiuntivite
stagionale ed i sintomi oculari, spesso associati a riniti allergiche, sono strettamente
correlati con la presenza di allergeni quali pollini delle graminacee, parietaria e
polline di piante arboree. La SAC è una classica reazione di ipersensibilità di tipo I
(IgE mediata). Può interessare l’età pediatrica anche se il picco di incidenza si
colloca negli ultimi anni della seconda decade. I sintomi più importanti sono prurito e
sensazione di bruciore, lacrimazione, in casi più impegnativi si possono riscontrare
sintomi corneali quali fotofobia e offuscamento; eccezionali sono comunque gli esiti
permanenti. segni clinici, usualmente bilaterali, sono rappresentati da iperemia
congiuntivale (Fig. 16), ipertrofia papillare a livello della congiuntiva tarsale ed infine
produzione di essudato inizialmente chiaro/trasparente (fase acuta) e
successivamente denso/fibroso (fase cronica).
La congiuntivite allergica perenne (PAC) è considerata una variante della SAC che
persiste per tutto l’anno ed è per lo più associata a rinite pluristagionale; circa il 79%
dei pazienti presenta esacerbazioni stagionali. Acari della polvere, epiteli di animali,
spore fungine presenti negli ambienti domestici o lavorativi sembrano essere gli
allergeni più comuni. La prevalenza è più bassa della SAC. Nelle forme perenni la
sintomatologia è meno pronunciata ma è comunque caratterizzata da prurito, lieve
iperemia congiuntivale, bruciore, sensazione di corpo estraneo. Sia la SAC che la
PAC hanno all’incirca lo stesso esordio e si associano entrambe a sintomi quali
asma/eczema. Il sospetto diagnostico di SAC e PAC si basa sull’evidenza clinica
(eritema, iperemia congiuntivale, ipertrofia papillare, edema palpebrale), sulla
sintomatologia soggettiva (in particolare il prurito). La diagnosi sarà confermata con
reperti di laboratorio (aumento eosinofi li e neutrofi li nel sangue, presenza elevata di
IgE specifi che sieriche e cutanee (Skin prick Test).
Tra i farmaci per uso topico nella SAC, gli antistaminici sono sensibilmente, ma non
significativamente, superiori ai farmaci stabilizzatori mastocitari (sodio cromoglicato,
nedocromile, lodoxamide) per il controllo della sintomatologia soggettiva. I farmaci
vasocostrittori hanno una breve durata d’azione (< 2 ore), possono determinare una
iperemia rebound, congiuntivite follicolare, occlusione lacrimale e, se pur raramente,
ipertensione sistemica.
Fig. 16 Iperemia congiuntivale
Gli antistaminici topici, come azelastina ed emedastina sono farmaci di prima scelta,
ma le molecole a doppia azione (DAA: inibizione del rilascio di mediatori mastocitari
e inibizione competitiva per il recettore H1), come olopatadina e chetotifene, sono da
preferire. In presenza di una sintomatologia prevalentemente oculare nell’ambito di
una rinocongiuntivite, gli antistaminici (o DAA) si mostrano più effi caci per via
oculare che per via sistemica, anche per la maggiore rapidità di azione. Una loro
associazione può, comunque, potenziarne l’effetto.
La cheratocongiuntivite Vernal (letteralmente ”primaverile”, VKC) è una affezione
oculare ritenuta rara, classificata come allergica, seppure ad eziologia sconosciuta.
Si tratta di una affezione cronica bilaterale, spesso severa, a rischio di esiti
permanenti se non adeguatamente trattata. Il termine cheratocongiuntivite implica un
possibile coinvolgimento della cornea (abrasioni, ulcere) con conseguente
compromissione del visus; “vernal” significa letteralmente”primaverile, termine che
indica il momento della riacutizzazione clinica e non il periodo esclusivo in cui si
manifesta la sintomatologia. La VKC inizia a manifestarsi nella prima decade di vita,
solitamente non prima dei 3 anni e tende a risolversi spontaneamente (anche se non
sempre) dopo la pubertà, alla fine della seconda decade. Geograficamente è diffusa
nelle aree a clima caldo e temperato come il bacino del Mediterraneo, il medio
oriente, la penisola dell’Anatolia, la penisola arabica, l’India, il Pakistan, il Giappone.
Il prurito è il sintomo costante con intensa fotofobia e arrossamento marcato con
secrezione mucosa abbondante. Si distinguono tre forme cliniche: tarsale, limbare,
mista. Nelle forme tarsali sono caratteristiche le papille giganti (Fig.17), di dimensioni
variabili, ma superiori ad 1 mm localizzate alla palpebra superiore con aspetto di
"acciottolato romano" su cui si deposita la secrezione mucosa. Nelle forme limbari
(Fig.18) gli infiltrati, localizzati al limbus, sono multipli e di aspetto gelatinoso,
accompagnati a concrezioni di aspetto calcareo puntiformi all'apice, denominati
noduli di Trantas; si nota nelle forme più gravi neovascolarizzazione corneale
periferica. Nelle forme miste si trovano associati i segni delle due forme.
L'interessamento corneale è frequente sotto forma di cheratite punctata superficiale,
ed a volte si possono riscontrare ulcere a scudo, di colorito lattescente presenti nelle
forme tarsali che bisognerà detergere chirurgicamente. La morbilità di questa
affezione dipende soprattutto dalla inefficacia dei farmaci tradizionali impiegati per il
trattamento delle congiuntiviti allergiche (antistaminici, cromoni, NSAIDs) e dalla
necessità di impiegare cortisonici, unici farmaci efficaci, per periodi prolungati, con i
ben noti rischi di effetti secondari sull’occhio, come ipertensione oculare, glaucoma,
cataratta. Negli ultimi anni, in diversi centri italiani, si utilizza la ciclosporina in
soluzione oculare, e nei pazienti resistenti una preparazione di tacrolimus per via
oculare.
Fig. 17 Papille giganti tarsali nella VKC Fig.18 Papille limbari con noduli di
Trantas
La cheratocongiuntivite atopica (AKC) è un’infiammazione cronica che coinvolge la
congiuntiva tarsale inferiore; se interessa la cornea può portare a cecità. È molto
frequente storia familiare per atopia, in particolare eczema (95% pazienti) o asma
(87%). L’esordio di questa patologia è tra i 16-19 anni e può persistere fino alla
quarta-quinta decade di vita. Molto spesso è associata, nella fascia di età 30-50 anni
a complicanze quali blefarocongiuntiviti, cataratta, disordini corneali ed herpes
simplex. La sintomatologia è caratterizzata da prurito, bruciore, fotofobia e
sensazione di corpo estraneo; tali sintomi sono più severi rispetto alla SAC e PAC e
sono presenti per tutto l’anno. I segni oculari sono rappresentati da ipertrofia
papillare tarsale (inizialmente inferiore), cheratite puntata, infiltrati limbari con noduli
di Trantas; nei casi più gravi si può presentare congiuntivite cicatriziale con fibrosi
subepiteliale e simblefaron. L’uso prolungato di corticosteroidi topici favorisce
ovviamente l’insorgenza di questa complicanza. Distacco di retina e infezioni
erpetiche oculari rappresentano altre possibili complicanze della AKC. La terapia si
avvale dell’impiego di corticosteroidi topici e di ciclosporina per via oculare. In un
recente studio l’impiego di tacrolimus unguento nella terapia dell’eczema palpebrale
in questi pazienti ha prodotto un significativo miglioramento nel quadro oculare in
pazienti con AKC.
La congiuntivite gigantopapillare (GPC) (Fig.19) è una patologia caratterizzata da
un’infiammazione della congiuntiva tarsale. È solitamente associata all’uso delle lenti
ma si può presentare in altri pazienti con storia di corpi estranei, comprese suture
corneali e/o congiuntivali, cheratoprotesi, protesi oculari, innesti corneo-sclerali ecc.
Le cause e la patogenesi della GPC non sono ancora del tutto conosciute.
L’evidenza clinica suggerisce che possa essere il risultato del trauma meccanico
combinato con una reazione di ipersensibilità a proteine antigeniche trattenute sulla
superficie della lente a contatto, della protesi o delle suture. La sintomatologia
comprende prurito oculare, offuscamento del visus, intolleranza alle lenti, secchezza
oculare; obiettivamente si possono rilevare papille tarsali superiori e sul bordo
palpebrale, secrezione mucosa, cheratopatia puntata. La terapia si basa
essenzialmente sulla rimozione delle lenti o dell’eventuale causa meccanica e
dell’impiego di farmaci antinfiammatori locali; la prognosi è buona.
Fig.19 Congiuntivite gigantopapillare da lenti a contatto
Il notevole aumento della frequenza delle congiuntiviti allergiche in età pediatrica ci
impone una conoscenza più approfondita dei diversi quadri clinici, al fine di
effettuare una corretta diagnosi differenziale (Tab. 3), porre una tempestiva e
corretta diagnosi definitiva finalizzata all’avvio di terapie specifiche e mirate ed alla
prevenzione delle complicanze.
Tab. 3 Diagnostica delle congiuntiviti allergiche
Il bambino con il naso chiuso e/o che cola
Il naso chiuso consiste nell’ostruzione delle cavità del naso che rende difficoltosa la
respirazione. Le principali cause del naso chiuso sono: 1) Infezioni nasali e sinusali:
virus e batteri possono essere frequentemente la causa dell’ostruzione del naso; 2)
Malformazioni delle cavità nasali: sono malformazioni congenite del setto nasale.
Tali deformazioni impediscono il normale fluire dell’aria; in questo caso il naso
rimarrà otturato se non si interviene con un semplice intervento chirurgico che sposti
il setto nella giusta posizione. Il setto nasale deviato è una malformazione presente
circa nel 7% dei bambini, che molto spesso si manifesta con ipertrofia adenoidea
(adenoidi); 3) Allergie: il contatto con gli allergeni può determinare l’ ostruzione delle
mucose provocando una congestione; 4) Riniti non allergiche (riniti vasomotorie):
sono quei tipi di rinite in cui il naso e le mucose nasali si occludono a causa di
intolleranza ad agenti climatici (caldo o freddo), a umidità, a fumo o smog.
Sicuramente le condizioni patologiche associate ad ostruzione nasale e rinorrea
maggiormente frequenti in età pediatrica sono le rinosinusiti.
E’ definita rinosinusite l’infiammazione, acuta o cronica, della mucosa della cavità
nasale e dei seni paranasali (Fig. 20). E’ una patologia molto frequente dell’infanzia
e dell’adolescenza, caratterizzata da una significativa morbilità acuta e cronica e che
può andare incontro a gravi complicanze.
Il bambino si ammala di rinosinusite per la presenza di coesistenti morbidità
(allergia, patologie malformative, genetiche, deficit immunitari) o per l’incontro con
un patogeno particolarmente aggressivo. La successiva chiusura degli osti, con
relativo accumulo di muco produce i segni clinici caratterizzati da congestione
nasale, secrezioni nasali purulente, febbre e tosse. Frequente è il senso di dolore e
pressione al volto, localizzato generalmente nella zona del seno nasale coinvolto dal
processo flogistico, specie nelle forme ad eziologia batterica, così come l’edema
periorbitario. Meno comuni sono l’alitosi, la cefalea, il mal di denti.
Le rinosinusiti secondarie a riniti allergiche sono in costante aumento. La prevalenza
in età pediatrica varia dal 20 al 30%. L’elevata suscettibilità infiammatoria della
mucosa nasale ostacola il ricircolo di muco dagli osti dei seni, causando una
maggiore permanenza di patogeni all’interno delle cavità. E’ inoltre dimostrato che i
soggetti affetti da rinite allergica sviluppano più frequentemente infezioni virali a
carico della mucosa nasale. La sovrainfezione con i patogeni virali è frequentemente
riscontrata con i Rhinovirus. Le infezioni batteriche, che spesso insorgono come
complicanza di una patologia virale, sono costituite dallo Streptococcus Pneumonie,
Haemophilus Influentiae, Moraxella Catarrhalis.
Nelle forme di natura batterica il decorso è generalmente più grave, con sintomi più
marcati e di durata maggiore.
La rinosinusite può essere classificata in: subacuta, acuta e cronica (Fig. 21).
La diagnosi di sinusite acuta si basa in modo preponderante sull’anamnesi:
secrezioni nasali e tosse per più di 10 giorni senza miglioramento, temperatura
corporea elevata, ad esempio, sono indici di sinusite batterica acuta insorta come
complicanza. I bambini con sinusite cronica hanno invece sintomi respiratori
persistenti, tra cui tosse, secrezioni o congestione nasale per più di 90 giorni.
Non è ritenuta necessaria nel percorso diagnostico la Radiografia del cranio, mentre
la TAC, che può mostrare ispessimento della mucosa o livelli idroaerei, dovrebbe
essere riservata alle forme croniche che necessitano di intervento chirurgico. Le
linee guida dell’American Academy of Pediatrics raccomandano il trattamento
antibiotico nella sinusite batterica acuta, per promuovere la risoluzione dei sintomi e
prevenire le complicanze suppurative. L’amoxicillina è l’antibiotico di prima scelta,
utile in gran parte dei casi. Il dosaggio è di 40 mg/kg/die. Di seconda scelta sono le
cefalosporine di terza generazione e i macrolidi, utili soprattutto nei pazienti allergici
alle penicilline per tre settimane. La sola terapia antibiotica può non bastare: di
fondamentale importanza è il controllo della normale respirazione ed il controllo della
funzionalità degli osti mascellari.
sociosanitario. L’asma è una malattia infiammatoria cronica delle vie aeree (Fig. 22)
nella quale entrano in gioco molte cellule e mediatori.
Fig. 20 Cavità nasale e seni paranasali
Evidenze di classe IA consigliano l’impiego delle soluzioni saline, come
decongestionanti della mucosa nasale. Nei soggetti allergici è indispensabile il
controllo della rinite che da sola porta ostruzione del naso e degli osti. L’impiego
della Cetirizina ha nel controllo della rinite allergica ampio riscontro sia negli studi
clinici, che nella applicazione pratica. A seconda della frequenza e dell’entità degli
episodi, è necessario l’impiego di diversi tipi di farmaci: antistaminici o
decongestionanti nelle forme intermittenti, cortisonici topici e anticolinergici e
antileucotrienici, nelle forme persistenti. Il trattamento chirurgico va infine riservato
esclusivamente alle gravi forme croniche, che non hanno risposto al trattamento
medico o secondarie a difetti dell’architettura dei seni o delle cavità nasali.
Fig. 21 Rinosinusite, classificazione
Un’appropriata terapia riduce notevolmente l’insorgenza delle complicanze. Esse
sono quasi tutte localizzate nelle immediate vicinanze dei seni paranasali,
soprattutto nelle cavità orbitarie e nell’endocranio. La cellulite periorbitaria e orbitaria
è tra le più temibili complicanze. La prima è caratterizzata da eritema ed edema dei
tessuti circostanti il bulbo oculare, mentre la seconda coinvolge le strutture
intraorbitarie provocando proptosi, chemosi, diminuzione del visus e diplopia.
Complicanze intracraniche sono gli ascessi epidurali, la meningite, la trombosi del
seno cavernoso, l’empiema subdurale e l’ascesso cerebrale. Sebbene molto rare,
sono un’emergenza medica: in presenza di alterazioni dello stato di coscienza,
rigidità nucale o segni di ipertensione endocranica è richiesto un immediato esame
TC dell’encefalo e un trattamento antibiotico per via endovenosa (cefalosporina
associata a vancomicina), da iniziare immediatamente. Rarissime complicanze sono
invece l’ostemiolite dell’osso frontale (tumore di Pott) e il mucocele.
In definitiva la rinosinusite è una patologia pediatrica che non può più essere
interpretata come semplice infiammazione di un distretto anatomico, ma come
espressione di uno stato infiammatorio persistente, che è possibile prevenire solo
inquadrandone le caratteristiche principali e agendo con la terapia più adatta.
Il bambino che respira male
Dispnea è il termine clinico con cui si definisce la mancanza di respiro, dal greco
dys che significa difficoltoso e pnoea che significa respirazione. Forse nessuna altra
sensazione può evocare tanta paura quanto l’incapacità di respirare.
La dispnea si divede in acuta e cronica. Causa di dispnea cronica sono le
valvulopatie, l’anemia, l’insufficienza renale e le disfunzioni neuromuscolari. Causa
di dispnea acuta sono l’embolia polmonare, la polmonite, pneumotorace e le
sindromi da ostruzione acuta vie aeree. Le ostruzioni acute delle vie aeree si
dividono in ostruzione delle prime vie aeree e le ostruzione sottotracheali. Nelle
ostruzione delle prime vie aeree la dispnea è inspiratoria; tipico esempio sono la
laringotracheite, il laringospasmo, l’epiglottide da emofilo e la difterite. Nelle
ostruzione sottotracheali la dispnea è espiratoria, tipico esempio sono la bronchiolite
e l’asma. L’asma è la causa più frequente di dispnea espiratoria anche se nelle
forme severe la dispnea è in/espiratoria. L’asma bronchiale è una malattia molto
diffusa la cui prevalenza nei paesi occidentali è stimata intorno al 5% negli adulti e al
10% nei bambini. Per tale motivo, la “malattia asma” suscita, a livello mondiale, un
notevole interesse non solo del settore medico-scientifico ma anche di quello
Fig. 22 L’asma, malattia infiammatoria cronica delle vie aeree
L’infiammazione cronica è associata ad iperreattività bronchiale che porta a
ricorrenti episodi di respiro sibilante, dispnea, senso di costrizione toracica e tosse,
specialmente di notte o di primo mattino. Questi episodi sono di solito associati con
diffusa ma variabile ostruzione bronchiale solitamente reversibile spontaneamente o
in seguito alla terapia.
Clinicamente la malattia va definita in rapporto alla gravità degli episodi acuti
(Tab.4), alla frequenza degli stessi nel tempo (Tab.5) e alla risposta alla terapia (Tab.
6).
L’Asma acuto viene distinto in (Tab. 4): lieve, moderato, grave (Fig. 23)
Fig. 23 Alterazioni dei bronchi nelle diverse forme di asma
Nell’asma grave acuto si possono ulteriormente distinguere: - episodi a rapida
insorgenza, in genere scatenati dall’esposizione ad allergeni nei soggetti sensibili episodi ad evoluzione lenta, in genere associati a terapia inadeguata, a scarsa
compliance, ad inappropriato controllo medico e a fattori psicologici.
L’asma acuto può essere ancora distinto in rapporto alla presenza/assenza di
sintomi premonitori: nel 70% dei bambini gli episodi acuti sono preceduti da:
rinorrea, tosse, irritabilità, apatia, ansia, disturbi del sonno, febbricola, perdita di
appetito, prurito, che possono manifestarsi 6- 24 ore prima dell’accesso e che
tendono ad essere sempre gli stessi prima di ogni crisi; il rimanente 30% dei bambini
presenta una rapida evoluzione della sintomatologia. In ogni paziente con diagnosi
di asma va stabilito il livello di gravità (Tab.5-6), poiché ad ogni livello corrisponde
una raccomandazione terapeutica.
Segno tipico dell’asma è il respiro sibilante con espirio prolungato, presente su tutto
il torace, polifonico. Va sempre tenuto presente che il bambino asmatico si può
presentare obiettivamente senza rumori secchi ma soltanto con ridotto ingresso
aereo, mentre non tutto ciò che fischia è necessariamente asma, per cui è
importante saper effettuare una corretta diagnosi differenziale (Tab.7).
particolarmente efficace e sicuro in età pediatrica si è dimostrato budesonide. Anche
i farmaci antileucotrieni sono indicati e possono essere utilizzati alternativamente o
in associazione ai corticosteroidi inalatori. Gli antileucotrieni sono particolarmente
indicati nel bambino con asma e rinite, in cui sono efficaci in entrambe le patologie e
consentono anche un risparmio economico o nelle riacutizzazioni virali nelle quali si
sono dimostrati particolarmente efficaci. In ogni caso la terapia dell’asma va sempre
individualizzata con l’obiettivo di controllare la malattia con la dose minima di
farmaci.
Tab. 8 Livelli di controllo dell’asma (da GINA 2006)
Il bambino che si gratta
Il prurito è un sintomo soggettivo molto comune che può accompagnare malattie
cutanee diverse. E’ una sensazione cutanea sgradevole, complessa, che evoca la
risposta riflessa del grattamento o il desiderio di grattarsi più o meno irrefrenabile. È
provocato da molteplici cause e può essere l’espressione di diverse patologie.
Meccanismi di tipo centrale e periferico sono all'origine del prurito. Le ricerche
neurofisiologiche hanno permesso d'identificare le vie nervose del prurito, che sono
ben distinte da quelle del dolore e ci hanno consentito di distinguere un prurito
periferico (pruritocettivo) e un prurito centrale (neurogenico o neuropatico). Il prurito
periferico origina nella cute ed è dovuto all'infiammazione, alla secchezza o ad altri
danni della pelle: esso è trasmesso dalle fibre nervose C. Esempi di questo prurito
sono la scabbia, l'orticaria e le reazioni alla puntura di insetti. Il prurito neurogenico
origina invece centralmente, senza segni evidenti di patologia, come il prurito della
colestasi, dovuto all'azione dei neuropeptidi oppioidi sui recettori specifici. Il prurito
neuropatico è causato da una malattia, localizzata in un qualsiasi punto delle vie
nervose afferenti: la neuropatia post-zosteriana, la sclerosi multipla ed i tumori
cerebrali, occasionalmente associati al prurito, rientrano in questa categoria. Esiste
infine un quarto tipo di prurito, quello psicogeno, che insorge in maniera ossessiva in
soggetti con parassitofobia.
La sensazione del prurito viene trasmessa da fibre mieliniche del gruppo C della
classificazione di Erlanger e Gasser, fibre distinte da quelle nocicettive,
caratterizzate da una lenta velocità di conduzione e da estese terminazioni. I
recettori dai quali origina questa particolare sensazione, non sono recettori
morfologicamente distinti, bensì sfioccamenti delle fibre nervose amieliniche, detti
cnesmocettori, localizzati nello strato papillare del derma. Le fibre C veicolano lo
stimolo ai neuroni del midollo spinale, da dove prosegue, lungo i tratti spino-talamici
antero-laterali, fino al talamo, terminando infine nell'area sensoriale del giro
post-centrale della corteccia (Fig.3). Con il grattamento il paziente affetto da prurito
provoca la stimolazione di fibre nervose centripete mieliniche, più grosse e quindi
con velocità di conduzione maggiore, che, a livello dei neuroni del midollo spinale,
down-regolano il traffico del prurito, con meccanismi pre-o post-sinaptici.
Tab. 7 Diagnosi differenziale del respiro sibilante ricorrente
L’obiettivo principale del trattamento è ottenere il “controllo” dell’asma (Tab. 8).
Per ottenere il controllo le linee guida GINA prevedono 5 livelli di trattamento. I
corticosteroidi inalatori sono i farmaci più efficaci nel controllo dell’asma. Tra questi
Fig. 3 Neurofisiologia del prurito
Nella cute la vicinanza delle mastcellule ai terminali dei neuroni C afferenti
suggerisce una relazione funzionale fra questi due tipi di cellule. Le mastcellule
cutanee esprimono due proteasi: la triptasi e la chinasi. Di recente è stato proposto
un legame fra la triptasi delle mastcellule e l'eccitazione dei recettori nocicettivi della
cute. L'attivazione delle mastcellule libera infatti la triptasi, che a sua volta attiva il
recettore 2 della proteinasi attivata (PAR-2), localizzato sui terminali delle fibre
nervose C (Fig. 4). Le fibre C attivate trasmettono questa informazione al sistema
nervoso centrale, per cui si avverte la sensazione di prurito. Dal terminale nervoso si
libera sostanza P (un neuropeptide) che induce un'aumentata produzione di tumor
necrosis factor (TNF), che a sua volta sensibilizza i terminali nervosi nocicettivi e le
mastcellule.
Fig.4 Colloquio fra i terminali cutanei del neurone afferente C e le mast cellule
del derma
Possiamo distinguere il prurito in: Pruritus cum materia, secondario a malattie
cutanee, Pruritus sine materia, secondario a malattie sistemiche, Pruritus Simplex,
idiopatico.
Dal punto di vista clinico possiamo distinguere il prurito in localizzato e diffuso (Tab.
1). Il prurito localizzato è di solito causato da dermatosi con caratteristiche cliniche
ben definite, lesioni cutanee visibili, lineari di varie dimensioni con o senza croste
squamose ematiche associate ad esiti cicatriziali a seconda della fase evolutiva. Il
prurito diffuso può essere causato da malattie sistemiche, che hanno una scarsa
obiettività cutanea, oppure da malattie cutanee primitive.
Il prurito, dunque, può essere l’espressione di diverse patologie (Fig. 5), anche in
età pediatrica.
Tab.1 Patologie associate a Prurito
Fig.5 Il bambino che si gratta e patologie correlate
Sicuramente, però, la patologia associata al sintomo prurito, di gran lunga più
frequente in età pediatrica, è la Dermatite Atopica (DA). La DA è una malattia
infiammatoria cronica della cute, ad eziopatogenesi multifattoriale che riconosce una
forte predisposizione genetica alla cui espressività fenotipica contribuiscono
numerosi fattori ambientali, in accordo con quanto postulato per le altre malattie
atopiche (Fig.6). La prevalenza della malattia in età pediatrica varia dal 5 al 20% nei
paesi industrializzati. La DA si contraddistingue, sul piano clinico, per lesioni
eczematose intensamente pruriginose ad evoluzione cronico-ricorrente, xerosi ed
iperreattività cutanea (Fig.7-8-9). L’aspetto e le sedi dell’eruzione differiscono in
rapporto all’età del soggetto, per cui se ne riconoscono 3 fasi evolutive (Tab. 2).
Tab. 2 La Dermatite Atopica e gli stadi relativi all'età
In ogni fase il sintomo principale della malattia è il prurito che, soprattutto nel
bambino piccolo, si accompagna ad irrequietezza ed insonnia. In un’elevata
percentuale di pazienti la DA si associa ad alti livelli sierici di IgE totali, ad IgE
specifiche verso allergeni inalanti e/o alimentari ed a manifestazioni cliniche
extracutanee di atopia, in particolare rinite allergica ed asma bronchiale.
Fig. 6 Dermatite atopica: tra geni e ambiente
La DA rappresenta, spesso, la prima spia della costituzione atopica del bambino
essendo, frequentemente, la prima in assoluto fra le manifestazioni allergiche
dell'età pediatrica. Sulla base delle caratteristiche cliniche ed allergo-immunologiche,
oltre che prognostiche, si possono differenziare almeno due quadri clinici di DA. Il
primo ad esordio molto precoce, entro i primi due anni di vita, con caratteristiche
morfologiche prevalentemente essudanti, spesso in bambini con familiarità atopica
positiva, di gravità variabile, frequentemente correlato all'allergia alimentare. Esso
presenta una precoce positività dei marker atopici (Skin Prick Test e/o RAST per
alimenti e/o inalanti) ed è il più frequente in età pediatrica.
Fig. 7-8-9 Lesioni cutanee in bambini con DA
Nelle forme di DA più gravi e più precoci (entro l'anno o i primi mesi di vita) un ruolo
preminente è svolto dagli allergeni, particolarmente quelli alimentari (proteine del
latte vaccino, uovo…). In questi bambini è spesso presente anche la familiarità per
altre malattie allergiche, a conferma che la componente genetica in senso atopico è
preponderante. Il secondo quadro clinico, a differenza delle forme più precoci,
mostra un esordio tardivo della DA (al di sopra dei due anni di vita), presenta
caratteristiche morfologiche diverse ossia una maggiore tendenza alla
lichenificazione, ed è meno frequentemente legata all'allergia alimentare ma è
caratterizzata da una maggiore persistenza nel tempo dei sintomi cutanei.
La severità clinica della DA può essere valutata mediante lo Scoring Atopic
Dermatitis (SCORAD)
Index (Fig.10), utilizzato per classificare il grado di gravità della DA in lieve,
moderato o grave. Esso è dato dalla somma di 3 subscores: A) prevede la
valutazione di estensione delle lesioni che viene calcolata mediante la “regola del
nove”; B) intensità dei segni clinici. L'intensità è data dalla somma dei punteggi
ottenuti attraverso la valutazione di 6 parametri (eritema, edema e papule ovvero
infiltrazione cutanea palpabile, essudazione/evoluzione crostosa, escoriazione,
lichenificazione, ovvero espressione dell'ispessimento cutaneo nelle lesioni croniche,
xerosi). Ogni parametro viene valutato secondo una scala a 4 punti a variabile da 0
a 3: la somma dei singoli punteggi consente di ottenere il punteggio totale relativo
alla intensità (0- assente, 1- lieve, 2- moderata, 3- severa); C) sintomi soggettivi.
prurito e perdita di sonno, vengono valutati attraverso una scala analogica da 0 a 10,
dove 0 corrisponde alla minima percezione del sintomo e 10 al massimo. L'indice
SCORAD si ottiene sommando i singoli punteggi calcolati per le tre aree di
valutazione secondo l'equazione: SCORAD = A/5 + 7 (B/2) + C. Il punteggio varia tra
0 e 83 se non si considerano i parametri soggettivi oppure tra 0 e 103 se si
considerano anche la perdita di sonno ed il prurito riferiti dal paziente.
Il decorso della DA è caratterizzato da un andamento cronico recidivante che alterna
fasi di miglioramento a fasi di peggioramento dei sintomi. Si stima che dal 60 al 90%
delle DA vada incontro a variazioni annuali con un miglioramento, nella maggior
parte dei casi, durante il periodo estivo e un peggioramento durante l'autunno e
l’inverno. Nel corso degli anni la DA può andare incontro, nella maggior parte dei
casi, ad una graduale remissione, residuando talora una xerosi cutanea che è più
pronunciata nelle sedi preferenziali per quell’età (pieghe del gomito, cavi poplitei,
regione del collo). In un’alta percentuale di casi, all'attenuarsi della dermatite si
accompagna la comparsa di manifestazioni allergiche a carico di altri organi ed
apparati. Ciò avviene soprattutto nei bambini con familiarità atopica, che hanno
presentato una DA precoce, con andamento grave, e positività precoce dei markers
cutanei e/o sierici per atopia (Skin Prick Test e/o IgE totali e RAST).
Una gestione efficace della DA richiede un approccio multidisciplinare. L’idratazione
cutanea e l’uso di emollienti per ripristinare le funzioni della barriera cutanea
danneggiata è un punto chiave delle strategie terapeutiche. Sebbene le infezioni
virali e fungine possano rappresentare un trigger per la DA, la colonizzazione o
l’infezione da S. Aureus è comunemente responsabile dell’aumentata severità della
DA. In tali pazienti un ciclo di terapia antibiotica associato a terapia
antinfiammatoria, consente un miglior controllo della patologia cutanea. Il
trattamento con corticosteroidi topici si è dimostrato efficace nel controllare
l’infiammazione cutanea sia acuta che cronica.A causa degli effetti collaterali
secondari all’uso prolungato dei corticosteroidi, non sono impiegati nella terapia di
mantenimento, specie in assenza di lesioni cutanee. Un altro approccio terapeutico è
rappresentato dagli inibitori della calcineurina ad uso topico. L’FK506 topico e il
pimecrolimus sono stati recentemente approvati dalla FDA per il trattamento della
DA. Trial a breve termine, multicentrici, studi in cieco e caso-controllo, sia negli adulti
che nei bambini, hanno dimostrato l’efficacia sia del Tacrolimus che del
pimecrolimus, ma non abbiamo dati clinici sui loro effetti a lungo termine nei
bambini. Tali farmaci dovrebbero essere impiegati nel trattamento di pazienti poco
responsivi agli steroidi topici. I corticosteroidi sistemici risultano efficaci e
prontamente capaci di controllare dermatiti atopiche nell’adulto, ma il loro impiego
dovrebbe essere a breve termine. Eruzioni cutanee rebound e diminuzione
dell’efficacia ne limitano l’uso in maniera importante. Un’altra alternativa terapeutica
è rappresentata dalla ciclosporina A che è un potente inibitore sistemico della
calcineurina. Un numero di studi ha dimostrato l’efficacia sia sui bambini che sugli
adulti con forme severe e refrattarie di DA, sebbene la tossicità, soprattutto renale,
ne limiti l’impiego a lungo termine. Gli antimetaboliti come il micofenolato-mofetile,
un inibitore della biosintesi delle purine, il methotrexate e l’azatioprina sono stati
inoltre utilizzati nelle forme recidivanti di DA, sebbene il potenziale tossico sistemico
di tali farmaci ne limita l’impiego richiedendo un attento monitoraggio. Un altro
approccio terapeutico nel trattamento della DA, come proposto in passato nella
letteratura, è rappresentato dal sodio-cromoglicato (DSCG). DSCG è un efficace
inibitore delle reazioni di ipersensibilità IgE mediata ed è stato usato con successo
nei pazienti con ipersensibilità respiratoria. Diversi studi sono stati condotti sul
trattamento orale e topico con DSCG in pazienti con DA sebbene non vi siano
ancora studi controllati che ne certifichino l’efficacia.
Fig.10 Scoring Atopic Dermatitis (SCORAD) Index
Bibliografia
1) National Institutes of Health: National Heart, Lung, and Blood Institute and
National Asthma Education and Prevention Program. Expert Panel Report:
Guidelines for the Diagnosis and Management of Asthma, Update on Selected
Topics. June 2003.
2) Pearce N, Pekkanen J, Beasley R (1999). How much asthma is really attributable
to atopy. Thorax, 54: 268-272.
3) Martinez FD (2000). Viruses and atopic sensitization in the first years of life. Am J
Respir Crit Care Med, 162: 95-99.
4) Strachan DP (1994). Is allergic disease programmed in early life? Clin Exp Allergy
24:603-5.
5) Matricardi PM, Rosmini F, Riondino S, Fortini M, Ferrigno L, Rapicetta M, et al.
(2000). Exposure to foodborne and orofecal microbes versus airborne viruses in
relation to atopy and allergic asthma:epidemiological study. BMJ, 320: 412-417.
6) Sheik A, Strachan DP (2004). The hygiene hypothesis: fact or finction? Curr Opin
Otolaryngol Head Neck Surg, 12 (3): 232-236.
7) Strannegard O, Strannegard IL (2001). The cause of the increasing prevalence of
allergy: is atopy a microbial deprivation disorder? Allergy, 56: 91-102.
8) Matricardi PM, Bonini S (2000). High microbial turnover rate preventing atopy: a
solution to inconcistencies impinging on th Hygiene hypothesis? Clin Exp Allergy, 30:
1506-1510.
9) Wold AE (1998). The hygene hypothesis revised: is the rising frequency of allergy
due to changes in the intestinal flora? Allergy, 53: 20-25.
10) Matricardi PM, Rosmini F, Ferrigno L, Nisini R, Rapicetta M, Chionne P, et al.
(1997). Cross sectional retrospective study of prevalence of atopy among Italian
military students with antibodies against hepatitis A virus. BMJ, 314: 999-1003.
11) Keeley DJ, Neill P, Gallivan S (1991). Comparison of the prevalence of
reversible airways obstruction in rural and urban Zimbabwean children. Thorax, 46:
549-553.
12) Litonjua AA, Carey VJ, Weiss ST, Gold DR (1999). Race, socioeconomic factors,
and area of residence are associated with asthma prevalence. Pediatr Pulmonol, 28:
394-401.
13) Schwartz J, Gold D, Dockery DW, Weiss ST Speizer FE (1990). Predicotrs of
asthma and persistent wheeze in a national sample of children in the United States.
Association with social class, perinatal events, and race. Am Rev Respir Dis, 142:
555-562.
14) Rigoli L, Briuglia S, Salpietro DC, Pajno GB et al. Molecular analysis of
sequence variants in the Fcepsilon receptor I beta gene and IL-4 gene promoter in
Italian atopic families. Allergy, 2004 Feb;59 (2):213-8
15) Luciana Rigoli, Carmelo Salpietro, Lucia Caminiti, Chiara Di Bella, Vincenzo
Procopio, Elisabetta Canfora, Caterina Cuppari, Daniela Vita, Giovanni Barberio,
Giovanni Battista Pajno. Investigation of the eotaxin gene -426 C>T, -384 A>G and
67 G>A SNPs and atopic dermatitis in Italian children using family-based association
methods. Clin.Exp.Derm. 2007
16) Yoshinaka, T.; Nishii, K.; Yamada, K.; Sawada, H.; Nishiwaki, E.; Smith, K.;
Yoshino, K.; Ishiguro, H.; Higashiyama, S. : Identification and characterization of
novel mouse and human ADAM33s with potential metalloprotease activity. Gene
282: 227-236, 2002
17) Jongepier H, Boezen HM, Dijkstra A, Howard TD, Vonk JM, Koppelman GH,
Zheng SL, Meyers DA, Bleecker ER, Postma DS. Clin Exp Allergy. Polymorphisms of
the ADAM33 gene are associated with accelerated lung function decline in asthma.
2004 May;34 (5):757-60.
18) Yang IA, Fong KM, Holgate ST, Holloway JW. The role of Toll-like receptors and
related receptors of the innate immune system in asthma. Curr Opin Allergy Clin
Immunol. 2006 Feb;6 (1):23-8.
19) Phipps S, Lam CE, Foster PS, Matthaei KI. The contribution of toll-like receptors
to the pathogenesis of asthma. Immunol Cell Biol. 2007 Aug-Sep;85 (6):463-70.
20) Rylander R, Michel O. Organic dust induced inflammation--role of atopy and
TLR-4 and CD14 gene polymorphisms. Am J Ind Med. 2005 Oct;48 (4):302-7.
21) Greaves MW. Pathogenesis and treatment of pruritus. Curr Allergy Asthma Rep.
2010 Jul;10 (4):236-42.
22) G. Bartolozzi. Il trattamento del prurito. Medico e bambino. Volume XXII, Num.
2. 2003
23) Paolo Fabbri, Giorgio Leigheb, Carlo Gelmetti. Manuale di dermatologia medica.
Elsevier srl, 2010
24) Fleischer DM, Bock SA, Spears GC, Wilson CG, Miyazawa NK, Gleason MC,
Gyorkos EA, Murphy JR, Atkins D, Leung DY. Oral Food Challenges in Children with
a Diagnosis of Food Allergy. J Pediatr. 2010 Oct 27.
25) Jacob SE, Yang A, Herro E, Zhang C. Contact allergens in a pediatric
population: association with atopic dermatitis and comparison with other north
american referral centers. J Clin Aesthet Dermatol. 2010 Oct;3 (10):29-35.
26) Edwards AM, Matthews S, Arshad SH. Systemic absorption of sodium
cromoglicate from a new cutaneous emulsion (Altoderm ®) in children with atopic
dermatitisEur J Dermatol. 2010 Oct 19.
27) Greenhawt M. The role of food allergy in atopic dermatitis. Allergy AsthmaProc.
2010 Sep;31 (5):392-7.
28) Dhar S, Banerjee R. Atopic dermatitis in infants and children in India. Indian J
Dermatol Venereol Leprol. 2010 Sep-Oct;76 (5):504-13.
29) Peters AS, Kellberger J, Vogelberg C, Dressel H, Windstetter D, Weinmayr G,
Genuneit J, Nowak D, von Mutius E, Radon K. Prediction of the incidence,
recurrence, and persistence of atopic dermatitis in adolescence: a prospective
cohort study. J Allergy Clin Immunol. 2010 Sep;126 (3):590-5.e1-3.
30) McCollum AD, Paik A, Eichenfield LF. The Safety and Efficacy of Tacrolimus
Ointment in Pediatric Patients with Atopic Dermatitis. Pediatr Dermatol. 2010 Jul
31) Carbone A, Siu A, Patel R. Pediatric atopic dermatitis: a review of the medical
management. Ann Pharmacother. 2010 Sep;44 (9):1448-58.
32) Neri Pucci, Giuseppe Pingitore, Sergio Arrigoni, Gabriele Di Lorenzo, Gian Luigi
Marseglia, Giovanni Simeone, Anna Zicari. Diagnosi differenziale delle congiuntiviti
allergiche. Rivista di Immunologia e Allergologia Pediatrica 01/2010
33) Singh K, Bielory L. Ocular allergy: a national epidemiologic study. J Allergy Clin
Immunol 2007;119 (Suppl 1):S154.
34) Bielory L, Friedlaender MH. Allergic conjunctivitis. Immunol Allergy Clin North
Am 2008;28:43-48, vi.
35) Leonardi A. Expert opinion. Emerging drugs for ocular allergy. Exp Opin Emerg
Drugs 2005;10:505-20.
36) Schultz BL. Pharmacology of ocular allergy. Curr Opin All Clin Immunol
2006;6:383-9.
37) Bielory L, Kenneth W, Bigelsen LS. Effi cacy and tolerability of newer
antihistamines in the treatment of allergic conjunctivitis. Drugs 2005;65:215-28.
38) Calonge M, Herreras JM. Clinical grading of atopic keratoconjunctivitis. Curr
Opin Allergy Clin Immunol 2007;7:442-5.
39) Zribi H, Descamps V, Hoang-Xuan T, et al. Dramatic improvement of atopic
keratoconjunctivitis after topical treatment with tacrolimus ointment restricted to the
eyelids. J Eur Acad Dermatol Venereol 2009;23:489-90.
40) Elhers WH, Donshik PC. Giant Papillary conjunctivitis. Curr Opin Allergy Clin
Immunol 2008;8:445-9.
41) Bielory L. Ocular Allergy Guidelines. A pratical treatment algorithm. Drugs
2002;62:1611-34.
42) Blaiss MS. Allergic rhinitis: Direct and indirect costs. Allergy Asthma Proc. 2010
Sep;31 (5):375-80.
43) Camelo-Nunes IC, Solé D. Allergic rhinitis: indicators of quality of life. J Bras
Pneumol. 2010 Feb;36 (1):124-33. Review.
44) Dykewicz MS, Hamilos DL. Rhinitis and sinusitis. J Allergy Clin Immunol. 2010
Feb;125 (2 Suppl 2):S103-15. Review.
45) Pollini F, Capristo C, Boner AL. Upper respiratory tract infections and atopy. Int J
Immunopathol Pharmacol. 2010 Jan-Mar;23 (1 Suppl):32-7. Review.
46) Leo G, Incorvaia C. The clinical spectrum of rhinosinusitis in children. Int J
Immunopathol Pharmacol. 2010 Jan-Mar;23 (1 Suppl):24-8. Review.
47) Leonardi S, Miraglia del Giudice M, La Rosa M, Bellanti JA. Atopic disease,
immune system, and the environment. Allergy Asthma Proc. 2007
48) Barbato A, Turato G, Baraldo S, et al. Airway Inflammation in Childhood Asthma.
AJRCCM 2003;168: 798-803.
Home page
49) Sears MR, Greene JM, Willan AR, et al. A longitudinal, population-based, cohort
study of childhood asthma followed to adulthood. N Engl J Med 2003; 354:
1985-1987.
50) Bateman ED, Boushey HA, Bousquet J, et al. Can guideline-defined asthma
control be achieved? The Gaining Optimal Asthma Control Study. AJRCCM 2004;
170: 836-844.
51) Baena-Cagnani CE, Badellino HA. Diagnosis of Allergy and Asthma in
Childhood. Curr Allergy Asthma Rep. 2010 Oct 30.
52) Demir AU, Celikel S, Karakaya G, Kalyoncu AF. Asthma and Allergic Diseases in
School Children from 1992 to 2007 with Incidence Data. J Asthma. 2010 Nov 1.
53) Lødrup Carlsen KC, Hedlin G, Bush A, Wennergren G, de Benedictis FM, De
Jongste JC, Baraldi E, Pedroletti C, Barbato A, Malmström K, Pohunek P, Pedersen
S, Piacentini GL, Middelveld RJ, Carlsen KH; on behalf of the PSACI (Problematic
Severe Asthma in Childhood Initiative) group. Assessment of problematic severe
asthma in children. Eur Respir J. 2010 Oct 28.
54) Leo G, Incorvaia C. Current management of allergic asthma in children. Minerva
Pediatr. 2010 Oct;62 (5):475-84.
55) Saharan S, Lodha R, Kabra SK. Management of Status Asthmaticus in Children.
Indian J Pediatr. 2010 Sep 8.
1 2 3 4 5 6 7 8 9 10
Scarica l'articolo: pagina 1.pdf
Sommario 10 pagine
Direttore scientifico
Trimestrale di divulgazione scientifica dell'Associazione Pediatrica di Immunologia e Genetica
Legge 7 marzo 2001, n. 62 - Registro della Stampa Tribunale di Messina n. 3/09 - 11 maggio 2009
Carmelo Salpietro - Direttore responsabile
Giuseppe Micali - Segreteria redazione
Basilia Piraino - Piera Vicchio
Direzione-Redazione: UOC Genetica e Immunologia Pediatrica - AOU Policlicnico Messina
pagina 1 Avanti ►












