Alice Biato, Francesca Chiappini, Alessandro Rosolini
Relazione sullo stage di fisica al DIFI
Sezione di biofisica
Tutor: Francesca Pellistri
Lo stage al DIFI prevedeva delle sessioni di laboratorio mattutine, seguite da
seminari pomeridiani tenuti nell’aula magna da docenti del dipartimento; gli
argomenti trattati riguardavano le ultime scoperte della fisica nucleare (materia e
antimateria), le tecniche della biofisica e le nanoscienze.
Le esperienze di laboratorio sono descritte di seguito.
LA TECNICA DEL PATCH CLAMP
La tecnica del patch clamp è stata utilizzata su granuli di cervelletto di ratto. I
granuli sono neuroni dal corpo piccolo con poche ramificazioni dendritiche.
In quanto cellule nervose, i granuli trasferiscono informazioni da uno all’altro
attraverso la sinapsi, giunzione specializzata nella quale un terminale assonico prende
contatto con un’altra cellula.
Le sinapsi sono di due tipi: elettriche e chimiche. Le prime sono caratterizzate da
un trasferimento diretto della corrente ionica da una cellula alla successiva. Le sinapsi
chimiche stimolano, attraverso la liberazione di un neurotrasmettitore, l’attivazione di
recettori.
La cellula presinaptica rilascia per esocitosi nel mezzo extracellulare un
messaggero chimico destinato a legare un recettore di membrana della cellula
postsinaptica. Il messaggero chimico è il neurotrasmettitore.
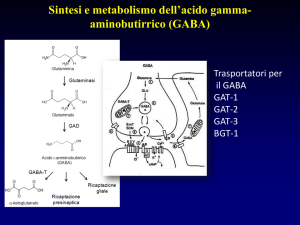
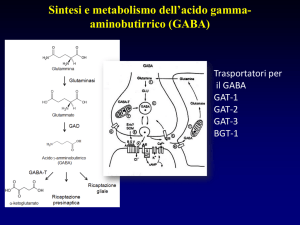
In questa esperienza, abbiamo osservato l’azione del neurotrasmettitore
inibitorio GABA, acido ?-amminobutirrico, che è coinvolto nella regolazione di vari
processi fisiologici, a livello del sistema nervoso centrale. Il GABA stimola il
recettore GABAA collegato ad un canale ionico selettivo per il Cloro; in seguito
all’attivazione di tale recettore da parte del GABA si ha l’apertura del canale,
l’entrata di ioni Cloro all’interno del neurone, con la conseguente iperpolarizzazione
della membrana.
In tutte le cellule esiste una differenza di potenziale elettrico ai due lati della
membrana plasmatica, con densità di carica negativa dal lato citosolico, con valori
variabili che raggiungono un massimo di 100 mV. La corrente elettrica passante
attraverso la membrana, causata dalla d.d.p., è misurata con la tecnica del patch
clamp.
Tale tecnica consiste nell’ isolare elettricamente un frammento (patch) di
membrana dalla soluzione esterna e registrare la corrente che vi fluisce attraverso. E’
stato seguito il seguente protocollo:
• Prelevare le cellule dall’incubatore e immergerle nella soluzione esterna
che riproduce la normale soluzione extracellulare
• Preparare un capillare di vetro (ampiezza della punta: 0,5 µm); al suo
interno, si inserisce la soluzione interna, che ha le medesime caratteristiche
della soluzione citoplasmatica, e un elettrodo collegato ad uno strumento di
registrazione del voltaggio
• Porre la cameretta delle cellule sotto al microscopio ottico, collegato ad
una telecamera che proietta le immagini su un monitor
• Inserire nella soluzione esterna l’elettrodo di riferimento, mantenuto a
potenziale V=0
• Utilizzando macro e micro manipolatori, mettere a contatto il capillare
alla cellula
• Aspirare con la siringa: ciò crea una depressione all’interno del capillare,
che permette una migliore adesione alla membrana cellulare
• Porre il potenziale della membrana a -80 mV
• Inserire il GABA nella soluzione esterna
• Misurare il passaggio di corrente dall’esterno all’interno della membrana
Nel corso di questa esperienza, non si è potuto acquisire della misurazioni
perché le cellule erano troppo deboli, e morivano al semplice contatto con il capillare.
Tuttavia, ci si aspettava di ottenere un grafico simile a questo:
La barra orizzontale indica la durata di stimolazione della cellula col GABA (in
concentrazione 10µM); il grafico rappresenta la corrente al cloro registrata, che è
caratterizzata da un picco e da una rapida fase di desensitizzazione che si assesta su
un valore stazionario. La corrente torna al valore iniziale terminata la stimolazione
col GABA.
Abbiamo anche preparato la soluzione esterna sciogliendo in acqua bidistillata i
seguenti composti:
mM
NaCl
KCl
MgCl2
CaCl2
Hepes
Glucosio
136
5,4
1
1,8
5,0
1’0
Abbiamo pesato i composti con una bilancia analitica, dopodiché li abbiamo
sciolti in 2 l d’acqua. Abbiamo portato il pH della soluzione a 7,4 aggiungendo gocce
di una soluzione NaOH 2M. Abbiamo infine filtrato la soluzione.
Marcatura del recettore GABAA con QUANTUM
DOTS in cellule cerebellari di ratto
Il recettore GABAA è una proteina di membrana presente nelle cellule del SISTEMA
NERVOSO CENTRALE. E’costituito da 5 subunità e viene attivato dal legame con il
neurotrasmettitore GABA. Inoltre costituisce un canale ionico selettivo per il cloro; il
legame con il neurotrasmettitore GABA provoca l’apertura del canale con ingresso di
ioni cloro e conseguente iperpolarizzazione della membrana.
Per marcare il recettore GABAA abbiamo seguito il seguente protocollo:
• Estrazione delle cellule dall’incubatore
•
Aspirazione del loro terreno di coltura
• Lavaggio delle cellule con la soluzione fisiologica
• Incubazione dell’anticorpo per 20 minuti a 37°C in camera umida
• Tre lavaggi con la soluzione fisiologica per rimuovere il primario in eccesso
• Incubazione con anticorpo secondario Qdot per 5 minuti a 37° C in camera umida
• Tre lavaggi delle celle cellule con fisiologica per rimuovere il secondario in
eccesso
• Osservazione delle cellule con il microscopio ottico invertito con ingrandimento
100x in olio
• Acquisizione e analisi delle immagini al computer
I QUANTUM DOTS sono nanocristalli semiconduttori che hanno proprietà elettriche
intermedie tra i materiali isolanti e i conduttori. Sono costituiti da un nucleo di CdSe
e ricoperti da uno strato di ZnS e coniugati con PEPTIDI, PROTEINE o
AC.NUCLEICI permettono la visualizzazione di determinate molecole biologiche.
Hanno dimensioni dell’ordine di 1-10 nm e possono emettere nell’infrarosso (spettro
ottimale per evidenziare la fluorescenza negli organismi viventi).
I nanocristalli Qdot sono legati all’anticorpo secondario che non può legarsi
direttamente alla subunità del recettore GABA ma può unirsi all’anticorpo primario
che a sua volta possiede un sito specifico per il legame con la subunità δ del recettore
GABA. Quindi attraverso l’ unione dei due anticorpi i cristalli Qdot vengono legati
alla subunità δ e ne permettono la visione in fluorescenza.
La fluorescenza è il risultato di un processo a tre stadi che avviene in alcune
molecole
chiamate fluorofori. I Qdot sono sonde di fluorescenza.
Una sonda
fluorescente è un fluoroforo che deve localizzarsi in una regione specifica della
molecola biologica. Il processo di fluorescenza è illustrato dal seguente diagramma di
stato elettronico (diagramma di Jablonski):
1.
ECCITAZIONE: un fotone di energia h? viene emesso da una fonte
esterna come un lampo incandescente o un laser e assorbito da un fluoroforo, questo
determina la formazione di uno stato eccitato di singoletto (S1’).
2.
STATO TEMPORANEAMENTE ECCITATO: lo stato di eccitazione si
mantiene tale per circa 10×10-9 secondi. Durante questo periodo di tempo, il
fluoroforo va incontro a cambiamenti conformazionali grazie ai quali ha la possibilità
di interagire con il proprio ambiente molecolare. Questi processi determinano due
importanti conseguenze. Per prima cosa, l’energia di S’1 viene in parte dissipata,
producendo uno stato eccitato di singoletto (S1) dal quale si ha emissione di
fluorescenza. Secondo, non tutte le molecole inizialmente eccitate dall’assorbimento
ritornano allo stato fondamentale (S0)
3.
EMISSIONE DI FLUORESCENZA: si ha emissione di un fotone con
energia hvEM e il fluoroforo ritorna allo stato fondamentale (S0).Durante questo
processo l’energia del fotone è più bassa rispetto al fotone eccitato hvEX, e di
conseguenza la lunghezza d’onda è maggiore.
Grazie all’esperienza precedentemente descritta abbiamo ottenuto delle immagini in
cui si può osservare in fluorescenza la presenza delle subunità δ del recettore GABA.