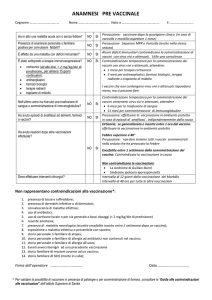
PANDEMIA INFLUENZALE DA VIRUS A(H1N1)
Allegato 2
PREVENZIONE VACCINALE
Dipartimento di Sanità pubblica e Microbiologia – Università di Torino
Servizio Regionale Epidemiologia Malattie Infettive – ASL AL
IL VACCINO PANDEMICO (in Allegato Riassunto Caratteristiche di Prodotto - RCP)
Il vaccino influenzale pandemico è un vaccino inattivato, costituito dagli antigeni di superficie
H1N1, adiuvato con MF59 (squalene).
E' stato autorizzato sulla base dei dati ottenuti dalle sperimentazioni su un preparato
contenente l'antigene H5N1 (virus dell'influenza aviaria) integrati con quelli ottenuti con le
sperimentazioni effettuate con l’antigene H1N1 (virus influenza pandemica).
Questo tipo di autorizzazione avviene secondo le indicazioni di un "core dossier" che fornisce
all'industria il dettaglio per il tipo di documentazione che deve essere prodotta e secondo un
"modello" ("mock up") per l'approvazione; in pratica, poichè le preparazioni dei vaccini
influenzali sono ampiamente standardizzate e tutti gli anni si utilizzano
tecnologie
sovrapponibili, all'atto della nuova preparazione vaccinale pandemica sono considerate come
"costanti" (utilizzate per vaccini "modello" tipo H5N1 dal 2007), alcune caratteristiche di
sicurezza, efficacia, immunogenicità (qualità della produzione, sperimentazione in popolazioni
suscettibili, dosi, calendario) e vengono sottoposte a sperimentazione e valutazione alcune
caratteristiche di qualità specifiche del nuovo ceppo virale. In Europa, l'uso di un ceppo virale
diverso è accompagnato da un piccolo trial clinico richiesto dalla European Medicines Agency
(EMEA; www.emea.europea.eu). Il nuovo vaccino pandemico viene approvato quando i dati
relativi alle eventuali variazioni qualitative sono soddisfacenti.
I dosaggi e gli adiuvanti presenti nei vaccini pandemici attualmente autorizzati nel mondo
dispongono di una autorizzazione "mock up" ottenuta per il ceppo virale H5N1.
Il vaccino pandemico disponibile in Italia è FOCETRIA (Novartis) e contiene in ogni dose da 0.5
ml: 7.5 mcg di antigene di superficie (emoagglutinina e neuraminidasi) del ceppo analogo al
ceppo A/California/7/2009 (H1N1)v (X-179A).
• Adiuvante: MF59C.1 - emulsione olio in acqua, contenente squalene come fase oleosa,
stabilizzata con polisorbato 80 e sorbitan trioleato in tampone citrato:
squalene
9,75 milligrammi
po lisorbato 80
1,175 milligrammi
sorbitan trioleato
1,175 milligrammi
L'adiuvante MF59 è utilizzato da diversi anni nei vaccini stagionali anti-influenzali chiamati
"adiuvati"; si stima ne siano state utilizzate almeno 25 milioni di dosi; l'indicazione all'uso di
tali vaccini era prevalentemente rivolta a soggetti in età anziana o soggetti
immunocompromessi, in situazioni nelle quali si rendesse necessario potenziare la risposta
anticorpale meno efficiente. Nel vaccino pandemico l'adiuvante è stato introdotto per poter
utilizzare più bassi dosaggi di antigene (7.5 mcg anzichè i consueti 15 mcg dei vaccini
stagionali) e proprio per rendere più efficiente la vaccinazione. L'adiuvante MF59 introdotto
da Novartis nei vaccini pandemici è l'unico adiuvante che disponga al momento attuale di
una ampia esperienza di utilizzo sul campo.
• Eccipienti: Sodio cloruro, Potassio cloruro, Potassio fosfato monobasico, Sodio fosfato
dibasico diidrato, Magnesio cloruro esaidrato, Calcio cloruro diidrato, Sodio citrato, Acido
citrico, Acqua per preparazioni iniettabili.
1
Esistono preparazioni commerciali monodose e da 10 dosi; solo nelle preparazioni
multidose è stato introdotto come conservante il thiomersale.
Il thiomersale, sulla base della legislazione italiana, è stato completamente eliminato dai
vaccini pediatrici o in alcuni casi è utilizzato solo in fase di preparazione dei vaccini
influenzali, ma viene eliminato nella fase finale; nelle dosi in commercio, quindi, questo
conservante è assente o ne rimangono solo tracce indosabili. Non esiste tuttavia alcuna
dimostrazione che la presenza del thiomersale, ampiamente utilizzato in passato nelle
preparazioni vaccinali, abbia determinato conseguenze di tipo neurologico sulla
popolazione pediatrica; in particolare studi su vasta scala hanno confutato la possibile
correlazione tra presenza di thiomersale nei vaccini pediatrici e autismo.
Modalità e via di somministrazione:
Iniezione intramuscolare preferibilmente nel muscolo deltoide o nella parte anterolataterale
della coscia (a seconda della massa muscolare).
Non iniettare per via intravascolare o sottocutanea.
POSOLOGIA (ultima approvazione Riassunto Caratteristiche di Prodotto – RCP dicembre
2009)
RCP prevede 2 dosi di vaccino (da 0.5 ml).
La seconda dose va somministrata dopo un intervallo di almeno 3 settimane dalla prima; si
consiglia di effettuare entrambe le somministrazioni con lo stesso tipo commerciale di vaccino.
Le dosi raccomandate si basano sui dati disponibili sulla sicurezza ed immunogenicità relativi
alla somministrazione del vaccino adiuvato con MF59C.1 contenente 7,5 mcg di HA derivato da
A/Vietnam/1194/2004/ (H5N1).
Schedula raccomandata: 2 dosi a 0 e 21 giorni in adulti (compresi gli anziani) e bambini di età
compresa tra 6 mesi e 17 anni.
Sono attualmente disponibili dati di immunogenicità ottenuti tre settimane dopo la
somministrazione di una singola dose di Focetria (H1N1) in un piccolo numero di adulti sani
(inclusi anziani).
E' attualmente disponibile una limitata esperienza clinica con Focetria (H1N1) in adulti sani
(compresi gli anziani), mentre non c'è esperienza clinica in bambini o adolescenti.
La decisione relativa all’utilizzo di Focetria (H1N1) in ognuna delle fasce di età definite di
seguito si basa sui dati clinici disponibili relativi ad una versione del vaccino contenente
l’antigene dell’H5N1 nonché alle caratteristiche patologiche dell’attuale pandemia influenzale.
In seguito alla somministrazione del vaccino, il sistema immunitario produce anticorpi contro la
malattia; nessuno dei componenti del vaccino può causare l'influenza.
Nei pazienti con immunosoppressione endogena o iatrogena la risposta anticorpale può essere
insufficiente.
CONTROINDICAZIONI
- Ipersensibilità nota (reazioni diverse dall'anafilassi) a un componente di Focetria o a residui in
tracce (proteine di uova e di pollo, ovalbumina, kanamicina e neomicina solfato, formaldeide e
cetiltrimetilammonio bromuro (CTAB)).
- Precedente reazione anafilattica (eruzione cutanea pruriginosa, dispnea e rigonfiamento del
viso o della lingua) con pericolo di vita ad uno qualsiasi dei componenti di Focetria oppure a
residui in tracce (proteine di uova e di pollo, ovalbumina, kanamicina e neomicina solfato,
formaldeide e cetiltrimetilammonio bromuro (CTAB)) o a thiomersale (solo per la preparazione
multidose)
- In presenza di una grave affezione febbrile (>38°C) o di una infezione acuta la vaccinazione
viene rimandata; infezioni minori (es. raffreddore) non costituiscono controindicazione.
2
- Dopo la vaccinazione anti-influenzale è possibile ottenere risultati falsi positivi in test
sierologici con il metodo ELISA per il rilevamento di anticorpi contro il virus
dell’immunodeficienza umana di tipo 1 (HIV-1), il virus dell’epatite C e soprattutto HTLV-1. In
questi casi, il metodo Western Blot risulta negativo. Questi risultati falsi positivi transitori
potrebbero essere dovuti alla risposta IgM indotta dal vaccino.
POSSIBILI EFFETTI INDESIDERATI
Reazioni comuni (1-10 soggetti su 100)
nella sede d’iniezione: arrossamento, gonfiore, indurimento, ecchimosi e dolore;
febbre, malessere, affaticamento e brividi; sudorazione; cefalea, artralgia e mialgia.
Queste reazioni scompaiono generalmente entro 1-2 giorni senza trattamento.
Sono stati osservati nelle settimane successive all'immunizzazione:
Effetti non comuni (1-10 soggetti su 1000):
Reazioni cutanee generalizzate con prurito, orticaria o rush non specifico.
Effetti rari (1-10 soggetti su 10.000):
reazioni allergiche con ipotensione pericolosa fino allo shock.
Effetti molto rari (meno di 1 soggetto su 10.000):
Vasculite con coinvolgimento renale ed eritema multiforme essudativo;
disturbi neurologici (encefalomielite, neurite e sindrome di Guillaume Barré).
Adulti e anziani: in studi clinici condotti con vaccino mock-up (H5N3, H9N2, H5N1) su 3400
soggetti, la maggior parte delle reazioni è stata di entità lieve, di breve durata e
qualitativamente simile alle reazioni indotte da vaccini influenzali stagionali convenzionali.
Si ritiene comunemente che, in confronto con i vaccini influenzali convenzionali non adiuvati,
l’effetto dell’adiuvante, responsabile della maggiore immunogenicità, sia associato ad una
frequenza leggermente maggiore di reazioni locali (soprattutto lieve dolore).
Dopo la seconda vaccinazione si sono verificate meno reazioni che dopo la prima
vaccinazione.
L’incidenza dei sintomi osservati nei soggetti di età superiore ai 60 anni è stata inferiore
all’incidenza riscontrata nella popolazione di età compresa tra i 18 e i 60 anni.
Bambini e adolescenti di età compresa tra 6 mesi e 17 anni: è stato condotto un trial clinico
con un vaccino H5N1 combinato con l’adiuvante MF59C.1 su 471 bambini di età compresa tra
6 mesi e 17 anni. Sono state somministrate due dosi di vaccino contenente:
H5N1 (A/Vietnam/1194/2004) con 7,5 µg di emoagglutinina [HA]/dose con adiuvante MF59C.1
ad un intervallo di tre settimane.
È stato inoltre valutato l’effetto di una dose booster somministrata 12 mesi dopo la seconda
dose.
La reattogenicità sia locale che sistemica è stata monitorata nella settimana seguente la
somministrazione del vaccino. Le reazioni locali sono risultate più frequenti nelle
somministrazioni successive alla prima, in ogni fascia di età.
La maggioranza delle reazioni sistemiche si è verificata entro 3 giorni dalla vaccinazione ed è
risultata di natura transitoria e di gravità da lieve a moderata.
In queste fasce di età, la frequenza delle reazioni per ogni dosaggio è risultata maggiore
rispetto a quella riscontrata in adulti ed anziani.
È stata inoltre osservata una frequenza maggiore di eventi febbrili >39.0°C.
Età 6-36 mesi: Gli eventi avversi sistemici molto comuni sono risultati irritabilità, pianti insoliti,
sonnolenza, diarrea e cambiamenti nelle abitudini alimentari.
Bambini: Gli eventi molto comuni riscontrati nei bambini comprendono cefalea e affaticamento.
Adolescenti: gli eventi molto comuni sono risultati malessere, mialgia, cefalea, affaticamento,
sudorazione, nausea e brividi.
3
•
INDICAZIONI ALLA VACCINAZIONE PANDEMICA DEFINITITE NEL CORSO DELLA
CAMPAGNA STRAORDINARIA DI VACCINAZIONE
COSOMMINISTRAZIONI
La co-somministrazione di vaccino influenzale stagionale NON adiuvato a sub-unità e di
vaccino pandemico è possibile in tutti i soggetti di qualsiasi età.
Nei casi in cui non sia possibile la co-somministrazione, il Consiglio Superiore di Sanità ritiene
che, soprattutto per i soggetti a rischio di complicanze per patologie pregresse, si debba dare la
priorità al vaccino pandemico e che è raccomandato il rispetto di un intervallo temporale di
almeno tre settimane tra le due somministrazioni, se si utilizza vaccino antinfluenzale
stagionale adiuvato.
INTERVALLO TEMPORALE FRA LA SOMMINISTRAZIONE DEL VACCINO PANDEMICO
PER L’INFLUENZA A(H1N1)v E ALTRI VACCINI
Esperti dell’Istituto Superiore di Sanità, dell’Agenzia Italiana del Farmaco, del Centro Nazionale
Trapianti e il Consiglio Superiore di Sanità si sono espressi come segue.
“Al fine di assicurare il maggior beneficio ai soggetti trattati, e di non ritardare le vaccinazioni
programmate, la finestra temporale di almeno 3 settimane fra la somministrazione del vaccino
pandemico e di quello stagionale non adiuvato (o viceversa) inizialmente suggerita può, se
necessario, essere ridotta.
Nei bambini, la finestra temporale di almeno tre settimane, fra la somministrazione del vaccino
pandemico e quella dei vaccini inattivati previsti dal calendario vaccinale dell’età evolutiva (o
viceversa) può essere ridotta. Qualora la somministrazione sia contemporanea, i vaccini
dovranno essere inoculati in siti differenti.”
SOGGETTI CUI LA VACCINAZIONE PANDEMICA PUÒ’ ESSERE OFFERTA - SCHEDULA
VACCINALE
Il Ministero del Lavoro della Salute e delle Politiche Sociali, il Comitato per i Medicinali
per uso umano (CHMP) dell' EMEA, l'OMS attraverso il proprio gruppo di esperti sulle
strategie vaccinali (SAGE), indicano quanto segue.
Adulti 18-60 anni:
Una dose di 0,5 ml ad una data prescelta.
I dati di immunogenicità attualmente disponibili suggeriscono che una sola dose può essere
sufficiente in questo gruppo.
Anziani >60anni:
Una dose di 0,5 ml ad una data prescelta. Deve essere somministrata una seconda dose di
vaccino dopo un intervallo di almeno 3 settimane.
Bambini e adolescenti di età compresa tra 10 e 17 anni:
Una dose di 0,5 ml ad una data prescelta.
Nel decidere il numero di dosi è possibile tenere presenti i dati di immunogenicità ottenuti su
adulti sani.
Bambini e adolescenti di età compresa tra 6 mesi e 9 anni:
Una dose di 0,5 ml ad una data prescelta.
Deve essere somministrata una seconda dose di vaccino dopo un intervallo di almeno 3
settimane.
Bambini di età inferiore a 6 mesi
NON è attualmente raccomandata la vaccinazione per i bambini di età < 6 mesi.
Pazienti oncologici e oncoematologici, trattati con chemioterapia
Vaccinazione da effettuarsi possibilmente due settimane prima della chemioterapia o
4
nell’intervallo tra un ciclo e l’altro.
Soggetti HIV positivi
Vaccinazione raccomandata con somministrazione di un’unica dose.
Pazienti in lista d’attesa e già sottoposti a trapianto di organi solidi
Vaccinazione con somministrazione di due dosi distanziate di almeno tre settimane e
vaccinazione di loro conviventi e caregivers.
Pazienti in dialisi
Vaccinazione con somministrazione di due dosi distanziate di almeno tre settimane.
Donne in gravidanza e in allattamento:
La vaccinazione è indicata al 2° o 3° trimestre di gravidanza.
Non sono disponibili al momento attuale studi clinici su efficacia e sicurezza del vaccino
pandemico in gravidanza; i dati disponibili sull'uso di vaccini antinfluenzali stagionali inattivati
non adiuvati non hanno evidenziato malformazioni o tossicità sul feto o sul neonato. Uno studio
condotto su animali con il vaccino mock-up H5N1 non ha indicato alcuna tossicità riproduttiva.
L'indicazione alla vaccinazione stagionale è presente da alcuni anni nella Circolare Ministeriale
emessa annualmente, poichè è riconosciuto un rischio aumentato di complicanze e di decesso
correlati ad influenza in corso di gravidanza.
In particolare l'indicazione alla vaccinazione pandemica in gravidanza nasce dall'esperienza
argentina che ha registrato un limitato numero di decessi su donne in gravidanza (peraltro
affette da altre patologie) e da un eccesso di ospedalizzazione per malattia grave in donne
statunitensi in gravidanza riferite da un articolo su Lancet Infectious Disease di gennaio 2009.
Il vaccino può essere utilizzato in corso di allattamento.
SOGGETTI A RISCHIO PERCHE’ AFFETTI DA PATOLOGIE PREDISPONENTI
Ordinanza 11 settembre 2009. Art. 1; comma 2.
In particolare sono considerate persone a rischio quelle affette da almeno una delle
seguenti condizioni:
• malattie croniche a carico dell’apparato respiratorio, inclusa asma, displasia
broncopolmonare, fibrosi cistica e BPCO;
• malattie dell’apparato cardiocircolatorio, comprese le cardiopatie congenite ed acquisite;
• diabete mellito e altre malattie metaboliche;
• malattie renali con insufficienza renale;
• malattie degli organi emopoietici ed emoglobinopatie;
• neoplasie;
• gravi epatopatie e cirrosi epatica;
• malattie congenite ed acquisite che comportino carente produzione di anticorpi;
immunosoppressione indotta da farmaci o da HIV;
• malattie infiammatorie croniche e sindromi da malassorbimento intestinale;
• patologie associate ad un aumentato rischio di aspirazione delle secrezioni respiratorie,
ad esempio malattie neuromuscolari;
• obesità con Indice di massa corporea (BMI) > 30 e gravi patologie concomitanti;
condizione di familiare o di contatto stretto di soggetti ad alto rischio che, per
controindicazioni temporanee o permanenti, non possono essere vaccinati.
5
STRATEGIA IN PIEMONTE
La Campagna Straordinaria di Vaccinazione-CSV anti-A(H1N1)v, tutt’ora in corso, in
Piemonte si è articolata in Fasi, avviate progressivamente, con target definiti dalle Ordinanze
del Ministero del Lavoro della Salute e delle Politiche Sociali aventi per oggetto “Misure urgenti
in materia di protezione A(H1N1)v” ed emanate l’11 settembre 2009, il 20 ottobre 2009 ed infine
il 3 dicembre 2009 con l’ampliamento della disponibilità dell’offerta vaccinale.
Il target delle varie fasi è stato formalizzato con Circolari regionali ed è di seguito riportato.
Fase 1: operatori sanitari e socio-sanitari – avvio 19.10.09;
Fase 2: donne al 2° e 3° trimestre di gravidanza, bambini nati pretermine e soggetti da 6 mesi a
64 aa d’età affetti da patologie croniche – avvio 09.11.09;
Fase 2 bis: agenti di polizia carceraria – avvio 13.11.09;
Fase 3: donatori di sangue periodici, forze di pubblica sicurezza e vigili del fuoco – avvio
23.11.09;
Fase 4: operatori della protezione civile e operatori del trasporto pubblico essenziale – avvio
30.11.09;
Fase 5: tutti gli operatori dei servizi pubblici essenziali – avvio 04.12.09;
Fase 6: soggetti della popolazione generale di età compresa tra 6 mesi e 17 anni, e adulti di età
superiore a 65 anni con patologie di rischio - avvio 14.12.09;
Fase 6 bis: bambini di età superiore a 6 mesi che frequentano l’asilo nido, minori che vivono in
comunità istituzionalizzati e donne che hanno partorito da meno di 6 mesi o la persona che
assiste il bambino - avvio 16.12.09.
6
Fonti istituzionali
CIRCOLARI MINISTERIALI
22 luglio 2009: Aggiornamento delle indicazioni relative all'impiego dei farmaci antivirali per
l'influenza da virus influenzale A(H1N1).
27 luglio 2009: Aggiornamento delle indicazioni relative alla prevenzione, sorveglianza e
controllo della Nuova influenza da virus influenzale A (H1N1).
7
agosto
2009:
Note
di
esplicazione/integrazione
alla
nota
circolare
DGPREV/V/34102/1.4.c.a.9 del 27/7/2009 " Aggiornamento delle indicazioni relative alla
prevenzione, sorveglianza e controllo della Nuova influenza da virus influenzale A(H1N1)".
1 ottobre 2009: Gestione delle forme gravi e complicate da influenza da virus A(H1N1).
5 ottobre 2009: Risposta alla Nuova influenza A(H1N1) - Medici di Medicina Generale (MMG)
e Pediatri di Libera Scelta (PLS)
6 novembre 2009: Vaccinazione contro l’influenza pandemica da virus AH1N1v:
aggiornamento indicazioni schedula vaccinale e modalità somministrazione indicazioni in caso
di patologie autoimmuni.
10 novembre 2009: Vaccinazione contro l’influenza pandemica da virus AH1N1v:
aggiornamento indicazioni schedula vaccinale e modalità somministrazione e indicazioni in
caso di patologie autoimmuni. CHIARIMENTI.
1 dicembre 2009: Intervallo temporale fra la somministrazione del vaccino per l’influenza
A(H1N1)v e altri vaccini; Influenza A(H1N1)v e vaccinazione in soggetti immunodepressi
9 dicembre 2009: Vaccinazione contro l’influenza pandemica AH1N1v: aggiornamento
indicazioni schedala vaccinale
10 dicembre 2009: Vaccinazione contro l’influenza pandemica AH1N1v: aggiornamento
indicazioni schedala vaccinale e modalità somministrazione e indicazioni in caso di patologie
autoimmuni. CHIARIMENTI
ORDINANZE MINISTERIALI
21 maggio 2009: Misure urgenti in materia di profilassi e terapia dell’influenza A(H1N1).
11 settembre 2009: Misure urgenti in materia di profilassi vaccinale dell’influenza pandemica
A(H1N1).
30 settembre 2009: Misure urgenti in materia di protezione AH1N1v.
20 ottobre 2009: Misure urgenti in materia di protezione AH1N1v.
3 dicembre 2009: Misure urgenti in materia di protezione AH1N1v.
7
I SITI SU CUI SONO DISPONIBILI DATI EPIDEMIOLOGICI ED È MONITORATA LA
PANDEMIA
www.ministerosalute.it
www.epicentro.iss.it
www. ecdc.europa.eu
www.who.int
www.regione.piemonte.it/sanita/
8