Biologia Molecolare della Cellula ’08
7: Regolazione ormonale del metabolismo del
glicogeno e della glicolisi
Desensitizzazione
cAMP
Proteina-CHINASI cAMP DIPENDENTE (PKA)
Proteine target :
ε metabolici
Fosforilasi chinasi
Glicogeno Fosforilasi
Glicogeno Sintasi
Diminuzione della
sintesi del glicogeno
Aumento della demolizione del glicogeno
I principali ormoni che regolano il metabolismo energetico negli animali
Ormone
Insulina
Glucagone
Epinefrina
Effetti biochimici
Permeabilita’ cellulare (muscolo e tessuto
adiposo)
Glicolisi
Sintesi del glicogeno
Sintesi dei trigliceridi
Gluconeogenesi
Lipolisi
Degradazione delle proteine
Sintesi proteica, del DNA e RNA
Livelli di cAMP (fegato e tessuto adiposo)
Glicogenolisi
Sintesi del glicogeno
Idrolisi dei trigliceridi
Gluconeogenesi
Glicolisi
Livelli di cAMP nel muscolo
Mobilizzazione dei trigliceridi
Glicogenolisi
Sintesi del glicogeno
Effetti fisiologici
Segnala lo stato di abbondanza di
nutrienti
Livello di glucosio ematico
Immagazzinamento dei combustibili
Crescita cellulare e
differenziamento
Rilascio di glucosio dal fegato
Livello di glucosio ematico
Rilascio di glucosio dal fegato
Utilizzo del glucosio da parte del
muscolo
Livello di glucosio ematico
Gli ormoni chiave nella regolazione del metabolismo energetico sono l’insulina, che promuove l’utilizzo del
glucosio, e il glucagone e l’epinefrina, che aumentano il livello ematico del glucosio
CONTROLLO del GLUCOSIO EMATICO (glicemia)
β-cells
α-cells
Negli animali il glucosio viene immagazzinato sotto forma di GLICOGENO (un
grosso polimero del glucosio) nel fegato e nel muscolo scheletrico.
Nel fegato il glucosio ottenuto dalla degradazione del glicogeno puo’ essere
rilasciato nella circolazione perche’ possa essere assorbito dagli altri tessuti.
Nel muscolo viene utilizzato per generare energia necessaria per la contrazione.
6
4
1
6
6
5
5
1
1 4
4
3
2
3
2
Legame α-1,4 glucosidico
glicogeno
CONTROLLO del GLUCOSIO EMATICO (glicemia)
NELSON cap. 15
Funzione del fegato e’ di mantenere costante (circa 5mM) la concentrazione di glucosio nel sangue.
Risponde a GLUCAGONE e insulina.
- bassa [gluc] (= fame, attivita’) α cells pancreas rilasciano GLUCAGONE
aum. cAMP demolizione del glicogeno e inibiz. della glicolisi
- alta [gluc] β cells pancreas rilasciano INSULINA
attivazione PP1 SINTESI del GLICOGENO
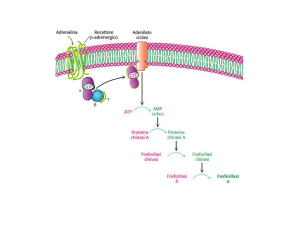
La PKA nel METABOLISMO del GLICOGENO
SINTESI del glicogeno:
UDP-glucosio + glicogeno (n residui)
DEGRADAZIONE:
glicogeno (n)
glicogeno
FOSFORILASI
glicogeno
SINTASI
glucosio1-
glicogeno (n+1) + UDP
+ glicogeno (n-1)
Pi
muscolo e altri tessuti il glucosio 6-P entra nella glicolisi
MUTASI
gluc1-
gluc 6-
fegato :
gluc1-
MUTASI
gluc 6-
glicolisi
G-6-FOSFATASI
glucosio
ATP
SANGUE
altri
tessuti
Pi
L’aumento della concentrazione di cAMP indotta da stimolazione con adrenalina o glucagone
aumenta la conversione da glicogeno a glucosio1- mediante:
- L’inibizione della SINTESI del glicogeno
- L’attivazione della sua DEGRADAZIONE (glicogenolisi)
Il processo e’ reversibile quando cala la concentrazione di cAMP
a
Sintesi e degradazione del glicogeno
Legame α-1,4 glucosidico
b
GLICOGENO
FOSFORILASI (GP)
GLICOGENO
SINTASI (GS)
(a) L’Incorporazione del glucosio
da UDP-glucosio nel glicogeno
e’ catalizzato dalla glicogeno
sintasi.
(b) La rimozione di unita’ di
glucosio dal glicogeno e’
catalizzata dalla glicogeno
fosforilasi.
Siccome due enzimi differenti
catalizzano la formazione e la
degradazione del glicogeno, le
due reazioni possono essere
regolate in modo indipendente.
(R e’ la porzione rimanente della
molecola di glicogeno)
LODISH cap.20
Regolazione della sintesi e degradazione del glicogeno indotta da cAMP
in cellule epatiche e muscolari
GLUCAGONE
PKA
Ca2+
PIP-
(a) Un aumento del cAMP citosolico attiva la chinasi cAMP dipendente (cAPK-PKA) che
innesca una cascata di protein chinasi che include la Glicogeno fosforilasi chinasi
(GPK) e la Glicogeno fosforilasi (GP), e porta alla demolizione del glicogeno. La cAPK
attiva fosforila e inattiva la Glicogeno Sinatasi (GS) inibendo la sintesi del glicogeno. La
fosforilazione di un inibitore (PIP) della fosfoprotein fosfatasi (PP) (v. oltre) impedisce alla
PP di defosforilare gli enzimi attivati della cascata di chinasi e la GS inattiva.
(Gli enzimi attivi sono in toni di colore piu’ scuri, i toni piu’ chiari corrispondono alla forma inattiva)
Regolazione della sintesi e degradazione del glicogeno indotta da cAMP
in cellule epatiche e muscolari
(INSULINA)
Fosfatasi
(b) Un decremento del cAMP inattiva la PKA, e libera la fosfoprotein fosfatasi (PP) nella
sua forma attiva. Questo enzima rimuove i fosfati dalla GPK e GP, inibendo quindi la
demolizione del glicogeno. La fosfatasi rimuove anche il fosfato alla glicogeno sintasi
(GS) inattiva, attivando questo enzima e stimolando la sintesi del glicogeno.
(Gli enzimi attivi sono in toni di colore piu’ scuri, i toni piu’ chiari corrispondono alla forma inattiva)
Le Protein fosfatasi
Phosphoprotein Phosphatase (PP)
Protein fosfatasi 1 (PP-1)
Protein fosfatasi 2A (PP2A)
Protein fosfatasi 2B
Protein fosfatasi 2C
PP-1
ATTIVA
cAMP
PP-1
INATTIVA
PKA
PIP
attivo
P
PIP
attivo
P
ADP
ATP
PIP
inattivo
Glicogeno fosforilasi (GP)
Fosforilasi chinasi (GPK)
Glicogeno sintasi (GS)
La protein fosfatasi-1 e’ inibita da
un inibitore fosforilato: PIP
(Phosphatase Inhibitor Protein)
L’aumento del cAMP inibisce l’attivita’
della protein fosfatasi 1 (PP-1) in
quanto la PKA rende attivo l’inibitore,
fosforilandolo
La fosforilazione da parte della PKA di
- Glicogeno FOSFORILASI CHINASI (GPK) (attivattore glicogeno fosforilasi)
- Glicogeno SINTASI
ha effetti opposti sull’attivita’ dei due enzimi
assieme all’inibizione della fosfatasi porta alla mobilitazione del glicogeno
GPK
GPK-
GS
INATTIVA
ATTIVA
GP
GP-
GS-
SINTESI
DEGRADAZIONE
gluc 1P
Quando cala la concentrazione di cAMP prevale l’attivita’ della Protein
fosfatasi (PP) con effetto opposto
HR
cAMP
UDP
UDP- Gluc
PKA
R2C2
R2
2C
GPK
DEGRADAZIONE
glicogeno
GS
GS
4cAMP
SINTESI
GP
Gluc-1P
GP
Ca2+
GPK
HR nel fegato = GLUCAGONE (ADRENALINA)
nel muscolo = ADRENALINA
attivazione
inibizione
( => GPCR accoppiati a Gs)
CONTROLLO della GLICOLISI da PKA
Nel muscolo il G1P prodotto dalla GP e’ utilizzato per generare ATP
G1P G6P glicolisi ciclo acido citrico
Nel fegato il glucosio puo’ essere rilasciato nel circolo sanguigno in quanto
e’ presente glucosio-6-fosfatasi,
G1P G6P
G6 fosfatasi
glucosio + Pi
e grazie al blocco della glicolisi.
La regolazione della glicolisi avviene a livello delle 3 reazioni esoergoniche,
mediante regolazione allosterica e modificazioni covalenti.
La Fosfofruttochinasi 1 (PFK-1) e’ un enzima chiave
F6P + ATP F1,6BP + ADP
Tetramero di 340KDa
Inibito da ATP, CITRATO
Inibizione da ATP e’ reversibile da AMP
Inoltre e’ attivata da F2,6BP
La regolazione mediata da cAMP dell’attivita’ PFK-1 avviene a livello della
concentrazione di F2,6BP
GLICOGENO
GP
Gluc.1P
PFK-1
mutasi
Regolazione ormonale della glicolisi
nel fegato
glicogeno
sangue
GP
GLUCOSIO
GS
UDP
UTP
Il fruttosio 2,6 bisfosfato (F2,6BP) e’
regolatore della glicolisi.
Riflette la disponibilita’ di GLUCOSIO
= Basso GLUCAGONE
[F2,6BP]
Glicolisi
[F2,6BP]
Glicolisi
G1P
G6P
F6P
PFK-2
F2,6BP
FBPase-2
PFK-1
FBPase-1
F1,6BP
PEP
Gluconeogenesi
PIRUV
attivazione
inibizione
SINTESI e DEGRADAZIONE del F2,6BP sono REGOLATE da
FOSFORILAZIONE dell’ENZIMA TANDEM (PFK-2 / FBPase-2)
PFK -2
FBPase -2
enzima tandem
Fosfofrutto chinasi-2/Fruttosio Bisfosfatasi- 2
PKA
Fosforilazione PFK2/FBPase2
(= glucagone, BASSO glucosio)
ATTIVAZIONE FBPase-2
INIBIZIONE PFK-2
F2,6BP
Controllo del metabolismo del GLUCOSIO da cAMP in fegato
Glicogenolisi
Glicolisi
La modulazione della trasmissione del segnale a livello del
RECETTORE:
la DESENSITIZZAZIONE
- Spegnimento del segnale
-Adattamento alla intensita’ dello stimolo
Permette di ottenere una risposta cellulare che dipende dalla variazione
dell’intensita’ dello stimolo piuttosto che alla quantita’ assoluta dello stesso
risposta correlata alla Δ[H] quando la stimolazione e’ prolungata
Riduzione del numero di recettori funzionali per cellula
effetto a breve o a lungo termine (es. inattivazione funzionale / sequestro
del recettore oppure degradazione)
per stimoli ormonali, neurotrasmettitori o stimoli sensoriali
DESENSITIZZAZONE
La quantita’ di una specie di recettore sulla superficie cellulare non e’ costante:
il suo livello e’ modulato
- SENSITIZZAZIONE
(incremento del n.recettori)
- DESENSITIZZAZIONE (riduzione del n. recettori funzionali)
L’esposizione prolungata all’ormone porta alla riduzione dei recettori funzionali.
Cio’ DESENSITIZZA la cellula a quel dato ligando
= per ottenere la medesima risposta fisiologica e’ necessario uno stimolo (conc.
ligando) piu’ elevato.
• I recettori possono essere internalizzati per endocitosi e degradati
• I recettori possono essere internalizzati, ma restano in vescicole intracellulari
e possono essere riciclati in superficie (sequestro)
• I recettori restano in superficie ma diminuisce la loro affinita’ per il ligando
• I recettori restano in superficie, legano l’ormone, ma il complesso ormone recettore
non e’ piu’ funzionale - disaccoppiamento dal sistema di trasduzione del segnale
(es. non e’ piu’ in grado di riconoscere / attivare le proteine G)
SEQUESTRO
DOWN-REGOLAZ INATTIVAZIONE
RECETTORE
INATT
PROTEINA
SEGNALATRICE
PRODUZIONE
INIBITORE
Cinque modi in cui una cellula target puo’ divenire desensitizzata a una molecola segnale. I meccanismi di inattivazione
che sono mostrati sia per il recettore che per le proteine segnalatrici avvengono spesso mediante fosforilazione della
proteina che viene inattivata, ma ne sono conosciuti anche altri. Nella chemiotassi dei batteri la desensitizzazione
dipende dalla metilazione del recettore.
Il processo reversibile di ADATTAMENTO o DESENSITIZZAZIONE permette alle cellule
di rispondere a cambiamenti della concentrazione di ligando, piuttosto che alla
concentrazione assoluta dello stesso, per una finestra piuttosto ampia di concentrazione
di ligando.
- uno o piu’ meccanismi possono essere coinvolti
- spesso coinvolge la fosforilazione dei recettori
- un effetto secondario e’ l’abbassamento della [H] libero nell’ambiente extracellulare
(per legame non produttivo)
Rec. β2-Adrenergico
Siti di GLICOSILAZIONE (S/T X N)
SX N
C
C
INTERAZIONE con il LIGANDO
D113 sulla TM3
S204, S207 sulla TM5
F290 sulla TM6
D
RRX
S
PONTI DISOLFURO
S
Siti di FOSFORILAZIONE PKA (R K/R X S/T)
Siti di FOSFORILAZIONE βARK (beta Adrenergic Receptor Kinase)
L’Attivazione della PKA downregola i recettori accoppiati a Gs
Diagramma schematico della regolazione a feedback che controlla l’attivita’ di recettori accoppiati a Gs
mediante cicli di fosforilazione e defosforilazione. Tutti i recettori di questo tipo sono fosforilati dalla chinasi
cAMP dipendente (PKA).
Residui addizionali sono fosforilati da chinasi specifiche per il recettore, come βARK, il cui substrato e’ il
recettore beta-adrenergico, o da GRK.
Chinasi ATTIVATA dal RECETTORE
BARK (βARK ) = Beta Adrenergic Receptor Kinase
Gβγ
Kinase
PH
Domini di Interazione
I domini PH (Pleckstrin Homology)
N
Costituiti da circa 100 aa
2 β-sheet antiparalleli
β-strands connessi da loop non
conservati
α-elica C-terminale
C
Funzione e legame del dominio:
• I domini Pleckstrin-homology (PH) si ritrovano in molte proteine della trasduzione del
segnale che si associano alle membrane.
• Alcuni domini PH legano con alta affinita’ fosfoinositidi specifici formati durante la
trasduzione del segnale (PI-4,5P2; PI-3,4P2, PI-3,4,5P3 - Kd a bassa µM, o nM).
• Il legame ai fosfoinositidi potrebbe permettere alle proteine con domini PH di
rispondere ai messaggeri lipidici per esempio mediante la rilocalizzazione presso la
membrana.
• La porzione C-ter di alcuni PH e’ in grado di legare le subunita’ beta/gamma di G
proteine eterotrimeriche (v. BARK).