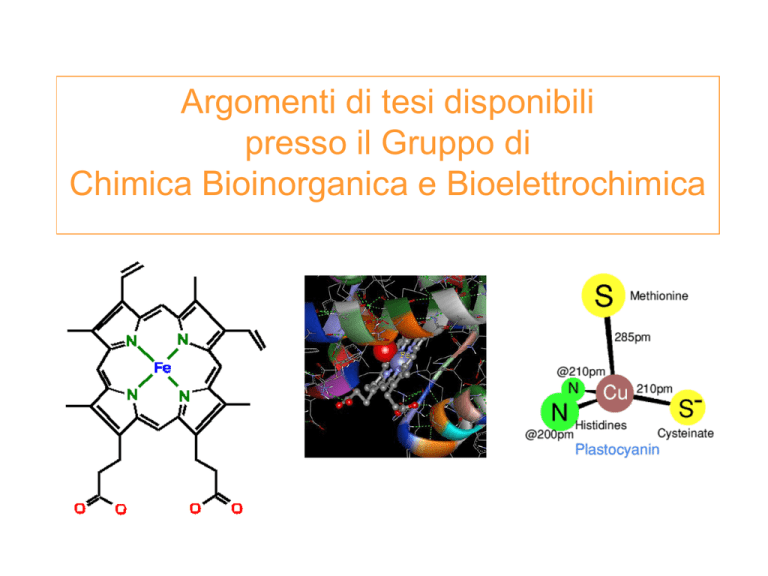
Argomenti di tesi disponibili
presso il Gruppo di
Chimica Bioinorganica e Bioelettrochimica
Gruppo di Chimica Bioinorganica e Bioelettrochimica
G. Battistuzzi
M. Borsari
L. Paltrinieri
A. Ranieri
C. A. Bortolotti
G. Di Rocco
M. Sola
M. Bellei
Argomenti di ricerca
Ci occupiamo di metallo-proteine (proteine di trasferimento elettronico ed
enzimi redox) native o soggette a mutazioni sitospecifiche
Argomenti di ricerca
Studio del rapporto struttura - funzione
Studio della termodinamica e della cinetica dei processi di
trasferimento elettronico di metallo-proteine in soluzione ed
immobilizzate su superfici inorganiche
Studio dei fattori molecolari che influenzano le interazioni fra
metallo-proteine e i propri partner fisiologici
Studio delle proprietà strutturali e funzionali di metallo-proteine e
metallo-enzimi in condizioni denaturanti e in interazione con
membrane fosfolipidiche
Tecniche di indagine utilizzate
Voltammetria ciclica su elettrodi stazionari
modificati e non
Spettroelettrochimica con cella OTTLE
Spettroscopie UV-Vis, Dicroismo circolare
magnetico (MCD), Dicroismo circolare (CD),
Fluorescenza
Spettroscopia Raman e Raman risonante
(SERRS)
Tecniche computazionali
Mutagenesi sitospecifica
Sistemi proteici studiati (nativi o soggetti a
mutazioni sitospecifiche)
Citochromi c mitocondriali
Neuroglobina umana
Eme-enzimi redox
e
sinucleina
Neoroglobina
La Neuroglobina (Ngb) è una globina localizzata nei
neuroni. A differenza delle altre globine, il suo gruppo
eme è esacordinato. Il ruolo fisiologico della Ngb non
ancora stato chiarito. Fra le possibili funzioni
fisiologiche della Ngb troviamo
• protezione dei neuroni da ipossia e ischemia,
rifornendoli di O2;
• eliminazione dell’eccesso di NO o sintesi di NO;
• eliminazione radicali ossigenati e azotati (ROS and
RNS, respectively);
• Inibizione dell’apoptosi, grazie alla riduzione del
citocromo c rilasciato nel citosol.
Nel corso del tirocinio sarà studiata la
reattività della Ngb (nativa e mutanti),
mediante tecniche spettroscopiche (UV-Vis,
MCD, CD, Fluorescenza) e voltammetriche.
e sinucleina
Le sinucleine sono proteine presenti nei terminali
presinaptici dei neuroni, coinvolte nella genesi e nello
sviluppo del Morbo di Parkinson, a causa della loro
capacità di formare aggregati che originano fibrille e
successivamente i Corpi di Lewy. La loro
autoaggregazione e oligomerizzazione sono facilitate
dalla presenza di Cu(II) e Fe(II), che si coordinano a
due siti di legame, posti nella zona C- ed N- terminale.
Una volta coordinati alla sinucleina, gli ioni Cu(II) e
Fe(II) possono catalizzare l’ossidazione della proteina
stessa da parte dei radicali ossigenati (ROS),
provocandone l’oligomerizzazione e la precipitazione.
Nel corso del tirocinio saranno studiate,
mediante tecniche voltammetriche, le
proprietà redox del complesso formato dal
Fe(II) con peptidi, che riproducono il sito
metallo-legante posto nella zona N−terminale
dell’ e della -sinucleina ( S1-15 e S1-15).
Immobilizzazione di eme-proteine in
matrici vetrose mesoporose
L’immobilizzazione di enzimi su matrici solide permette:
• il loro efficiente recupero alla fine della reazione;
• il loro riutilizzo in più cicli catalitici;
• la riduzione della contaminazione da parte dei prodotti
della reazione.
Inoltre, gli enzimi immobilizzati possiedono una maggiore
specificità e selettività nei confronti dei substrati, sono più
stabili in condizioni denaturanti (pH estremi, agenti
denaturanti, temperatura, solventi organici) e sono
impiegati nella produzione di biosensori, nella sintesi di
bio-carburanti, nella rimozione di inquinanti e nelle celle a
biocombustibile
Nel corso del tirocinio sarà studiata la
possibilità di immobilizzare eme-proteine
(native e mutanti) in matrici vetrose
mesoporose
a
porosità
controllata,
verificandone l’effetto sulle proprietà funzionali
e strutturali.
Eme-perossidasi
Le eme-perossidasi sfruttano la riduzione di H2O2 per
catalizzare l’ossidazione di un’ampia varietà di bistrati
organici e inorganici. Il loro ciclo catalitico prevede tre
step redox consecutivi che coinvolgono due specie
intermedie (Composto I e Composto II) caratterizzate da
un alto potenziale di riduzione, le quali ossidano le
molecule di substrato. La comprensione dei fattori
molecolari che influenzano il potenziale di riduzione delle
coppie redox coinvolte nel ciclo catalitico delle
perossidasi è cruciale per capire I dettagli molecolari che
determinano le loro proprietà catalitiche.
Nel corso del tirocinio sarà studiata la
reattività redox in soluzione di eme-enzimi
redox nativi e ricombinanti mediante tecniche
spettroelettrochimiche.
Argomenti di tesi proposti (2-3 posti disponibili)
Studio spettroscopico ed elettrochimico della reattività della forma nativa della
neuroglobina umana.
Studio spettroscopico ed elettrochimico della reattività di mutanti della
neuroglobina umana.
Studio elettrochimico delle proprietà redox del complesso formato dalla
sinucleina con ioni Fe(II).
Studio spettroelettrochimico della reattività redox di eme-enzimi con proprietà
antiossidanti (collaborazione con C. Obinger, University of Natural Resources
and Life Sciences, Vienna).
Studio dell’immobilizzazione di eme-proteine in matrici vetrose mesoporose
(collaborazione con il Prof. Gianluca Malavasi).