www.haikzarian.com
copyright © Haik Zarian
FARMACI DEL SISTEMA CARDIOVASCOLARE
Prof. Chinellato
FARMACI ANTIIPERTENSIVI
Regolazione della pressione arteriosa
La pressione arteriosa è un parametro importante ed assicura una corretta circolazione del
sangue necessario per il metabolismo cellulare. La pressione ematica è la pressione che il
sangue esercita sulle pareti dei vasi e garantisce il regolare svolgimento delle funzioni
metaboliche cellulari. Distinguiamo due tipi di pressione arteriosa:
-
pressione sistolica corrisponde alla pressione durante la sistole ventricolare sx
(massima)
-
pressione diastolica corrisponde alla diastole ventricolare cioè alla pressione (minima).
Vi è poi una pressione media che si registra durante il ciclo cardiaco.
Dal punto di vista fisico la pressione arteriosa è direttamente proporzionale al prodotto del
flusso ematico (gittata cardiaca) per la resistenza al passaggio del sangue attraverso
le
arteriole precapillari (resistenze vascolari periferiche).
Regolazione della pressione arteriosa sistemica
La pressione arteriosa è regolata da diversi fattori come per esempio dalla forza di
contrazione del miocardio e dalla frequenza delle contrazioni del muscolo cardiaco che è
direttamente regolata dal cuore. La gittata poi è regolata oltre che dal muscolo cardiaco
anche dal volume del sangue circolante. Le resistenze periferiche vengono regolate dalla
viscosità del sangue oltre che dal fattore vasale, cioè tono vasale, e dalla elasticità delle
pareti del vaso e vanno a costituire il fattore resistenza. Il controllo della pressione
arteriosa sistemica che è di tipo neurormonale, sistema che agisce modificando la gittata
cardiaca. La gittata cardiaca e le resistenze periferiche vengono modificate in modo da
mantenere costante la pressione arteriosa.
1
www.haikzarian.com
copyright © Haik Zarian
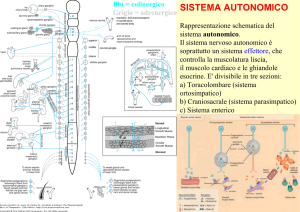
Sistema nervoso autonomo
Come detto abbiamo un importante controllo di tipo neuro-ormonale, in grado di
modificare l’omeostasi cardiocircolatoria. Il sistema nervoso autonomo è regolato dal
simpatico e parasimpatico che media gli effetti di riposo ed è in grado di rallentare
frequenza cardiaca, respirazione e stimolare digestione.
Effetti del sistema nervoso simpatico:
-
modulazione di situazioni di emergenza ed è in grado di stimolare:
-
frequenza cardiaca
-
vasocostrizione
-
respirazioneù
-
rallentamento della digestione.
Effetti del sistema nervoso parasimpatico
-
modulazione di situazioni di riposo ed è in grado di rallentare:
-
frequenza cardiaca
-
respirazione
-
stimolo digestione
Inoltre esistono dei controlli ormonali della muscolatura liscia aretriolare:
-
Adrenalina-noradrenalina: agiscono su tutti i vasi costringendo (mm. scheletrico,
cardiaco) vasodilatando
-
Angiotensina: potente vasocostrittore con costrizione di arteriole periferiche e venose.
Viene rilasciato quando la pressione arteriosa diminuisce.
-
Vasopressina: potentissimo vasocostrittore, trattiene H2O dalle urine a livello renale e
contribuisce ad aumentare la Pa
Oltre ai fattori ormonali esistono anche dei fattori che agiscono a livello locale come pO2,
pCO2, K+, H+, metaboliti (vasodilatazione).
Recettori
La conoscenza e la localizzazione dei recettori è importante anche per capire la sede e la
modalità di azione dei farmaci anti-ipertensivi. I recettori più importanti sono α e β
adrenergici.
Recettori α-adrenergici:
2
www.haikzarian.com
-
copyright © Haik Zarian
α1: localizzati nella muscolatura liscia vasale, a livello delle grandi arterie e delle
arteriole.
-
α2: localizzati a livello presinaptico e giocano un ruolo importante nel controllo della
trasmissione inibendo il rilascio della noardrenalina della vescicole tramite un
meccanismo di feedback negativo.
Recettori β-adrenergici
-
β1: localizzazione a livello cardiaco con effetti cronotropo positivo, initropo positivo a
livello renale e liberazione di renina.
-
β2: localizzati sui vasi determinano vasodilatazione. A livello polmonare hanno effetti di
broncodilatazione e liberazione di insulina.
Tra gli α quelli più importanti sono α 1 e α 2. I farmaci agiscono soprattutto sugli α1. Po Gli
anti ipertensivi β 2 sono importanti entrambi gli effetti che modulano effetto globale anti
ipertensivo dei β bloccanti.
Sistema RAS
Il sistema RAS consiste in un fine meccanismo ormonale atto a regolare la pressione
sanguigna, il volume plasmatico circolante (volemia) ed il tono della muscolatura arteriosa
attraverso diversi meccanismi. Fattore cardine di questo sistema è dato dalla renina che si
forma nelle seguenti situazioni:
-
riduzione del volume sanguigno circolante (ipovolemia);
-
bassa pressione arteriosa (ipotensione);
-
stimoli da parte del sistema nervoso ortosimpatico;
-
altri stimoli anche di natura patologica.
Quando diminuisce la perfusione dell'apparato iuxtaglomerulare, si ha produzione di
prorenina a livello delle cellule iuxtaglomerulari. Dalla prorenina si forma la renina la quale
converte un peptide inattivo, l'angiotensinogeno, in angiotensina I; quest'ultimo peptide
viene convertito a sua volta in angiotensina II dall'enzima di conversione dell'angiotensina I
o ACE (angiotensin-converting enzyme), presente principalmente a livello dei capillari
polmonari.
L'angiotensina II è il principale prodotto bioattivo del sistema renina-angiotensina ed ha
un'azione ormonale sia endocrina, sia autocrina/paracrina, che intracrina.
AII è un
potente vasocostrittore che da un alto vasocostrizione e dall’altro aumenta riassorbimento
di Na e H2O con aumento pressione arteriosa.
3
www.haikzarian.com
-
copyright © Haik Zarian
I farmaci β bloccanti a livello renale bloccano la sintesi di renina.
Se scappa al
controllo di β antagonisti succede che la renina attiva angiotensinogeno ad AI.
-
Gli ACE inibitori agiscono sull’attivazione AI-AII e bloccano anche metabolismo della
bradichinina che da rilascio di NO e la prostaciclina 2. Se la bradichinina non viene
inattivata sono in grado di aumentare la produzione di questi due agenti vasodilatanti.
-
Gli AT1 (sartani) bloccano attività dell’angiotensina come vasocostrittore e attivante
l’aldosterone.
Esiste uno shunt in quanto si è visto che dall’angiotensinogeno nonostante ci fosse il
blocco, su alcuni pz si formava lo stesso l’AII in quanto esiste una via indipendente per la
formazione AI e poi AII. Alla luce di questo le case farmaceutiche hanno proposto miscela
di ACE inibitori e sartanici in modo da avere un blocco totale della cascata
dell’angiotensina. La problematica da un punto di vista farmacologico è che un farmaco
divenuto vecchio diventa farmaco generico dopo 20 anni si ha la perdita del brevetto.
Pertanto le case farmaceutiche si inventano qualche nuova formula per tenere la proprietà
del brevetto.
Il successo nella terapia dell’ipertensione è del 12% mantenendola nel tempo, in quanto si
tratta di patologia cronica.
Ritmo circadiano
La pressione ha suo particolare ritmo circadiano e subisce più o meno rapidi incrementi e
cali per tutta una serie di stimoli legati all’attività fisica e mentale, ai pasti, al riposo.
La pressione sistolica e diastolica quindi variano nel corso delle 24h, alle 9 di mattina è
abbastanza elevata per poi scendere durante l’arco della giornata. La sera al momento del
coricamento la pressione scende per poi alzarsi nuovamente di giorno.
Quindi abbiamo valori massimi al risveglio e minimi nel riposo notturno. Massimi nella
stagione fredda e minimi nella calda e a lungo termine si ha aumento della pressione con
l’età.
Ipertensione arteriosa
L’ipertensione arteriosa si definisce come un aumento della pressione di qualsiasi origine
essa sia.
È importante riconoscerla precocemente in quanto è causa di diversi tipi di
patologie come malattie cardiache, ma anche danni d’organo. L’ipertensione arteriosa è uno
dei principali fattori di rischio delle malattie cardiovascolari.
Il decorso clinico dell’IA vede diverse fasi. In genere esordisce come ipertensione labile alla
quale fa seguito una fase permanente di ipertensione asintomatica con livelli pressori al di
4
www.haikzarian.com
copyright © Haik Zarian
sopra della normale. A questa fa più seguito una fase di ipertensione non complicata
seguita dalla fase con complicazioni che possono condurre all’exitus (ipertensione maligna).
Epidemiologia dell’IA
La pressione arteriosa aumenta con l’età, a parità di età è più alta nei maschi che nelle
femmine, ma fino ad un certo punto, in quanto la donna dopo la menopausa ha aumenti
pressori della pressione media con equiparazione agli uomini o anche superiore nelle
donne. Intorno alla menopausa cioè avviene il così detto sorpasso.
Il 10% degli ipertesi ha età compresa tra 20-30anni, 30% tra 30-60 e il 60% oltre i 60 anni.
La % dei pz che riusciremo a guarire ottimamente sarà che su 100 persone 50 non sanno
di essere ipertesi, di questi 50 25 non si curano ma di questo 25 ancora il 50% dopo 5 anni
è ancora in trattamento quindi solamente poco più del 10%. Cioè la così detta legge della
metà metà metà. Nel 10% non è detto che tutti si curino perfettamente.
Classificazione dell’ipertensione
-
Ipertensione primaria: la primaria in genere è di origine sconosciuta quindi non si
sanno le cause e riguarda il 90% delle ipertensioni ed è classificata secondo le gravità.
I fattori che possono influenzare l’ipertensione primaria sono l’attività fisica, la dieta
(iposodica), pochi grassi altrimenti ipercolesterolemia. Pochi sono fattori genetici e
ormonali (vedi donna).
-
Ipertensione secondaria: è solo un sintomo di altre patologie e riguarda il 10% dei pz
(nei centri specialistici il 20%)e ha diverse cause come malattie renali, disordini
endocrini, farmaci e gravidanza. Ci sono diversi elementi suggestivi di ipertensione
secondaria come la storia familiare di malattie renale (rene policistico), malattie renali,
infezioni tratto urinario, ematuria, abuso di analgesici, feocromocitomi, ipertiroidismo,
iperaldosteronismo, uso di farmaci o sostanze come contraccettivo orali, FANS,
liquirizia, vasocostrittori nasali, cocaina, amfetamine, steroidi, eritropietina ecc.
Diagnosi
Tanto più precoce sarà la diagnosi eziologia e intervento terapeutico mirato alle cause
dell’ipertensione e tanto più probabile sarà la normalizzazione dei valori pressori con al
rimozione della causa dell’ipertensione. Questo però non accade sempre in quanto il pz
assume farmaci piuttosto che cambiare lo stile di vita. Il pz quindi non riesce a rimuovere
la causa di ipertensione quindi è più facile assumere una pastiglietta. La misurazione della
pressione va fatta almeno due volte al giorno intervallato da un minuto, con bracciali di
uso adeguato e nella prima visita su entrambe le braccia.
5
www.haikzarian.com
copyright © Haik Zarian
Esiste anche l’ipertensione da camice bianco. In questo caso si deve suggerire
l’automisurazione domiciliare per una misurazione più reale.
L’IA è una condizione molto importante: l’OMS afferma infatti che la metà di tutte le
malattie cardiovascolari trovano la loro origine nella situazione di pressione arteriosa.
Questo può portare ad un accorciamento della durata della vita.
Sintomi
Nella maggior parte dei casi l’IA è asintomatica, a volte può produrre cefalea, vertigini,
dolori toracici, disturbi della vista, alterazioni dell’umore. È meglio quindi evidenziare
l’ipertensione nella fase asintomatica.
I valori tensivi dell’IA secondo OMS e ISH (società internazionale dell’IA).
- ottimale: <120 /<80
- normale: <130/<85
- normale-alta: 130-139/85-89
- > 130 >85 si parla di ipertensione
Le diverse linee guida diranno se pz borderline, se bisogna iniziare subito il trattamento.
Patologie correlate sono il diabete, ipercolesterolemia e fattori di rischio come il fumo,
obesità ecc.
Fattori di rischio e misure comportamentali
La pressione alta accorcia di 10-20 anni la vita media dei pz. Le complicanze sono cerebro
vascolari, episodi cerebro vascolari e insufficienza renale. Ridurre la pressione serve anche
per evitare il danno d’organo cioè a prevenire l’ipertrofia ventricolare sx, ispessimento
pareti arteriose complicate dalla dislipidemia e alterazioni a livello renale.
Altri fattori di rischio cardiovascolare comprendono:
-
sesso maschile >55anni, nelle femmine con età >65 anni
-
fumo
-
dislipidemia
-
obesità
-
diabete
-
familiarità
-
stile di vita sedentario
Sono di fondamentale importanza inoltre le misure comportamentali, da tener presente
prima di ricorrere alla terapia farmacologia:
6
www.haikzarian.com
copyright © Haik Zarian
-
riduzione peso corporeo
-
riduzione consumo di alcol
-
eccessivo consumo di sale
-
aumento attività fisica
-
abolizione fumo da sigaretta
-
regimi alimentari in grado di correggere il rischio cardiovascolare
FARMACOLOGIA DELL’IPERTENSIONE
I primi farmaci introdotti sono stati i diuretici, poi β bloccanti, α bloccanti, Ca antagonisti,
negli anni 80 gli ACEI, poi ARB e JNC7.
Classi antiipertensivi di prima scelta
-
diuretici
-
Ca antagonsiti
-
ACEI
-
Inibitori recettoriali dell’AII
-
α e β bloccanti
Classificazione ATC (anatomica chimica terapeutica)
-
C: sistema cardiovascolare
-
C01: terapia cardiaca
-
C02: antiipertensivi
-
C03: diuretici
-
C04: vasodilatatori periferici
-
C05: vasoprotettori
-
C06: beta bloccanti
-
C07:Ca antagonisti
-
C08: sostanze ad azione sul sistema RAS
-
C09: sostanze ipolipemizzanti
DIURETICI
Generalità
Sono i farmaci di più vecchia data hanno la funzione di abbassare la pressione arteriosa
mediante depauperamento sodico e riduzione della volemia. Nell’ipertensione primaria non
7
www.haikzarian.com
copyright © Haik Zarian
complicata dovrebbero essere farmaci di prima scelta ma non lo sono purtroppo e sono
poco utilizzati. Sono F che possiamo trovare utilizzati molto ma in associazione e
normalmente si associano con ACE inibitori. Gli ACE inibitori sulla razza nera sono meno
efficaci.
Classificazione
Per quanto riguarda la classificazione appartengono alla classe C03. Ciascun farmaco
diuretico ha un proprio ATC (C03Ab come tiazidi associate a potassio). Esistono poi
diuretici ad azione minore, C03C diuretici ad azione diuretica maggiore come le solfonamidi
non associate, furosemide, bumetanide. Ultima classe sono i C03D che sono farmaci
risparmiatori di potassio quindi antagonisti dell’aldosterone, spironolattone, canrenoato di
potassio ecc. I diuretici a seconda della loro intensità d’azione possono esser classificati
come:
-
Ad alta intensità di azione (Na+ escreto >10%). Comprendono la furosemide,
torasemide etc
-
A media intensità d’azione (Na+ escreto tra il 5-10%). Comprendono idroclortiazide,
indipamide, clortalidone.
-
A debole intensità d’azione (Na+ escreto <5%). Comprendon spironolattone, canreone,
amiloride, trimetrene.
Ciascun diuretico ha una sua azione diuretica a livello di specifici siti d’azione.
Da tenere presente che l’ultrafiltrato è isosomotico con il liquido extracelluare e man mano
che si scende H2O esce dal nefrone che diventa iperosmotico. Risalendo per l’ansa di
Henle ci sono trasportatori attivi che estraggono Na, Cl, K attivamente riportando ad una
condizione di ipoosmolarità l’ultrafiltrato originario. Successivamente vi sono sistemi di
estrusione attivo di Na+ che portano l’ultrafiltrato ad essere iperosmotico. Proprio sulla
capacità del nefrone di essere permeabile e centrare le urine che i farci diuretici agiscono.
La classificazione quindi dei diuretici comprende:
-
osmotici:
-
inibitori anidrasi carbonica:
-
tiazdici: agiscono nel tubulo contorto distale
-
dell’ansa: agiscono nella parte discendente dell’ansa di Henle
-
risparmiatori di potassio: agiscono a livello del dotto collettore
1. DIURETICI OSMOTICI
8
www.haikzarian.com
copyright © Haik Zarian
Composti a basso peso molecolare che sono metabolizzati in misura modesta. Vengono
infatti filtrati passivamente nel glomerulo ed assorbiti in quantità trascurabile. Per effetto
osmotico richiamano una certa quantità di H2O nel sangue. In altre parole sono sostanze
farmacologicamente inerti che filtrate nel glomerulo sono poco o per nulla riassorbite. Per
osmosi viene trattenuta l’H2O nel nefrone ed in parte viene ridotto anche il riassorbimento
del Na+. Un esempio di diuretico osmotico è dato dal mannitolo che non viene
metabolizzato ed escreto per filtrazione glomerulare (senza processi di riassorbimento). Il
mannitolo limita l’assorbimento di H2O nel tubulo prossimale e nel tratto discendente
dell’ansa (permeabili) per forza osmotica contraria. Aumenta inoltre il volume del fluido
intratubulare e aumento di quello urinario. Viene usato anche per ridurre l’edema
cerebrale e ridurre pressione intraoculare. Oltre al mannitolo altri DO comprendono la
glicerina, l’isosorbide e l’urea. Le prime due possono essere somministrate anche per os
mentre il mannitolo (come anche l’urea) va somministrato per e.v.
Indicazioni più importanti per l’uso dei DO
-
l’IRA
-
per auemnteare voume di urina (per prevenire anuriaa in caso di rabdomiolisi);
-
per diminuire la pressione intracranica e intraoculare (glaucoma). Questo però porta
espansione volume extracelluare con rischio di edema polmonare, cefalea, nausea e
vomito. In seguito si ha anche disidratazione ed ipernatriemia.
Tossicità
L’impiego di DO può provocare:
-
espansione del volume extracellulare (edema polmonare, cefalea, nausea e vomito)
-
disidratazione ed ipernatremia.
2.INIBITORI DELL’ANIDRASI CARBONICA
Generalità
L’AC è un enzima sito nel tubulo contorto prossimale dei nefroni che catalizza la reazione:
CO2 + H2O <--> H2CO3
L'acido carbonico così formatosi nelle cellule del tubulo prossimale si dissocia in protone e
bicarbonato, e il protone viene scambiato con Na+ all'interno del lume del tubulo. L'AC
induce così ritenzione di Na+ (e quindi di H2O) e la sua inibizione ha dunque un effetto
diuretico e di alcalinizzare le urine.
9
www.haikzarian.com
copyright © Haik Zarian
Meccanismo d’azione e farmacocinetica
I farmaci appartenenti a questa classe sono la acetozolamide, diclorophenamide,
methazolamide. In queste molecole è fondamentale il gruppo SO2NH2 (sulfonamide). Sono
ben assorbiti dopo somministrazione per os e sono efficaci dopo 30 min e per 12 ore circa.
L’AC è presente in due isoforme, la IV e la II. Gli inibitori agiscono su entrambe le isoforme.
La via di eliminazione è prevalentemente renale. Abbiamo il blocco dell’AC in due punti: a
livello del tubulo prossimale dove c’è idrolisi ad H2O e CO2. Abbiamo anche blocco anche
nella formazione di acido carbonico che passa in circolo, come base dell’acido carbonico. Si
instaura un acidosi metabolica in quanto si blocca questo processo. Come detto prima
abbiamo diversi tipi di AC, la IV nel lume, mentre nella cellule c’è la tipi II.
Per quanto concerne il meccanismo d’azione gli inibitori dell’AC bloccano il riassorbimento
del bicarbonato di sodio (<85%) con conseguente diuresi del bicarbonato e riduzione delle
riserve
(acidosi metabolica ipercloremica). Ha attività anche in siti extrarenali come il
corpo ciliare dell’occhio, plesso corioideo, ma a processo invertito.
Indicazioni
Sono impiegati come diuretici nel trattamento di:
-
glaucoma (trattamento cronico): abbassano la formazione di umor acqueo con calo
della pressione intraoculare. Dorzolamide e brinzolamide composta di attività locale (c’è
una forma di AC anche nell’occhio)
-
alcalinizzazione urine, in caso di intossicazioni da farmaci acidi (come alcuni FANS);
-
ipertensione
-
malattia da alta quota (formazione di edemi polmonari e cerebrali) e stati edematici
come nello scompenso cardiaco congestizio. Gli inibitori dell’AC diminuiscono la
formazione del liquor cefalorachidiano abbassandone
il pH. Profilasi in 24h prima
dell’associazione per impedire la formazione di edema cerebrale e polmonare.
Effetti collaterali
Comprendono:
-
acidosi metabolica ipercloremica: riduzione cronica delle riserve organiche di
bicarbonato;
-
calcoli renali: fosfaturia e ieprcalciuria dovuta ad eliminazione di bicarbonato (uso
cronico). Sali di Ca insolubili a pH alcalino.
-
Perdita di potassio renale
10
www.haikzarian.com
-
copyright © Haik Zarian
Altri effetti: sonnolenza e parestesie. Ipersensibilità (febbre, eruzioni cutanee, nefriti
interstiziali e depressione midollo osseo).
3. TIAZIDI
Generalità
Sono diuretici del tubulo distale, moderatamente potenti e sono stati preparati modificando
la struttura degli inibitori dell’AC. Questa classe di diuretici agisce sul segmento iniziale del
tubulo distale dove inibisce il riassorbimento di NaCl.
Questa classe di farmaci comprende:
-
clorotiaside
-
idroclorotiazide
-
clortalidone
Meccanismo d’azione efarmacocinetica
Agiscono su un sistema di co-trasporto e quindi del cloro. Aumenta il Na+ a livello
dell’ultrafiltrato che trattiene conseguentemente anche l’H2O. Sono in grado di aumentare
l’assorbimento del Ca.
Anche in questi composti è necessaria presenza gruppo sulfonamidico. Vengono assorbiti
per via renale. Competono con la secrezione di ac. urico e danno quindi iperuricemia.
Indicazioni cliniche
Le indicazioni cliniche comprendon:
-
ipertensione;
-
insufficienza cardiaca moderata
-
edema grave e resistente (viene utilizzato specialmente il metolazene, insieme con i
diuretici dell’ansa)
-
prevenzione calcoli nell’percalciuria idiopatica in qunato favoriscono rissorbiemtno Ca
e diabete insipido nefrogeno.
-
Diabete insipido nefrogeno.
Sono assorbiti a livello gastrointestinale, aumentano escrezione Na, Cl ma anche K. I
diuretici tiazidici anche anche effetto vasodilatante diretta.
Effetti collaterali e tossicità
Bisogna stare attenti a:
-
alcalosi ipokaliemica ed iperuricemia
11
www.haikzarian.com
-
copyright © Haik Zarian
ridotta tolleranza ai carboidrati (iperglicemia per diminuzione della secrezione di
insulina)
-
iperlipidemia (aumento del 15% del colesterolo sierico)
-
iponatremia
-
reazioni allergiche (fotosensibilità e dermatiti)
-
altri effetti: astenia, parestesie
4.DIURETICI DELL’ANSA
Generalità
I diuretici dell’ansa comprendono una famiglia di farmaci con struttura chimica diversa,
ma che hanno in comune il fatto di agire nel tratto ascendente dell’ansa di Henle.
Hanno effetto diuretico molto intenso e vengono rapidamente assorbiti. L’effetto
normalmente dura tre ore.
Fanno parte di questa classe:
-
furosemide
-
torasemide
-
piretanide
-
etozolina.
Meccanismo d’azione e farmacocinetica
I diuretici dell’ansa agiscono nella parte ascendente dell’ansa di Henle e bloccano il
trasportatore Na-K-Cl. Riducono anche l’assorbimento di magnesio e calcio.
Proprio per il sito dove agiscono cioè tratto ascendente ansa, producono effetto duplice: se
non concentrano le urine concentrate, non sono in grado di produrre un gradiente di
concentrazione che si forma nello spazio extracellulare e quindi abbiamo duplice effetto
diuretico che si svolge sia nel tratto ascendente dell’ansa di Henle che nel doto collettore.
Altro effetto di questa classe di diuretici è la vasodilatazione diretta.
Indicazioni cliniche
Sono indicate nel trattamento di:
-
edema polmonare acuto
-
scompenso cardiaco
-
cirrosi complicata da ascite
-
sindrome nefrosica
-
insufficienza renale
-
nell’ipertensione specialmente se accompagnata da insufficienza renale
12
www.haikzarian.com
-
copyright © Haik Zarian
trattamento acuto iperclacemia.
Effetti collaterali e tossicità
Gli effetti indesiderati comprendono:
-
alcalosi metabolica ipokalemica (dovuta a secrezione renale di K+ e H+)
-
ototossicità (generalmente reversibile)
-
iperuricemia (dovuta all’ipovolemia ed aumento del riassorbimento di ac.urico)
-
ipomagnesemia
-
reazioni allergiche (eruzioni cutanee ed eosinofilia, rara nefrite interstiziale)
-
disidratazione.
Da tenere presente che sono diuretici drastici e l’iperuricemia deriva dal fatto che non si
forma per gradiente osmotico.
5. RISPARMIATI DI K
Generalità
Bloccano il riassorbimento di sodio e la secrezione di potassio nei tubuli collettori e nei
dotti, (la secrezione di K risulta essere un importante effetto indesiderato delle due
precedenti classi di diuretici). I RdP hanno un effetto diuretico moderato e per tal motivo
non
sono
usati
in
monoterapia,
ma
vengono
associati
a
tiazidici.
Sono controindicati con gli inibitori dell'ACE per il pericolo di un'iperkaliemia.
Si distinguono
-
Antagonisti dell'aldosterone, come lo spironolattone
-
Risparmiatori indipendenti dall'aldosterone: amiloride, triamterene
Il canreonato di potassio ha dimostrato effetti carcinogeni in esperimenti animali. Tale
molecola è un metabolita dello spironolattone, che non ha alcun effetto cancerogeno.
Lo spironolattone, in associazione alla triterapia (iACE, diuretici, digitalici) diminuisce la
mortalità dell'insufficienza cardiaca agli stadi NYHA III e IV.
Meccanismo d’azione e farmacocinetica
Il meccanismo d’azione si basa sulla riduzione dell’assorbimento Na+ e risparmio di K+.
Da tenere presente che l’aldosterone ha un suo recettore ed induce sintesi di canali al Na+
e secrezione di K+ portando anche alla formazione di nuove pompe per la captazione del K+
e secrezione di Na+. Il meccanismo d’azione si basa su:
13
www.haikzarian.com
-
antagonizzazione
copyright © Haik Zarian
diretta
di
recettori
citoplasmatici
dei
mineralcorticoidi
(spironolattone) presenti in cellule del tubulo collettore, quindi inibizione sintesi pompa
ATPasi Na+/K+.
-
inibizione diretta del trasporto di Na+ attraverso canali ionici della membrana luminale
(triamterene amiloride)
-
blocco della secrezione del K+ all’interno del lume poichè impediscono il generarsi di
un potenziale elettrico negativo luminale.
Indicazione clinica
Una delle indicazioni cliniche è data nell’uso in associazione con diuretici che promuovono
la perdita di K+. Lo spironolattone viene utilizzato meno frequentemente dell’amiloride o del
triamterene a causa della sua minore tollerabilità. Lo spironolattone viene utilizzato:
-
nell’iperaldosteronismo primario (sindr di Conn), che è una aptologia abbastanza rara;
-
nell’iperaldosteronismo secondario dovuto a cirrosi epatica complicata dall’ascite.
Effetti collaterali e tossicità
Per quanto concerne la tossicità è possibile il riscontro di:
-
iperkaliemia (rischio aumentato in presenza di patologie renali);
-
acidosi metabolica ipercloremica
-
giencomastia (alterazioni endocrine agendo su recettori degli steroidi)
-
IRA (combinazione triamterene e indometacina)
-
Nefrolitiasi (triametrene poco solubile e può precipitare nelle urine).
DIURETICI IN SINTESI
I diuretici quindi danno perdita di Na. Tra i F. più usati sono le associazioni dei diversi
farmaci e quindi la cosa più semplice da fare, è quella di associarli ad altri F. che siano in
grado di bloccare il loro effetto collaterali. La perdita di Na provoca produzione di renina.
a) Azione a breve termine
-
aumento della diuresi (aumentata eliminazione renale di Na+ e H2O)
-
riduzione della volemia
-
riduzione della gittata cardiaca
-
riduzione della portata cardiaca
-
riduzione della pressione arteriosa
b) Azione a lungo termine
14
www.haikzarian.com
-
copyright © Haik Zarian
diminuzione delle RP (diminuità reattività vascolare e incremento sintesi PG
vasodilatatori)
c) Liberazione di renina
Effetti collaterali dei diuretici
-
ipovolemia (ipotensione);
-
ipokaliemia (aritmie ventricolari, debolezza muscolare, astenia)
-
iperglicemia: riduzione della volemia e dell’insulino resistenza (ipokaliemia indotta)
-
iperuricemia (ipovolemia aumenta del 35% l’assorbimento, gotta)
-
dislipidemia (ipercolesterolemia e ipertrigliceridemia).
Indicazioni
-
scompenso
cardiaco
(diminuiscono
il
volume
telesistolico
cioè
il
precarico,
diminuiscono le resistenze vascolari periferiche, aumentano la gittata cardiaca,
diminuiscono i sintomi congestizi e aumentano la capacità all’esercizio)
-
ipertensione nell’anziano
-
ipertensione sistolica
-
ipertensione in razza nera.
I diuretici sono anche di aiuto nella fase sdi inizio e di titolazione degli ACE inibitori, beta
bloccanti e vasodilatatori.
Controindicazioni
- gotta (assoluta)
- gravidanza (reslativa)
FARMACI DEL SISTEMA RAAS
Generalità
Si tratta di F. che bloccano la sintesi o l’azione dell’angiotensina e perciò riducono le
resistenze vascolari e (potenzialmente) il volume ematico.
I farmaci che interferiscono con il sistema RAS sono i farmaci:
- antagoisti della renina, non in uso in Italia
- inibitori dell’ACE
- antagonisti dei recettori AT1
- diuretici anti aldosteronici (già visti la volta scorsa)
15
www.haikzarian.com
copyright © Haik Zarian
Secondo la classificazione ATC (anatomico chimico terapeutica) li troviamo come C09.
Si distinguono i C09A che sono i non associati cioè ACE inibitori registrati, vedi captobril.
È molto diffusa l’associazione ACE inibitori con diuretici che molto vantaggiosa e permette
di usare bassi dosaggi di ACE inibitore e anche di diuretico; sono comuni le associazioni
ACEi con Ca antagonisti. Infine i sartani, prima non associati, e poi associati con diuretici
e quindi Ca antagonisti.
La catena del sistema RAS
Si parte dalla sintesi di renina nel rene, la quale agisce andando ad attivare
l’angiotensinogeno. La renina è coinvolta nella trasformazione di angiotensinogeno ad
angiotensina I che è ancora poco vasoattiva che però si trasforma in AII grazie all’ACE ed è
qui che agiscono gli ACE inibitori. Una volta formato AII agisce a livello de vasi, reni snc,
midollare surrenale producendo i suoi effetti peculiari. Gli antagonisti dei recettori, ATI e
ATII, i sartani agiscono sui ATI bloccando tutti gli effetti.
Regolazione rilascio renina
Una diminuzione della pressione a livello dell'arteriola afferente induce un aumento della
liberazione di renina, forse attraverso il rilascio di prostaglandine.
Le cellule juxtaglomerulari possiedono recettori β-adrenergici (β -AR) accoppiati a una
proteina G, che stimola l'attività adenilato ciclasica; questo determina un aumento dei
livelli intracellulari di cAMP che, a sua volta, stimola la liberazione di renina. Le cellule
della macula densa del tubulo contorto distale modulano la liberazione di renina in base al
flusso di NaCl a livello del tubulo contorto distale. In caso di diminuzione del flusso di
NaCI, la riduzione dell'ingresso di CI- mediante il trasportatore Na+-K+-2CI- (NKCC2),
espresso sulla membrana apicale delle cellule della macula densa, attiva la ciclossigenasi 2
(COX-2), e questo determina un aumento della produzione di prostaglandine. Queste
diffondono
nelle
cellule
juxtaglomerulari,
in
cui
attivano
recettori
specifici
(PG),
determinando un aumento della liberazione di renina attraverso l'aumento della
produzione di cAMP. AI contrario, un aumento dell'apporto di NaCI a livello del segmento
corticale del tratto ascendente spesso (TAL, Thick Ascending Limb) porta, attraverso
meccanismi ancora in via di definizione, a un aumento della produzione di adenosina
nell'interstizio del mesangio glomerulare. L'attivazione nelle cellule juxtaglomerulari di
recettori A1 accoppiati a una proteina Gi diminuisce i livelli intracellulari di cAMP e questo
sembra costituire il segnale per la diminuzione della liberazione di renina.
16
www.haikzarian.com
copyright © Haik Zarian
Pare che sia proprio l’adenosina l’antagonista bloccante della renina e quindi l’origine di
tutta la cascata. La renina nello specifico rompe il legame leu-leu dalla parte C-terminale,
mentre la ACE agisce a livello del legame Phe-His dell’AI formando AII. La AII agisce a
livello di cuore, vasi, rene per sintesi di aldosterone, cervello. Gli effetti prodotti dall’AII
sono:
-
vasocostrizione diretta
-
favorisce rilascio noradrenalina
-
stimola centro vasomotore
-
stimola secrezione aldosterone
-
aumenta la sete.
Sono tutte azioni che danno aumento delle resistenze periferiche e aumento ritenzione
idrica, è una risposta ad una ipovolemia cardio-circolatoria.
Il blocco dell’AII quindi produce:
-
vasodilatazione
-
riduzione sintesi di aldosterone e quindi aumento secrezione di Na
-
depressione a livello del cuore con effetti crono e isotropo negativi
-
riduzione tono simpatico
Il tutto si traduce come riduzione della pressione sanguigna.
Inibitori della renina
Gli inibitori della renina sono molecole “modellate” sull’angiotensinogeno umano che
bloccano l’azione della renina sul substrato legandosi in maniera competitiva al sito attivo
della renina al quale rimangono legati senza subire alcun attacco enzimatico (falsi
substrati). I farmaci che interagiscono con questo sistema comprendono:
- enalkiren
- ramikiren
- aliskiren
- zankiren
Sono registrati ma non commercializzati; agiscono come falsi substrati per la renina e si
legano alla renina, bloccandone l’attacco enzimatico. Il blocco dell’angiotensinogeno fa in
modo che non si formi la cascata. Potremmo comunque avere anche uno seitch anche per
gli inibitori della renina.
17
www.haikzarian.com
copyright © Haik Zarian
ACE INBITORI
Generalità
Sono una importante famiglia di farmaci scoperti e isolati per la prima volta da Ferriera, il
quale notò che il veleno della vipera brasiliana Bothrops jararaca contiene un nonapeptide,
che potenzia gli effetti della bradichinina, provocando la paralisi delle prede per rapida
caduta della pressione sanguigna (per forte vasodilatazione negli animali da esperimento).
Il veleno fu studiato meglio finchè non vene isolata una struttura e da questa sintetizzata
la prima molecola che è il captobril. Quasi tutte le case farmaceutiche hanno un ACEI in
prontuario.
A seconda dei gruppi funzionali sulfidirlic, fosforic, carbossilico, abbiamo diverse classi di
ACEI:
•
Gruppo sulfidrilico:
–
•
Gruppo fosforilico:
–
•
captopril
fosinopril
Gruppo carbossilico:
–
Enalapril
–
Quinapril
–
Lisinopril
–
Ramipril
–
Cilazapril
–
Benazepril
–
Perindopril
–
Trandolapril
–
Moexipril
Il captobril agisce sull’ACE a livello di un sito dove è presente lo Zn bivalente (è a questo
livello che si lega AII e quindi anche gli inibitori dell’enzima). Il Captbril è un farmaco
mentre gli altri sono pro-farmaci, oppure carbossilici cioè tutti profarmaci che necessitano
di essere attivati.
Analogamente gli ACE inibitori fosforilici si leganoa siti con Zn++. Gli ACEI hanno quindi
un effetto anti-ipertensivo grazie a diversi effetti:
-
dilatazione delle arteriole e quindi riduzione resistenze sistemiche (la gittata e la
frequenza cardiaca non risultano particolarmente alterate)
-
depressione del sistema adrenergico
-
riduzione sintesi aldosterone
18
www.haikzarian.com
-
copyright © Haik Zarian
aumento della sintesi di bradichinina e quindi aumento di sintesi di prostaglandine o
NO. Vi è quindi una stimolazione del sistema callicreiana-renina.
Tutto ciò riduce la pressione arteriosa. Da una altro punto di vista, abbiamo ACEI che
agiscono sia sulla sintesi di AII che sulla bradichinina. Gli ACEI sono impiegati anche in
caso di ipertensione per dare nefroprotezione, che si estrinseca con aumento del flusso
renale,
in
conseguenza
a
vasodilatazione
arteriolare
afferente
e
calo
pressione
intraglomerulare; tutto questo si traduce in un effetto diretto diuretico degli ACE inibitori.
Principali caratteritche faracocinetiche degli ACEI
Abbiamo già visto i gruppi con i quali si lega all’enzima. Sono tutti pro-farmaci eccetto il
captobril, si legano in modo variabile alle proteine plasmatiche, l’eliminazione è
prevalentemente renale (glomerulo filtrazione o secrezione tubulare). I dosaggi sono
variabili: in caso di ipertensione resistente possiamo aumentare il dosaggio o aggiungere
secondo o terzo farmaco per avere attacco da più fronti. I dosaggio partono da 50-150mg
per il captobril, per i carbossilici da 5-40. L’attivazione da profanaci si caratterizza da due
tmax, una che si attiva subito ed una lente. L’azione veloce si compie nell’arco di poche ore.
Meno si prendono e meglio è, la posologia corretta è la somministrazione giornaliera.
La somministrazione è per os.
Indicazioni degli ACEI
-
ipertensione (effetto aumentato da dieta povera di sale).
-
scompenso cardiaco
-
post infarto
-
ictus
-
alto rischio di patologia coronaria
-
pz con nefropatia diabetica (diminuiscono la proteinuria e stabilizzano la funzione
renale)
Effetti collaterali degli ACEI
-
tosse: quello più diffuso ed è indotta da una molecola che se da un lato potenzia
l’effetto ACEI dall’altro ha effetto irritativo e quindi tosse. A volte è fastidiosa e va
interrotta la terapia.
-
eccessiva ipotensione (soprattutto all’inizio del trattamento)
19
www.haikzarian.com
-
copyright © Haik Zarian
angioedema (molto raro): si manifesta in genere entro 1 settimana con disturbi GI
(nausea, vomito, diarrea fio a dispnea con edema alla laringe). Si interrompe in questo
caso la terapia e si tratta con antiitmainci
-
alterazioni del gusto
-
iperpotassiemia per riduzione della secrezione di aldosterone
-
eruzioni cutanee
Controindicazioni
L’uso di ACEI è controindicato in gravidanza per rischio di:
-
Oligoidramniosi
-
Ipotensione fetale
-
sindrome di difficoltà respiratoria
-
ritardo dello sviluppo
-
anuria neonatale
-
insufficienza renale
-
aborto
controindicato anche in:
-
allattamento
-
pz in emodalisi dove sono state osservate reazioni anafilattiche
-
iperpotassemia
-
stenosi arterie renale e bilaterali: vale per tutti gli ipertensivi che diminuiscono le
resistenze vascolari.
Si possono associare con:
-
diuretici
-
Ca antagonsiti
-
Α bloccanti
-
Β bloccanti
-
Sartanici (meno razionali)
SARTANI
Generalità
Sono farmaci antagonisti recettoriali dell’AII Acronimo di ARBS (angiotensin receptor
bloccers). A differenza degli ACEI, i satanici non inibiscono il catabolismo della
bradichinina e quindi bloccano gli effetti dell’AII in maniera più selettiva rispetto agli ACEI,
20
www.haikzarian.com
copyright © Haik Zarian
e anche in modo più completo (dato che esistono altri enzimi oltre all’ACE in grado di
produrre AII). Per questo motivo questi farmaci non sembrano causare, a differenza degli
ACEI, tosse secca persistente, e rappresentano un'alternativa per i pz che devono
interrompere la terapia dell'ipertensione con gli ACEI.
Da un punto di vista chimico hanno la struttura difenil metilica presente in tutte eccetto
nel levosartan, abbiamo poi anello pentaciclico con 4 atomi di azoto e un anello
pentaciclico con 2 di azoto ed una in saturazione.
Farmaci di questa classe comprendono il losartan, valsartan, irbesartan, candesartan.
Meccanismo d’azione e farmacocinetica
L’attivazione dei recettori AT1 porta a vasocostrizione diretta che porta a:
-
aumento attività simpatica con rilascio di catecolammine dal surrene;
-
aumento
dell’attività
noradrenergica
periferica
che
porta
all’aumento
del
riassorbimento del Na+, rilascio aldosterone e calo del flusso ematico.
Altri effetti sono l’aumento della proliferazione delle cellule muscolari lisce che nel tempo
causa un rimodellamento cardiovascolare, aspetto importante dell’ipertensione congestizia.
Tutti questi effetti si traducono in un calo della pressione arteriosa.
Recettori per AII
Ci sono due tipi di recettori: recettori per ATI e ATII.
AT1 si trovano nel:
-
muscolo vascolare liscio,
-
la zona glomerulosa surrenalica
-
cellule renali
-
tessuto neuronale
AT2 si trovano nel:
-
cellule mesenchimali fetali
-
tessuto cerebrale
-
midollare surrenale
-
utero
Gli effetti che mediano li abbiamo visti prima:
-
Contrazione muscolare (vasocostrizione rapida e vasocostrizione lenta)
21
www.haikzarian.com
-
Senso di sete
-
Rilascio di vasopressina
-
Secrezione di aldosterone
-
Rilascio di catecolamine
-
Aumento del tono simpatico
-
Ipertrofia e iperplasia cellulare
copyright © Haik Zarian
I recettori AT1 producono vasocostrizione e attività proliferativa, mentre rimane da
indagare il ruolo fisiopatologico de recettori AT2.
Farmacocinetica
Vengono somministrati per os sebbene la biodisponibilità sia variabile.
Indicazione dei sartani
Sono indicati in pz con:
-
Ipertensione con tosse da ACE-inibitore
-
Ipertensione con DM2 con nefropatia (ibesartan losartan)
-
Microalbuminuria diabetica
-
Proteinuria
-
Ipertrofia ventricolare sinistra
Non vi sono evidenze che i sartani siano superiori agli ACEI
Sono controindicate nella gravidanza, in caso di iperpotassemia e stenosi a renali e aortica.
Effetti collaterali e tossicità
Non presentano grandi effetti collaterali, normalmente possono venire associati con
diuretici e Ca antagonisti.
Nel caso dell’enapril da quando divenuto generico il suo uso è sceso a favore degli altri ACE
inibitori. Il costo mensile con un diuretico era di circa 3 euro al mese, mentre gli ACEI e il
costo medio è salito fino a 20, su 80 mila pz le cifre diventano importanti. Il costo
dell’associazione ACE&diuretico costa di più.
CA ANTAGONISTI
Generalità
Sono un'altra famiglia di antipertensivi e sono dei bloccanti dei canali del calcio che
interferiscono con il flusso di ioni Ca verso l’interno delle cellule attraverso i canali lenti
della membrana plasmatica.L’ingresso del Ca nelle cellule infatti è necessario per la
22
www.haikzarian.com
copyright © Haik Zarian
contrazione. Questi farmaci agiscono sulle cellule miocardiche, sulle cellule specializzate
del sistema di conduzione del cuore e sulle cellule della muscolatura liscia vascolare. In
questo modo, la contrattilità miocardica può essere ridotta, la formazione e la propagazione
dell’impulso elettrico all’interno del cuore possono essere depresse e il tono vascolare
coronarico o sistemico può essere diminuito.
Vengono classificati come C08 e vengono suddivisi come ATC a secondo della loro struttura
chimica e attività. Ci sono molecole attive sul sistema vascolare a altre attive
prevalentemente sul cuore. I derivati idropiridinici hanno effetto prevalentemente
vascolare.
Altre
famiglie
di
calcio
antagonisti
comprendono
derivati
fenilici.e
benzodiazepinici.
Ci sono diverse molecole utilizzate: la amildopina è la più usata mentre quelli per il cuore
sono i dilitazem. Altri farmaci comprendono la felodipina, isradipina, nicardipina,
nifedipina.
Un mese di trattamento costa circa 20 euro al mese.
Canali del Ca
Il Ca è fondamentale per la contrazione muscolare e qualsiasi sua variazione porta ad
alterazione della capacità contrattile. Il Ca è il grilletto che fa scattare il sistema astina
miosina nel sarcomero. Affinché ciò avvenga correttamente l’organismo ha a disposizione
tre sistemi di omeostasi del Ca:
-
uno insito nella cellula ed è i reticolo sarcoplasmatico
-
regolati dai canali del Ca suddivisi in canali attivati dalla differenza di potenziale che
sono i VOC e quelli che sono attivati dai recettori e quindi ROC.
Canali del calcio voltaggio-dipendenti (VOC) si aprono in risposta
alla depolarizzazione
della membrana, il Ca++ extracellulare entra secondo gradiente chimico e può stimolare il
rilascio del calcio dal reticolo sarcoplasmatico
L’aumento del Ca++ intracellulare si ha per rilascio dal reticolo sarcoplasmatico via PLCIP3 in seguito a stimolo recettoriale. Il Ca++ extracellulare entra per stimolazione di
recettori specifici (ROC)
Le concentrazioni di Ca extracellulare si possono quindi modificare in risposta
alla
depolarizzazione con entrata di Ca nella cellula e l’effetto viene aumentato per la entrata di
Ca dal VOC i quali stimolano la liberazione di Ca dal reticolo sarcoplasmatico. In caso di
attivazione del recettore abbiamo entrata di Ca per i ROC entrata che viene aumentata per
rilascio massiccio dal reticolo sarcoplasmatico. Anche senza entrata possiamo avere per
23
www.haikzarian.com
copyright © Haik Zarian
attivazione fosfolipasi trifosfato che stimola entrata Ca dal reticolo sarcoplamsatico. Ci
sono quindi tre sistemi:
-
Canali del calcio voltaggio-dipendenti (VOC) si aprono in risposta alla depolarizzazione
della membrana, il Ca++ extracellulare entra secondo gradiente chimico e può
stimolare il rilascio del calcio dal reticolo sarcoplasmatico.
-
L’aumento del Ca++ intracellulare si ha per rilascio dal reticolo sarcoplasmatico via
PLC-IP3 in seguito a stimolo recettoriale.
-
Il Ca++ extracellulare entra per stimolazione di recettori specifici (ROC).
I canali del Ca hanno delle sottoclassi, quelle voltaggio dipendenti sono i più importanti
dove agiscono i farmaci. Nei canali VOC abbiamo 3 sottotipi principali:
-
lenti: sono presenti in particolare sulla membrana delle fibrocellule muscolari lisce
vasali e cardiache;
-
transitori: meno noti e si attivano in modo rapido e sembrano caratteristici a livello di
rene e cuore;
-
N,P,Q: caratteristici delle cellule nervose.
I Ca antagosniti agiscono sugli L, che sono presenti a livello cardiaco e vascolare e i farmaci
Ca antagonisti sono selettivi proprio per questo tipo di farmaco. I canali L sono quindi una
famiglia
eterogenea:
sono
sensibili
ai
Ca-antagonisti,
sono
aperti
da
una
forte
depolarizzazione e la corrente di calcio è molto lenta.
I canali del Ca voltaggio dipendente L ha 5 subunità, ci interessa solamente l’α che forma il
canale stesso e sul quale si legano Ca antagonisti. Ci sono quindi dei siti per le diverse
famiglie. Abbiamo quattro strutture transmembranarie uguali tra loro formate da 6
subunità transmembranarie. N questa struttura si legano i Ca antagonsiti. I singoli Ca
antagonisti si legano in posti differenti della subunità α e in particolar modo le
fenialchilamine hanno sito di legame molto più interno e quindi si legano quando ci sono
forti depolarizzazioni che permettono al farmaco di entrare dentro rispetto ai siti esterni. Le
benzotiazepine hanno affinità intermedie (maggiore affinità per il miocardio), hanno alta
frequenza di depolarizzazione), mentre le diidropiridine si legano con alta affinità al canale
indipendentemente dalla apertura (maggiore affinità per il muscolo liscio vascolare rispetto
al miocardio). Il Ca quando entra attiva i reticolo sarcoplasmico che libera Ca che si lega a
seconda del tipo di cellula muscolare alla calmodulina.
24
www.haikzarian.com
copyright © Haik Zarian
Classificazione Ca antagosti
Possono essere di tipo inorganico (tossici) come
-
cobalto
-
nichel
-
lantanio
-
manganese
non sono usati in farmacologia. Poi abbiamo Ca antagonisti organici
-
selettivi per canale de calcio
-
non selettivi (canali Ca e Na) come cinnarizina, flunarizina ecc.
I Ca antagonisti selettivi comprendono:
-
Fenilalchilamine (verapamil)
-
Benzotiazepine (diltiazem)
-
Diidropiridine (Nifedipina, amlodipina, lercanidipina,lacidipina, felodipina, manidipina.
Un'altra classificazione comprende:
-
Ca di prima generazione: nifedipina, nicardipina, felodipina, diltiazem e verapamil,
caratterizzati da una durata d’azione relativamente breve e quindi dalla necessità di
ripetute somministrazioni giornaliere.
-
Ca seconda generazione: sia nuove formulazioni farmaceutiche di preparati di prima
generazione (nifedipina AR, nifedipina GITS, felodipina ER, nicardipina SR, diltiazem
SR, verapamil SR), sia nuovi composti attivi (benidipina, isradipina, manidipina,
nilvadipina, nimodipina, nisoldipina, nitrendipina, gallopamil. I farmaci di seconda
generazione hanno selettività di azione ed un migliore profilo farmacocinetico per la
somministrazione cronica. I farmaci di nuova formulazione hanno maggiore specificità
sulla muscolatura vascolare piuttusto che cardiaca.
-
Ca antagonisti di terza generazione: esacerbano quelli della seconda e quindi
farmaci con prolungata azione o quelli con attività molto specfica.. Sono caratterizzati
da prolungata durata di azione per proprietà intrinseche (amlodipina) o per peculiare
azione a livello di canale (lacidipina)
Diidropiridine
I principali composti diidropiridinici comprendono la felodipina, amlodipina, nisoldipina,
nifedipina, nicardipina. In para abbiamo disattivazione della struttura. Importante è la
25
www.haikzarian.com
copyright © Haik Zarian
stereoselettività, solo i levogiri hanno attività Ca antagonista. Solamente nelle forme
levogire abbiamo attività antagnosta.
È importante il gruppo CN e azotato nelle fenilalchilamine.
Le DHP sono riconosciute dai recettori specifici attraverso il gruppi fenolico che viene
accolto in una sacca liofila e orienta il resto della molecola verso gli altri siti di interazione.
Per questa ragione l’ingombro sterico e la posizione dei sostituenti sul sistema aromatico
sono più importanti degli effetti elettronici. Le sostituzioni in orto e meta portano ad una
conformazione più favorevole all’interazione con il recettore. Sostituzioni para quindi sono
svantaggiose:
-
la struttura diidropiridinica è essenziale in
quanto
la
trasformazione
in
piridina
(ossidazione) o la riduzione a tetraidropiridina
o
esaidropiridina
(piperidina)
provoca
la
perdita di attività.
-
Piccolis sotituienti eletronattrattori (CH2F) in
posizione 2 sono vantaggiosi;
-
Le diverse dimensioni dei gruppi R2 e R3
influenzano la selettività;
-
L’interazione delle DHP con le proteine dei
canali del Ca++ è stereoselettiva. L’effetto antagonista è dato dall’enantiomero R.
Fenilalchilamine
Sono essenziali per l’attività due
gruppi aromatici, il gruppo CN (o
similare CHO, N3) e i l gruppo
amminico
terziario.
Inoltre
è
fondamentale la complanarità fra
anello aromatico e gruppo CN. La sostituzione N-CH3 è ottimale. Gruppi più voluminosi
riducono la potenza. Variazioni della lunghezza o ramificazioni delle catena polimeriniche
determina una diminuzione di attività. Piccoli sostituenti elettronattrattori sui fenili
aumentano la potenza.
Benzotiazepine
È importante l’azoto con gruppi non troppo ingombranti e quindi metilici, per tutti i Ca
antagonisit è importante che l’atomo venga protonato.La sostituzione S con CH2 non
influenza l’attività. È necessario che il gruppo OCH3 nella posizione para dell’anello
26
www.haikzarian.com
copyright © Haik Zarian
aromatico (probabilmente agisce da accettare di legame ad idrogeno). È indispensabile la
presenza di un gruppo basico con piccoli sostituenti (come visto per le DHP).
Effetti farmacologici dei Ca antagosniti
Questa classe di farmaci bloccano la corrente del Ca sia nel cuore che nei vasi, producendo
inotropismo negativo, calo della velocità e forza di contrazione e quindi abbiamo calo della
richiesta di O2. Sul mm liscio abbiamo vasodilatazione, maggior afflusso di sangue ai
tessuti con aumento O2 e quindi vi è una migliore ridistribuzione nei vari distretti sia
coronarie che a livello periferico.
L’azione anti-ipertensiva dei calcio-antagonisti (Calcium antagonists; Calcium Channel
Blockers, CCB) è fondamentalmente attribuibile alla
vasodilatazione arteriolare periferica, determinata dalla riduzione della disponibilità di ione
calcio a livello della cellula muscolare liscia della tonaca media della parete arteriosi. Da ciò
derivano impieghi terapeutici:
-
Antianginosi e quindi nei disturbi ichemici del cuore e ipertensione
-
Antiaritmici: poiché regolano la frequenza cardiaca
-
Ipotensivi: perché rilassano la muscolatura liscia vasale.
Metabolismo dei Ca-antagonisti
Il metabolismo Ca antagonsiti è a livello epatico, citP450. Tutto i farmaci che interagiscono
con questo sistema portano ad aumento della concentrazione dei farmaci. Sono assorbiti
per os, hanno biodisponibilità variabile e anche t1/2 molto variabile.
La funzione a seconda della molecola può essere indipendente dall’assunzione dei farmaci.
L’insufficienza epatica riduce il metabolismo dei Ca antagonisti. Insufficenza renale non
produce effetti in quanto queste vengono eliminati per via renale ed epatica. Nelle persone
anziane porta riduzione capacità metaboliche oltre 65 anni si fa attenzione alle posologie di
utilizzo.
Meccanismi antiipertensivi:
-
azione diretta sulle arterie (vasodilatazione) effetti sull’endotelio con rilascio di NO.
-
Riduzione post carico (riduzione della ipertrofia ventricolare sin)
-
Aumento della gittata sistolica con aumento del circolo renale e lieve effetto diuretico
-
Effetti collaterali: rilascio di NO3, inibizione della sintesi di endotelina 1
-
Effetti antiprolifeativi ed antiossidanti
-
Inibizione della aggregazione piastrinica.
27
www.haikzarian.com
-
copyright © Haik Zarian
Presentano effetti antiproliferativi e antiossidanti (pz con dislipidemia e aterosclerosi).
Danno inibizione aggregazione piastrinica e insieme di questi effetti permette attività
antiipertensiva vista in modo globale.
Come tutti gli antiipertensivi anche i Ca antagonsiti possono dare tachicardia riflessa come
la nifidipina ai primi dosaggi. Con le formulazioni slow release o lipofili questo effetto è
meno evidente. Verampil e diadema hanno invece effetto vasodilatante minore e la
tachicardia viene bloccata dall’effetto cronotropo negativo.
Riassumendo quindi le azioni dei Ca antagonisti comprendono:
-
vasodilatazione periferica
-
vasodilatazione coronarica
-
inotropismo negativo
-
riduzione di frequenza.
Indicazioni cliniche dei Ca antagonisti
-
ipertensione arteriosa non complicata, sono di terza scelta o in aggiunta a quelli di
prima scelta (diuretici) o ACEI o beta bloccanti (II scelta);
-
trattamento dell’ipertensione in caso di angina pectotris, aterosclerosi carotideam,
tachicardie sopraventricolari (verapamile o diltiazem).
-
trattamento
in
gravidanza
anche
se
discordante,in
prolungamento del parto bloccando la contrazione dell’utero.
-
Angina pectoris
-
Tachicardia sopraventricolare
-
Emicrania
-
Vasospasmo cerebrale
-
Sindrome Reynauld
Ca antagonsiti nell’angina pectoris determinano:
-
sopressione dello spasmo
-
rallentata formazione ateroma
-
rallentata aggregazione pisatrinica
-
dilatazione coronarica
-
vasodilatazione periferica
-
rallentamento della frequenza cardiaca
28
quanto
possono
dare
www.haikzarian.com
copyright © Haik Zarian
Tutto questo permette di aumentare il flusso e di ridurre consumo di O2, rallenta anche
aggregazione piastrinica.
I Ca antagonsiti nell’angina pectoris servono sia nella terapia che nella profilassi, veramapil
e diltiazem hanno effetto crono e inoltro negativi.
Nell’angina instabile (solo se accompagnata da vasospasmo) sono attivi come vasodilatatori
ed antiaggreganti piastrinici, riducono la formazione di plascche aterosclerotiche. Le
diidropiridine possono essere invece associate a beta-bloccanti nitroderivati.
Nell’angina variante prozmetal invece i Ca antagonsiti sono i farmaci di elezione e risolvono
circa l’80% dei casi. Nei casi più resistenti possono essere associati a nitroderivati.
Per i suoi effetti sul circolo cerebrale la nimodipina è indicata nel deficit neurologico
ischemico da emorragia subaracnoidea.
Angina da sforzo: verapamil e diltiazem sono particolarmente efficaci per i loro effetti
cardiaci. Solo il verapamil è indicato nelle aritmie sovraventricolatri in alternativa ai beta
bloccanti.
Quindi:
a) Attività vasale
- Nifedipina > diltiazem > verapamil
b) Attività cardiaca
- Verapamil > diltiazem > nifedipina
Effetti collaterali, interazioni e tossicità
Gli studi clinici concordano sul fatto che i Ca antagonisti NON migliorano la morbilità e la
mortalità nella prevenzione secondaria della cardiopatia ischemica dopo un infarto acuto
del miocardio. L’uso di Ca antagonisti nell’infarto è indicato solo in caso di angina
persistente o in caso di aritmie sopraventricolari.
Controindicazioni:
-
verapamil e dilitiazem sono controindicati nella bradicardia, blocco AV e SA, anamnesi
di insufficienza cardiaca.
-
Le diidropriridine sono controindicate invece nella stenosi aortica, infarto del miocardio
recente, gravidanza ed allattamento.
Gli effetti collaterali dei Ca antagonisti sono diversi:
-
ipotensione
29
www.haikzarian.com
copyright © Haik Zarian
-
stipsi in particolare con verapamil per rilasciamento della mm GI
-
vampate al viso: in particolare con diidropiridine (5-15%)
-
cefalea (6-8%)
-
edema alle caviglie (in particolare con diidreopiridine (10-15%)
-
vertigini (1-6%)
-
nausea (3-4%)
-
bradicardia, blocco AV ed insufficienza cardiaca congestizia.
Le interazioni sono date dai processi di metabolismo ed eliminazione dei farmaci. Sono
state osservate aumento di transaminasi epatiche. I geriatria per pz con età superire ai 65
anni, non presentano effetti metabolici, possono essere usati in pz con alterato
metabolismo glucidico e lipidico, hanno effetto benefico su pz con alterato metabolismo
lipidico. Sono stati segnalati aumenti delle transaminasi con e senza concomitante
aumento della fosfatasi alcalina e della bilirubina. E’ quindi consigliabile un monitoraggio
periodico della funzionalità epatica in pazienti trattati con verapamil. deve essere
somministrato con cautela a pazienti con alterata funzione epatica. Una grave disfunzione
epatica prolunga l’emivita di eliminazione di verapamil a circa 14-16 ore. Quindi a questi
pazienti si deve somministrare circa il 30% della dose usuale impiegata nei pazienti con
normale funzionalità epatica.
Particolare attenzione deve essere prestata nella somministrazione di Ca-antagonisti a
pazienti di età superiore o uguale a 65 anni. In tali pazienti si potrebbe verificare la
comparsa di ipotensione o di insufficienza cerebrovascolare.
Per quanto concerne invece gli effetti metabolici, i CA antagonisti non alterano il
metabolismo glucidico e quello lipidico.
Il futuro dei Ca antagonisti
Fra le varie potenzialità, vi è quella che si concretizzi una nuova classe di una calcioantagonisti, ovverosia quella dei cosiddetti «T- & L- channel calcium blockers». Infatti,
mentre la stragrande maggioranza degli odierni calcio-antagonisti – sia diidropiridinici che
non diidropiridinici – interagiscono solo sul canale L del calcio, una serie sempre più
cospicua di indizi suggerisce che vi sono molecole – alcune già in commercio, come
manidipina ed altre di prossima commercializzazione come nilvadipine ed efonidipine che
sono in grado di interagire non solo con il canale L, ma anche con il T. Il beneficio atteso di
questi cosiddetti «T- & L- channel calcium blockers» farebbe - ad esempio - riferimento a un
effetto di elettiva protezione renale.
30
www.haikzarian.com
copyright © Haik Zarian
FARMACI SIMPATICOLITICI
Generalità
I farmaci simpatilitici fanno parte della famiglia dei farmaci che agiscono sul sistema
nervoso simpatico. Sono un'altra categoria di farmaci anti-ipertensivi che interagiscono in
massima parte bloccare ma non sempre, l’attività dei recettori α e β. Questa classe di
farmaci le troviamo classificate come C02 e C07 come i βbloccanti. I C02 cioè antiipertensivi abbiamo sostanze adrenergiche come alcaloidi della rauwolfia, metildopa, e
antagonsiti dei recettori degli imidazoli. Sono sempre sostanze antiadrenergiche ma con
attività periferica e sono C02C come i bloccanti dei recettori α, più usati e in particolar
modo il doxazocin. Per quanto concerne i farmaci C07 cioè βbloccanti possono essere non
selettivi, sono una serie che hanno attività sia sui recettori β1 che β2 e poi β bloccanti
selettivi sui recettori β 1 con le loro associazioni. Poi abbiamo i βbloccanti che agiscono sui
recettori α e β adrenergici e con le loro associazioni cioè tiazidi e con altri diuretici. Si
trovano in commercio già preformate. I β bloccanti più usati comprendono bisoprorolo,
carvedilolo, antenololo. Sono usati i β bloccanti con attività selettiva come nebivololo ecc In
associazione con diuretici si usa atenololo. Gli α bloccanti comprendono il doxazocin, unica
molecola utilizzata. Il costo medio dell’iperteso è di 10 euro al mese.
I recettori α e β sono diversi:
-α1
-α2
-β1
-β2
-β3
Rec
Agonista
Antagonista
Sede d’azione
Risposta
α1
Adr≥NA>>
Prazosina
Vasi
Contrazione
isoproterenolo,
Muscolo
Gen
Contrazione
Fenilefrina
Ur
Glicogenolisi,
Fegato
gluconeogenesi
Musc
Iperpolarizzazione
Intestinale
rilassamento
Cuore
↑
forza
aritmie
31
e
contrattile,
www.haikzarian.com
α2
copyright © Haik Zarian
Adr≥NA>>
Yoimbina
Pancreas
(β
↓ secrezione insulina
isoproterenolo,
cell)
↑ aggregazione
clonidina
Piastrine
↓ rilascio NA
Terminaz.
Contrazione
Nerv.
Vasi
β1
isoproterenolo
Metoprololo
Cell. Iuxtaglom.
↑ secrezione renina
>adr=NA,
CGP20712A
Cuore
↑
dobutamina
β2
forza,
frequenza
e
conduzione nodo AV
isoproterenolo
ICI 118551
Mus vasi,bron,
Rilasciamento
>adr>>NA,
GI,Ge Ur
Glicogenolisi
Terbutalina
Muscolo
Glicogenolisi,
schelet
gluconeogenesi
Fegato
β3
isoproterenolo=NA>
ICI 118551
Tessuto
adr BRL37344
CGP20712A
adiposo
Lipolisi
Gli effetti sono mediati dai sistemi recettoriali, vedi G proteins che per gli α sono le G
protein Q i cui effettori sono la fosfolipasi C, fosfolipasi A2 e aumento flusso del Ca
intracellulare. Per recettori α 2 abbiamo diversi tipi di G protein, sono le G o G0 e il loro
effetto è mediato da depressine della adenilato ciclasi, apertura canali K chiusura Ca e
attivazione fosfolipasi C.
Quelli β 1 mediano attivazione adenilato ciclasi con aumento
cAMP e attivazione canali al Ca.
Rec
Proteina G e sottotipi
Effettori coinvolti
α1
Gq
↑ fosfolipasi C
Gq
↑ fosfolipasi D
Gq, Gi/Go
↑ fosfolipasi A2
Gq
?↑ Ca2+ calcio
α2
Gi 1,2
oppure 3
↓ adenilato ciclasi
32
www.haikzarian.com
β1
copyright © Haik Zarian
Gi (βγ subunità)
↑ canali del K+
Go
↓ canali del Ca2+ (L e N)
?
↑PLC, PLA2
Gs
↑ adenilato ciclasi
↑ canali del calcio L
β2
Gs
↑ adenilato ciclasi
β3
Gs
↑ adenilato ciclasi
Tipologie di farmaci simpatocolitici
Farmaci che bloccano questi recettori sono antagonisti dei β e α.
Per gli α abbiamo F non selettivi come la fentolamina e fenossibenzamina, nei selettivi
abbiamo prazosina, terazosina ecc e per gli α 2 selettivi abbiamo lo yohimbine. Per i β
abbiamo:
-
non selettivi
-
β 1 selettivi di seconda generazione
-
β 1 selettivi di terza generazione
Gli antagonisti α 1 come la prazosina sono sintetizzate nel 1974 e la ultima è la doxazosina
nel 1988.
1-Antagonsiti non selettivi dei recettori α -adrenergici
Sono la fenossibenzamina e fentolamina.
-
la fenossibenzamina è un bloccante irreversibile dei recettori α 1 e α 2 adrenergici;
-
la fentolamina è un antagonista reversibile dei recettori α 1 e α 2 adrenergici.
Questa tipologia di farmaci provoca:
-
riduzione resistenze periferiche e quindi vasodilatazione;
-
aumento della gittata cardiaca per stimolazione del riflesso nervoso simpatico e per
stimolazione del rilascio
e blocco della ricaptazione di noradrenalina (blocco α-2
presinaptici);
-
per converso vi è una stimolazione del sistema RAS con aumento ritenzione di H2O e
Na+, effetto riflesso sulla vasodilatazione;
33
www.haikzarian.com
-
copyright © Haik Zarian
vi sono recettori α nella vescica e quindi a questo livello abbiamo un blocco che causa
calo della ritenzione idrica (ma qui non troviamo impiego).
Usi terapeutici:
-
il principale impiego di questi due farmaci è nella diagnosi e nel trattamento del
feocromocitoma.
-
La fentolamina può essere utilizzata anche nelle ipertensioni da rimbalzo quando
venisse
interrotto
trattamento
con
la
clonidina
che
da
ipotensione
ma
ipersensbilizzazione dei recettori α.
Da tenere presente che sono farmaci poco maneggievoli, danno ipotensione ortosatica,
aritmia, angina, congestione nasale. Sono F di uso prevalentemente ospedaliero.
2-Antagonsiti selettivi degli α1-adrenergici con azione periferica
Fanno parte di questa categoria di farmaci la prazosina, doxazosina, terazosina, alfuzosina,
tamsulosina. Questi farmaci hanno un profilo farmacodinamico simile, ma differiscono per
caratteristiche farmacocinetiche.
Effetti farmacologici:
-
ipotensione da caduta delle resistenze periferiche
-
riduzione del carico cardiaco e del consumo di O2
-
diminuzione ipertrofia ventricolare sin e della congestione polmonare
-
il flusso renale non è influenzato e pertanto non c’è variazione di ritenzione di H2O e
Na+
-
rilasciamento dei mm del trigono e dello sfintere vescicale e dei mm lisci prostatici
(tamzolasina), tutti effetti che favoriscono il deflusso urinario (recettori α1A )
-
riduzione di colesterolo e trigliceridi e LDL
-
aumento di HDL
Dato che l’ipertensione si associa ad ipecolesterolemia è chiaro che un farmaco che associ
entrambi gli effetti terapeutici è un vantaggio. Sono quindi i farmaci d’elezione per il
trattamento dell’ipertensione con dislipidemia. Questo è possibile in quanto il blocco
recettori α1A provoca blocco dell’idrossi glutaril coenzima A responsabile della sintesi di
colesterolo (e quindi induzione di recettori per le LDL e quindi ricaptazione di colesterolo
dal circolo ematico e quindi minor sintesi di colesterolo e minor fuoruscita di LDL a livello
epatico). Viene depressa anche la sintesi dei trigliceridi e conseguentemente essendo
minore il colesterolo sintetizzato le cellule periferiche sono costrette ad utilizzare il
34
www.haikzarian.com
copyright © Haik Zarian
colesterolo esogeno, con conseguente aumento del catabolismo delle LDL con aumento
delle HDL e quindi minor sintesi dei trigliceridi e colesterolo e aumento del HDL cioè gli
scavanger del colesterolo al fegato. Altri effetti, oltre al metabolismo lipidico comprendono
una riduzione del tono simpatico e quindi aumento flusso ematico periferico e conseguente
riduzione del valori pressori. Oltre a questo effetto abbiamo anche un miglior uso del
glucosio a livello periferico e una riduzione del glucosio ematico con minor inslulino
resistenza. Tutti questi fenomeni associano alla riduzione del rischio cardiovascolare.
La biodisponiblità degli antagonisti selettivi dei recettori α-adrenergici è variabile tra 50 e
100%, l’emivita è variabile (il doxazocin ha t1/2 di 20 ore).
Come già accennato prima gli α-bloccanti vengono usati oltre che nell’ipertensione, anche
nell’ipertrofia prostatica benigna, sia nei disturbi irritativi che in quelli ostruttivi.
-
disturbi irritativi: disturbi del riempimento come la frequente minzione, incontinenza
d’urgenza, nicturia, minzione imperiosa).
-
disturbi ostruttivi: disturbo dello svuotaemtno (intermittenza, sensazione di incompleto
svuotamento, sgocciolamento terminale).
Questi farmaci sono utili in quanto il blocco delle terminazioni permette un rilassamento
degli sfinteri e quindi una migliore minzione e svuotamento urina vescicale. La posologia
che può andare da 1mg a 20mg per prazosina con 2-3 somministrazioni e nella doxazosina
anche una somministrazione.
Gli antagonisti selettivi quindi si usano oltre che per l’ipertensione nell’iperlipemia,
insufficienza cardiaca congestizia e ipertrofia prostatica benigna.
Effetti collaterali:
-
tachicardia riflessa (minore per terazosina e doxazosina)
-
effetto da prima dose da tenere sempre conto, è molto frequente la grave ipotensione
posturale dopo la somministrazione;
-
impotenza;
-
effetti specifici come cefalea, vertigini e astenia
3-Farmaci adrenergici ad azione centrale
Questa categoria di farmaci diminuisce il flusso di impulsi efferenti simpatici dai centri
vasopressori del tronco cerebrale. Si tratta di farmaci antipertensivi molto potenti
(d’elezione in gravidanza), ma non sono molto utilizzati. Fanno parte di questa famiglia la
clonidina, metildopa e moxonidina.
35
www.haikzarian.com
copyright © Haik Zarian
Il meccanismo d’azione è dovuto alla stimolazione dei recettori α2 adrenergici presinaptici
nel snc con conseguente riduzione del tono simpatico periferico che riduce le resistenze
vascolari sistemiche. Hanno probabile azione anche sui recettori imidazolinici I1 (clonidina1
e moxonidina). Inoltre determinano modesta riduzione della gittata e della frequenza
cardiaca.
La α-metildopa ha una via metabolica parallela alla sintesi della noradrenalina da e viene
trasformata in α-metildopamina e α-metil-noradrenalina. La α –metil-dopaminasi deposita
nei granuli adrenergici delle terminazioni nervose dove rimpiazza la noradrenalina e viene
liberata in seguito a stimolazione nervosa per interagire con i recettori adrenergici postsinaptici. È da tener presente che questa sostituzione della noradrenalina con un falso
neurotrasmettitore nei neuroni periferici NON è responsabili dell’effetto anti-ipertensivo
della α –metildopa, ma tale azione sembra essere dovuta a stimolazione dei recettori
centrali α-drenergici da parte della α-metil-noradrenalina o da parte della α-metildopamina.
La clonidina invece è un derivato 2-imidazolinico ed è stato scoperto nel corso di ricerche
per trovare un farmaco da impiegare per uso locale come decongestionante nasale.
Sommnistrata per via nasale infatti provoca un iniziale breve aumento pressorio cui fa
seguito un più prolungato effetto ipotensivo. La risposta pressoria è dovuta ad un diretta
stimolazione di recettori α-adrenergici a livello arteriolare. La clonidina riduce il tono
simpatico ed aumetna quello parasimpatico e si ha conseguentmente un abbassamento
della pressione arteriosa e un calo della frequenza cardiaca (la riduzione della pressione
arteriosa è associata alla diminuzione delle catecolamine).
Sono assorbiti per via orale, la clonidina ha t1/2 di 12h mentre il metil dopa t1/2 di 2h.
Altra categoria di farmaco è la guanetidina che a dosi elevate può dare simpaticoplegia. Il
suo meccanismo d’azione è dovuto alla inibizione della liberazione della noradrenalina dalle
terminazioni nervose simpatiche. È stata molto impiegata un tempo nei pz con grave
ipertensione ma ogi il suo uso è praticamente abbandonato per i suoi effetti collaterali (vedi
simpatectomia farmacologica con marcata ipotensione posturale, diarrea, difficoltà nella
eiaculazione).
La reserpina invece è un alcaloide estratto dalle radici di una pianta indiana (Rauwolfia
serpentina) ed è stato uno dei primi farmaci efficaci, usato in larga scala, per il trattamento
dell’ipertensione. In India è utilizzata per il trattamento dell’insonnia, ansia e psicosi. La
reserpina induce deplezione di noradrenalina, serotonina e dopamina (metabolizzate dalle
MAO). La reserpina nello specifico ha la capacità di bloccare la captazione di NA nelle
vescicole di deposito. Questo fenomeno avviene in tutto l’organismo e si ha in tal modo un
1
La clonidina è disponibile anche in cerotto trans dermico settimanale
36
www.haikzarian.com
copyright © Haik Zarian
depauperamento di noradrenalina, dopamina e serotonina a livello dei neuroni sia centrali
che periferici. Abbiamo sequestro di catecolammine anche a livello della midollare del
surrene, sebbene in misura inferiore rispetto alle vescicole dei neuroni. La reserpina
penetra rapidamente nel cervello, ed il depauperamento delle scorte cerebrali di amine
provoca sedazione, depressione psichica e sintomi parkinsoniani.
La reserpina provoca
lieve ipotensione posturale e la maggior parte degli effetti indesiderati della reserpina deriva
dalle azioni sul snc o tatto GI (diarrea, crampi intestinali, aumento secrezione acida). Dosi
elevate provocano sedazione, debolezza, calo della libido, impotenza, incubi e grave
depressione psichica. Meno frequentemente si verificano effetti extrapiramidali simili alla
malattia di Parkinson
4-Antagonisti dei recettori β–adrenergici
Gli antagonisti dei recettori β-adrenergici (β-bloccanti) sono farmaci molto importanti e
largamente utilizzati per il trattamento di importanti patologie cardiovascolari ad alto
impatto sociale. Il blocco dei recettori β-adrenergici ha un effetto limitato sul cuore normale
a riposo, ma ha effetti profondi in presenza di un elevato tono simpatico che si ha durante
l’esercizio fisico o lo stress, o in determinate patologie. I β bloccanti si distinguono tra
selettivi e non selettivi e nel tempo hanno trovato un grande impiego essendo stati tra i
primi ipertensivi ad essere messi in commercio. I βbloccanti hanno azione limitata su un
cuore normale a riposo e la loro attività si svolge quando vi è presenza di un tono simpatico
elevato o quando vi è stress fisico o in presenza di determinate patologie. Il β bloccante
viene preso dagli oratori per esempio (provoca ripristino del battito cardiaco).
Per quanto concerne i recettori β, questi sono localizzati in diverse sedi:
-
miocardio (β 1) responsabili dell’automatismo sinusale, forza di contrazione;
-
apparato respiratorio (β 2)
-
muscoli lisci vascolari, dove producono vasodilatazione, non sono diffusamente
rintracciabili
nel
nostro
sistema
vascolare.
A
livello
coronarico
vasodilatazione;
-
apparato endocrino dove mediano la secrezione di insulina e glucagone (β 2);
-
rene dove
-
regolazione metabolica con recettori β2 che stimolano la glicogeno lisi;
-
occhio: produzione umor acqueo (β1)
-
utero: rilassamento muscolo uterino (β2).
37
mediano
www.haikzarian.com
copyright © Haik Zarian
Si possono classificare oltre che per le generazioni I, II III, o per la selettività ma anche
sulla loro lipofilicità che varia le caratteristiche farmacocinetiche;
-
i composti lipofili: hanno intenso metabolismo epatico, alto legame F/P (bassa
biodisponibilità;
-
i
composti
idrofili:
scarso
metabolismo
epatico,
basso
legame
F/P
(alta
biodisponibilità).
La clearance è renale per idrofili ed epatta per lpofili.
Sono tutti parametri con pz con
problematiche epatiche e renali. La concomitante patologia può e deve far riflettere sul β
bloccante corretto da utilizzare. I β bloccanti non hanno però solo attività su β 1 e β 2.
Quelli di terza generazione, si è visto che hanno altre attività farmacologiche volte a
migliorare in ogni caso il complesso della patologia ipertensiva e sono state pertanto
sintetizzate molecole con attività sui vari sistemi della vasodilatazione. Abbiamo β bloccanti
che aumentano la sintesi di ossido nitrico, che è un potente vasodilatante prodotto
dalla’endotelio.
I β bloccanti poi possono esser agonsiti sui β 2 oppure β bloccanti antagonisti degli α 1
recettori, oppure attività C antagonista like, oppure β bloccanti con attività anti ossidante
che pur non avendo attività vasoattiva sono in grado di migliorare il quadro clinico che si
osserva nell’ipertensione e nella dislipidemia. È infatti il colesterolo perossidato che è
quello cattivo portando alla formazione delle cellule schiumose e quindi se ci sono
antiossidanti avremo miglioramento del quadro clinico del pz vasculopatico con ritardo
nella formazione dell’ateroma e sulla disfunzione della cellula endoteliale. L’apoptosi poi è
la cosa finale con morte delle cellule vascolari. L’attività dei β bloccanti si estrinseca in:
-
attività ipotensiva vaso dilatante
-
riduzione attività cardiaca (calo della frequenza, gittata e portata);
-
rallentamento conduzione atriale ed atrioventricolare
-
aumento delle resistenze periferiche (scompare dopo somministrazione cronica)
-
riduzione della tolleranza allo sforzo fisico.
Effetti extravascolari
-
blocco dei recettori β2 della muscolatura bronchiale (antagonisti non selettivi)
-
inibizione del rilascio di renina dall’apparato iuxtaglomerulare
-
aumento di VLDL e riduzione di HDL (effetto pro-aterogeno da bloccanti non selettivi)
-
prolungamento della ipoglicemia indotta da insulina per blocco della glicogeno lisi
-
effetti centrali come insonnia, allucinazioni depressione (bloccanti lipofili)
-
riduzione dei tremori da eccessiva attività simpatergica centrale (bloccanti lipofili);
38
www.haikzarian.com
copyright © Haik Zarian
-
riduzione della sintesi della cascata della renina.
-
Β bloccanti sono coinvolta anche nel rilascio di adrenalina a livello sistemico.
Sulla base degli effetti si selezionano i pz adatti.
-
ipertensione
-
angina pectoris
-
aritmie cardiache
-
cadiomiopatia ipertrofica
-
prevenzione II arto miocardio
-
insufficienza cardiaca
Da tenere presente che:
-
tutti i β-bloccanti hanno effetti ipotensivi alle dosi terapeuticamente attive, anche se il
meccanismo di azione è tuttora in discussione;
-
l’effetto dei β-bloccanti vasodilatatori è dovuto al blocco dei recettori β associato ad altri
meccanismi con riduzione delle resistenze periferiche;
-
i β-bloccanti vasodilatatori aumentano nel breve termine le resistenze periferiche, che
poi diminuiscono probabilmente per:
a) blocco dei recettori β presinaptici con inibizione del rilascio di noradrenalina;
b) inibizione del rilascio di renina;
c) riduzione persistente della gittata cardiaca
Usi specifici
-
Angina pectoris: tutti i β-bloccanti sono potenzialmente efficaci nel trattamento della
malattia coronarica, compresa l’angina instabile effetto terapeutici qui si estrinseca per
un’effetto di riduzione del consumo di O2 che si ha per calo della frequenza e gittata
cardiaca. In secondo luogo l’efficacia è dovuta ad un aumento del tempo di diastole che
è in grado di migliorare il flusso coronarico prolungandone la perfusione diastolica.
-
Aritmie cardiache: usati nelle aritmie ipercinetiche dati da alti livelli di catecolammine
(tireotossicosi, feocromocitoma, sforzo fisico, ansia) e controllo della frequenza
ventricolare nel flutter e enlla fibrillazione atriale. L’efficacia è dovuta all’aumento della
conduzione AV, prolungamento del periodo refrattario del nodo AV (particolarmente
pronunciato nel sotalolo).
-
Cardiomiopatia ipertrofica: caratterizzata da efflusso cardiaco ridotto per ostruzione
e da aumento della pressione intracardiaca che viene ridotta significativamente dai βbloccanti
39
www.haikzarian.com
-
copyright © Haik Zarian
Cardiopatia ischemica: qui si sono fatti diversi studi a seconda che farmaci siano
usati in periodo post infartuale, prima o durante. Se usati a scopo profilattico non
danno reale miglioramento della patologia e calo mortalità di tipo coronario. Lo stesso
vale per utilizzo dei farmaci nel periodo perinfartuale. Si sono rilevati utili invece nella
fase postinfartuale dopo le 72h e il trattametno prolungato riduce le morti e le recidi
ve quindi sono indicati nella prevenzione II dell’infarto. Sono da preferire cmq i β 1
selettivi.
-
Flutter
-
Fibrillazione atriale: aumento del tempo della conduzione Av e prolunga periodo
refrattario del nodo AV
Clinica
-
Monosomministrazione (atenololo, nadololo) bid (metoprololo)
-
Rispondono meno: anziani, neri, bassa renina
-
Vantaggiosi nei pazienti ipertesi con angina, post-infarto (riducono la recidiva di infarto
e la mortalità del 25 %) e tachiaritmie.
Indicazioni possibili
scompenso cardiaco (carvedilolo), diabete, gravidanza
Effetti collaterali
-
Bradicardia
-
Riduzione dell’efficienza fisica (da preferire i bloccanti β1 selettivi)
-
Dislipidemia
-
Prolungamento della ipoglicemia da insulina (da preferire i composti selettivi)
-
Insonnia,allucinazioni, depressione (da preferire i composti meno lipofili)
-
Deficit circolatorio periferico, sensazione di freddo all’estremità
-
Impotenza sessuale (da preferire i composti con effetti anti-α1)
-
Incubi
-
Fenomeno di Raynaud.
Controindicazioni
-
Ipotensione arteriosa, bradicardia (FC<60bpm), sindrome del seno malato e blocco
seno-atriale, blocco atrio-ventricolare di II e III grado, insufficienza cardiaca
scompensata, shock cardiogeno. Angina vasospastica, angina instabile, angina
variante, angina di Prinzmetal. In questi casi i β-bloccanti potrebbero peggiorare il
40
www.haikzarian.com
copyright © Haik Zarian
vasospasmo; tuttavia possono essere efficacemente utilizzati in alcuni casi se
opportunamente associati a farmaci vasodilatatori come i nitrati od i calcio-antagonisti
diidropiridinici.
-
Asma: nel pz asmatico il blocco dei recettori β2 situati sulla muscolatura bronchiale
può infatti precipitare crisi broncospastiche.
-
Depressione attuale o pregressa.
-
Blocco dei β-adrenocettori centrali
-
Diabete (β-bloccanti bloccano la liberazione di insulina; sono preferibili i cardioselettivi)
-
Sindrome di Raynaud, vasculopatie obliteranti periferiche, claudicatio intermittens.
Queste controindicazioni valgono in particolar modo per i β-bloccanti non selettivi in
quanto l’antagonismo β2 potrebbe ostacolare la dilatazione dei vasi di resistenza siti nei
muscoli scheletrici. Teoricamente celiprololo (β1-antagonista, β2-agonista parziale),
labetalolo e carvedilolo (α1/β1- antagonisti) dovrebbero essere scevri da questa
controindicazione poiché dotati di un’inconfutabile azione vasodilatatoria
-
Dislipidemie: i β-bloccanti non selettivi possono infatti peggiorare il profilo lipidico,
determinando un incremento dei trigliceridi plasmatici ed un decremento del
colesterolo HDL.
-
Altro: feocromocitoma non trattato.
Indicazioni per l’uso dei β-bloccanti in patologie non cardiovascolari
-
Ipertiroidismo per il controllo della tachicardia, tremori, palpitazioni e per ridurre la
vascolarizzazione della ghiandola.
-
Ansia
-
Glaucoma da angolo aperto (timololo 0.25-0.5%)
-
Profilassi dell’emicrania (propranololo, timololo, metoprololo)
-
Prevenzione di emorragie gastrointestinali in portatori di varici esofagee per riduzione
del flusso ematico portale
LINEE GUIDA SULLA REGOLAZIONE DELLA PRESSIONE ARTERIOSA
Trattamento iniziale – Le informazioni dalle metanalisi
Sono informazioni di tanti trial clinici. Alcun ricercatori rendono tutti i trial clinici e fanno
metanalisi per aumentare l’N della nostra sperimentazione, fatto utile se la patologia è rara.
Diuretici VS altri ipertensivi
Ci sono alcuni farmaci che pur non avendo trial clinici alle spalle sono registrati lo stesso.
41
www.haikzarian.com
copyright © Haik Zarian
Nel caso dei diuretici si è confrontato nel 2003 diuretici a basso dosaggio con gli altri antiipertensivi e si è visto che sono superiori:
-
ai Ca antagonisti nella prevenzione degli eventi CV e in particolare dello scompenso
-
agli ACE inibitori nella prevenzione di eventi CV, ictus e scompenso
-
ai β bloccanti nella prevenzione di eventi CV
-
α bloccanti nella prevenzione di eventi CV e (in modo netto) dello scompenso.
Ipertensione e diabete (ACEI, sartani e gli altri)
Una metanalisi del 2005 ha confrontato tra loro le diverse classi di antipertensivi in pz
diabetici non ha evidenziato sostanziali differenze sui principali esiti CV. Questa metanalisi
ha
anche
evidenziato
che,
nei
soggetti
diabetici,
un
trattamento
più
intensivo
dell’ipertensione è più efficace nel ridurre i principali eventi CV rispetto a uno meno
intensivo. Tale risultato non si osserva invece nei soggetti non diabetici. Inoltre, a
differenza dei sartani, gli ACE-inibitori riducono la mortalità totale verso placebo (confronto
indiretto).
Da tenere presente che le principali metanalisi pubblicate hanno considerato popolazioni
eterogenee di ipertesi, che avevano diversi livelli di rischio, con o senza eventi CV pregressi
e/o diabete. Pur con il vantaggio di offrire un quadro complessivo dei vari studi disponibili
e di valutare in modo generale gli effetti dei trattamenti su esiti clinicamente rilevanti, i loro
risultati non sono facilmente utilizzabili dal clinico al momento di prendere decisioni sul
singolo paziente con un rischio CV definito.
In presenza di diabete ACEI riducono la mortalità, fatto non osservato per i sartani. In ogni
caso.
Nella situazione giornaliera le condizioni sono sempre diverse dal trial clinico e i risultati
saranno sicuramente differenti.
Gli ACE sono efficaci per prevenire e curare la nefropatia diabetica, i sartani solo per
rallentare progressione nefropatia e non nel prevenire.
Uso farmaci anti ipertensivi in ipertensioni non complicate e complicate
La percentuale di successo per trattamento di successo per ipertensione è del 50%, nelle
migliori condizioni. Questo fatto dipende da tre variabili:
-
compliance al trattamento cioè l’aderenza al trattamento; in altre parole da quanto
riusciamo a convincere il pz ad assumere il farmaco ogni giorno;
42
www.haikzarian.com
copyright © Haik Zarian
-
effetti collaterali dei farmaci;
-
fattori correlati al medico, cioè terapia sbagliata o non completamente corretta.
La prevalenza della NON compliance è tra 20-60% ed è prevalente la riduzione della dose
prescritta. Le conseguenze della non compliance sono numerose e principalmente
comprendono l’aumento delle complicanze cardiovascolari dell’ipertensione e modificazioni
dello schema terapeutico.
I principali motivi della ridotta compliance terapeutica comprendono:
-
posologia (14%)
-
dimenticanza (24%)
-
effetti indesiderati (16%)
-
ridotta comprensione dell’importanza del trattamento (24%)
-
rifiuto dello stato di patologia cronica (22%).
Ci sono inoltre diversi che ostacolano la compliance dell’ipertensione:
-
lunga durata trattamento
-
condizione spesso asintomatica
-
assenza beneficio immediato
-
necessità controllo trattamento
-
costi eccessivi.
Inevitabilmente le conseguenze dell’insufficiente controllo pressorio negli ipertesi trattati
causa persistenza e progressione del danno d’organo relativo all’ipertensione e maggiori
eventi cardiovascolari e cerebrovascolari rispetto agli ipertesi ben controllati ed ai
normotesi.
In caso di non raggiungimento del target terapeutico il medico non ha niente.
Raccomandazioni delle linee guida nel trattamento dell’ipertensione
Le linee guida per ipertensione sono numerose e alcune linee guida sono giunte ormai alla
VII e VIII edizione. Pertanto l’argomento del corretto trattamento dell’ipertensione è sentito
da diversi anni.
Tra le principali linee guida troviamo:
-
LG americane (JNC 7)
-
LG europee (ESH/ESC)
-
LG brittaniche (NICE e BHS)
-
LG canadesi (CHEP)
43
www.haikzarian.com
copyright © Haik Zarian
Pur presentando sostanziale concordanza sugli aspetti più rilevanti delle strategie
terapeutiche, riguardo alcune problematiche specifiche tra le varie LG si notano differenze
nelle
raccomandazioni,
parzialmente
spiegabili
se
si
tiene
conto
della
diversa
interpretazione data ai risultati degli studi disponibili da parte dei diversi gruppi di
produzione delle LG.
Vi è anche una differenza nella classificazione della PA nelle diverse linee guida come si
vede nella tabella sotto riportata.
Tutte le linee guida concordano sulla opportunità di far precedere e/o associare alla terapia
farmacologica un intervento sugli stili di vita:
-
perdere peso
-
limitare alcol
-
aumentare attività fisica
-
ridurre assunzione di sale
-
smettere di fumare
-
limitare assunzione di cibi ricchi grassi e colesterolo
44
www.haikzarian.com
copyright © Haik Zarian
Nella scelta del farmaco bisogna considerare alcuni aspetti importanti:
-
profilo di rischio cardiovascolare del pz
-
patologie concomitanti
-
causa dell’ipertensione
-
tollerabilità del farmaco (neri rispondono poco a ACEI)
-
farmaci che il pz st usando
-
età del pz
-
costo del farmaco
E’ possibile combinare 2 o 3 farmaci di classe differente, anche se, come vedremo, certe
associazioni farmacologiche sono più consigliate di altre ed alcune sono francamente
sconsigliate per l’assommarsi dei possibili effetti collaterali. Il primo passo nella strada
dell’associazione farmacologica antiipertensiva consiste nell’aggiungere alla monoterapia
che abbia ottenuto una qualche efficacia un secondo medicamento con meccanismo
d’azione diverso e possibilmente complementare.
45
www.haikzarian.com
copyright © Haik Zarian
Nella ionoterapia con i farmaci attuali l’aumento della dose media del medicamento
prescelto come monoterapia offre un piccolo incremento di efficacia a fronte della comparsa
o del peggioramento degli effetti collaterali.
La monoterapia sequenziale invece, consistente nella sostituzione di una monoterapia con
un’altra di differente classe farmacologica fino ad ottenere la massima risposta
antiipertensiva, richiede lunghi tempi di intervento con le conseguenti ricadute sulla
compliance
terapeutica
e
la
fiducia
nel
medico
curante.
Le
caratteristiche
di
maneggevolezza e tollerabilità dei farmaci di prima scelta, unite al loro differente e spesso
complementare meccanismo d’azione e alla possibilità della somministrazione monodose,
rendono al medico più agevole rispetto al passato la gestione della terapia di associazione.
Come detto prima è possibile combinare 2 o 3 farmaci di classe differente, anche se, come
vedremo, certe associazioni farmacologiche sono più consigliate di altre ed alcune sono
francamente sconsigliate per l’assommarsi dei possibili effetti collaterali. Le associazioni
farmacologiche antiipertensive sono condizionate in parte dalle patologie cardiovascolari
eventualmente presenti nel paziente iperteso.
Il primo passo nella strada dell’associazione farmacologica antiipertensiva consiste
nell’aggiungere alla monoterapia che abbia ottenuto una qualche efficacia un secondo
medicamento
con
meccanismo
d’azione
diverso
e
possibilmente
complementare.
Indicazione delle diverse classi di farmaci
-
Ipertrofia Ventricolare Sinistra: ACE Inibitori, α 1 bloccanti, calcioantagonisti,
antagonisti recettore AT II
-
Infarto Miocardico: betabloccanti, ACE Inibitori
-
Angina pectoris: betabloccanti, calcioantagonisti
-
Scompenso cardiaco: diuretici, ACE Inibitori, ß bloccanti
-
Ipertensione sistolica: diuretici, calcio antagonisti
-
Aritmie: ßbloccanti, calcioantagonisti (non diidropiridinici)
-
Insufficienza renale lieve: ACE Inibitori (creatinina < 4-5 g/ml), a1bloccanti, diuretici
ansa
-
Insufficienza renale avanzata: diuretici ansa a1bloccanti
-
Asma: a1bloccanti, antagonisti recettore ATII, calcioantagonisti
-
Dislipidemia, sindrome plurimetabolica: a1bloccanti, ACE Inibitori
-
Iperuricemia: antagonisti recettore ATII, α1bloccanti, ßbloccanti, calcioantagonisti
-
Gravidanza: α-metildopa, atenololo
-
Diabetici: α1-bloccanti , ACE Inibitori, antagonisti recettore ATII
-
Razza nera: diuretici
46
www.haikzarian.com
-
copyright © Haik Zarian
Ipertrofia prostatica: α1-bloccanti.
FARMACOLOGIA DELLA CARDIOPATIA ISCHEMICA
Generalità
La cardiopatia ischemica si può definire in diversi modi. Una delle migliori definizioni
descrive la C.I. come l’incapacità di perfondere adeguatamente il miocardio in modo da fare
fronte alle esigenze metaboliche. Questo si traduce in conseguenze di ordine acuta o
cronica, di ordine biofisico, biochimico, meccanico e clinico. L’insieme delle alterazioni è
detta insufficienza coronarica.
Manifestazioni cliniche della insufficienza coronarica
-
Arresto cardiaco: è il fatto più grave delle manifestazioni e può portare rapidamente a
morte se non si interviene.
-
Angina pectoris: patologia più diffusa per la cardiopatia ischemica ed è legato ad uno
squilibrio tra domanda e apporto metabolico di O2. L’ischemia è reversibile e non
provoca danni anatomici permanenti. Se l’ischemia non da sintomi si parla di ischemia
silente. Se si protrae nel tempo si può avere danno irreversibile del miocardio che porta
a necrosi di parte del miocardio.
-
Infarto miocardico: consegue ad ischemia protratta che porta ad un danno cellulare
irreversibile o necrosi miocardica.
-
Scompenso cardiaco: esso può manifestarsi come complicanza di un infarto acuto o
pregresso, oppure può essere precipitato da episodi di ischemia miocardica transitoria
o da aritmie.
-
Aritmie: esse possono essere l’unico segno di una cardiopatia ischemica. In questo
caso la diagnosi è solo presuntiva, a meno che con esami strumentali non si dimostri
una sicura ischemia miocardica oppure una coronarografia non evidenzi una
coronaropatia ostruttiva.
Epidemiologia
In Italia le malattie cardiovascolari sono la causa del 40-50% della mortalità globale. La
cardiopatia ischemia da sola è a sua volta responsabile del 35% dei decessi dovuti a
malattie cardiovascolari. Si stima che la mortalità annuale per le forme tipiche della
cardiopatia ischemia (angina, infarto e morte improvvisa) sia tra 70'000 e 80'000 casi. In
Italia vivono circa un milione di soggetti affetti da cardiopatia ischemica nelle sue forme più
tipiche.
47
www.haikzarian.com
copyright © Haik Zarian
Eziologia
La causa più frequente di cardiopatia ischemia è data senza dubbio dall’aterosclerosi
coronarica e da un punto di vista pratico essa può essere considerata la causa esclusiva.
Numerosi studi epidemiologici, condotti negli ultimi venticinque anni, hanno consentito di
individuare alcune variabili individuali che si associano a un maggior rischio di malattia;
queste variabili sono state definite fattori di rischio coronarico le quali possono essere o
non modificabili oppure parzialmente oppure modificabili:
a) Fattori di rischio non modificabili
-
età: all’aumentare dell’età aumenta il rischio di malattia coronarica in particolar modo
si è visto che mediamente a partire dai 60 anni questo aumenta in modo deciso
raggiungendo un massimo per i maschi a 65 anni e 71 per le donne che sono più
protette;
-
sesso: le donne sono protette dagli estrogeni;
-
fattori genetici
-
storie personali di malattie cardiovascolari pregresse.
b) Fattori di rischio parzialmente modificabili con interventi anche farmacologici si
possono normalizzare
-
ipertensione arteriosa: è un fattore di rischio in quanto si instaura una tachicardia e
essendo l’irrorazione nella fase diastolica delle coronarie, diminuisce il tempo di
irrorazione e quindi il flusso sanguigno.
-
diabete mellito
-
ipercolesterolemia e basso colesterolo HDL
-
obesità
c) Fattori di rischio modificabili
-
fumo
-
abuso di alcol.
Cenni di anatomia e fisiologia del distretto cardiaco
Una dipartizione dall’aorta da luogo alle coronarie di dx e sin che poi si biforcano nei loro
rami. Le cellule del miocardio hanno una peculiarità che è data dalla forte estrazione
dell’O2 (estraggono circa il 70% della O2 nel sangue). L’unido meccanismo di compenso in
caso di aumentato fabbisogno di O2 è rappresentato da un proporzionale aumento del
48
www.haikzarian.com
copyright © Haik Zarian
flusso coronarico, determinato da una vasodilatazione del distretto coronarico arteriolare
(vasi di resistenza).
La capacità massima di vasodilatazione secondaria a uno stimolo è definita
riserva coronarica.
Ci sono diversi fattori che modificano la riserva coronarica cioè i fattori che in sostanza
regolano il circolo coronario:
-
Fattori anatomici: posizionamento seni di Valsalva, spessore del ventricolo sn,
presenza di circoli collaterali.
-
Fattori meccanici: portata sistemica, resistenze vascolari, efficienza di estrudere il
sangue dal sistema coronario, riflesso piogeno e viscosità ematica.
-
Fattori neurogeni: attivazione recettori α, recettori β2 e azione vagale.
-
Fattori metabolici: pO2, pH, K+, adenosina e prostaglandine che sono mediatori che
producono vasodilatazione oppure vasocostrizione.
Dal punto di vista anatomico i vasi coronarici possono essere suddivisi in:
-
vasi di conduttanza: grossi rami epicardici e loro diramazioni
-
vasi di resistenza: rami intramiocardici e arteriole
Le resistenze coronariche sono regolate da fattori estrinseci (azione compressiva del
miocardio ventricolare) e da fattori intrinseci (di natura neuro-ormonale, miogena e
metabolica)
Fattori meccanici: il flusso coronario si attua soprattutto in diastole in quanto in sistole i
rami intramurali vengono virtualmente occlusi dalla contrazione ventricolare. Ne consegue
che la tachicardia predispone allo sviluppo di ischemia, poiché accorcia il tempo di
diastole. Gli strati sub endocardici sono generalmente i più esposti all’ischemia soprattutto
perché maggiormente esposti alla pressione diastolica endocavitaria. In altre parole in
tachicardia cioè situazione di aumentato consumo di O2 è chiaro che un cuore che non è
in grado di assicurare la riserva coronarica, in quanto parzialmente chiuso si sviluppa una
condizione di ischemia in quanto abbiamo maggiore consumo di O2 e una tachicardia
anche riflessa e quindi si accorcia il tempo di diastole e si riduce irrorazione e quindi
apporto di O2.
Fattori neurogeni: le coronarie sono innervate dal sna e quindi abbiamo grazie alla
stimolazione ortosimpatica vasodilatazione mediata dai recettori β e l’innervazione
49
www.haikzarian.com
copyright © Haik Zarian
ortosimpatica da a livello cardiaco aumento della contrattilità e frequenza cardiaca, dando
vasodilatazione a aumento della contrattilità e della frequenza cardiaca.
Fattori metabolici: l’aumentato della richiesta metabolica del miocardio determina idrolisi
di ATP e conseguente liberazione di adenosina nell’interstizio. L’adenosina induce una
vasodilatazione (antagonizzando l’ingresso dello ione Ca all’interno delle cellule muscolari
lisce) soprattutto a livello dei vasi di resistenza, con un conseguente aumento del flusso
coronarico proporzionale all’aumento delle richieste metaboliche.
L’adenosina non è la sola sostanza implicata nel processo, (il sistema degli eicosanoidi,
l’attività nitrossido sintetetasica) ma è verosimilmente la principale. Se siamo in una
situazione aterosclerotica sappiamo che l’endotelio è lesionato e l’unico o il principale
metabolita che può contribuire ad una pervietà coronarica è l’adenosina. Abbiamo quindi
una situazione patologica e non più fisiologica.
Fisiopatologia dell’ischemia cardiaca
Ci sono due fattori che intervengono alla genesi dell’ischemia:
-
riduzione flusso coronario
-
aumento del consumo miocardico di O2 per aumentato consumo dello stesso.
Fino all’80% della riduzione del flusso, le coronarie sono ancora in grado di
approvvigionare di metaboliti al muscolo cardiaco. I problemi giungono per occlusioni
superiori all’80%. Se la stenosi riduce la sezione del ramo epicardico di oltre l’80%, si ha
una riduzione del flusso anche in condizioni basali; in questa situazione l’albero
coronarico impegna gran parte della sua “riserva” per mantenere un apporto metabolico
adeguato.
In caso di aumento delle richieste metaboliche quindi il circolo coronarico non è più in
grado di far fronte alle richieste con comparsa di ischemia. L’ischemia interessa
inizialmente gli strati sub endocardici. Una modulazione del tono coronarico legato a
fattori neuroumorali può modificare temporaneamente la riserva coronarica; questo spiega
la variabilità della soglia ischemica che abitualmente si osserva in clinica anche nello
stesso soggetto. La riserva può quindi essere talvolta insufficiente a coprire le necessità del
miocardio e come detto prima esiste una variabilità interindividuale per mantenere il
flusso coronario anche per la presenza di metaboliti in grado di produrre vasodilatazione
locatale.
50
www.haikzarian.com
copyright © Haik Zarian
L’ischemia interessa gli strati subendocardici che più difficilmente vengono raggiunti da
flusso sanguigno. Lo stesso soggetto nelle stesse condizioni sotto sforzo può avere o meno
una ischemia
Condizioni cliniche affinchè si instauri una ischemia:
-
variazioni del postcarico come avviene in caso di stenosi aortica, ipertensione aortica,
ridotta compliance aortica;
-
aumento della contrattilità, da sindrome ipercinetica, ipertiroidismo, attività fisica,
tachicardia o farmaci.
-
aumento della frequenza: stenosi aortica, ipertensione arteriosa, ridotta compliance
aortica
-
precarico: con insufficienza cardiaca e aumentato ritorno venoso o aumentato ritorno
venoso del cuore. Il cuore dilatato lavora di più e consuma più ossigeno
-
volume: cardiomiopatia congestizia.
-
Spasmo coronario: per presenza di fattori endogeni che danno coronarocostrizione
(trombossano, PgE e meccanismo neurogeni).
-
Trombi piastrinici: iperaggregabilità e iperlipidemia
-
Fattori emoreologici: aumento della viscosità ematica.
Tutto questo può portare all’attacco ischemico che si irradia lungo tutto il braccio.
Manifestazioni cliniche della cardiopatia ischemica
a) sindromi coronariche stabili:
-
angina da sforzo
b) Sindromi coronariche acute (instabili)
-
angina instabile
-
angina di nuova insorgenza
-
angina postinfartuale
-
angina in crescendo
-
angina variante o vasospatica di Prizmental.
Le più facili da trattare sono le forme stabili.
51
www.haikzarian.com
copyright © Haik Zarian
Angina stabile
Forma di ischemia miocardica acuta transitoria associata a sforzo fisico e emozione e si
produce in condizioni omogenee, stabili nel tempo. Vi è in altre parole una costante e
ripetibile discrepanza fra la domanda di O2 da parte del miocardio e una insufficiente
disponibilità di flusso coronarico e
Ci sono diversi fattori precipitanti nell’angina:
-
attacco provocato da uno sforzo, in particolare in seguito ad un lavoro che comporta
l’utilizzo delle braccia al di sopra delle spalle;
-
in presenza di ambiente freddo, camminata controvento e dopo pasto abbondante;
-
crisi ipertensiva
-
paura, rabbia, stati di ansia, rapporti sessuali.
L’angina si manifesta oltre al dolore tipico, con respiro corto, palpitazioni, debolezza.
L’angina da sforzo ha dolore tipico durante lo sforo, è di breve durata, ha regressione con il
riposo il dolore, sono sensibili ai nitroderivati.
Classificazione funzionale della angina stabile secondo la società CV canadese:
-
classe I: la normale attività fisica non induce angina
-
classe II: modesta limitazione nelle attività motorie, hanno limitazioni nelle attività
ordinarie. L’angina insorge camminando in fretta, dopo i pasti, al freddo, al vento.
-
classe III: forti limitazioni nelle attività motorie ordianarie, anche salendo le scale.
L’angina insorge camminando per due isolati o salendo un piano di scale.
-
clase IV: incapacità di compiere movimenti in quanto l’angina insorge anche a riposo.
Angina instabile
Simile a quella da sforzo ma il dolore è più intenso, persitente, fino a 30 min e può
insorgere qualsiasi livello. Si usano i nitrati che spesso danno sollievo per via sub linguale
(danno però sollievo temporaneo ed incompleto).
Infarto
Quando le condizioni peggiorano e il
dolore cioè l’occlusione coronarica porta ad un
ischemia tale da non permettere più l’approvviggionamento metabolico del cuore stesso e lo
stato anginoso è protratto nel tempo e questo è causa di dolore anginoso ma più intenso e
prolungato, spesso accompagnato da irrequietezza sudorazione ecc.
Da ricordarsi che la durata del dolore di solito è superiore a 20-30 min.
52
www.haikzarian.com
copyright © Haik Zarian
FARMACI ANTIANGINOSI
Generalità
L’obiettivo di questi farmaci è il trattamento dei disturbi del circolo coronarico. Questo
perché il flusso coronarico insufficiente di breve durata è l’angina pectoris. Una carente
irrorazione del miocardio di lunga durata o la mancata irrorazione di una parte del
muscolo cardiaco porta all’infarto miocardico con necrosi cellulare del distretto interessato.
Finalità primaria dei farmaci antianginosi è la rimozione dello squilibrio tra il fabbisogno e
la disponibilità dell’O2 necessario per le attività metaboliche.
I farmaci antianginosi sono numerosi e vengono classificati sotto C01D:
- C01A
- nitroglicerina
- isorbide nitrato
- pentaetertritile tetra nitrato
Tra i farmaci antianginosi troviamo i nitrati ma anche Ca antagonisti e β bloccanti. I nitrati
sono indicati per il trattamento acuto.
ß-bloccanti
Diminuiscono la frequenza cardiaca e la forza di contrazione del cuore bloccando il sistema
nervoso. Vengono utilizzati nelle manifestazioni ischemiche da sforzo fisico e nella profilassi
del’angina pectoris. Riducono il flusso di Ca++, inibendo la fosforilazione delle proteine del
sarcolemma che utilizza cAMP.
Nitriti e nitrati organici
Sono esteri dell’acido nitroso (nitrito di isoamile) e dell’ac. nitrico (nitroglicerina, isosorbide
dinitrato ecc). Esplicano la loro attività farmacologica generando NO (prodotto dalle cellule
endoteliali) il quale attivando l’enzima guanilato ciclasi, determina u incremento di cGMP.
In tal modo questi composti provocano rilassamento della muscolatura liscia dei vasi.
I nitrati agiscono in modo differente a seconda del distretto vascolare sono derivati di
esterificazione di alcol semplici o acido nitroso. Subiscono metabolismo di primo passaggio
rapido e sono molto efficaci nelle emergenze per rapido assorbimento. L’effetto
vasodilatatore si ha all’aumentare del dosaggio.
A livello delle coronarie agiscono con vasi collaterali che non permettono aflusso sufficiente
di sangue. Il nitrato quando viene somministrato non influenza il vaso ma è in grado di
ripristinare il flusso dei rami collaterali ripristinando l’aflusso di sangue nell’area
ischemica. A livello coronarico quindi abbiamo una riduzione della pressione arteriosa che
53
www.haikzarian.com
copyright © Haik Zarian
genera minore richiesta di O2, vasodilatazione e quindi scomparsa dello spasmo arterioso
ed aumento del flusso collaterale e miglior perfusione del miocardio ischemico. Ci sono
anche dei rovesci della medaglia come in molti farmaci: un abbassamento della pressione
arteriosa provoca tachicardia riflessa con maggiore richiesta di O2 e quindi anche una
riduzione del tempo di perfusione coronarica e quindi una minore perfusione del miocardio.
Da tenere presente che i nitrati sono dei profarmaci in quanto la molecola attiva è l’NO con
formazione di GMPc. Non è ancora ben chiaro tutto il meccanismo, si sa che vengono
coinvolti gruppi sulfdrilici a formare nitrosotioli ma non si sa come avvenga la liberazione
del NO dal nitrato. I nitrati hanno però anche altre attività, in particolar modo l’NO:
-
inibisce l’aggregazione piastrinica riducendo la viscosità ematica
-
provoca vasodilatazione arteriolare
-
diminuisce il postcarico
-
provoca vasodilatazione delle vene e diminuisce il precario
-
inibisce anche la proliferazione delle cellule muscolari della parete vascolare e miociti e
quindi la formazione degli ateromi.
I nitrati esercitano la loro azione mediante:
-
riduzione consumo di O2: il rilasciamento della muscolatura liscia determina
infattidiminuzione del precario e quindi diminuzione del ritorno venoso al cuore per cui
lo stress di parete è ridotto e la contrazione del cuore diminuisce (< lavoro). Si ha
inoltre diminuzione
del posta carico e quindi diminuzione del lavoro del cuore (<
lavoro). Il minor lavoro del cuore significa una minore richiesta di O2.
-
ridistribuzione flusso coronario attraverso arteriole collaterali: questi compsti sono in
grado di facilitare il circolo collaterale e quindi aumentano la disponibilità di O2.
-
rimozione spasmo coronario nell’angina pectoris variante: in generale tali derivati
hanno una modesta azione coroarodilatatrice, però nelle forme di angina pectoris
causate da spasmo coronarico, agiscono direttamente provocando un rilassamento
della parete del vaso, anche le diidropiridine (Ca antagonisti) sono efficaci in questa
situazione.
Composti utilizzati in terapia
-
nitrito di isoamile: si somministra per inalazione, ha azione istantanea ma di breve
durata di azione (1-5min).
-
nitroglicerina: ha una via di somministrazione che può essere o sublinguale o
mediante cerotti transdermici. Ha una durata di azione di circa 1h e viene rapidamente
metabolizzato dal fegato a nitrito inorganico ad opera della glutatione-nitrato riduttasi.
54
www.haikzarian.com
-
copyright © Haik Zarian
isosorbide dinitrato: si somministra in compresse sublinguali ma anche per os. Il
tempo di insorgenza di azione è più lento della nitroglicerina (3min) ma ha durata
d’azione maggiore (4-6h).
-
isosorbide mononitrato: ha caratteristiche simili ma con un nitrato in meno.
-
pentaeritrolo tetranitrato e eritrolo tetranitrato; hanno azione più prolungata.
-
molsidomina: donatore di NO, ha peculiarità che può essere somministrato per via
orale e raggiunge la concentrazione plasmatici massima dopo 30-60min.
Coronarodilatatori
-
Dipiridamolo:
possiede
azione
diretta
sulle
coronarie,
agisce
diminuendo
la
ricaptazione dell’adenosina. Il problema è che può portare ad un peggioramento dello
stato ischemico favorendo per l’effetto del furto coronarico cioè il fatto che può portare
ad un aumento della perfusione di aree normossiche a discapito di quelle ischemiche
peggiorando lo stato ischemico.
-
Khellina e derivati: sono coronarodilatatori che vengono prodotti dai frutti della
Visnaga. La khellina infatti è un prodotto naturale che si ricava dai semi e dai frutti
della Amni Visanga. È sia un coronarodilatatore che un broncodilatatore ed uno
spasmolitico. Viene somministrato per os, im e per via rettale. Gli effetti collaterali che
può generare sono nausea, vomito e reazioni allergiche. Ha tanti effetti collaterali e
viene poco usato.
-
Eflossato: prodotto di derivazione strutturale della khellina ma con minori efetti
collaterali. È poco usato.
-
Metilcromone: è uno spasmolitico utile negli stati anginosi e nelle coliche biliari,
intestinali e renali. Ha struttura simile ai composti visti precedentemente.
-
Carbocromene: ha gli stessi impieghi dei composti precedenti. Si somministra per os,
ev, ha stesse caratteristiche viste prima.
Vie di somministrazione
-
sublinguale: nitroglicerina (0,3-0,6mg) e isosorbide di nitrato (5mg)
-
spray di nitroglicerina: caratteristiche analoghe alla somministrazione sublinguale:
0,5mg
-
orale:con azione da 2-12h
-
cerotto transdermico con azione fino a 24h
Effetti indesiderati e tolleranza
-
cefalea, nausea, confusione
55
www.haikzarian.com
-
ipotensione
copyright © Haik Zarian
talvolta
potenzialmente
con
reazione
pericolosa
in
vasovagale
associazione
oppure
con
severa,
sidenafil,
prolungata
tadalafil,
e
vardenafil
(controindicazione assoluta)
-
metaemoblobinemia, più raro
La tolleranza è un altro problema e provoca perdita nel tempo dell’effetto emodinamico ed
antianginoso durante la terapia prolungata. Questo non è dovuto a fattori farmacocinetici
in quanto monitorando la concentrazione ematica dei nitroderivati si è visto che sono
costanti nel tempo. Sono stati proposti pertanto diversi meccanismi come:
-
biotrasformazione dei nitrati (deplezione gruppi sulfidrilici)
-
attivazione neuro umorale (risposte sistemiche come sistemi simpatico e RAS) e
risposte locali (endotelina);
-
espansione volume vascolare
-
produzione di radicali liberi
-
ridotta sensibilità adenilato ciclasi
-
ridotta captazione cellulare dei nitrati
-
ridotta attività fosfodiesterasica.
Una cosa è certa: quando si ha interruzione della somministrazione dei nitrati può esserci
un fenomeno di rimbalzo da sospensione; vi è aumentata sensibilità ad agenti
vasodilatatori. È sicuramente attivato un sistema a favore della vasocostrizione e allora la
somministrazione deve essere intermittente e si deve rispettare un intervallo di 6-12h ogni
somministrazione per prevenire sviluppo intolleranza.
Possibilità di fenomeni di rimbalzo dopo sospensione dei nitrati:
-
episodi di angina a riposo / infarto acuto
-
peggioramento della tolleranza allo sforzo (“zero-hour effect”)
CA-ANTAGONISTI
La concentrazione di Ca++ all’interno della cellula determina la contrazione della
muscolatura liscia e del miocardio. I ca antagonisti sono composti che bloccano il flusso di
Ca++ all’interno della cellula e pososno essre utilizzati come:
-
anianginosi:
controbilanciano
la
contrazione
coronariche.
-
antiaritmici: regolano la frequenza cardiaca
-
ipotensivi: rilassano la muscolatura liscia vasale.
I farmaci disponibili in commercio comprendono:
56
ischemica
dolorosa
dele
arterie
www.haikzarian.com
-
veramapile
-
difendipina
-
nifedipina
-
amplodipina
copyright © Haik Zarian
BLOCCANTI DEI CANALI IF (IDUARD FUNNY – CORRENTI SIMPATICHE)
Sono farmaci con caratteristiche antiangionose, non sono degli anti-aritmici. I canali If
sono canali specifici e sono localizzati a livello del seno AV e a livello oculare, non in altri
tessuti e sono canali responsabili dell’automatismo del nodo del seno. Sono i canali che a
un certo punto permettono entrata Na+ e Ca++ nella cellula permettendo alla membrana di
raggiungere il potenziale d’azione; sono in pratica i canali che assicurano l’automatismo
alla cellula cardiaca, permettendo alle cellule pacemaker di raggiungere i fatidici 40mmVolt per il potenziale di azione. Una fase importante è l’aumento della cAMP correlato
alla apertura dei canali If e una attivazione del sistema ß-adrenergico che porta
all’aumento della frequenza cardiaca (quelli muscarinici portano al contrario ad una
depressione e quindi bradicardia). I farmaci che agiscono su questi canali sono farmaci
attivi quando il canale If è aperto e questi entrano bloccando il canale If e quindi bloccano
la corrente responsabile della depolarizzazione della cellula cardiaca. È stata la ricerca
italiana a scoprire che la frequenza cardiaca è regolata dall’attività di canali If. Una
molecola che blocca questi canali in modo selettivo e specifico è l’ibaverdina la quale è una
molecola che blocca l’attività dei canali If e riduce esclusivamente la frequenza cardiaca,
con enorme vantaggio in quanto essendo selettiva non presenta effetti indesiderati classici
degli altri farmaci, come broncospasmo, riduzione della contrattilità del miocardio,
conduzione del sistema cardiaco o della resistenza vascolare coronarica. L’ivabradina si
usa nel trattamento sintomatico dell’angina pectoris stabile cronica e viene usata nei
pazienti con ritmo sinusale (battito cardiaco) normale che non possono essere trattati o che
non tollerano la terapia con betabloccanti (altro medicinale per curare l’angina).
L’ivabradina (farmaco di seconda scelta) va presa per bocca durante i pasti due volte al
giorno, al mattino e alla sera. La dose iniziale raccomandata è di 5 mg due volte al giorno.
Nei pazienti di oltre 75 anni è possibile iniziare con una dose di 2,5 mg fino ad arrivare alla
dose di 5 mg. Dopo 3-4 settimane di trattamento la dose può essere aumentata a 7,5 mg
due volte al giorno, a seconda della risposta individuale. L’effetto collaterale più comune,
ovvero comparso in oltre un paziente su 10, è costituito da fenomeni luminosi o ‘fosfeni’
(sensazione luminosa temporanea nel campo visivo). Altri effetti collaterali sono visione
57
www.haikzarian.com
copyright © Haik Zarian
sfocata, bradicardia (frequenza cardiaca molto bassa), battito irregolare, mal di testa (in
genere durante il primo mese di trattamento) e capogiri.
FARMACOLOGIA DELL’INSUFFICIENZA CARDIACA
Generalità
L’insufficienza cardiaca è una situazione fisiopatologica in cui una alterata funzione
cardiaca è responsabile dell’incapacità del cuore di pompare sangue ad una velocità
commisurata alle necessità metaboliche dei tessuti. L’insufficienza cardiaca si può anche
definire come la situazione di qualsiasi cardiopatia in cui nonostante il riempimento
ventricolare adeguato, la portata cardiaca è ridotta, o in cui il cuore è incapace di pompare
sangue ad una velocità adeguata per soddisfare le necessità tissutali, con parametri di
funzione che restano entro i
Fattori di rischio di insufficienza cardiaca
-
età
-
sesso maschile
-
infarto del miocardio
-
cardiopatia ischemica anche in assenza di infarto del miocardio
-
ipertensione arteriosa
-
ipertrofia ventricolare sin
-
dilatazione ventricolare sin o dilatazione ventricolare sin
-
diabete
-
fibrillazione atriale.
Fisiopatologia dell’insufficienza cardiaca
Un insufficienza cardiaca può essere data da:
-
deficit contrattile del miocardio
-
sovraccarico di volume
-
sovraccarico di pressione.
A ciò succede che vie è riduzione della gittata cardiaca e a questa come risponde il cure? Il
cuore e in generale il sistema cardiovascolare risponde mediante:
-
sistema Starling
-
ipertrofia cardiaca
-
attivazione neuro-ormonale.
58
www.haikzarian.com
copyright © Haik Zarian
Tutte e tre le componenti vanno a contribuire allo scompenso cardiaco.
1- Meccanismo Frank Starling
Quando aumenta il precario e aumenta anche il raggio della cavità ventricolare, aumenta
la lunghezza dei sarcomeri e aumenta la tensione sviluppata.
2 - Ipertrofia cardiaca
-
in caso di sovraccarico di pressione abbiamo aumento della tensione sistolica,
replicazione sarcomeri in parallelo e ipertrofia concentrica cioè il cuore si dilata;
-
in caso di sovraccarico di volume invece abbiamo un aumento della tensione diastolica,
replicazione sarcomeri in serie e dilatazione ventricolare e quindi ipertrofia eccentrica.
3 - Attivazione neurormonale
L’attivazione neurormonale comporta:
-
attivazione simpatica generalizzata
-
attivazione sistema RAS
-
aumento arginina vasopressina
-
aumento fattore natriuretico atriale
-
aumento endotelina
-
riduzione NO.
In pratica si ha aumento della pressione venosa e riduzione della gittata cardiaca e
aumento filtrazione capillare. Se cala la gittata abbiamo calo pressione sanguigna,
aumento attività simpatica, calo flusso renale, aumento RAS e aldosterone e aumento
ritenzione di Na e H2O e quindi edema.
Classificazione funzionale NYHA
-
classe I: no limitazione attività fisica
-
classe II: moderata limitazione attività fisica
-
classe III: marcata limitazione attività fisica
-
classe IV: incapacità di eseguire qualsiasi attività fisica senza sintomatologia.
Sintomatologia
59
www.haikzarian.com
copyright © Haik Zarian
-
dispnea da sforzo
-
ortopnea
-
dispnea parossistica notturna
-
edema polmonare acuto
-
astenia e affaticabilità
-
nicturia, oliguria
-
confusione mentale, ansia cefalea
-
dolore all’ipocondrio dx o all’epigastrio, anoressia, nausea.
Terapia farmacologia
I farmaci usati nello scompenso sono:
- ACEi
- antagonisti della AII (sartani)
- β bloccanti
- antagonsiti dell’aldosterone (spironolattone, eplerenone)
- diuretici (tiazidici prima, dell’ansa nelle fasi avanzate)
- inotropi positivi.
Gli isotropi positivi sono numerosi, sono registrati come C01A cioè i glucosidi cardiaci, poi
digitossina, diossina e metildidgossina. Tutto il resto delle altre molecole non trovano
impiego come registrazione commerciale. Altri farmaci sono i stimolanti cardiaci eccetto i
digitatici come adrenergici, dopaminergici. I farmaci sono suddivisi secondo “importanza
farmacologica” riconosciuta dal ministero della salute, abbiamo farmaci della fascia C che il
pz paga in quanto sono “poco importanti per la salute del cittadino”. Della fascia A sono
quelli a carico SSN che il pz può avere con la ricetta rossa e farmaci della fascia H cioè solo
ad uso ospedaliero per la loro difficoltà di somministrazione quindi in ambito ristretto e
sorvegliato in ambito ospedaliero. Abbiamo quindi inibitori delle fosfodiesterasi ecc.
Tra tutti questi andando a consultare la banca dati troviamo che i più usati nel SSN sono 4
molecole:
-
diossina
-
metildigossina
-
midodrina
-
epinefrina
Il sesso è un fattore di rischio importante: su un totale di 4884 le femmine sono l’1,38%
della popolazione e i maschi l’1,10% e le femmine sono più esposti.
60
www.haikzarian.com
copyright © Haik Zarian
Ma prima avevamo detto i maschi: si deve bilanciare uso del farmaco in base alla
popolazione, misurando nelle persone anziane le donne vivono di più, quindi abbiamo
selezionato una popolazione anziana e in questa le donne sono in maggioranza e quindi si
ritrovano in maggior numero di femmine rispetto ai maschi ed è quindi un falso positivo.
Non sempre tutto è vero anche se troviamo nel trial clinici.
Farmaci inotropo positivi
I farmaci inotropi positivi sono divisi in 4 classi:
-
glicosidi caridioattivi
- agonisti dopaminerigici e adrenergici
-
inibitori della PDE
-
sensibliizzatroi delle miofibrille al Ca++
1. Glicosidi cardioattivi: sono farmaci storici, tra i più antichi in cui le prime molecole
erano state trovate in diversi tipi di piante, come digitali, eliacee, (scrofulariacee, liliacee,
ranunolacee, apocinacee). Possiedono tutti una struttura chimica complessa e mostrano
selettività per il miocardio rispetto ad altre cellule muscolari (cellule muscolari lisce).
La più nota è la digitalis purporea, così chiamata per la sua somiglianza alle dita di un
guanto. Fu scoperta nel XVI sec e fu considerata veleno, sino a quando William Witherig
nella seconda metà del ‘700, ne dimostrò le proprietà cardiotoniche delle foglie della
digitale purpurea. Benché non ne comprendesse il meccanismo d’azione sul cuore, scrisse
che ha sul cuore un effetto che nessuna altra medicazione raggiunge e che può condurre a
guarigione. Successivamente nel corso degli anni, alla digitale è stata riconosciuta la
capacità di aumentare la contrattilità e quindi la portata cardiaca con incremento dei flussi
ematici ed in particolare del flusso plasmatico renale. L’aumento della portata migliora le
condizioni di compenso e riduce la pressione telediastolica. Il principio attivo è dato dai
glicosidi. Per quanto concerne la struttura hanno una parte zuccherina data da 3 molecole
di zucchero (variabile), un nucleo steroideo e un anello lattonico. Questa è la struttura
fondamentale. L’azione farmacologica è legata alla componente steroidea in quanto le
genine libere provocano i medesimi effetti; la parte zuccherina invece ha grande influenza
sulle
proprietà
farmacocinetiche
(assorbimento,
legame
alle
distribuzione, metabolismo)
Meccanismo di azione dei glicosidi cardioattivi
Le strutture che vengono coinvolte sono:
-
pompa Na-K-ATP_asica la quale estrude i Na+ e fa entrare il K
61
proteine
plasmatiche,
www.haikzarian.com
-
copyright © Haik Zarian
il Ca entra nella cellule, viene estruso dalla cellule facendo da scambiatore Ca++-N+ a
che fa uscire Ca e entra Na+ che aumenta di concentrazione e viene estruso con
scambiatore Na-K facendo entrare il K e uscire il Na. Questo è quanto avviene per gli
scambi ionici. All’entrata del Ca abbiamo liberazione di Ca intracellulare con
contrazione delle miofibrille. La digitale danno inibizione di questa pompa cioè Na-KATPasica e quindi abbiamo che il Na intracellulare aumenta di concentrazione e lo
scambiatore Ca-Na non scambia più e quindi non estrude efficacemente il Ca dalla
cellula e si ha quindi una contrazione maggiore. Si è visto poi che ad una bassa
concentrazione di K extracellulare c’è maggiore affinità della digitalina alla pompa.
Quindi bisogna monitorare attentamente la concentrazione del K!. Spesso vengono
associati dei diuretici che potrebbero alterare il K.
In altre parole i glicosidici agiscono inibendo la pompa Na+/K+ e quindi causano un
aumento del [Na+] il quale provoca un ridotto scambio Na+/Ca++ causando un aumento
secondario dell’accumulo di Ca++ da parte del reticolo sarcoplasmatico. L’effetto principale
consiste nell’aumento della forza di contrazione.
La struttura tipica di un glicoside comprende 4 anelli più uno in posizione 17 come anello
lattonico.
Gli zuccheri legati sono il lattosio, xilulosio ecc. Le genine hanno tutte la struttura con 2
OH in 3 e 14 e OH in varie posizioni ma l’attività non cambia.
Vi sono poi composti semisintetici come metadigossina che è uno tra i composti digitalici
più usati, vi è mutilazione dell’ultimo residuo zuccherino.
Gli effetti della sommnistrazione di un glicoside cardioattivo su pz con grave scompenso
cardiaco comprendono l’aumento della forza di contrazione del miocardio e quindi aumetno
della gittata cardiacache si traduce a sua volta in:
-
diminuzione della pressione venosa, diminuzione riempimento diastolico e quindi
diminuzione delle dimensioni del cuore
-
diminuzione del tono simpatico che comporta da un lato aumento della perfusione
renale (diuresi) e dall’altro rallentamento dei battiti.
Altri effetti importanti:
-
aumento attività pacemaker ectopica
-
riduzione conduzione AV
-
aumento attività vagale con conseguente bradicardia
-
effetti meccanici: aumento intensità dell’interazione tra filamenti di actina e di miosina,
la durata della risposta contrattile non è prolungata.
62
www.haikzarian.com
copyright © Haik Zarian
Il potenziale d’azione presenza di un glucoside è dato da:
-
riduzione durata PA
-
riduzione potenziale d’azione
-
aumentata pendenza della fase 2
-
aumentata pendenza della fase 4.
Gli effetti diretto sull’attività elettrica (osservazioni sono state fatte sulle fibre del Purkinje)
comprendono:
-
diminuzione durata PA, per accorciamento fase 2 (plateau)
-
aumento della pendenza della depolarizzazione della fase 4. La salita del potenziale
d’azione (fase 0) inizia da un potenziale meno negativo.
Questo provoca aumento dell’automaticità. Le cellule pacemaker si depolarizzano più
facilmente, ma non finisce qui, abbiamo anche gli effetti indiretti:
a) Effetti indiretti sul sistema colinergico vagale con effetto bradicardizzante.
Tale effetto è dovuto a:
-
aumento degli impulsi vagali efferenti
-
diminuzione sensibilità fibre di conduzione
-
diminuzione attivazione riflessa del simpatico.
L’aumento dell’attività vagale sembra essere il risultato di una interazione del farmaco a
vari livelli del sistema nervoso:
-
sensibilizzazione dei barocettori arteriosi
-
aumento dell’attività afferente nei nervi del seno carotideo
-
aumento dell’eccitabilità delle fibre efferenti del ganglio nodoso e dei nuclei vagali
centrali.
b) Effetti indiretti sul sistema simaptico catecolaminergico:
Nei nodi SA e AV, dosi terapeutiche di digitale determinano una diminuzione della
sensibilità alle catecolamine. Inoltre, il miglioramento delle condizioni emodinamiche
determina una riduzione dell’attività simpatica ed una diminuzione della sintesi di renina.
L’effetto inotropo positivo migliorano le condizioni di pre e post carico con minore
coinvolgimento del sistema simatico, si ottiene l’opposto in caso di intossicazione digitalina.
63
www.haikzarian.com
Da
tenere
presente
copyright © Haik Zarian
che
un’intossicazione
digitalica
determina
un
potenziamento
dell’attività efferente simpatica, probabilmente per attivazione dell’AREA POSTREMA del
midollo allungato.
la diversa biodisponibilità provoca picchi plasmatici diversi sia in termini quantitativi che
temporali.
Tossicità dei digitatici
Questi composti hanno basso indice terapeutico, la tossicità è dovuta ad un aumento
eccessivo della concentrazione di Ca++ intracellulare ed interessa diversi distretti
dell’organismo:
-
cuore: palpitazioni, aritime, fibrillazione ventricolare
-
snc: mal di testa, fatica, confusione
-
apparato GI: anoressia, vomito diarrea
-
sistema visivo: vista annebbiata, visione colorata.
La tossicità viene aggravata in caso di concomitante somministrazione di diuretici tiazidici
poiché la diminuzione del K+ extracellulare determina un’ulteriore inibizione della pompa
Na+/K+.
64
www.haikzarian.com
copyright © Haik Zarian
In caso di intossicazione bisogna sospendere immediatamente il digitalico e somministrare
sali di K+ e utilizzare farmaci antiaritmici (fentoia, lidocaina).
I problemi associati all’uso dei glicosidi hanno stimolato la ricercadi nuovi agenti
cardiotonici. Composti con effetto inotropo positivo che si possono utilizzare in alternativa
ai glicosidi cardioattivi sono gli attivatori dei recettori adrenergici e dopaminergici e gli
inibitori delle fosfodiesterasi (PDE)
2. Agonisiti adrenergici e dopaminergici
Agiscono sui recettori β portando ad aumento del Ca intracellulare. Alternativamente si
inattiva la cAMP cioè la fosfodiesterasi e ci sono farmaci che ne inattivano l’attività.
-
recettori β1: mediano l’effetto inotropo positivo in quanto la loro attivazione provoca
scompensi, aritmie e tachicardia;
-
recettori β2: mediano l’effetto inotropo positivo a livello cardiaco e a livello vascolare,
infatti inducendo vasodilatazione arteriosa periferica, riducono il postcarico;
-
recettori D1: mediano l’effetto inotropo positivo provocando vasodilatazione diretta;
-
recettori D2: mediano l’effetto inotropo positivo provocando vasodilatazione indiretta
per inibizione del rilascio di NA.
I farmaci che sono in grado di agire sui recettori adrenergici sono la dubutamina che agisce
su tutta una serie di recettori, β e anche α. I recettori D1 e D2 che pure hanno effetto
isotropo positivo non vengono attivati dal F, mentre l’effetto sui recettori α vengono
compensati in quanto la forma destro gira ha azione agonista sugli α 1. L’effetto pertanto è
mediato dai recettori β.
Gli inibitori delle fosfodiesterasi permettono aumento della cAMP che da maggiore forza di
contrazione al muscolo.
3. Inibitori della fosfodiesterasi (PDE)
Il cAMP stimola la liberazione di Ca++ quindi provoca la contrazione del muscolo cardiaco
ed
un
maggiore
rilassamento
della
muscolatura
vascolare.
Per
aumentare
la
concentrazione di cAMP possiamo_
-
stimolare l’adenilato ciclasi
-
inibire la PDE
Farmaci inibitori della PDE sono l’amrinone e milrinone. Gli effetti inotrpi di questi
composti sono dovuti alla inibizione della fosofdiesterasi FIII specifica per il cAMP. In tale
modo si ha un aumento di cAMP che provoca un incremento della concentrazione di Ca++
65
www.haikzarian.com
copyright © Haik Zarian
intracellulare con conseguente aumento ella contrattilità. Gli effetti collaterali provocati
dall’amrinine sono disturbi gastro-intestinali e trombocitopenia.
4. Sensibilizzatori delle miofibrille al Ca++
Questi composti non sono inibitori della Na+/K+ ATPasi, non sono simpatico mimetici, non
inibiscono la PDE, ma svolgono a loro azione inotropa aumentando la sensibilità delle
strutture contrattili che, a parità di concentrazione di Ca++, si contraggono maggiormente.
Farmaci di questa classe comprendono il pimobendano e sulmazolo che agiscono come
detto essenzialmente sulla sensibilità delle strutture contrattili al Ca. Le miofibrille
cardiache sono più sensibili alla loro attività e vi è maggiore forza di contrazione.
Nello scompenso cardiaco la terapia di supporto è data da antitrombotici, antiaritmici,
vasodilatatori e Ca antagonisti in quanto migliorano il quadro clinico del pz.
ARITMIE
La presenza di 4 diversi tipi di tessuto conferisce al cuore 4 proprietà funzionali:
-
eccitabilità e refrattarietà
-
ritmicità
-
conducibilità dello stimolo eccitatorio
-
contrattilità.
L’eccitabilità è la proprietà di rispondere ad uno stimolo, adeguato per qualità ed
intensità, con un cambiamento di stato. Le cellule cardiache rispondono ad un adeguato
stimolo con una modificazione del loro potenziale di riposo, detta potenziale d’azione cui
segue una contrazione.
Ritmo sinusale: normalmente il ritmo cardiaco è dato dal ritmo sinusale, cioè ritmo
imposto dall’overtide. La frequenza è data da 60-100 battiti al minuto. Lo stimolo poi si
diffonde a tutto il miocardio, si diffonde al nodo AV e procede speditamente tramite il fascio
di HIS tra le branche del Purkinje fino ad estendersi nelle tra le branche del ventricolo, e
questo è il ritmo sinusale. Per capire come avviene l’eccitazione bisogna tenere conto dei
meccanismi di polarizzazione e ripolarizzazione.
A riposo una cellula del tessuto cardiaco Il potenziale di riposo si instaura tra interno ed
esterno della cellula non eccitata (può essere misurato con dei microelettrodi).a riposo una
cellula cardiaca ha una concentrazione ionica squlibrata cioè alcuni ioni sono più
66
www.haikzarian.com
copyright © Haik Zarian
concentrati nella cellula e altri più all’esterno e nel caso specifico abbiamo che il Na+ è
poco concentrato nella cellula (14mmEq/l) 10 volte superiore che all’esterno, al rovescio il
K+ che è poco concentrato all’esterno (4mmEq/l) e molto di più nella cellula cioè
145mEq/L. Il Cl è 120mEq all’esterno e 5 all’interno. La membrana non è permeabile agli
ioni Na. Il K è maggiormente concentrato nella cellula visto che la membrana è
parzialmente permeabile al K. In altre parole a riposo la membrana cellulare è permeabile
agli ioni K+ e Cl– mentre è impermeabile agli ioni Na+.
IL K+ non può uscire perché:
-
non si può scambiare con un Na+ (impermeabilità della membrana allo ione Na+, inoltre
la pompa Na + - K+ lo ributterebbe fuori);
-
non può associarsi ad un anione A- perché questo è troppo grande per passare
attraverso la membrana cellulare;
-
non può associarsi al Cl- perché varierebbe la stechiometria di quest’ultimo all’interno
della cellula, e il Cl- andrebbe contro un gradiente di concentrazione.
Il potenziale di membrana è imposto dallo ione a cui è più permeabile in quel momento la
membrana cellulare. A riposo, dunque, il potenziale dipende da K+ e Cl-. Il potenziale
d’azione di diffusione all’equilibrio per il K+ è dato dall’equazione di Nerst:
R=8.2 J/mol K, T=temperatura assoluta, F=Faraday (96500 Coulomb), n=valenza con
segno dello ione.
Lo scambio degli ioni durante un potenziale d’azione: si parte dal potenziale di riposo
(canali funny) con depolarizzazione della cellula, all’inizio entra il Na+ e poi Ca, poi si ha
entrata massiccia di Na+ e la fase di entrata del Ca e fuoriuscita del K+ e la fase di
ripolarizzazione estrusione del Na+ e rientro del K+. Questo è detto potenziale pacemaker e
l’altro potenziale d’azione. Il potenziale d’azione consta di 4 fasi:
-
fase 0: depolarizzazione rapida
-
fase 1: ripolarizzazione rapida
-
fase 2: plateau
-
fase 3: ripolarizzazione rapida
-
fase 4: potenziale riposo e depolarizzazione diastolica.
67
www.haikzarian.com
copyright © Haik Zarian
Questa è l’attività autonoma del cuore. L’attività cardiaca può essere modulata da fattori
esterni, cioè: la via parasimpatica con recettore muscarinico, la via simpatica con recettori
β 1 recettori e in parte gli α recettori e poi tramite surrene con rilascio di catecolammine per
via sistemica e quindi adrenalina e noradrenalina.
Normalmente il controllo della frequenza cardiaca è dato dal parasimpatico. Se isoliamo un
cuore vediamo che il ritmo sinusale è di 90-100 battiti al minuto, mentre fisiologicamente
la frequenza è di 70-75 battiti al minuto, dovuto all’attività parasimpatica del nodo del
seno.
Il sistema simpatico tramite i recettori β 1 adrenergici danno attivazine della adenilato
ciclasi formazione cAMP aumento Ca intracellulare e quindi tute le attività del simpatico e
quindi si traduce sul ritmo cardiaco in un ritmo più accelerato in quanto vi è accelerazione
nella depolarizzazione delle cellule pacemaker aumentando il ritmo cardiaco, cioè velocità
di depolarizzazione.
Il sistema parasimpatico invece agisce tramite recettore muscarinico dando da una parte
blocco del canale del Ca++ e iperpolarizzazione della membrana permettendo maggiore
fuoriuscita del K+ e quindi iperpolarizzazione della membrana. Questo sul tracciato del
ritmo mediato dal parasimpatico si traduce in iperpolarizzazione e rallentamento della
depolarizzazione e quindi rallentamento della frequenza cardiaca.
Pertanto il controllo del sistema cardiovascolare dipende dai neuroni simpatici2 e
parasimpatici3, dando ingresso Ca++ e Na+ e quindi aumento della frequenza cardiaca.
Invece mediante il parasimpatico si ha attivazione dei recettori muscarinici e quindi
iperpolarizzazione di membrana e quindi diminuzione della frequenza cardiaca.
Meccanismi delle aritmie caridache
1) difetti della genesi degli impulsi:
- alterazione dell’attività autonomia
- alterazione dell’attività innescata (trigges activity)
2) Difetti della conduzione degli impulsi
- aritmie da rientro
- blocco della conduzione
- presenza di tratti accessori delle vie di conduzione
2
la stimolazione simpatica e l’adrenalina circolante depolarizzano le cellule auto ritmiche e
aumentano la velocità di depolarizzazione, determinando un incremento della frequenza cardiaca.
3 La stimolazione parasimpatica iperpolarizza il potenziale di membrana ella cellula auto ritmica e
rallenta la velocità di depolarizzazione, determinando una riduzione della frequenza cardiaca.
68
www.haikzarian.com
copyright © Haik Zarian
Difetti della genesi degli impulsi
Possono essere dati da:
a) Alterata attività automatica
-
ritmo di fuga si manifesta quando la frequenza di scarica del nodo SA diviene
patologicamente bassa o la conduzione dell’impulso SA è alterata si può avere un
impulso innescato da un pacemaker latente (eccessiva attività vagale, compromissione
della conduzione dell’impulso SA;
-
ritmo ectopico se le cellule pacemaker latenti sviluppano un ritmo di scarica più veloce
del nodo SA (ischemia, anomalie elettriche, aumento del tono simpatico).
b) Alterazione dell’attività innescata (triggered activity)
-
delayed
after
depolarization
(DAD)
normale
potenziale
d’azione
seguito
da
ripolarizzazione anormale in seguito ad elevate [Ca++]i
-
early after depolarization (EAD) postdepolarizzazione precoce durante la fase di plateau
(fase 2) o di ripolarizzazione rapida (fase 3) per correnti in entrata di Ca++ e poi di Na+.
Sono causate da farmaci che allungano la durata del potenziale d’azione che portano a
sviluppo di una forma di aritmia ventricolare (torsades de pointes)
Difetti della conduzione di impulsi
Sono grossomodo due:
-
l’impulso segue sia una via normalmente può rientrare anche attraverso una via
accessoria e trova il nodo in condizione di non refrattarietà e si crea un circolo vizioso
che porta ad aritmia. Se impulso passa tramite questa via ci mette molto meno e per
questo si formano aritmie o aternativamente aritmie da rientro.
-
In caso di danno del tessuto in caso di blocco della conduzione si ha blocco
unidirezionale della conduzione dell’impulso. Siccome blocco è unidirezionale rientra e
si forma il circolo di aritmia che si può propagare in tutta l’area.
Quindi la classificazione delle aritme è vasta.
Esempi:
-
disfunzioni del nodo SA
-
ritmi ectopici prematuri
-
ritmi ectopici di di scappamento
-
disturbi di conduzione.
69
www.haikzarian.com
copyright © Haik Zarian
Farmaci delle aritmie
Abbiamo grosso modo 4 classi di farmaci che interagiscono tra di loro.
-
I classe: farmaci che bloccano i canali del Na+
-
II classe: antiadrenergici β (β bloccanti)
-
III classe: prolungano la durata del potenziale d’azione (bloccano i canali del K)
-
IV classe: bloccanti dei canali del Ca++ (Ca antagonisti).
Sulla base di questo abbiamo estrazione dei F registrati in Italia, cioè i F antiaritmici puri:
-
C01B antiaritmici classe I e III
-
C01BB; antiaritmici classe IB
-
ecc
Quelli più usati nella ULSS sia come prescirzioni che spesa e si vede che la lista si riduce a
3 molecole:
-
Propafenone (Ic)
-
Flecainide (IC)
-
Amiodarone (III).
A distinzione tra i due sessi, tra circa 40mila pazienti nei due sessi non vi è differenza: le
femmine sono leggermente di più e la patologia insorge precocemente e non c’è differenza
sensibile tra i due sessi. Grosso modo l’1% della popolazione assume questi farmaci.
Secondo la classificazione secondo Vaughan Williams, i farmaci antiaritmici vengono
suddivisi in tre classi
70
www.haikzarian.com
copyright © Haik Zarian
A seconda della loro attività di blocco del canale del Na.
Il canale è aperto maggiore è l’attività cardiaca. Maggiore l’attività aritmica e maggiore sarà
pertanto l’attività del farmaco stesso. Abbiamo poi i β bloccanti e bloccanti più specifici del
canale del K.
Antiaritmici di classe I
Vengono suddivisi in tre sottoclassi (IA, IB, IC), in base alla modalità e al grado di blocco
del canale di Na+ e a proprietà farmacodinamiche aggiuntive.
Si legano al canale del sodio quando questo è nella fase aperta o refrattaria, più frequente è
l’attivazione dei canali maggiore è il blocco prodotto.
Ia proprietà intermedie a Ib e Ic
Ib si dissociano rapidamente dal canale permettendo il successivo potenziale d’azione
quando il ritmo è normale ma bloccando i battiti prematuri
Ic si dissociano più lentamente dando un blocco più stazionario del potenziale d’azione
(poco efficaci nei battiti prematuri ma sopprimono le aritmie da rientro
Antiaritmici di classe Ia
Capostipite è la chinidina. Il farmaco da medio rallentamento della fase zero cioè
depolarizzazione rapida cioè ingresso Na+ nella cellula, allungamento del potenziale
d’azione, allungamento del periodo refrattario e lieve e effetto isotropo negativo. Però questo
viene nascosto dall’attività vago litica la quale a sua volta produce aumento frequenza
71
www.haikzarian.com
copyright © Haik Zarian
cardiaca aumento conduzione AV che è la causa della pro aritmogenicità della chinidina
stessa. C’è poi una attività α bloccante che da vasodilatazione per aumento attività
simpatica riflessa, aumento frequenza cardiaca e aumento velocità di conduzione AV.
Riassumendo:
Effetti elettrofisiologici diretti
-
Rallentamento fase 0 (depolarizzazione rapida)
-
Allungamento PdA
-
Allungamento Periodo Refrattario
-
Lieve eff. inotropo negativo
Effetti neurovegetativi
-
Vagolitica: ↑freq. cardiaca/ ↑ velocità conduzione AV (↑ rischio di flutter atriale, può
essere utile associare farmaci che diminuiscono la conduzione AV come β-bloccanti o
Ca-antagonisti);
-
Alfa bloccante: vasodilatazione / ↑ att. simpatica riflessa / ↑ freq. cardiaca/ ↑ velocità
di conduzione AV
Ci sono diverse forme farmaceutiche della chinidina: solfato,poliglutarato, cloridrato,
gluconato. Le dosi della chinidina solfato sono 300-600mg ogni 6h, steady state in 24-48h.
Indicazioni:
-
tachiaritmie sopra e ventricolari
-
cardioversione FA (associazione con digitalici)
-
profilassi recidive di FA (aumento mortalità vs placebo).
Effetti collaterali
Sono diversi e sono causa di sospensione terapia nel 30% dei pz trattati. Gli effetti
collaterali comprendono:
-
gastroenterici: diarrea
-
SNC (parestesie, confusione)
-
Ematologici (trombocitopenia, anemia emolitica)
-
Cardiaci (bradicardia, tachiaritme, torsioni di punta).
Altri antiaritmici della classe A comprendono:
-
procainamide: rispetto alla chinidina ha effetti simili inclusi quelli proaritmci e ha
minore durata d’azione (circa 4h)
72
www.haikzarian.com
-
copyright © Haik Zarian
diisopramide: rispetto alla chinidina ha maggior effetto inotropo negativo, maggior
effetto vago litico (possibilità di secchezza fauci, ritenzione urinaria, stipsi, glaucoma).
Viene usato principalmente nella cardiomiopatia ipertrofica.
Antiaritmici classe Ib
a) Lidocaina
Ha effetti elettrofisiologici diretti:
-
quelli assenti sulla fase 0 (depolarizzazione rapida)
-
diminuisce il PdA
-
diminuisce il periodo refrattario
-
non ha nessun effetto inotropo negativo.
Ha metabolismo epatico, somminsitrazione ev, bolo 1-2mg/kg (circa 100mg) ripetibile
oppure infusione di 1-4mg/min. Viene usata nelle tachiaritmie dell’infarto miocardio e
effetti collaterali sono a carico del SNC con vertigini parestesie, convulsioni e coma.
b) Mexiletina (e tocanamide)
Ha effetti simili alla lidocaina ma ha il vantaggio della somministrazione anche per os. Può
essere usato nelle tachiaritmie ventricolari e in associazione con F della classe I e III.
Ha effetti collaterali sul SNC simili alla lidocaina, a livello GI con nausea, pirosi vomito e
effetto proaritmico.
Antiaritmici di classe Ic
Farmaci di questa categoria comprendon:
-
propafenone
-
felicaide
Danno blocco efficace del canale del Na. Non danno variazioni significative del potenziale
d’azione e deprimono la contrattilità cardiaca in modo importante. Sono i più usati in
questa classe di farmaci.
Effetti elettrofisiologici e miocardici:
-
diminuiscono la velocità di depolarizzazione rapida;
-
aumentano la durata del potenziale d’azione
-
aumentano il periodo refrattario effettivo
73
www.haikzarian.com
-
copyright © Haik Zarian
riducono la velocità di conduzione
hanno leggera attività β bloccante e Ca antagonista like.
Vengono usati sia nel trattamento acuto e dell’aritmia che nel trattamento cronico quindi
profilattico. Nelle aritmie cinetiche sopraventricolari, cardioversione nella FA, profilassi
delle recidive della fibrillazione striale. Per il propafenone il dosaggio è 150-300 mg die
mentre per via ev0,5-2mg/kg.
Effetti indesiderati:
-
bradicardia, blocchi AV, blocchi di branca
-
effetto proaritmico
-
insufficienza cardiaca.
Come tutti hanno effetto collaterale la proaritmogenicità che è insito nel meccanismo
stesso del farmaco.
Antiaritmici di classe II (β bloccanti)
Gli antiaritmici della classe seconda hanno effetto antiaritmico grazie all’antagonismo della
noradrenalina sui recettori β 1 e dei nodi SA e soprattutto AV. Ciò si realizza per blocco dei
canali del Ca++ (antagonismo simpatico).
Da un punto di vista neurofisiologico vi è immodificata la velocità di depolarizzazione,
mentre si ha aumento della durata del PdA e durata del periodo refrattario. Si ha inoltre
diminuzione della contrattilità.
Indicazioni:
-
tacharitmie sopra e ventricolari causate soprattuttoda iperattività adrenergica
post infarto.
Sotalolo
Lo possiamo trovare nella classe II e III in quanto sì ha azione sia β bloccante che blocco
canali del K nella ripolarizzaizoene. Quindi abbiamo azione beta bloccante (L-sotalolo) +
azione tipo antiaritmico tipo III (L- e D-sotalolo).
Effetti:
-
vi è quasi nulla alterazione della velocità di depolarizzazione;
74
www.haikzarian.com
copyright © Haik Zarian
-
aumento della velocità di depolarizzazione
-
aumento del periodo refrattario (tipico degli antiaritmici della classe terza);
-
riduzione contrattilità ed effetto β bloccante.
Il sotalolo viene usato per trattamento acuto e cronico, nelle aritmie ipercinetiche sopra e
ventricolari, profilassi e recidiva di FA.
Gli effetti indesiderati comprendono bradicardia, effetto proaritmico ed insufficienza
cardiaca.
Antiaritmici di classe III (bloccanti dei canali K)
Comprendono amiodarone e ibutilide. Amidarone ha anche effetti di classe:
-
I (inibizione dei canali di Na+, in conformazione inattiva);
-
II (è antiadrenergico β, oltre che α)
-
IV (è Ca2+-antagonista): probabilmente per un’azione sulla componente lipidica della
membrana dei miociti, con alterazione della funzione di canali diversi.
L’amiodarone come classe III ha effetto β bloccante oltre che α bloccante e anche effetto Ca
antagonista.
Gli effetti elettrofisiologici e miocardici comprendono:
-
Scarsa diminuzione della velocità di depolarizzazione
-
aumento della durata de PdA
-
aumento durata periodo refrattario
-
diminuzione velocità di conduzione
Effetti emodinamici
-
debolezze azione inotropa negativa
-
lieve azione vasodilatante sistemica.
L’amiodarone è mediamente biodisponibile e l’inizio della comparsa è protratto nel tempo.
L’inizio della comparsa degli effetti di tipo beta bloccante è calcolato introno a 5-10gg
mentre l’efficacia antiaritmica si manifesta a 5-6 settimane dall’inizio della terapia. Il
metabolismo è a livello epatico e il metabolita è ancora attivo e qui si spiega effetto
protratto nel tempo. Si accumula in polmoni, fegato, tessuto adiposo, cute, cornea. Viene
rintracciato nel sangue fino a 120 giorni per cessione a tessuti poco irrorati. La
concentrazione miocardica = 10-50 volte quella plasmatica senza rapporti precisi tra di
loro.
75
www.haikzarian.com
copyright © Haik Zarian
Si somministra per via os con riduzione progressiva della quanittà di farmaco. Nella prima
settimana 400 mg x3die fin a 200mg 2-3die. Per via ev la posologia è 2,5-10mg7kg.
Indicazioni:
-
tutte le tachiaritmie sopra e ventricolari (cardioversione e profilassi delle recidive);
-
prevenzione della morte improvvisa (effetto antifibrillatorio), cardiomiopatia ipertrofica
ostruttiva, postinfarto;
-
cardiomiopatia dilatativa.
Gli effetti collaterali sono dose dipendenti e fino a 300mg/die non c’è ne sono di evidenti
se non fibrosi polmonare che è rara. Altri effetti collaterali comprendono epatoptie, rush
cutanei, microdepositi corneali, iper o ipo tiroidismo. Questo probabilmente perché la
secrezione degli ormoni tiroidei altro:
-
disturbi GI
-
bradicardia
-
tachiaritmie (eff pro aritmico raro)
Antiaritimici di classe IV
Sono i Ca antagonisti. I più usati sono il verapamile e diltiazem. L’effetto antiaritmico è il
risultato dell’azione sui canali di Ca2+ dei nodi SA e AV:
-
rallentamento della velocità di conduzione (per rallentamento della fase 0)
-
aumento della durata del periodo refrattario effettivo (per prolungamento della fase di
ripolarizzazione).
Sono efficaci nella aritmie da rientro in cui il nodo AV è parte del circuito di rientro, perciò
si usano soprattutto nelle tachicardie parossistiche sopraventricolari.
Il verapamil (> diltiazem) bloccano l’ingresso di Ca a livello dei nodi SA e AV ed in cellule
muscolari lisce di tessuti extravascolari. Solo il verapamil è indicato nelle aritmie
sopraventricolari in alternativa ai beta bloccanti.
76
www.haikzarian.com
copyright © Haik Zarian
Adenosina
Non è classificata come antiaritmico nel sistema di Vaughn-Williams ma ha attività
antiaritimica in quanto provoca iperpolarizzazione della membrana agendo sui canali del K
e dando rallentamento della velocità di depolarizzazione pacemaker.
Altri effetti cardiovascoalri:
-
inibizione canali Ca tipo L
-
vasodilatzien coronarica
-
calo frequenza e contrazione cariacia
-
inibizione conduzione AV
-
inibizione rilascio catecolamine.
Viene usato nelle aritmie sopraventricolari in somministrazione ev in 3 mg: ha emivita
molto breve, di 1-3 sec e poi viene metabolizzata rapidamente.
Effetti collaterali:
- vasodilatazione cutanea
- è controindicata nel blocco AV e nell’asma bronchiale.
FARMACOLOGIA DELL’EMOSTASI E DELLA TROMBOSI
Generalità
L’emostasi è un processo complesso e viene controllato da:
1) Parete dei vasi (cellule endoteliali): in condizioni normali l’endotelio possiede proprietà
anti-piastriniche, anticoagulanti e fibrinolitiche ma, dopo attivazione, anche procoagulanti, l’equilibrio fra tali attività è critico nel determinare se un trombo si formerà, si
propagherà o verrà dissolto. In condizioni normali l’endotelio ha caratteristiche tali che non
fanno aderire le piastrine (non attivate) e impediscono a queste di interagire con la
sottostante matrice extracellulare (ECM) altamente trombogena.
Proprietà anti-trombotiche:
-
Inibizione della aggregazione piastrinica: comprende la produzione di prostaciclina
(PGI2) e di NO potenti vasodilatatori (piastrine spazzate via) e inibitori della
aggregazione piastrinica. Esistono inoltre delle ADP-asi endoteliali convertono ADP
(potente aggregante) prodotto dalle piastrine in nucleotidi adenilici inibitori della
aggregazione piastrinica;
-
Inibizione della coagulazione: la trombina è catturata dalla trombomodulina e il
complesso risultante attiva la proteina C del plasma che è anticoagulante. Esistono
77
www.haikzarian.com
copyright © Haik Zarian
inoltre molecole eparino-simili che agiscono con antitrombina III per inattivare
numerosi componenti della cascata della coagulazione (trombina);
-
Proprietà fibrinolitiche: secerezione dell’attivatore tissutale del plasminogeno (tPA) e
urochinasi, due attivatori del plasminogeno.
Proprietà pro trombotiche:
-
Induzione della aggregazione e adesione piastrinica: produzione del fattore di von
Willebrand che permette alle piastrine di aderire al sottoendotelio. Altro meccanismo è
la produzione di PAF;
-
Stimolazione della coagulazione: espressione del fattore tissutale della coagulazione
(tromboplastina) sulle cellule endoteliali a seguito di stimolazione con citochine o
endotossine. I fattori V, IX e X si legano alla superficie endoteliale;
-
Inibizione della fibrinolisi: produzione dell’inibitore dell’attivatore del plasminogeno
(PAi) che favorisce accumulo di fibrina
L‘emostasi può essere distinta in 4 punti:
1) Fase vascolare: ad un insulto della parte vascolare abbiamo contrazione della
muscolatura vasale e vasocostrizione periferica. La fase vascolare comprende:
-
Vasocostrizione
-
Risposta diretta delle cellule muscolari in risposta al trauma
-
Riflesso neurovegetativo
-
Liberazione locale di sostanze vasocostrittrici (endotelina, serotonina)
2) Fase piastrina: comporta la formazione del tappo piastrinico che avviene mediante
adesione, cambiamento di forma, de granulazione, aggregazione. La fase piastrinica
comprende diverse sequenze:
-
la lesione espone il sottoendotelio (collagene, proteoglicani, fibronectina);
-
adesione delle piastrine tramite integrine e stabilizzazione dell’adesione tramite fattore
di von Willebrand (vWF)
-
Cambiamento conformazione discoide → sfera spinosa dovuto alla polimerizzazione
ATP-dipendente dell’actina, aumento di Ca++ e liberazione del contenuto dei granuli
(ADP, serotonina, fibrinogeno, trombina), esternalizzazione di fosfatidilserina (PF3),
attivazione di fosfolipasi C (IP3→Ca++) e fosfolipasi A2 (→trombossano);
-
Aggregazione delle piastrine che è maggiormente stimolata da trombossano. Vi è inoltre
ssposizione di recettori per fibrinogeno e formazione di ponti.
78
www.haikzarian.com
copyright © Haik Zarian
3) Fase coagulativa: consiste nella formazione del coagulo di fibrina e nella cascata delle
reazioni enzimatiche. La fase coagulativa comprende due sistemi:
-
sistema intrinseco: contatto con superfici con cariche negative in assenza di fattori
intracellulari. La via intrinseca viene valutata con il tempo di tromboplastina che è il
tempo necessario per la coagulazione dopo contatto con una superficie standard
(caolino). Il tempo normale è di 30-50sec;
-
sistema estrinseco: lesione tissutale e fattori intracellulari. La via estrinseca viene
valutata con i tempo di protrombina che è il tempo necessario per la coagulazione dopo
esposizione a un fattore tissutale standard (cefalina). Il tempo normale è di circa 10-15
sec e prevede attivazione di zimogeni. Poi c’è la via comune che viene calcolata con il
tempo di trombina.
Entrambi i sistemi terminano in una via finale comune che è l’attivazione del fattore X
(Stuart) che porta alla conversione della protrombina in trombina la quale a sua volta
converte il fibrinogeno (solubile) in fibrina (insolubile). Test clinico utile per questa via è il
tempo di trombina che è il tempo necessario per la coagulazione dopo contatto con la
trombina (tempo normale di 10-15sec).
Pertanto la distinzione tra il sistema intrinseco ed estrinseco è solo una distinzione storica.
Tutti i fattori presenti nel plasma in forma inattiva (proenzimi o zimogeni), attivi a cascata
sono indicati con numeri romani in ordine di scoperta.
Vitamina K
La vitamina K è un composto liposolubile e non passa attraverso la placenta. È un
coattivatore importante nella coagulazione; nello specifico la vit.K è importante per la
carbossilazione di glutammato e carbossigluttamato in molti dei fattori della coagulazione
(incluso trombina II, VII e IX e X).
Abbiamo vari tipi di vit K:
-
K1: vegetali verdi
-
K2: deriva da K1 ad opera di batteri intestinali
-
K3 o menadione: preparato industriale.
Farmaci che antagonizzano la vit K sono la warfarina e dicumarolo. La vit K è necessaria
per la carbossilazione del glutammato (Glu) a carbossiglutammato (Gla) in molti dei fattori
della coagulazione (incluso trombina, II, VII, IX e X).
I deficit di vit K (rari), associati al malassorbimento dei grassi:
79
www.haikzarian.com
-
Infanti sottoalimentati
-
Ittero ostruttivo
-
Lunghe cure antibiotiche
copyright © Haik Zarian
4) Fase fibrinolitica: lo scopo di questa fase è la dissoluzione del reticolo di fibrina
formatosi in conseguenza della coagulazione del sangue. La fibrinolisi ha lo scopo di
mantenere l’integrità del coagulo per il tempo strettamente necessario all’arresto
dell’emorragia e di impedire altresì la formazione di trombi intravascolari che si può
verificare per attivazione spontanea della coagulazione. La fibrinolisi inizia con la
conversione del plasminogeno in plasmina per opera degli attivatori del plasminogeno, i più
noti fra i quali sono l’urochinasi, tPA, varie sostanze di origine tessutale e vascolare
(liberate in seguito a esercizio fisico, ipoglicemia, shock ipovolemico) e una sostanza di
origine batterica, la streptochinasi. La plasmina è un enzima proteolitico capace di scindere
la fibrina e il fibrinogeno (formando i cosiddetti FDP), i fattori V e VIII. La sua liberazione
incontrollata avrebbe effetti disastrosi se non esistessero in circolo gli inibitori della
plasmina, cioè sostanze in grado di neutralizzarla. Esistono condizioni caratterizzate da un
aumento della fibrinolisi: coagulazione intravascolare disseminata (in sigla, CID),
carcinoma della prostata, della mammella e del pancreas, leucemie acute, interventi
chirurgici sul cuore in circolazione extracorporea. In terapia gli attivatori del plasminogeno
(soprattutto l’urochinasi) sono molto usati come agenti trombolitici nell’infarto miocardico,
nell’embolia polmonare, nella trombosi venosa.
La fibrinolisi viene inibita dalla α2-antiplasmina. I farmaci fibrinolitici (infarto del
miocardio) comprendono:
-
tPA ricombinante
-
Streptokinasi
-
Urokinasi.
Fattori di rischio alla base della trombogenesi
Sono riassunti dalla triade di Virchow:
-
danno vascolare: dovuto a trauma accidentale, chirurgico
-
stasi venosa: piccoli trombi non lavati via dal flusso, aumento delal viscosità,
immobilizzazione;
-
ipercoagulabilità del sangue: incremento dell’attività del fibrinogeno, fattori della
coagulazione, diminuzione degli inibitori della coagulazione, deficit della fibrinolisi.
FARMACI ANTITROMBOTICI
80
www.haikzarian.com
copyright © Haik Zarian
I farmaci che hanno attività anti coagulante possono esser raggruppati a seconda dei tempi
visti precedentemente nella coagulazione con formazione del trombo e F antiaggreganti che
inibiscono aggregazione piastrinica. I farmaci anticoagulanti sono in grado di inibire la
formazione del trombo. Ci sono poi i farmaci fibrinolitici con dissoluzione della fibrina.
Hanno come classificazione ATC B01 e sono classificati con ordine strano:
-
B01AA: antitrombotici
-
B01AA03: warfarin
-
B01Ab01: eparina-
Abbiamo poi antiaggreganti piastrinici esclusi l’eparina quindi una serie di farmaci che
vanno ad inibire la fosfolipasi A2. Esistono anche farmaci che sono una miscellanea
inibitori del recettore del trombossano, inibitori dei purinegici, inibitori della trombina o
recettore per la fibrina.
Ci sono poi i farmaci detti enzimi cioè i fibrinolitici come streptochinasi, neurochinasi,
farmaci ricombinanti. Quelli indicati con il simbolo H sono farmaci ospedalieri e C vuol
dire che non vengono rimborsati.
Gli enzimi sono tutti i fascia H oppure in fascia C, non c’è nessuno in fascia A. gli
antitrombotici nel 2007 usati nella ULSS 9 tv sono:
-
enoxaparina
-
acido acetilsalicilico
-
nodroparina
-
reviparina
-
warfarin.
In una terapia antittrombotica la prima cosa è prevenire e in caso di rischio trombotico la
cosa migliore è ridurre
fattori di rischio che sono diversi: ipertensione, sedentarietà,
aritmie cardiache. I farmaci che vengono usati nella terapia antitrombotica sono inibitori
dell’aggregazione piastrinica, farmaci che inibiscono la generazione della trombina e quindi
la formazione della fibrina cioè anticoagulanti e infine come ultima ratio i farmaci
fibrinolitici e dobbiamo risolvere nel più breve tempo possibile. Le indicazioni per iniziare
terapia antitrombotica sono la tromboembolia venosa cioè TEV (trombosi venosa profonda,
embolia polmonare e profilassi delle due) poi:
-
tromboembolia arteriosa per protesi di valvole cardiache, alterazione valvole cardiache
(fibrillazione atriale), cardiomiopatia congestizia, fibrillazione atriale, attacchi ischemici
transitori, infarti in evoluzione.
81
www.haikzarian.com
copyright © Haik Zarian
Riassumendo quindi le indicazioni per la terapia antitrombotica sono numerose:
a)Tromboembolia venosa
- trombosi venosa profonda (DVT)
- embolia polmonare (PE)
- profilassi primaria di DVT o PE
b) Tromboembolia arteriosa
- protesi valvole cardiache
- alterazione funzionalità valvola mitrale, specialmente con fibrillazione atriale
- cardiomiopatia congestizia, specialmente con fibrillazione atriale
- fibrillazione atriale
- attacchi ischemici transitori
- infarto in evoluzione
c) Coagulazione disseminata intravasculare
d) Mantenimento della pervietà di trapianto vascolare, bypass
1. Farmaci antiaggreganti
Sono farmaci che inibiscono la formazione del trombo. Sul trombo una volta create le
condizioni affinché questo venga attivato vanno ad agire tutta una serie di fattori o
molecole che contribuiscono alla aggregazione piastrinica, tra queste quelle di maggior
rilievo sono l’ADP e trombossano ma anche fattore Von Willebrand con formazione di ponti
tra le varie piastrine. Importante è il fibrinogeno gli attivatori del fibrinogeno.
Classificazione degli antiaggregati:
-
farmaci che aumentano la concentrazione intrapiastrinica di cAMP come
dipridamolo, prostacicilina (e analoghi di sintesi), PGE1;
-
inibitori del metabolismo dell’acido arachidonico: inibitori della ciclossigenasi, ac.
acetilsalicilico,
idobufene (e altri anti-infiammatori non steroidei), inibitori della
trombossano-sintetasi.
-
inibitori recettori per l’ADP: ticlopedina e clopidrogel
-
inibitori recettori per il fibrinogeno: anticorpi anti GP IIb-IIIa (Abciximab),
eptifibatide, tirofiban;
-
inibitori dei recettori per il trombossano: picotamide.
82
www.haikzarian.com
copyright © Haik Zarian
Tienopiridine
Sono la ticlopidina e cloropidogrel che bloccando i recettori purinergici interagiscono con
attivazione del recettore per il fibrinogeno.
Di purinocettori c’è ne sono diversi, almeno 7-8. Essenzialmente sono i P2x e Pry. Il P2Y1
accoppiato ad una Gq protein da un aumento Ca intracellulare il quale è in grado di
attivare la piastrina e anche promuovere attivazione recettori per fibrinogeno oltre che
favorire produzione trombossano A2. Il P2t o P2y12 è in grado di dare calo cAMP con
attivazione diretta dei recettori per il fibrinogeno e produzione trombossano.
Farmacocinetica delle tienopiridine
Vengono assorbite per os, è rapido, prese a qls ora del giorno, metabolismo epatico, t1/2 di
8h e hanno attività irreversibile sulle piastrine. Escrezione urinaria e fecale per il clopidogel
la dose è 75mg/die e per la ticlopidina 250mg/due volte al giorno.
Reazioni avverse
Nausea, vomito diarrea, neutropenia, trombcitopenia (abb grave). È chiesta la conta
leucocitaria, è importante la trombocitopenia. Clopidogrel ha un profilo di tossicità
leggermente migliore.
Indicazioni cliniche
Ticlopidina:
-
prevenzione secondaria di eventi ischemici occlusivi cerebro e cardiovascolari in
pazienti a rischio trombotico;
-
pz affetti da infarto al miocardio e attacchi ischemici in pazienti che non tollerano
l’ASA;
-
prevenzione della riocclusione dei bypass aortocoronarici
Clopidogrel (piano terapeutico h-t):
-
pz affetti da infarto al miocardio
-
ictus ischemico in associazione con ASA
-
arteriopatia obliterante in associazione con ASA
-
sindrome coronarica acuta in associazione con ASA.
83
www.haikzarian.com
copyright © Haik Zarian
Farmaci che bloccano recettore per fibrinogeno
I recettori per fibrinogeno normalmente sono in uno stato non recettivo. L’azione di ADP
trombina, collagene ecc, questi recettori vengono attivati e cercano il fibrinogeno che forma
ponti per stabilizzare il trombo piastrinico. Questi farmaci bloccano questi recettori
impedendo la formazione dell’aggregazione trombo piastrinico. Sono degli Ab, quelli che
vengono usati sono gli ximab che sono Ab ricombinanti monoclonali.
L’Abciximab (mAb chimerico) è stato sviluppato e approvato come trattamento efficace per
la prevenzione delle trombosi a seguito della rottura della placca o di interventi di chirurgia
vascolare in pz ad alto rischio. Il bersaglio è rappresentato dai recettori piastrini α2,6β3/αv,β3
(integrine).
Oltre alla abciximab gli Ab che bloccano i recettori per la fibrina sono:
-
tirofibam: analogo non peptidico della tirosina indicato in pz ad alto rischio di infarto,
interventi di angioplastica e stent coronarico in associazione con ASA ed eparina non
frazionata;
-
eptifibatoide: peptide ciclico, indicato come sopra in pz ad alto rischio di infarto
-
lamifiban: non peptide, è indicato nella fase III.
Effetti collaterali
Aumento rischio sanguinamento e trombocitopenia.
Controindicazioni
Tutti quelli stati in cui rischio di sanguinamento, traumi, interventi oppure disfunzioni su
sistema della coagulazione.
2. Anticoagulanti
Sono una classe di farmaci in grado di inibire o comunque ritardare le reazioni coagulative
che portano alla formazione di trombina. Questo concetto può essere probabilmente
ampliato con l’introduzione in commercio dell’irudina che è uno specifico inibitore della
trombina. Attualmente nella categoria di farmaci anticoagulanti rientrano l’eparina e le
eparine a basso peso molecolare (quindi tutti gli eparinoidi), da questa derivate, e i
cumadinici (dicumarolici). Recentemente è stato introdotto in commercio il fondaparinux
sodico e sono in avanzata fase di studio alcuni inibitori diretti della trombina
(ximelegatran).
84
www.haikzarian.com
copyright © Haik Zarian
I processi di attivazione della trombina che porta all’attivazione del fibrinogeno: ci sono
tutta una serie di fattori intrinseci e non e quindi antagonisti vit K e dopo 2 grossi punti
d’azione di questi farmaci cioè quelli che bloccano le attività del fattore X come eparina
frazionata a basso PM o pentasaccaridi o F che legano antitrombina bloccando attività
trombina oltre inibitori diretti della trombina.
Ci accaniamo tanto contro la trombina in quanto la trombina ha diverse azioni:
-
converte il fibrinogeno in fibrina formando il tappo rosso
-
stimola aggregazione piastrinica
-
stimola espressione di molecole adesive sulle piastrine
-
ha azione mitogena diretta e indiretta e da azione anticoagulante.
a) Eparina non frazionata
L’eparina non frazionata è un mucopolisaccaride costituito da molecole alternate di acido
uronico
e D-glucosamina. Si estrae dalla mucosa intestinale di maiale o cavallo e dal
polmonare di bue ed è una miscela di frammenti (da 5000 a 30000 dalton). È presente
sotto sale sodico e calcico e non essendo stabilizzato per valutarne l’attività si usano UI
(1UI) 1mg eparina contiene 130-170 UI. 1 UI è la quantità che previene il coagulo di 1 ml di
plasma di pecora per 1h dopo aggiunta di 0,2ml di CaCl2 1%.
b) Eparina frazionata
È una miscela eterogenea di glicosaminoglicani a PM fra 3000 e 30000Da;
-
si lega ai macrofagi, cell endoteliali
-
cinetica mista di eliminazione
-
emivita dose dipendente
-
non passa barriera placentare
-
indispensabile il monitoraggio terapeutico con test di laboratorio (aPTT).
Eparina a basso PM
Sono glicosaminoglicani prodotti per la degradazione chimica o enzimatica da ENF con PM
compreso fra 1000 e 10000Da. Hanno minor legame con le proteine plasmatiche e cellule.
Possono essere somministrate a dosi prefissate, senza necessità di laboratorio eccetto che
per i pz con insufficienza renale e sovrappeso. La cinetica di eliminazione è quasi
esclusivamente renale (emivita 6h9 e la biodisponibilità dopo somministrazione sc 80-90%.
Non passano la barriera placentare.
Le proprietà anticoagulanti dell’eparina sono dovute a diveri fattori:
85
www.haikzarian.com
-
copyright © Haik Zarian
l’ eparina si lega all’antitrombina e forma un complesso bloccando l’attività della
trombina e questo succede in quanto l’eparina ha struttura allungata e coinvolge
anche la trombina ma è in grado di legarsi al fattore X e formare un legame tra
antritrombina eparina e fattore X.
-
inibisce aggregazione della trombina
-
inibisce attivazione dell’enzima stabilizzante la fibrina
-
inibisce attivazione dei fattori XII, XI, X e II.
Tute le eparine con PM <5400 non legano trombina e antitrombina e quindi agiscono
solamente sul fattore X.
Da tenere presente che l’eparina non frazionata ha diversi limiti:
-
ha variabilità alla risposta anticoagulante
-
emivita breve
-
necessita
monitoraggio
terapia
(fare
frequenti
determinazioni
tempo
come
la
prototrombina parziale attivata aPTT).
Vi sono inoltre diversi effetti avversi
-
sanguinamenti
-
trombocitopenia eparino indotta.
-
Osteoporosi.
È una terapia difficile da condurre a casa, meglio ospedale.
Caratteristiche farmacologche eparina basso PM
-
effetto anticoagulante correlato alla dose e quindi più stabile effeftto!
-
hanno emivita più lunga, sono ore piuttosto che mezz’ora e non necessità
monitoraggio, vedi pz obesi, renali dove si dosa efficacia e la concentrazione;
-
hanno minori effetti collaterali e si usano anche al di fuori ambiente ospedaliero.
Le eparine a basso PM sono:
-
bemiparina
-
reviparina
-
pamaparina
86
www.haikzarian.com
-
enoxaparina
-
nadroparina
-
dalteparina
-
ENF
copyright © Haik Zarian
L’affinità e la capacità d legarsi e inattivare il fattore X aumenta al diminuire del PM.
L’emivita va dalle 2-6h mentre la eparina frazionata ha t1/2 di 1,5h. L’eliminazione è mista e
renale per quelle a basso PM.
L’efficacia è abbastanza simile e i vantaggi dell’eparina a basso PM è che ha un effetto
anticoagulante stabile e prevedibile, è facile da somministrare, non sono necessari (con i
limiti) monitorare il tempo di tromboplastina, ha una migliore sicurezza, ed è possibile un
trattamento a lungo termine anche a domicilio.
Ci sono alcune situazioni nelle quali si rende necessario il dosaggio dell’eparina a basso
PM:
-
donne gravide, neonati, obesi, pz in insufficienza renale;
-
le eparina a basso PM ad alto dosaggio si associa ad aumento del rischio emorragico;
-
pz ad alto rischio trombotico.
Indicazioni all’uso delle eparine
-
profilassi chirurgia generale e ginecologica
-
profilassi in chirurgia ortopedico
-
profilassi chirurgia/fratture arti inferiori
-
trattamento fase acuta del TEV
-
profilassi secondaria del TEV nei pz oncologici
-
profilassi nei pz medici ad alto rischio
-
infarto miocardio acuto
-
sindrome coronarica acuta non Q e angina instabile.
Effetti collaterali
-
emorragie
-
piastrinopenia (HIT): 3,5% dei pz trattati in pz con eparina non farinata e 0,6 per
eparina a basso PM
-
osteoporosi
Controindicazioni
-
emorragia cerebrale o subaracnoidea
87
www.haikzarian.com
copyright © Haik Zarian
-
sanguinamento toracico, addominale, trauma severo
-
recenti interventi (biopsia fegato o rene, cerebrospinali o oculistica)
-
importanti difetti emostatici
-
trombocitopenia: la trombocitopenia indotta da eparina (HIT) è uno ststo di
ipercoagulabilità con aumentata produzione di trombina ed attivazione pisatrinica, per
la formazione di complessi immuni tra Abs e PF4-eparina. Compare nella seconda
settimana post-intervento nel 3% dei pz; posrta a IMA, eventi cerebrovascolari, morte.
Il 50% dei pz sotoposti a cardiochirurgia sviluppa AB anti eparina ed è necessario
interrompere la somministrazione di eparina. Meno frequente è in corso di terapia con
eparine a basso PM. Per quanto concernte il trattamento della HIT si raccomanda l’uso
dell’eparinoide danaparoid e l’uso di un inibitore diretto della trombina come il
lepirudin (irudina ricombinante).
In caso di sovradosaggio di eparina l’antidoto è la portamina solfato. (0,6ml di protamina
solfato neutralizzato circa 0,1ml di nadroparina). Per la quantità di protamina da iniettare
tenere conto del tempo trascorso dall’iniezione di eparina ed effettuare quindi un’eventuale
riduzione della dose dell’antidoto.
FARMACI ANTICOAGULANTI ORALI
Generalità
sono farmaci che agiscono sulla vit K che è un cofattore che determina attivazione dei
fattori VII-IX e X. A questo livello agiscono gli anticoagulanti orali. Succede che
normalmente la vit K in forma inattiva viene attivata e trasformata nella forma ridotta
attiva dalla NAD e solamente nella forme ridotta provoca carbossilazione dei residui di
glutammato dei vari fattori. I due gruppi carbossilici formano..
e hanno la funzione di
bloccare l’ox del NAD e il processo della attivazione della vit K.
I farmaci anticoagulanti orali sono:
-
dicumarolo
-
warfarina
-
acenocumarolo
-
idrossicumarina
-
anisidione
La terapia orale è una brutta bestia
in quanto la variabilità individuale e le numerose
interferenze che modificano gli effetti della terapia con AO rendono necessario un attento
monitoraggio di laboratorio che avviene mediante la valutazione del tempo di protrombina
88
www.haikzarian.com
copyright © Haik Zarian
(PT) espresso in INR. Il tempo di protrombina è sensibilie all’attività dei fattori della via
estrinseca (VII) e della via comune (II, V, X e fibrinogeno). L’impiego diagnostico della PT ci
permette di:
-
identificare carenze congenite dei fattori coagulativi della via estrinseca (II, V, VII e X)
-
identificare carenze acquisiste (danno epatico, CID)
-
monitoraggio della terapia con anticoagulanti orali.
Nello specifico:
-
INR 3,5: trattamento trombosi venose ed embolie polmonari ricorrenti, protesi valvolari
meccaniche;
-
INR 2,5: trattamento trombosi venosa profonda, embolia polmonare, fibrillazione
atriale, cardioversione, cardiomiopatia dilatativa, trombo murale post-IMA, valvulopatia
mitralica e reumatica;
-
INR 2-2,5: profilassi trombosi venosa profonda.
Normalmente INR è uguale ad 1. Nel pz che non è anticoagulato è uguale ad 1 e quando si
allunga, in caso di somministrazione di anticoagulanti si indica in INR (quante volte
auementato tempo protrombina rispetto al normale). A seconda tipologia del pz è
necessario avere un tempo di protrombina più o meno.
I principali anticoagulanti orali sono la warfarina che viene assunto per os, ha tempo di
azione nel giro di alcuni giorni, emivta 36-48h. dosaggio 5mg/die eper poi regolarsi
sull’INR. Si ha scompenso emorragico nel 5% dei casi. È teratogeno e non usato nel primo
trimestre di gravidanza.
Effetti collaterali
-
orticaria
-
alopecia
-
teratogeno
-
necrosi cutanea.
Nuovi antitrombotici (bloccanti la trombina)
Hanno la stessa attività dell’eparina a basso PM. Sono detti pentasaccaridi che hanno
meccanismo d’azione della eparina a basso PM, si legano trombina e fattore X. Sono la
idraparinux e la fondaparinux, hanno PM più basso delle eparine a basso PM. Sono
biodisponibili al 100% per via sottocutanea. Picco di concentrazione max in 1-3h e hanno
89
www.haikzarian.com
copyright © Haik Zarian
emivita molto elevato (130h e 17h). Non legano l’endotelio, piastrine proteine plasmatiche.
L’escrezione è urinaria, la farmacocinetica è lineare cioè dose dipendente e il picco di
concentrazione Cmax si raggiunge in 1-3h. Questi penta saccaridi inoltre non si legano in
modo significativo ne a proteine plasmatiche, ne all’endotelio ne alle piastrine.
Il fondaparinux è stato approvato dalla Food and Drug Administration (FDA) per la
profilassi antitrombinica in pz sottoposti a chirurgia ortopedica e nel trattamento iniziale
del TEV in alternativa alle eparine. In Italia il fondaparinux è registrato solo per la
profilassi del TEV nei pz che devono essere sottoposti a interventi di chirurgia ortopedica
degli arti inferiori.
Inibitori diretti della trombina
Agisco sui siti catalitici (argatran e melagatran) e irudina sia sito substrato
che
riconoscimento del substrato.
Fibrinolisi e farmaci correlati
Il plasminogeno quando viene attivato a plasmina è responsabile della disgregazione del
trombo (il plasminogeno può essere anche circolante). Molecole come α 2antitripsina
bloccano attivazione del plasminogeno. Invece ci sono dei fattori che attivano il
plasminogeno, come attivatore tissutale del plasminogeno, callicreina e fattore XII e quindi
la disgregazione del coagulo è mediata da questi fattori che promuovono la disgregazione e
la stabilizzazione del coagulo. In tutto ciò si inseriscono i farmaci responsabili
dell’attivazione del plasminogeno.
Attivazione esogena:
-
streptochinasi
-
urochinasi
-
rt-PA
Attivazione endogena
-
FXIIa
-
Callicreina
-
Pro-urochinasi
-
tPA
come detto prima ci sono diversi tipi di plasminogeno: plasminogeno circolante oppure
incorporato nel trombo fibrinico. I farmaci possono agire su tutte e due i plasminogeni
oppure, come gli tr-PA solamente sui plasmonogeni del tappo fibrinico. Attività diq eusti f
90
www.haikzarian.com
copyright © Haik Zarian
da trombolisi o degradazione fibrinogeno. Le streptochiansi agiscnono su entrambi i
plaminogeni mentre la rt-PA come detto solamente sul plasminogeno inserito nella fibrina.
Farmacocinetica
Streptochinasi e urchinasi e rt-PA hanno eliminazione epatica. La streptochinasi è il
farmaco che costa meno, mentre urochinasi e rt-PA sono molto costose.
Diversi trial clinici hanno dimostrato come la precoce risoluzione di un trombo con
fibrinolitici da risultati positivi in termini di sopravvivenza del pz, va considerato però il
rischio potenziale della streptochinasi nelle reazioni allergiche. Vantaggi delle strepto:
reazioni allergiche, ipotensione.
Farmaco
Vantaggi
Svantaggi
Tempo
Dose
Costo
1,5
500 $
somm
STREPTOCHINASI
Provata
riduzione
Antigenico
1 ora
della mortalità
Reazioni
milio
Poco costoso
allergiche
ni di
Aspirina
Ipotensione
unità
aumenta
attività
Grave
sanguinamento
infrequente
UROCHINASI
Non antigenico
Molto costoso
Grave
Necessita
sanguinamento
clinici
1,5 ore
dati
30
1500
milio
$
ni
infrequente
unità
Ri-trombosi rara
ALTEPLASI
Non antigenico
Necessita
RETEPLASE
Provata
clinici
TENECTEPLASE
della mortalità
(rt-PA)
riduzione
dati
Infusione lunga
Frequente
trombosi
91
ri-
3 ore
100
2200
mg
$
www.haikzarian.com
copyright © Haik Zarian
APSAC
Provata
Complesso
Antigenico
2-5
30
della mortalità
Reazioni
min
unità
Grave
allergiche
plasminogeno-
sanguinamento
Ipotensione
streptochinasi
infrequente
attivatore
acilato
riduzione
Ri-trombosi rara
Breve iniezione
La problematica della fibrinolisi è che trombo deve essere dissolto nel più breve tempo
possibile. Le urochinasi invece non sono antigeniche e ci sono rari casi di ritrombosi ma è
molto costoso e ci sono pochi dati clinci e devono essere completamente valutate. Viene
somministrata in 30 milioni di unità ed un trattamento costa 1500 dollari.
Controindicazioni
-
emorragie interne in atto o recenti (meno di 30gg)
-
malattie endocraniche o intraspinali (tumori ecc)
-
recenti tumori cranici
-
storia di ictus emorragici
-
recenti tumori cranici
-
piastrinopenia
-
ipertensione grave
-
disturbi della coagulazione
-
gravi piastrinopenie.
FARMACI IPOLIPEMIZZANTI
Generalità
Questi farmaci vengono ampiamente assunti, soprattutto quei farmaci che hanno come
target il colesterolo. L’ipertrigliceridemia infatti non è molto correlato a danni del sistema
cardiovascolare, mentre è il colesterolo che si presenta maggiormente dannoso.
Il fabbisogno di acidi grassi essenziali è diverso nei maschi e nelle femmine:
-
nei M è 4,5-6gr/die
-
femmine 1-1,5gr/die
92
www.haikzarian.com
copyright © Haik Zarian
Da tenere presente che sono necessari almeno 20 g di grassi per
trasportare le vitamine liposolubili.
Il contenuto di lipidi totale in un soggetto adulto normale è di circa 460-430mg in100mL di
plasma. Questi 460-430 sono così distribuiti:
-
triglicediridi: 100-170M e 80-130D
-
fosfolipidi: 200 (160-230M e 170-240D)
-
colesterolo libero30%
-
colesterolo esterificato 70%
-
acidi grassi liberi 70%
La quantità di lipoproteine presenti è:
-
chilomicroni: 100-250mg/100ml
-
VLDL: 130-200mg/100ml
-
LDL: 200-400mg/100ml
-
HDL: 50-130mg/100ml
Il colesterolo costituisce un componente fondamentale dell’organismo in quanto assolve
numerose funzioni:
-
sintesi membrana biologica di tutte le cellule
-
sintesi ormoni steroidei (gh. endocrine)
-
sintesi della Vit. D (pelle)
-
sintesi di acidi biliari
-
sintesi altre proteine cellular
Fonti di colesterolo:
-
dieta: apporto di circa 300-700mg die
-
secrezione bile: 100mg die. Transitano per il nostro intestino mediamente sui 15001700mg di colesterolo al l giorno.
L’assorbimento del colesterolo è un processo multistep:
-
il colesterolo viene dapprima emulsionato
-
trasferito dalle micelle verso le cellule dell’orletto a spazzola e quindi al reticolo
endoplasmatico
-
esterificazione (acilCaA a colesterolo-aciltransferasi ACAT)
-
incorporazione nei chilomicroni
-
secrezione dalla superficie basolaterale ed ingresso nel sistema linfatico.
93
www.haikzarian.com
copyright © Haik Zarian
La sintesi del colesterolo parte da una serie di componenti, acido grassi, acetoacetato e poi
grazie ad una serie di processi biochimici si forma colesterolo o colecalciferolo. Il colesterolo
per raggiungere diverse parti dell’organismo è necessario che venga veicolato attraverso le
lipoproteine plasmatiche. Il colesterolo e i trigliceridi sono insolubili in acqua e di
conseguenza, per consentirne il trasporto in circolo, vengono associati a proteine
denominate apolipoproteine. Questi complessi “carriers” vengono chiamati lipoproteine.
Sono complessi chimici costituiti da un nucleo lipidico idrofobo, contenente esteri del
colesterolo e trigliceridi, circondato da uno strato superficiale idrofilo composto da
fosfolipidi, proteine e colesterolo libero. Di lipoproteine esistono diversi tipi:
-
chilomicroni: sono le lipoproteine che compaiono in circolo a seguito di un pasto.
Trasportano i grassi esogeni (assunti con la dieta) dall’intestino tenue alle sedi di
utilizzo e di deposito;
-
VLDL: sono i principali carriers dei trigliceridi endogeni e del colesterolo epatico, che
trasportano alle sedi di impiego o di deposito.
-
IDL: sono i principali prodotti della degradazione delle VLDL.
-
LDL: generate dalle IDL, trasportano il 60-70% del colesterolo del sangue verso i
tessuti.
-
HDL: trasportano il 20-30% del colesterolo del sangue verso il fegato per l’escrezione.
Queste lipoproteine per poter interagire con i tessuti, devono presentare delle strutture che
sono le apolipoproteine che non sono altro che il contenuto proteico delle lipoproteine. I
livelli di ApoB sono utilizzati per stimare il numero di particelle LDL e l’incremento del
rischio CVD. Ci sono di diversi tipi ApoB: abbiamo all’interno colesterolo esterificato,
trigliceridi e fosfolipidi. Nella composizione delle lipoproteine variano le quantità dei vari
costituenti: variano le dimensioni, composizione e variano anche i quantitativi di recettori
presenti. L’ApoA-I – è la maggiore apolipoproteina presente nel C-HDL ed è collegata alla
riduzione del rischio CVD
Le funzioni delle apolipoproteine sono diverse:
-
facilitazione del trasporto dei lipidi nel sangue
-
attivazione di tre enzimi del metabolismo lipidico (lecitin colesterol aciltransferasi
(LCAT), lipoproteina lipasi (LPL) e trigliceride epatico lipasi (HTGL);
-
si legano ai recettori della superficie delle cellule
I chilomicroni compaiono dopo il pasto e trasportano grassi esogeni dall’intestino al fegato:
le VLDL in varie sedi come adipociti LDL invece sono ridotti dalle IDL, HDL invece
94
www.haikzarian.com
copyright © Haik Zarian
trasportano colesterolo al fegato. Le LDL presentano come apolipoproteina B sono usate
per stimare LDL e rischio cardiovascolare. L’ApoA-I è la maggiore apolipoproteina presente
nel C-HDL ed è collegata alla riduzione del rischio CVD.
Ridurre il colesterolo asmatico porta a riduzione significativa del rischio di eventi
coronarici.
Il processo aterosclerotico porta al danneggiamento delle cellule endoteliali. Con il
progredire della lesione, alcune cellule schiumose muoiono per apoptosi con la formazione
di un nucleo necrotico centrale che può andare incontro a rottura con conseguente
emorragia dalle micropareti della placca.
I segni clinici dell’arteriosclerosi comprendono:
-
angina
-
infarto
-
cardiopatia coronarica
-
patologie vasoclari periferiche.
Bisogna cercare di evitare di arrivare ai segni clinici di questa entità. Non è stato ancora
stabilito se le statine devono essere usati per la prevenzione primaria o secondaria.
Fattori predisponesti:
-
fattori non modificabili come età, sesso (maschi più esposti per la dislipidemia per
abitudini alimentari diverse dal sesso femminile ma anche per predisposzione genetica
familiare ecc)
-
fattori modificabili come dislipidemia, ipertensione arteriosa, diabete mellito, dieta
occidentale. Fumo.
La dieta è un fattore importante. Può fare male il consumo di alimenti con elevato
colesterolo, come anche il consumo di alcol e l’abitudine al fumo.
Da tenere presente che le placche aterosclerotiche si formano nei punti di turbolenza, come
nelle confluenze: arco aortico, biforcazione arterie renali, arterie carotidee e cerebrali. Sono
in genere i punti di maggior turbolenza.
Caratteristiche delle statine
Le statine costituiscono la classe di farmaci più prescritta al mondo. La loro funzione
principale è quella di abbassare i livelli di colesterolo e quindi prevenzione di delle patologie
cardiovascolari nei soggetti a rischio. Il meccanismo d’azione si basa sulla inibizione
dell’enzima 3-metil-glutarilCaA-reduttasi, coinvolto nella formazione dell’ac. mevalonico. Le
95
www.haikzarian.com
copyright © Haik Zarian
statine riducono anche il colesterolo circolante favorendo l’espressione dei recettori delle
LDL epatiche. Quindi oltre ad inibire la sintesi del colesterolo le statine riducono il
colesterolo circolante favorendo espressione delle LDL del colesterolo circolante stesso. Il
colesterolo come già visto da un punto di vista vascolare è dannoso. Nei processi di
eterogenesi è una delle molecole responsabili della formazione dell’ateroma. L’effetto
principale di questi farmaci è quella di diminuire il colesterolo legato a stimolazione del
riaptake delle LDL da parte dei recettori aumentando la clearance epatica. Le statine sono
in grado di ridurre seppur modestamente la concentrazione dei trigliceridi e di dare leggero
aumento della HDL che sono il colesterolo buono che sono deputate al trasporto del
colesterolo dalla periferia al fegato.
Le statine in uso comprendono:
-
atorvastatina
-
cerivastatina (recentemente per i suoi gravi effetti collaterali è stato ritirato dal
commercio)
-
fluvastatina
-
lovastatina
-
mevastatina
-
ecc.
Struttura chimica delle statine
Hanno struttura abbastanza simile, è importante ricordare la presenza dell’anelo lattonico,
che per lovastatina e simocastatina è un anello è chiuso mentre per gli altri è aperto.
Le statine attualmente in commercio in Italia sono la Lovastatina, Pravastatina,
simvastatina (di origine funginea) gli altri sono sintetici (atrostatina ecc).
Farmacocinetica
Vengono metabolizzate dal fegato ed eliminate per via intestinale. Normalmente sono
somministrati in un'unica dose serale perché la sintesi del colesterolo segue ritmo
circadiano. Alcune proprietà farmacocinetiche delle statine: vengono metabolizzate dal cit.
P450, tranne la pravastatina che viene eliminata in parte per via renale e in parte per via
GI. Sono altamente legate alle proteine plasmatiche e l’emivita si aggira intorno alle 2-3h
(atorvastatina 15h).
Sono importanti due sistemi enzimatici a livello epatico: nel cit.P450 l’isoforma S4A è
deputata al metabolismo di lovastatina, simvastatina e atovastatina,
mentre l’isoforma
2C9 metabolizza fluvostatina. L’interazione con farmaci è quindi differente a seconda della
96
www.haikzarian.com
copyright © Haik Zarian
statina che si usa con una interazione con farmaci differenti a seconda del citocromo dai
quali vengono metabolizzate.
Essendo il business allettante, le case farmaceutiche hanno tentato di introdurre nuove
molecole e solo poche statine in commercio sono state testate; la maggior parte sono state
testate sulla capacità di ridurre il colesterolo facendo l’approssimazione che la riduzione del
colesterolo fosse proporzionale alle vite salvate. Le capacità delle varie statine di ridurre la
LDL è diverso. Le migliori cioè le più attive a ridurre la colesterolemia anche a bassi
dosaggi sono la Atorvastatina.
I dosaggi vanno da 5 a 40mg; normalmente i dosaggi sono da 5-15mg. L’effetto più grave è
la rabdomiolisi motivo per cui la cerivastatina è stata ritirata dal commercio. Il picco
plasmatico è raggiunto in 3-5h; il farmaco ha minimo metabolismo epatico e la maggior
parte viene escreto per via biliare e si trova nelle urine. Il t1/2 è di 13-20 ore.
Effetti indesiderati
Effetti indesiderati principali delle statine sono:
-
nausea
-
affaticamento
-
anormalità degli enzimi epatici
-
dolori muscolari.
Si descrivono anche emicrania, astenia, infezioni delle vie respiratorie, miopatia.
La
registrazione delle diverse statine varia a seconda della dislipidemia e la simvastatina è
indicata per il trattamento dell’ipercolesterolemia primaria, ipercolesterolemia familiare o
iperlipemia mista.
Mentre la fluvostatina è indicata per la ipercolesterolemia primaria.
Quindi ogni farmaco ha delle indicazioni registrate, anche se poi ci sono delle eccezioni nel
senso che la maggior parte dei pz trattati sono off-label cioè non hanno la registrazione.
Tute le statine vengono considerate come effetto di classe nel senso che più riducono il
colesterolo e più sono attive e più salvano vita. Le statine però hanno anche altri effetti,
dando effetti positivi su altri distretti come la parete vascolare, funzione macrofagica,
reattività piastrinica, antiinfiammatoria ed immunomodulante.
Effetti pleiotripici delle statine:
- aumentano funzione endoteliale
- calano la migrazione delle cellule mm. lisce
- funzione piastrinica.
97
www.haikzarian.com
copyright © Haik Zarian
Le statine hanno quindi diversi effetti. Le statine hanno come effetto collaterale importante
la rabdomiolisi. Erano stati censiti al 2002 3239 casi di rabdomiolisi a carico della cervi
statina, la maggiore imputata. L’incidenza quindi per la cerivastatina era 3.16% ed è stata
pertanto ritirata dal commercio.
Indicazioni al trattamento con le statine
È necessario trattare:
-
trattare tutti i pz ad elevato rischio cardiovascolare
-
portare il target il colesterolo LDL per ridurre eventi cardiovascolari
-
trattare i pz in modo continuativo. Il pz che comincia a prendere pz deve continuare la
terapia per tutta la vita.
-
Trattare con giusti dosaggi per raggiungere il target che ci siamo prefissati.
Parametri di trattamento delle statine: una cosa fondamentale è che se riduciamo la
concentrazione del colesterolo LDL di 1% riduciamo dell’1% il rischio di malattia cardiaca
mentre se la aumentiamo di % riduciamo il rischio della malattia cardiovascolare del 3%.
Si è visto che c’è una diretta proporzionalità tra l’aumento della mortalità all’aumentare
della colesterolemia. Quindi è importante abbassare la colesterolemia.
Mediante diversi studi si è dimostrato che c’è una correlazione tra riduzione colesterolo ed
eventi cardiovascolari nella prevenzione secondaria. Nella prevenzione primaria ad una
riduzione del colesterolo non è poi molto evidente la riduzione di eventi cardiovascolari.
Sono numeri da 10mila, 20 mila pz. Se si riduce la colesterolemia si riduce
significativamente quelli che sono gli eventi cardiovascolari.
È importante l’aderenza alla terapia ed in questa analisi sono stati analizzati pz che hanno
raggiunto il target e pz che non lo hanno raggiunto. Il 14% raggiunge il target. Il pz quindi
deve assumere in modo continuativo la statina. Pz maggiormente motivati, cioè quelli con
eventi cardiovascolari sono quelli più motivati che riescono a raggiunger il target andando
alla ricerca del dosaggio della statina per raggiungere il target.
In ultima analisi la silvastatina che è diventato un farmaco generico e pertanto è stato
introdotto
l’ezetemibe
che
è
inibitore
dell’assorbimento
del
colesterolo
a
livello
gastrointestinale. È un farmaco che interessa quindi sia l’assorbimento che la sintesi del
colesterolo. In pratica l’ezetemibe è differente dal sequestro degli acidi biliari, entra nel
circolo enteroepatico assorbendo colesterolo a livello GI. Blocca quindi il trasportatore del
colesterolo. Inibisce l’assorbimento del colesterolo. Viene coniugato a glucoronide ed entra
nel circolo epatico e viene localizzato nel circolo enteroepatico. È sufficiente la
somministrazione giornaliera. Da tenere presente che la colesterolammina influenza
98
www.haikzarian.com
copyright © Haik Zarian
l’attività dell’ezetimibe. L’ezetemibe può esser quindi usata in associazione con altri
ipolipemizzanti come in associazione con la simvastatina.
Il dosaggio è si 10mg 1 volta al giorno però normalmente viene somministrato alla sera
insieme alla simvastatina.
Tramite uno studio (studio EHNANCE) si p visto che non vi è nessuna attività sulla placca
aterosclerotica.
TRASPORTO INVERSO DEL COLESTEROLO E I CHOLESTERYL TRANSFER PROTEIN
Gli inibitori delle CETP (proteine di trasporto del colesterolo esterificato) aumentano i livelli
delle HDL. Gli effetti funzionali associati a questo rimangono incerti. Si sa che le HDL
prima di arrivare al fegato incontrano le VLDL, ma anche le LDL che posseggono la
lipoproteina P che legandosi alla apo AI-Milano si arrichiscono di trigliceridi; si tratta di un
passaggio non molto desiderato in quanto permette alle HDL di portare il colesterolo agli
epatociti. Torcetrapib è stato portato fino alla fase III in quanto si era visto che si aveva
minima riduzione delle LDL. È stato fatto uno studio “Illuminante” che ha messo in
evidenza un aumento colesterolo HDL ed una riduzione del colesterolo LDL, nessun
significativo rallentamento sulla progressione dell’aterosclerosi coronarica. È stato quindi
ritirato dal commercio.
Altri ipolipemizzanti:
-
Bezafibrato
-
Gemfibrozil
-
Fenofibrato.
RESINE LEGANTI I SALI BILIARI
Sono disponibili due molecole:
-
colestiramina
-
colestipolo cloridrato.
Normalmente i sali biliari vengono riassorbiti per il 95% e le resine sono in grado di legare
gli acidi biliari e non essendo riassorbite le portano poi con il contenuto intestinale e
questo comporta il fatto che l’epatocita deve sintetizzare nuovamente colesterolo per la
produzione degli acidi binari. Questo porta a due effetti:
-
effetto favorevole: drenando i sali biliari l’epatocita è stimolato alla sintesi dei recettori
per le LDL.
99
www.haikzarian.com
-
copyright © Haik Zarian
effetto sfavorevole: attivazione dell’enzima HMGCaA reduttasi per aumentare la
neosintesi di colesterolo.
I livelli di colesterolo possono diminuire dal 10-35% a seconda della dose. Se vengono
associati con una statina abbiamo un effetto più completo.
Niacina
È stato il primo ipolipemizzante introdotto nel 1955. È un complesso della vitamina B e
fisiologicamente esplica le sue funzioni quando è convertito a nicotinamide-adenindinucleotide NAD o NADP. La sua azione ipolipemizzante non è ancora chiara ma parrebbe
inibire la lipolisi.
Per quanto concerne gli effetti collaterali si è visto che ha reazioni spesso a livello dermico
con prurito nelle parti superiori del tronco, ma il fenomeno pare legato alle prostaglandine
in quanto la somministrazione di acidoacetil salicilico pare diminuire l’effetto.
Probucolo
È un antiossidante molto usato in generale. Si
visto che negli animali da esperimento
inibiva la progressione dell’aterosclerosi sopportando l’ipotesi che gli effetti antiossidanti
prevenissero ossidazione a carico delle LDL (importante tappa nella formazione della placca
aterosclerotica. L’effetto del probucolo è stato visto anche negli animali da esperimento
perivi di recettori LDL, cioè in chi non ha questi recettori e il meccanismo non si conosce
ancora bene per il momento.
Clofibrato e Gemfibrozil
Sono poco utilizzati, riducono di poco la colesterolemia (circa il 9%)
Effetti principali:
-
riduzione VLDL, modesto aumento delle HDL ed effetto variabile sulle LDL
-
sembra che l’effetto sulle VLDL sia dovuto ad aumento di attività dell’enzima
lipoproteinasi.
I recettori PPAR-α inducono un attivazione delle espressione della lipoproteina lipasi e
induzione dei recettori APO-A1, cioè recettori espressi delle HDL.
L’assorbimento è orale, il picco plasmatico è di 1-4h, t1/2 è variabile. L’eliminazione è
orale. Le reazioni avverse sono Gi (5%), casi di rush, orticaria, emicrania, impotenza ed
anemia. In rari casi abbiamo aumento delle transaminasi e rischio di miopatia con co-
100
www.haikzarian.com
copyright © Haik Zarian
somministrazione insieme alla statina. Il dosaggio delle statine in questo caso deve essere
ridotto.
È importante prima di cominciare qualsiasi trattamento con statine:
-
ridurre apporto di colesterolo a livelli inferiori a 300mg/die
-
ridurre apporto grassi saturi
-
ridurre assunzione alcolici
-
preferire origine vegetale rispetto a quelli di originale animale
-
aumentare assunzione di pesce.
Oggi c’è scarsa compliance da parte dei pazienti. Per decidere se inserire in trattamento un
paziente si valutano le carte di rischio che tendono conto di variabili come l’età, colesterolo
totale, HDL, pressione ecc.
101