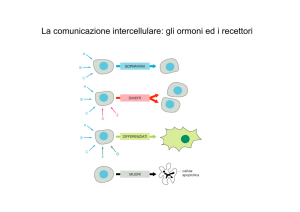
La comunicazione intercellulare:
gli ormoni ed i recettori
Copyright (c) by W. H. Freeman and Company
La trasduzione del segnale:
processo che converte i segnali extracellulari in
risposte cellulari.
Copyright (c) by W. H. Freeman and Company
La comunicazione mediante segnali extracellulari
implica sei tappe
a (1) sintesi della molecola segnale da parte della cellula che trasmette il
segnale
a (2) rilascio della molecola segnale da parte della cellula che trasmette il
segnale
a (3) trasporto della molecola segnale verso la cellula bersaglio
a (4) riconoscimento della molecola segnale da parte di specifiche proteine
recettrici
a (5) modificazione del metabolismo, della funzione o del differenziamento
della cellula avviata dal complesso recettore-molecola segnale
a (6) rimozione della molecola segnale, che spesso determina la fine della
risposta cellulare.
Copyright (c) by W. H. Freeman and Company
Negli animali le molecole segnale agiscono a
distanze diverse
a Comunicazione endocrina: le molecole segnale, ormoni, agiscono su cellule
bersaglio distanti dai loro siti di sintesi.
a Comunicazione paracrina: le molecole segnale rilasciate da una cellula
agiscono soltanto su cellule bersaglio localizzate in stretta prossimità (es.
neurotrasmettitori)
a Comunicazione autocrina: le cellule rispondono a sostanze rilasciate da loro
stesse.
Molti fattori di crescita agiscono in questo modo e le cellule in coltura spesso
secernono fattori di crescita che stimolano la propria crescita. Questo tipo di
trasmissione del segnale è molto comune tra le cellule tumorali.
Copyright (c) by W. H. Freeman and Company
Negli animali le molecole segnale agiscono a
distanze diverse
Copyright (c) by W. H. Freeman and Company
Le proteine recettrici esibiscono specificità di legame
per il ligando e specificità di effettore
a La risposta cellulare indotta da una determinata molecola segnale
extracellulare dipende dal suo legame ad una specifica proteina recettrice
situata sulla superficie, nel nucleo o nel citoplasma di una cellula bersaglio
a La molecola segnale (ormone, ferormone, neurotrasmettitore) agisce come
ligando che si lega a un sito specifico del recettore.
a L’associazione del ligando al recettore provoca un
cambiamento
conformazionale del recettore, che dà inizio ad una sequenza di reazioni che
portano ad una particolare risposta cellulare.
a Una proteina recettrice è caratterizzata da una specificità di legame per un
particolare ligando, ed il complesso ligando-recettore esibisce una
specificità di effettore (cioè media una risposta cellulare specifica).
Copyright (c) by W. H. Freeman and Company
Le proteine recettrici esibiscono specificità di legame
per il ligando e specificità di effettore
a La risposta di una cellula ad un ormone è determinata dal tipo di recettori
che la cellula esprime, e dalle reazioni cellulari avviate dal legame
dell’ormone al recettore.
a a) Tipi diversi di cellule possono possedere gruppi differenti di recettori per
uno stesso ligando, ognuno dei quali evoca una risposta diversa;
a b) lo stesso recettore può essere localizzato in tipi differenti di cellule, ed il
legame di uno stesso ligando può provocare risposte diverse a seconda del
tipo cellulare (cellule diverse rispondono in modi differenti ad uno stesso
ligando)
a c) in alcuni tipi di cellule, differenti complessi recettore ligando (es.
glucagone e adrenalina negli epatociti) possono indurre la stessa risposta
cellulare (es.: degradazione del glicogeno e rilascio di glucosio)
Copyright (c) by W. H. Freeman and Company
La maggior parte degli ormoni appartengono a tre categorie:
a (1) piccole molecole lipofile che diffondono attraverso la membrana
plasmatica ed interagiscono con recettori intracellulari;
a (2) molecole idrofile che si legano a recettori di superficie;
a (3) molecole lipofile che si legano a recettori di superficie;
Copyright (c) by W. H. Freeman and Company
Alcuni ormoni si legano a recettori intracellulari; altri a
recettori di superficie.
Copyright (c) by W. H. Freeman and Company
Piccole molecole lipofile che si legano a recettori
intracellulari
a Molti ormoni liposolubili diffondono attraverso la membrana plasmatica ed
interagiscono con recettori localizzati nel citosol o nel nucleo.
a I complessi ormone-recettore si legano a sequenze di DNA che controllano
la trascrizione, e quindi influenzano l’espressione di geni specifici.
a Gli ormoni di questo tipo comprendono gli steroidi (es.: cortisolo,
progesterone, estradiolo, testosterone), la tiroxina e l’acido retinoico.
a Gli ormoni steroidei hanno effetto per ore o giorni.
Copyright (c) by W. H. Freeman and Company
Gli ormoni liposolubili controllano le attività dei
recettori nucleari
a Gli ormoni liposolubili si
legano,
regolandoli,
a
specifici fattori di trascrizione
che
appartengono
alla
superfamiglia dei recettori
nucleari.
Copyright (c) by W. H. Freeman and Company
Molecole segnale che si legano a recettori
intracellulari
Copyright (c) by W. H. Freeman and Company
Struttura dei recettori nucleari
Regione N-terminale= variabile con domini di attivazione; Dominio di interazione con il DNA = zinc finger C4;
Regione C-terminale= dominio che lega l’ormone spesso associato a dominio di attivazione ormone-dipendente
Talvolta il dominio ormone-dipendente, in assenza di ligando, funziona come dominio di repressione.
Copyright (c) by W. H. Freeman and Company
Interazione con il DNA del dominio a dita di zinco C4 del
recettore per i glucocorticoidi.
a I recettori nucleari presentano domini a dita
di zinco del tipo C4, generalmente
contengono solo due unità (dita) e legano il
DNA come omodimeri o eterodimeri.
Copyright (c) by W. H. Freeman and Company
Sequenze consenso dei siti di DNA, chiamate elementi
di risposta (response elements) riconosciuti dai
principali recettori nucleari.
Recettori nucleri omodimerici
Recettori nucleri eterodimerici.
Uno dei monomeri è il recettore
nucleare RXR.
Copyright (c) by W. H. Freeman and Company
Meccanismi di controllo ormonale dell’attività del
recettore nucleare
a Quando i recettori nucleari eterodimerici (RXR-VDR, RXR-TR, RXRRAR) sono legati ai rispettivi siti sul DNA, essi agiscono come
repressori o attivatori a seconda che l’ormone sia o meno ad essi
legato.
a In assenza dell’ormone, determinano la deacetilazione degli istoni nei
nucleosomi vicini.
a In presenza dell’ormone il dominio che lega il ligando subisce una
variazione conformazionale che fa sì che questi recettori possano
dirigere l’iperacetilazione degli istoni nei nucleosomi vicini. In queste
condizioni il dominio di attivazione N-terminale interagisce con altri
fattori e stmola la formazione del complesso di inizio della trascrizione.
Copyright (c) by W. H. Freeman and Company
Il legame del ligando altera la conformazione del dominio che
lega il ligando dei recettori nucleari umani
a In assenza del ligando (acido retinoico
9-cis), il dominio di legame del ligando
dell’RARα
umano
ha
una
conformazione aperta (a).
a Quando è legato al ligando il dominio di
legame del ligando del RARγ umano ha
una conformazione compatta (b)
Copyright (c) by W. H. Freeman and Company
Meccanismi di controllo ormonale dell’attività dei
recettori nucleari omodimerici
a Al contrario dei recettori eterodimerici, che sono localizzati
esclusivamente nel nucleo, I recettori nucleari omodimerici sono sia nel
citoplasma che nel nucleo.
a L’attività dei recettori nucleari omodimerici è regolata dal controllo del
loro trasporto dal citoplasma al nucleo.
a Il trasporto all’interno del nucleo è ormone-dipendente.
a In assenza dell’ormone il recettore è ancorato al citoplasma in un
grande aggregato proteico complessato con proteine inibitorie tra cui
Hsp90.
Copyright (c) by W. H. Freeman and Company
Il legame dell’ormone stacca il recettore per i
glucocorticoidi dalla sua ancora citoplasmatica
permettendogli di entrare nel nucleo.
Copyright (c) by W. H. Freeman and Company
Modello dell’attivazione genica dipendente dagli ormoni
mediata dal recettore per i glucocorticoidi (GR)
Copyright (c) by W. H. Freeman and Company
Ormoni solubili in acqua che si legano a recettori di
superficie
a Le molecole segnale solubili in acqua non possono diffondere attraverso
la membrana plasmatica e si legano a recettori di superficie.
a Questa ampia classe di molecole segnale è divisa in due gruppi
1) ormoni peptidici (es.: insulina, glucagone, fattori di crescita)
2) piccole molecole cariche che derivano dagli amminoacidi e che
agiscono sia come ormoni che come neurotrasmettitori (es.: adrenalina,
istamina)
a Gli effetti prodotti dal legame di questo tipo di ormoni ai recettori di
superficie sono generalmente quasi immediati, ma durano solo un breve
intervallo di tempo.
Copyright (c) by W. H. Freeman and Company
Struttura di piccole molecole che agiscono da
neurotrasmettitori
Copyright (c) by W. H. Freeman and Company
Ormoni lipofili che si legano a recettori di superficie.
a I principali ormoni liposolubili che si legano a recettori di superficie sono
le prostaglandine.
a Le prostaglandine fanno parte di una famiglia di ormoni a venti atomi di C,
chiamati ormoni eicosanoidi, che vengono sintetizzati a partire d un
precursore comune, l’acido arachidonico.
a L’acido arachidonico è prodotto a partire da fosfolipidi e diacilglicerolo.
Copyright (c) by W. H. Freeman and Company
Eicosanoidi
Copyright (c) by W. H. Freeman and Company
I recettori di superficie possono essere suddivisi in
quattro classi principali
a Recettori accoppiati a proteine G
a Recettori canali ionici
a Recettori accoppiati alla tirosina chinasi
a Recettori con attività enzimatica intrinseca
Copyright (c) by W. H. Freeman and Company
Recettori accoppiati a proteine G
a Recettori accoppiati a proteine G (G protein-coupled receptors, GPCR): il
legame del ligando attiva una proteina G, che a sua volta stimola o
inibisce un enzima che produce uno specifico secondo messaggero o
modula un canale ionico.
Es. Recettori per l’adrenalina, la serotonina, il glucagone.
Copyright (c) by W. H. Freeman and Company
Recettori canali ionici
a Recettori canali ionici: il legame del ligando modifica la conformazione
del recettore in modo tale che specifici ioni possano fluire attraverso
esso. In tal modo viene alterato il potenziale elettrico della membrana.
Es.: recettori per l’acetilcolina nelle giunzioni neuromuscolari.
Copyright (c) by W. H. Freeman and Company
Recettori accoppiati alla tirosina chinasi
a Recettori accoppiati alla tirosina chinasi: questi recettori sono privi di
attività catalitica intrinseca, ma il legame del ligando induce la formazione
di un recettore dimerico che interagisce con ed attiva una o più tirosina
chinasi citosoliche.
Es.: recettori per molte citochine, per gli interferoni e per alcuni fattori di
crescita.
Copyright (c) by W. H. Freeman and Company
Recettori con attività enzimatica intrinseca
a Recettori con attività enzimatica intrinseca: recettori con attività catalitica
intrinseca che viene stimolata dal legame del ligando. Alcuni catalizzano
la conversione del GTP in cGMP; altri hanno attività fosfatasica.
I recettori per l’insulina e molti fattori di crescita possiedono attività di
proteina chinasi. Generalmente il ligando si lega sotto forma di dimero,
induce la dimerizzazione del recettore e ne stimola l’attività tirosina
chinasica.
Recettori tirosina chinasi (receptor tyrosine kinase, RTK)
Copyright (c) by W. H. Freeman and Company
Gli effetti di molti ormoni sono mediati da secondi
messaggeri
a Il legame di ligandi a molti recettori di superficie porta ad un aumento (o
ad una diminuzione) di breve durata della concentrazione di molecole
segnale intracellulari, chiamate secondi messaggeri.
Copyright (c) by W. H. Freeman and Company
AMP ciclico
Copyright (c) by W. H. Freeman and Company
I secondi messaggeri
a L’aumento della concentrazione intracellulare di uno o più secondi
messaggeri, causato dal legame dell’ormone, avvia una modificazione
dell’attività di uno o più enzimi o proteine non enzimatiche.
a La degradazione (o rimozione) del ligando del secondo messaggero, o
l’inattivazione del complesso ligando-recettore, determina la conclusione
della risposta cellulare.
Copyright (c) by W. H. Freeman and Company
Altre proteine conservate da un punto di vista evolutivo
agiscono nella trasduzione del segnale
a Proteine “interruttore” (switch protein) con attività GTPasica
a Proteine chinasi
a Proteine di raccordo
Copyright (c) by W. H. Freeman and Company
Proteine “interruttore” (switch protein) con attività
GTPasica
a Un ampio gruppo di proteine che
legano il GTP agiscono come
“interruttori” molecolari.
Segnale
a Queste proteine
sono “accese”
quando sono legate al GTP e “spente”
quando sono associate al GDP.
a Due classi di switch protein con
attività GTPasica:
a) le proteine G trimeriche
b) le proteine monomeriche Ras o
…..Ras-simili
Le switch protein presentano regioni che promuovono l’attività di specifiche proteine per
interazione diretta proteina-proteina.
Le proteine G trimeriche sono associate direttamente ai recettori attivati, mentre Ras solo
Copyright (c) by W. H. Freeman and Company
indirettamente
Proteine chinasi
a L’attivazione di tutti i recettori di superficie provoca variazioni del grado di
fosforilazione di alcune proteine attraverso l’attivazione di proteine chinasi.
a Due tipi di proteine chinasi:
a) quelle che fosforilano la tirosina
b) quelle che agiscono sulla serina o sulla treonina
Copyright (c) by W. H. Freeman and Company
Proteine di raccordo (adattatori)
a Molte vie di trasduzione del
segnale contengono grandi
complessi
multiproteici
che
sono
mantenuti
insieme da proteine di
raccordo.
a Le proteine di raccordo
non sono dotate di attività
catalitica
nè
attivano
direttamente le proteine
effettrici, ma possiedono
domini che funzionano
come siti di aggancio per
altre proteine
a Domini SH2 e PTB si legano a residui di fosfotirosina
a Domini SH3 legano sequenze ricche in prolina
Copyright (c) by W. H. Freeman and Company
Le medesime vie di trasmissione del segnale possono
essere attivate da recettori diversi
Copyright (c) by W. H. Freeman and Company
La sintesi, il rilascio e la degradazione degli
ormoni vengono finemente regolati
Copyright (c) by W. H. Freeman and Company
Recettori accoppiati a proteine G e loro effettori
a Nei mammiferi, molti differenti recettori di superficie sono
accoppiati a proteine G trimeriche che trasducono il segnale.
a Il legame dei ligandi ai recettori attiva le proteine G ad essi
associate, che a loro volta stimolano un enzima effettore che
catalizza la sintesi di un secondo messaggero.
a L’ampia famiglia dei recettori accoppiati a proteine G (GPCRs)
comprende i recettori attivati dalla luce (rodopsine) presenti
nell’occhio, i recettori olfattivi localizzati nel naso e numerosi
recettori per vari ormoni.
a Benchè questi recettori siano attivati da ligandi diversi, stimolano
vie simili di trasmissione del segnale.
Copyright (c) by W. H. Freeman and Company
Tutti i recettori GPCR contengono sette regioni transmembrana ed
hanno il segmento N-terminale sulla superficie esoplasmatica e quello
C-terminale sulla superficie citosolica della membrana
Copyright (c) by W. H. Freeman and Company
Recettori per le catecolammine un esempio di
recettori accoppiati a proteine G
a I recettori per le catecolammine
legano
l’adrenalina
e
la
noradrenalina, prodotti della
medulla del surrene.
a Proteine G trimeriche sono
associati a questi recettori e
trasducono il segnale
a L’adeninato ciclasi sintetizza il
secondo messaggero
Copyright (c) by W. H. Freeman and Company
Recettori per le catecolammine un esempio di
recettori accoppiati a proteine G
a L’adrenalina, che media la risposta dell’organismo alle situazioni di stress, si lega a 2
tipi di GPCR: i recettori β-adrenergici (β1 e β2) ed i recettori α-adrenergici (α1 e α2).
a Il legame dell’adrenalina ai recettori β-adrenergici delle cellule epatiche ed adipose
induce la liberazione del glucosio e degli acidi grassi;
a Il legame dell’adrenalina ai recettori β-adrenergici delle cellule muscolari cardiache
aumenta la frequenza cardiaca;
a Il legame dell’adrenalina ai recettori β-adrenergici delle cellule muscolari lisce
dell’intestino porta alla loro distensione;
a Il legame dell’adrenalina ai recettori α-adrenergici delle cellule che rivestono i vasi
sanguigni del tratto intestinale, della pelle e dei reni causa vasocostrizione;
a Adrenalina = rifornimento di energia necessaria per i movimenti rapidi dei principali
muscoli scheletrici in risposta a condizioni di stress.
Copyright (c) by W. H. Freeman and Company
Recettori per le catecolammine, un esempio di
recettori accoppiati a proteine G
a i recettori β- ed α-adrenergici sono accoppiati a proteine G diverse.
a Sia i recettori β1 che i β2 sono associati a proteine G (Gs) che attivano
l’adenilato ciclasi
a I recettori α1 e α2 -adrenergici sono invece accoppiati rispettivamente a Gq e
Gi
a Gi inibisce l’adenilato ciclasi, Gq stimola la fosfolipasi C in modo da
produrre IP3 e DAG
Copyright (c) by W. H. Freeman and Company
L’attivazione dei recettori β-adrenergici porta ad un aumento del
livello di cAMP
IP = Isoproterenolo
a La KD per il legame dell’adrenalina e di altre catecolamine ai recettori βadrenergici è molto simile alla concentrazione del ligando che induce una
attivazione semi-massimaleCopyright
dell’adenilato
cilcasi
(c) by W. H. Freeman and
Company
I recettori β-adrenergici mediano l’attivazione della sintesi
di cAMP avviata dall’adrenalina
Copyright (c) by W. H. Freeman and Company
Sono state identificate le caratteristiche fondamentali
delle catecolammine e dei loro recettori.
La catena laterale che contiene il
gruppo NH determina l’affinità
del ligando per il recettore
Copyright (c) by W. H. Freeman and Company
Sono state identificate le caratteristiche fondamentali
delle catecolammine e dei loro recettori.
L’anello
catecolico
è
necessario perché il ligando
possa indurre l’aumento di
cAMP
X
X
X
Copyright (c) by W. H. Freeman and Company
Sono state identificate le caratteristiche fondamentali
delle catecolammine e dei loro recettori.
La catena laterale che contiene il
gruppo NH determina l’affinità
del ligando per il recettore
L’anello catecolico è necessario
perché il ligando possa indurre
l’aumento di cAMP
Copyright (c) by W. H. Freeman and Company
I recettori β1- e β2- adrenergici, importanti target
farmacologici
a Nell’uomo i recettori β1- e β2- adrenergici sono localizzati su tipi cellulari diversi e
differiscono per la loro affinità relativa nei confronti di varie catecolamine.
a β1- adrenergici
- affinità isoproterenolo > noradrenalina > adrenalina
- fibre muscolari cardiache
- promuovono l’aumento della frequenza e della forza di contrazione cardiaca.
Farmaci antagonisti selettivi dei recettori β1- adrenergici (es.: practololo, β bloccanti)
sono utilizzati nelle aritmie cardiache e nell’angina per diminuire la forza di
contrazione cardiaca.
a β2- adrenergici
- affinità isoproterenolo >> noradrenalina = adrenalina
- fibre muscolari lisce dei dotti bronchiali;
- promuovono la distensione delle fibre muscolari
Farmaci agonisti selettivi dei recettori β2- adrenergici sono utilizzati nel trattamento
dell’asma.
Copyright (c) by W. H. Freeman and Company
Modello del complesso formato dall’isoprotenerolo con il
recettore β2-adrenergico.
a Studi effettuati con forme mutanti
dei recettori β-adrenergici hanno
identificato
4
residui
amminoacidici, localizzati nelle
eliche transmembrana 3, 5 e 6 che
intervengono nel legame con
l’agonista isoproterenolo.
Copyright (c) by W. H. Freeman and Company
Il legame del ligando al recettore porta all’attivazione della
proteina G
a Modello:
in seguito al legame del ligando, con il recettore alcune eliche si
spostano (eliche 5 e 6), portando ad una modificazione conformazionale
dell’ansa che le unisce.
a L’ansa si può quindi legare ed attivare la proteina G
Copyright (c) by W. H. Freeman and Company
Identificazione dei domini funzionali dei recettori
accoppiati a proteine G
Esperimenti condotti in ovociti di Xenopus
Copyright (c) by W. H. Freeman and Company
L’aumento del livello intracellulare di cAMP è il risultato
dell’attivazione dell’enzima adenilato ciclasi
Copyright (c) by W. H. Freeman and Company
La struttura dell’adenilato ciclasi
Copyright (c) by W. H. Freeman and Company
Le proteine Gs trimeriche sono accoppiate ai recettori βadrenergici e all’adenilato ciclasi
a Il collegamento tra il legame dell’ormone ad un dominio extracellulare
del recettore β−-adrenergico e l’attivazione dell’adenilato ciclasi è
fornito dalla proteina Gs, che funziona da trasduttore del segnale.
a Le proteine Gs sono costituite da 3 subunità chiamate α, β e γ.
Copyright (c) by W. H. Freeman and Company
Le proteine Gs trimeriche mettono in comunicazione i
recettori β-adrenergici e l’adenilato ciclasi
Copyright (c) by W. H. Freeman and Company
Amplificazione del segnale ormonale
a L’amplificazione del segnale ormonale è possibile perchè sia i recettori
che le proteine Gs possono diffondere rapidamente nella membrana
plasmatica.
a 1 complesso ormone-recettore attiva 100 molecole Gs.
a Ogni Gsα .GTP attiva 1 molecola di adenilato ciclasi
a 1 molecola di adenilato ciclasi sintetizza molte molecole di cAMP
durante tutto il tempo in cui il complesso Gsα. GTP è legato all’enzima
Copyright (c) by W. H. Freeman and Company
Terminazione della risposta cellulare
a La risposta della cellula bersaglio si conclude rapidamente non appena
la concentrazione dell’ormone diminuisce.
a La terminazione della risposta è favorita dalla diminuzione dell’affinità
del recettore per il ligando quando Gs viene convertita nella forma attiva.
a Il GTP legato a Gsα viene rapidamente idrolizzato interrompendo
l’attivazione dell’adenilato ciclasi.
a La risposta termina a meno chè la concentrazione dell’ormone non
rimanga alta per formare nuovi complessi ormone-recettore.
a E’ necessario che l’ormone sia sempre presente per mantenere attiva
l’adenilato ciclasi.
Copyright (c) by W. H. Freeman and Company
L’adenilato ciclasi viene stimolata ed inibita da
diversi complessi recettore-ligando.
Il complesso Gsα. GTP stimola l’adenilato ciclasi
Il complesso Giα. GTP inibisce l’adenilato ciclasi
Copyright (c) by W. H. Freeman and Company
Alcune tossine batteriche modificano in modo
irreversibile le proteine G
a La subunità α della tossina
colerica,
addiziona
l’ADPribosio del NAD+ alla subunità
α di Gs. Questa modificazione
irreversibile
impedisce
l’idrolisi del GTP, bloccando la
Gsα nello stato attivo.
a La tossina della pertosse,
prodotta
dal
batterio
Bordetella pertussis, addiziona
ADP-ribosio alla subunità α di
Gi.
Questa
modificazione
irreversibile
impedisce
il
rilascio del GDP, bloccando la
Copyright (c) by W. H. Freeman and Company
Giα nello stato inattivo.
Le modificazioni indotte in Gsα favoriscono la sua
dissociazione da Gβγ e la sua associazione all’adenilato
ciclasi
a Recenti studi di cristallografia ai raggi X hanno mostrato il modo in cui le
subunità dalla proteina G trimerica interagiscono tra loro, con un recettore
attivato e con l’adenilato ciclasi.
a Questo ha contribuito a comprendere:
a) il modo in cui il legame del GTP provoca la dissociazione di Gα da Gβγ;
b) come Gα si associa con l’adenilato ciclasi;
c) le differenze strutturali tra Gsα e Giα che fanno in modo che l’una attivi e
l’altra inibisca l’adenilato ciclasi.
Copyright (c) by W. H. Freeman and Company
Struttura di una proteina G trimerica legata al GDP
a
Nella forma associata al GDP, la subunità α
(verde) e la subunità β (giallo) interagiscono
l’una con l’altra, così come le subunità β e γ.
La regione N-terminale e 2 regioni dette
interruttore 1 e 2 di Gα interagiscono con Gβ.
a
La subunità γ (rosso) non è in contatto con la
subunità α.
a
Le subunità α e γ sono ancorate alla
membrana da code lipidiche
a
I domini N- e C-terminale di Gα interagiscono
con il recettore attivato, determinando una
modificazione conformazionale che induce il
rilascio del GDP ed il legame del GTP.
a
L’associazione del GTP induce un’estesa
modificazione conformazionale delle regioni
“interruttore” di Gα che provoca la
dissociazione da Gβγ.
Copyright (c) by W. H. Freeman and Company
Struttura di Gsα·GTP complessato con due frammenti che
contengono il dominio catalitico dell’adenilato ciclasi.
Adenilato ciclasi
Forskolina = agonista dell’adenilato ciclasi che stabilizza i frammenti catalitici nelle conformazioni attive.
Copyright (c) by W. H. Freeman and Company
L’adenilato ciclasi
Copyright (c) by W. H. Freeman and Company
Struttura di Gsα·GTP complessato con due frammenti che
contengono il dominio catalitico dell’adenilato ciclasi.
a
a
La forskolina blocca i frammenti dell’adenilato ciclasi
nella conformazione attiva
L’ansa amminoacidica α3-β5 e l’elica dell’
”interruttore II” di Gsα-GTP interagiscono con
l’adenilato ciclasi attivandola.
La conformazione di Gsα indotta dal GTP che
favorisce la dissociazione da Gβγ, è anche
necessaria per il legame all’adenilato ciclasi.
a
L’idrolisi del GTP catalizzata dall’attività
GTPasica intrinseca di Gsα induce una nuova
variazione conformazionale che porta alla
dissociazione dall’adenilato ciclasi e la
riassociazione con Gβγ.
L’attività GTPasica agisce come un “timer”
che controlla la durata dell’interazione con
l’effettore.
a
Giα si lega a regioni diverse dell’adenilato
ciclasi e ciò spiega i diversi effetti che
provoca sull’effettore.
Copyright (c) by W. H. Freeman and Company
Il livello intracellulare di cAMP è regolato anche
dall’idrolisi a 5’-AMP da parte della cAMP fosfodiesterasi
Copyright (c) by W. H. Freeman and Company
Recettori tirosina chinasi e proteine Ras
Copyright (c) by W. H. Freeman and Company
Recettori tirosina chinasi e proteine Ras
a I recettori tirosina chinasi (RTK) riconoscono ormoni peptidici/proteici
solubili o legati alla membrana che agiscono come fattori di crescita
(es.: NGF, PDGF, FGF, EGF, insulina).
a Il legame di un ligando stimola l’intrinseca attività proteina-tirosina chinasi
del recettore, che successivamente attiva una cascata di reazioni per la
trasduzione del segnale che porta a modificazioni della fisiologia cellulare
e/o dell’espressione genica.
a Le vie di trasmissione del segnale attivate dagli RTK sono coinvolte nella
regolazione della moltiplicazione e del differenziamento cellulari, la
promozione della sopravvivenza delle cellule e la modulazione del
metabolismo cellulare.
a Gli RTKs trasmettono il segnale ormonale a Ras, una switch protein con
attività GTPasica che trasmette il segnale ai componenti a valle della via di
trasduzione del segnale.
Copyright (c) by W. H. Freeman and Company
Il legame del ligando provoca l’autofosforilazione degli RTK
Copyright (c) by W. H. Freeman and Company
Il legame del ligando provoca l’autofosforilazione degli RTK
a Alcuni RTK (es. Recettore per l’insulina) esistono sotto forma di dimeri anche in
assenza del ligando; il legame del ligando induce una variazione conformazionale che
attiva la chinasi;
a L’attività chinasica di ogni subunità del recettore dimerico fosforila dapprima residui
di tirosina localizzati in prossimità del sito catalitico
a Successivamente vengono autofosforilati i residui di tirosina di altre regioni del
dominio citosolico;
a Le fosfotirosine servono come
siti(c) by
diW.aggancio
per proteine di raccordo contenenti
Copyright
H. Freeman and Company
domini SH2 e PTB;
Alternanza ciclica della proteina Ras tra la forma
inattiva, legata al GDP, e la forma attiva, legata al GTP.
a
Ras è una switch protein che lega il GTP
come la subunità Gα delle proteine G.
a
Ras si alterna tra uno stato attivo
“acceso”, in cui è legata al GTP, ed uno
stato inattivo “spento”, in cui è legata al
GDP
a
L’attivazione di Ras è accellerata da una
proteina chiamata fattore di scambio dei
nucleotidi guaninici (guanine nucleotideexchange factor, GEF), che si lega al
complesso Ras-GDP e provoca la
dissociazione del GDP.
a
L’inattivazione di Ras richiede l’intervento
di una proteina che attiva la GTPasi
(GTPase-activating protein, GAP), che si
lega al complesso Ras-GTP ed aumenta la
sua intrinseca attività GTPasica di un
centinaio di volte.
Copyright (c) by W. H. Freeman and Company
Ras e Gα appartengono alla superfamiglia di switch protein
intacellulari con attività GTPasica
Regione ras simile
Dominio ad elica
a
La proteina Ras (circa 170 aa) è più piccola delle proteine Gα (circa 300 aa) ma la sua struttura
tridimensionale è simile a quella del dominio GTPasico di Gα.
a
Gα contiene anche un dominio ad elica che sembra funzionare come la GAP nell’aumentare la
velocità di idrolisi del GTP.
a
L’interazione diretta tra un recettore GPCR attivato e Gα promuove il rilascio del GDP ed il
legame del GTP, rendendo non necessario l’intervento di un fattore di scambio.
Copyright (c) by W. H. Freeman and Company
Indicazioni sperimentali che Ras agisce a valle degli RTK in una comune
via di trasduzione del segnale.
a Microiniezioni di anticorpi anti-Ras inibiscono la moltiplicazione di
fibroblasti in coltura indotta dal trattamento con il fattore di crescita
derivato dalle piastrine (PDGF) ed il fattore di crescita dell’epidermide
(EGF).
a In assenza di fattori di crescita, iniezioni di proteine Ras mutanti
costitutivamente attive (prive di attività GTPasica, RasD) inducono la
moltiplicazione cellulare.
a L’addizione del fattore di crescita dei fibroblasti (FGF) a cellule in coltura
provoca un aumento della proporzione di proteine Ras presenti nella
forma attiva legata al GTP
Copyright (c) by W. H. Freeman and Company
Una proteina di raccordo ed il GEF accoppiano la maggior parte degli
RTK attivati alle proteine Ras
a Due proteine citosoliche, GRB2 e Sos, forniscono i collegamenti tra il
recettore per l’EGF attivato e Ras.
a Un dominio SH2 di GRB2 si lega ad uno specifico residuo di fosfotirosina
del recettore attivato.
a GRB2 contiene anche 2 domini SH3 che si legano ed attivano Sos.
GRB2 funziona quindi come proteina di raccordo per il recettore per l’EGF
a Sos è una proteina di scambio dei nucleotidi guaninici (GEF) che
contribuisce alla conversione della proteina Ras inattiva, legata al GDP,
nella forma attiva, legata al GTP.
Copyright (c) by W. H. Freeman and Company
Attivazione della proteina Ras in seguito al legame di un
ormone ad un RTK
Ancora farnesilica
Copyright (c) by W. H. Freeman and Company
L’analisi genetica di mutanti dello sviluppo dell’occhio della
Drosophila ha fornito informazioni sulle vie di trasmissione del
segnale attivate dagli RTK
a L’occhio della Drosophila è formata da oltre 800 unità ottiche dette ommatidi.
a Ogni ommatidio è formato da 22 cellule, 8 delle quali sono neuroni sensibili
alla luce (fotorecettori R1-R8)
Copyright (c) by W. H. Freeman and Company
L’RTK Sevenless
Wild-type
8 fotorecettori
mutante sevenless
7 fotorecettori (-R7)
a L’RTK Sevenless (Sev) regola in modo specifico il differenziamento della
cellula R7.
a Nei moscerini con il gene mutante sevenless (sev), la cellula R7 di ogni
ommatidio non si differenzia.
a Il fotorecettore R7 è necessario per la percezione della luce ultravioletta - I
mutanti privi di R7 possono essere facilmente individuati
Copyright (c) by W. H. Freeman and Company
L’RTK Sevenless
a Durante lo sviluppo larvale delle Drosophila
wild type, le cellule R8 esprimono una
proteina di membrana, chiamata Boss (Bride
of sevenless), che si lega al RTK Sev
localizzato sulla superficie della cellula
adiacente.
a Questa interazione induce modificazioni
dell’espressione genica che provocano il
differenziamento del precursore in una
cellula R7 funzionale
Copyright (c) by W. H. Freeman and Company
Analisi genetica dell’induzione del fotorecettore R7
nell’occhio di Drosophila (a)
Copyright (c) by W. H. Freeman and Company
Analisi genetica dell’induzione del fotorecettore R7
nell’occhio di Drosophila (b)
a L’analisi di mutanti Ts del gene sevenless ha permesso di isolare i geni che
codificano per tre importanti proteine della via attivata da RTK Sev:
a Una proteina Ras (80% omologia con proteina dei mammiferi)
a Un GEF chiamato Sos (Son of sevenless) (45% omologia con il GEF di topo)
a Una proteina di raccordo che contiene un dominio SH2 (64% omologia con
le GRB2 dell’uomo)
a Ipotesi di lavoro:
Ad una temperatura intermedia tra quella tollerata e quella non tollerata
dalla proteina Sev, i moscerini che portano, oltre alla mutazione sev ts una
mutazione recessiva in un altro gene coinvolto nella stessa via di
trasduzione del segnale saranno privi di cellule R7.
Copyright (c) by W. H. Freeman and Company
Analisi genetica dell’induzione del fotorecettore R7
nell’occhio di Drosophila (c)
Copyright (c) by W. H. Freeman and Company
Il cDNA umano codificante per la proteina
GRB2 è stato identificato utilizzando la
strategia della clonazione in librerie di
espressione
Vettore λgt11 modificato per esprimere alti
livelli della proteina β-galattosidasi
Come sonda è stato utilizzato un
frammento fosforilato dell’EGFR
umano
Il gene identificato codificava per una proteina
(GRB2) omologa alla proteina di raccordo
contenente il dominio SH2 identificata nella
via attivata da RTK Sev inDrosophila
Copyright (c) by W. H. Freeman and Company
GRB2, una proteina di raccordo
Copyright (c) by W. H. Freeman and Company
Il dominio SH2 di GRB2 si lega ad uno specifico residuo di
fosfotirosina di un RTK attivato
a
GRB2 e le proteine di raccordo simili si legano a
diversi residui di fosfotirosina degli RTK per mezzo
del dominio SH2 (dominio 2 omologo a Src, Src
omology 2) .
a
I domini SH2 hanno struttura molto simile ma
ognuno si lega ad una distinta sequenza
amminoacidica adiacente ad un residuo di
fosfotirosina.
a
La sequenza di ogni dominio SH2 individua gli
specifici residui di fosfotirosina a cui il dominio si
lega.
La fosfotirosina (P-Tyr) e l’isoleucina (Ile) si
inseriscono in due solchi sulla superficie del
dominio SH2
Copyright (c) by W. H. Freeman and Company
Riconoscimento di un residuo di fofotirosina da parte di un
dominio SH2
a
La specificità del legame del dominio SH2 è in gran
parte dovuta ai residui amminoacidici localizzati in
posizione C-terminale rispetto alla fosfotirosina
a
I recettori RTK attivati possono anche reclutare
molecole segnale attraverso un altro dominio chiamato
dominio
di
legame
per
la
fosfotirosina
(phosphotyrosine-binding, PTB).
a
La specificità di legame del PTB è determinata da 5-8
residui in posizione N-terminale rispetto alla
fosfotirosina.
Copyright (c) by W. H. Freeman and Company
I domini SH3 si legano in modo specifico a sequenze ricche di
residui di Pro
a
Oltre al dominio SH2, che si lega ai residui di
fosfotirosina degli RTK, GRB2 presenta due
domini SH3, che si legano a Sos, un fattore di
scambio dei nucleotidi guaninici.
a
I domini SH3 si legano in modo specifico a
sequenze ricche di residui di prolina presenti in
Sos ed in altre proteine.
a
Domini SH3 differenti si legano a sequenze
diverse ricche in prolina.
a
La sequenza ricca di prolina assume una
conformazione estesa che permette ampi contatti
con il dominio SH3;
a
Un sottoinsieme dei residui di Pro si inserisce
nelle “tasche” di legame presenti sulla superficie
del dominio SH3.
a
Altri residui amminoacidici diversi dalla prolina
interagiscono con il dominio SH3 e determinano la
specificità del legame
Copyright (c) by W. H. Freeman and Company
Modelli dei domini SH2 e SH3 legati a piccoli peptidi bersaglio
a)
b)
Il dominio SH2 nella proteina di raccordo GRB2 si lega ad uno specifico
residuo di fosfotirosina in un RTK attivato.
Sos, un fattore di scambio di nucleotidi guaninici, si lega ai domini SH3 in
GRB2
Copyright (c) by W. H. Freeman and Company
Pro-PrPro-Pro
GRB2, mediante il dominio SH2 si lega ai residui di fosfotirosina di un
recettore attivato, mentre attraverso i domini SH3 lega regioni ricche
in prolina di altre proteine come Sos
Sos
RTK
Pro-PrPro-Pro
P
Copyright (c) by W. H. Freeman and Company
Sos
Il complesso RTK, GRB2, Sos porta all’attivazione di
Ras
a In seguito all’attivazione di un RTK indotta da un ormone, sulla superficie
citosolica della membrana plasmatica si forma un complesso tra l’RTK
attivato, GRB2 e Sos.
a La formazione di questo complesso è resa possiblile dalla doppia capacità
di legame di GRB2.
a L’attivazione del recettore porta quindi alla rilocalizzazione di Sos dal
citosol alla membrana e quindi in prossimità del suo substato Ras-GDP.
a L’estremità C-terminale di Sos inibisce la sua attività di fattore di scambio
e GRB2 rimuove questa inibizione.
Copyright (c) by W. H. Freeman and Company
Complesso Ras.GDP-Sos
a Il legame di Sos a Ras-GDP
provoca
variazioni
conformazionali di 2 regioni
della proteina Ras, l’”interruttore
I” e l’”interruttore II”, che
determinano l’apertura della
tasca di legame per il GDP.
Copyright (c) by W. H. Freeman and Company
Strutture dei complessi Ras·GDP-Sos e Ras·GTP
Il legame del GTP porta ad una nuova modificazione conformazionale che provoca
la dislocazione di Sos e promuove l’interazione di Ras-GTP con i suoi effettori
Copyright (c) by W. H. Freeman and Company
La proteina GAP
a La proteina GAP, oltre a GRB2, si lega a specifici residui di fosfotirosina
degli RTK attivati.
a Questa interazione colloca la GAP vicino al complesso Ras.GTP, in modo
che possa stimolare l’attività GTPasica di Ras.
Copyright (c) by W. H. Freeman and Company
Vie di fosforilazione della MAP chinasi
a La Ras attivata stimola una cascata di chinasi che culmina nell’attivazione
della MAP chinasi (Proteina chinasi attivata da mitogeni).
a La MAP chinasi è una serina/treonina chinasi che può essere traslocata nel
nucleo e fosforilare molte proteine diverse compresi fattori di trascrizione
che regolano l’espressione di proteine coinvolte nel ciclo e nel
differenziamento cellulari.
a In due cellule diverse, come pure nella stessa cellula attraverso
l’attivazione di RTK differenti, la stimolazione della MAP chinasi può
portare a risposte cellulari simili o differenti.
a I meccanismi che controllano la specificità della risposta della MAP chinasi
sono ancora poco conosciuti
Copyright (c) by W. H. Freeman and Company
La via di trasduzione del segnale a partire dagli RTK
A valle di un RTK attivato:
a La proteina Ras attivata si lega al dominio N-terminale di Raf (o
MAPchinasi-chinasi-chinasi, MKKK), una serina/treonina chinasi, e la
attiva.
a La Raf si lega e fosforila la MEK (o MKK), una proteina chinasi con
specificità doppia, che fosforila sia residui di tirosina che residui di
serina.
a La MEK fosforila un residuo di tirosina ed uno di treonina, separati
da un singolo amminoacido, della MAP chinasi, un’altra
serina/treonina chinasi. E’ necessaria la fosforilazione di entrambi i
siti per attivare la MAP chinasi.
a La MAP chinasi fosforila molte proteine diverse, compresi alcuni
fattori di trascrizione nucleari, che mediano le risposte cellulari.
a Questa via di trasduzione del segnale è altamente conservata durante
Copyright (c) by W. H. Freeman and Company
l’evoluzione (lieviti, C. elegans, Drosophila, mammiferi)
I segnali vengono trasferiti dalla Ras attivata ad una
cascata di proteine chinasi
Copyright (c) by W. H. Freeman and Company
RTKÆRasÆRafÆMEKÆMAP
chinasi
Prove sperimentali della cascata RTKÆRasÆ Raf Æ..
a Proteine Raf mutanti costitutivamente attive inducono la
moltiplicazione di cellule quiescenti in assenza di stimolazione
ormonale (Raf mutanti sono codificate da oncogeni).
a La proteina mutante RasD non è in grado di stimolare la crescita di
cellule in cui Raf è mutata.
a Studi di binding in vitro hanno dimostrato che Ras-GTP purificata si
lega direttamente alla Raf
Copyright (c) by W. H. Freeman and Company
L’interazione tra le proteine Ras e Raf è stata mostrata
anche nel sistema del doppio ibrido di lievito
Copyright (c) by W. H. Freeman and Company
Prove sperimentali della cascata RTKÆRas ÆRafÆ MEKÆ MAP
a La localizzazione della MAP chinasi a valle di Ras è stata
dimostrata dall’osservazione che in cellule che esprimono la
proteina RasD costitutivamente attiva, la MAP chinasi viene attivata
in assenza di stimolazione ormonale
a I fotorecettori R7 si differenziano normalmente in mutanti di
Drosophila privi di proteine Ras o Raf funzionali se esprimono
una MAP chinasi costitutivamente attiva.
a Studi biochimici hanno dimostrato che la Raf non attiva direttamente
la MAP chinasi.
a E’ stata quindi isolata la MEK, una chinasi che fosforila la MAP
chinasi; studi successivi hanno dimostrato che MEK si lega al
dominio catalitico della Raf e da questa viene attivata mediante
fosforilazione
Copyright (c) by W. H. Freeman and Company
14-3-3 e Ksr partecipano alla cascata a valle di Ras che porta
alla fosforilazione di MAP chinasi.
a Prima di una stimolazione ormonale, la Raf è presente nel citosol in una
conformazione inattiva stabilizzata da un dimero di 14-3-3. Ogni
monomero di 14-3-3 si lega ad un residuo di fosfoserina di Raf (Ser-259 e
Ser-621).
a Il complesso Ras-GTP ancorato alla membrana richiama la Raf inattiva
verso la membrana e provoca una variazione conformazionale della Raf
che determina la sua dissociazione da 14-3-3.
a Il residuo Ser-259 viene quindi defosforilato attivando l’attività chinasica
della Raf.
a Per l’attivazione della Raf è necessaria anche la proteina Ksr che
contiene siti di legame per la Raf, la 14-3-3, la MEK e la MAP chinasi.
a Ksr può fungere da proteina di raccordo, fornendo l’”impalcatura” per la
formazione di un grande complesso per la trasmissione del segnale.
Copyright (c) by W. H. Freeman and Company
La fosforilazione di una tirosina e di una treonina attiva la
MAP chinasi.
a La fosforilazione della
MAP chinasi a livello
dei residui tirosina 185
e treonina 183 da parte
della MEK provoca una
estesa
variazione
conformazionale
del
“labbro”
di
fosforilazione”.
a Questa modificazione
conformazionale rende
accessibile
il
sito
catalitico al legame dei
substrati (ATP e varie
proteine) e promuove
la dimerizzazione della
MAP
chinasi,
necessaria
per
la
traslocazione nucleare.
Copyright (c) by W. H. Freeman and Company
Diversi tipi di recettori trasmettono segnali alla MAP chinasi
a Anche se i lieviti non hanno gli
RTK
possiedono
vie
di
fosforilazioni omologhe a quella
della MAP chinasi.
(Raf)
a Nel lievito il legame dei fattori
sessuali a e α ai recettori di
superficie porta all’attivazione di
una proteina G trimerica.
a Le risposte fisiologiche della via
per l’accoppiamento delle cellule
di lievito sono indotte dal
complesso Gβγ (e non da GαGTP), che attiva una cascata di
proteine chinasi simile a quella
situata a valle di Ras nelle vie
RTK.
Copyright (c) by W. H. Freeman and Company
Nelle cellule eucariotiche sono presenti molteplici vie
della MAP chinasi
•
Nelle cellule eucariotiche sono presenti proteine equivalenti alla MAP
chinasi dal punto di vista funzionale (es.: chinasi che fosforilano
l’estremità N-terminale di jun -jun N-terminal kinase, JNK, le p38).
•
Queste proteine, nel loro insieme dette MAP chinasi, sono
treonina/serina chinasi citosoliche, che vengono attivate in risposta a
specifici segnali extracellulari e possono essere traslocate nel nucleo.
•
L’attivazione di
fosforilazione.
•
Le diverse MAP chinasi mediano risposte cellulari specifiche.
•
Vie diverse di fosforilazione delle MAP chinasi possono condividere
componenti comuni.
tutte
le
MAP
chinasi
Copyright (c) by W. H. Freeman and Company
richiede
una
doppia
Le MAP chinasi di S. cerevisiae.
a 5 delle 6 MAP chinasi codificate dal genoma di S. cerevisiae sono state
attibuite a specifiche vie di trasmissione del segnale attivate da vari
segnali extracellulari.
a Ognuna di queste MAP chinasi
risposte
Copyright (c) bymedia
W. H. Freeman
and Company cellulari specifiche.
La specificità delle vie della MAP chinasi
a Nelle vie di fosforilazione della MAP chinasi che hanno componenti in
comune, l’attività di queste componenti è limitata ad un solo sottinsieme
di MAP chinasi dal loro assemblaggio in grandi complessi per la
trasmissione del segnale,
specifici a seconda della via.
Copyright (c) by W. H. Freeman and Company
Funzioni della MAP chinasi indipendenti dall’attività
chinasica
a Cellule mutanti di lievito che non esprimono la
Fus3 sono ancora in grado di accoppiarsi.
a In queste cellule i fattori sessuali inducono
l’espressione
dei
geni
necessari
per
l’accoppiamento attraverso la stimolazione di
Kss1.
a Anche i geni per la formazione dei filamenti
vengono attivati
a L’induzione
dei
geni
specifici
per
l’accoppiamento e per la formazione dei filamenti
mediata dalla Kss1 in risposta ai ferormoni
richiede la presenza di Ste5, la proteina
impalcatura della via per l’accoppiamento
Copyright (c) by W. H. Freeman and Company
Funzioni della MAP chinasi indipendenti dall’attività
chinasica (2)
a In mutanti di lievito che esprimono una Fus 3
inattiva (mutanti “chinasi inattiva), i fattori
sessuali non inducono nè l’espressione dei geni
specifici per l’accoppiamento, nè di quelli
necessari per la formazione dei filamenti.
a Interpretazione dei risultati:
La Kss1 si può legare alla Ste5, ma meno
efficacemente della Fus3 wt o della forma
inattiva.
Se la Fus3 è assente nel complesso viene
reclutata la Kss1.
La Fus 3 ha una funzione associata alla sua
attività chinasica ed una funzione indipendente
da tale attività e legata alla sua capacità di
prevenire l’attivazione della Kss1
Copyright (c) by W. H. Freeman and Company
L’organizzazione delle vie della MAP-chinasi da parte di
proteine impalcatura
Copyright (c) by W. H. Freeman and Company
I secondi messaggeri
Copyright (c) by W. H. Freeman and Company
AMP ciclico
a La stimolazione ormonale dei recettori accoppiati a proteine Gs
porta all’attivazione dell’adenilato ciclasi ed alla sintesi del
secondo messaggero cAMP
a Il cAMP non interviene nelle vie di trasmissione del segnale
avviate dagli RTK (altre molecole agiscono come secondi
messaggeri nelle vie di trasmissione del segnale stimolate sia dai
GPCR che dagli RTK).
a Il cAMP e gli altri secondi messaggeri attivano specifiche proteine
chinasi
a Gli effetti del cAMP, in particolare, vengono mediati
dall’attivazione delle proteine chinasi cAMP-dipendenti (cAMPdependent proteine kinase, cAPKs, o proteina chinasi A)
Copyright (c) by W. H. Freeman and Company
Attivazione della proteina chinasi cAMP -dipendente
(cAPK, o chinasi A) da parte dell’AMP ciclico
Ogni subunità R ha due siti distinti per il legame del cAMP, chiamati A e B.
Il legame del cAMP al sito B induce una variazione conformazionale che espone il sito A.
Il legame delle 2 molecole di cAMP alla subunità R è cooperativo
Il legame del cAMP al sito A porta al rilascio delle subunità C.
Copyright (c) by W. H. Freeman and Company
Proteine chinasi secondo messaggero-dipendenti
a Le chinasi secondo messaggero-dipendente sono regolate con un
meccanismo simile: in assenza del secondo messaggero l’attività della
chinasi è bassa; il legame del secondo messaggero aumenta l’attività della
chinasi.
a La chinasi è inibita dal legame al sito attivo di una sequenza peptidica,
chiamata pseudosubstrato.
a La sequenza pseudosubstrato può essere parte di una subunità regolatoria
distinta (es.: cAPK), o di un dominio regolatorio appartenente alla stessa
catena polipeptidica che contiene il sito attivo.
a In seguito al legame del secondo messaggero si ha una variazione
conformazionale che allontana la sequenza pseudosubstrato dal sito attivo.
a La fosforilazione del “labbro” di fosforilazione può contribuire all’attivazione
delle chinasi secondo mesaggero-dipendenti (es.: MAP chinasi)
Copyright (c) by W. H. Freeman and Company
Il cAMP e le cAPKs regolano il metabolismo del glicogeno
Copyright (c) by W. H. Freeman and Company
Regolazione della sintesi e della degradazione del glicogeno da parte
del cAMP nelle cellule del fegato e dei muscoli
↑ cAMP
Attivati:
7 = indiretto
GPK = Glicogeno fosforilasi chinasi
GP = Glicogeno fosforilasi
Inibiti:
GS = Glicogeno sintasi
PP= fosfoproteina fosfatasi , in modo
indiretto.
a Negli epatociti e nelle fibre muscolari, l’aumento del cAMP indotto
dall’adrenalina, stimola la conversione del glicogeno in glucosio 6-fosfato
in due modi:
inibendo la sintesi del glicogeno;
stimolando la degradazione del glicogeno
Copyright (c) by W. H. Freeman and Company
La regolazione dell’attività della fosfoproteina fosfatasi (PP) da parte
del cAMP è mediata da una proteina inibitrice
a Ad elevate concentrazioni di
cAMP, la cAPK fosforila una
proteina inibitrice (inhibitor
protein, IP) che si lega alla
proteina
fosfatasi
(PP)
formando un complesso
inattivo.
a Quando il livello di cAMP
diminuisce,
le
fosfatasi
costitutive defosforilano IP,
rilascianno la PP nella sua
forma attiva.
Copyright (c) by W. H. Freeman and Company
Regolazione della sintesi e della degradazione del glicogeno da parte
del cAMP nelle cellule del fegato e dei muscoli
↓ cAMP
Attivati:
PP= fosfoproteina fosfatasi
GS = Glicogeno sintasi
Inibiti:
GPK = Glicogeno fosforilasi chinasi
GP = Glicogeno fosforilasi
a Negli epatociti e nelle fibre muscolari, la riduzione del cAMP conseguente alla
riduzione della concentrazione dell’adrenalina circolante, inibisce la conversione del
glicogeno in glucosio 6-fosfato in due modi:
stimolando la sintesi del glicogeno;
inibendo la degradazione del glicogeno
a Questa inversione del metabolismo del glicogeno è mediata dalla fosfoproteina
fosfatasi.
Copyright (c) by W. H. Freeman and Company
Regolazione della sintesi e della degradazione del glicogeno da parte
del cAMP nelle cellule del fegato e dei muscoli
a La regolazione coordinata
della via stimolatoria e di
quella inibitoria è un
fenomeno molto comune in
biologia.
Copyright (c) by W. H. Freeman and Company
La trasduzione intracellulare di un segnale extracellulare attraverso
una cascata di reazioni di chinasi successive produce una notevole
amplificazione del segnale.
Copyright (c) by W. H. Freeman and Company
a
Una cascata enzimatica
permette ad un intero
gruppo
di
reazioni
catalizzate da enzimi di
essere
regolato
da
un’unica molecola.
a
Una cascata enzimatica
permette
un’enorme
amplificazione di un
segnale
inizialmente
piccolo.
a
Più numerose sono le
tappe che costituiscono
una cascata, maggiore
è l’amplificazione del
segnale
Le riposte cellulari al cAMP variano secondo il tipo di
cellula
L’azione del cAMP è sempre mediata da una o più cAPK.
W. substrati
H. Freeman and
Company
La risposta dipende dalla specificità dellaCopyright
cAPK(c)e by
dai
disponibili
nelle diverse cellule
Le proteine di ancoraggio circoscrivono gli effetti del
cAMP in specifiche regioni subcellulari
a E’ stata identificata una famiglia di proteine di ancoraggio che
posizionano le cAPK in specifiche regioni subcellulari, circoscrivendo in
tal modo le risposte cAMP-dipendenti a queste regioni
(es.: segnali cAMP-dipendenti che regolano il movimento del
citoscheletro di membrana, che sono alla base della motilità).
a Le proteine di questa famiglia, dette proteine associate alle cAMP chinasi
(cAMP kinase-associated protein, AKAP) hanno una struttura bipartita,
con una regione che conferisce loro una specifica posizione all’interno
della cellula, ed una regione che lega la subunità regolatoria delle cAPK
a Specifiche proteine di ancoraggio possono avere la funzione di
posizionare all’interno della cellula altre proteine segnale
Copyright (c) by W. H. Freeman and Company
La modificazione di un comune precursore dei fosfolipidi
genera molti secondi messaggeri: sintesi del DAG e del IP3
Copyright (c) by W. H. Freeman and Company
a I fosfoinositidi possono essere scissi dall’enzima fosfolipasi C
(PLC) associato alla membrana.
L’attivazione della isoforma β della fosfolipasi C è indotta dal
legame degli ormoni ai GPCR contenenti la subunità α di tipo
Go o Gq.
Alcuni RTK attivati possono aumentare l’attività della isoforma γ
della PLC
L’attivazione di PLC può quindi essere mediata sia da GPCR
che dagli RTK
Copyright (c) by W. H. Freeman and Company
La generazione di siti di attracco di inositolo fosfolipide da
parte della PI 3-chinasi
La PI 3-chinasi può essere attivata da RTK e daltri recettori compresi GPCR
Copyright (c) by W. H. Freeman and Company
Sintesi di altri fosfoinositidi ed inositolo fosfati
dal fosfatidilinositolo
a I PI fungono da siti di attacco alla membrana per le molecole
segnale e talvolta stimolano l’attività catalitica. Le proteine si
legano ai PI attraverso il dominio PH (di omologia alla Pleckstrina).
Domini PH diversi legano fosfoinositidi differenti.
Copyright (c) by W. H. Freeman and Company
Il Ca2+ intracellulare: un secondo messaggero
a La maggior parte degli ioni Ca2+ intracellulari vengono sequestrati nei mitocondri e
nel reticolo endoplasmatico (RE) o in altre vescicole.
a Le cellule mantengono la concentrazione citosolica degli ioni Ca2+ più bassa di 0,2 μM
a La Ca2+ ATPasi pompa gli ioni Ca2+ citosolici attraverso la membrana plasmatica
verso l’esterno della cellula, o nel lume del RE o di altre vescicole che immagazzinano
gli ioni Ca2+.
Copyright (c) by W. H. Freeman and Company
Il rilascio di Ca2+ dal RE è mediato dal IP3
a Canali per il Ca2+ localizzati
nella membrana plasmatica, i
così detti canali del calcio
attivati dal rilascio di calcio
intracellulare (store-operated
channel, SOC) si aprono in
risposta alla deplezione dei
depositi intracellulari di Ca2+,
garantendo
le
risposte
cellulari indotte da elevate
concentrazioni citosoliche di
Ca2+.
Copyright (c) by W. H. Freeman and Company
I recettori per la rianodina
a Le cellule muscolari e nervose
possiedono canali per il Ca2+
chiamati, per la sensibilità
all’alcaloide vegetale rianodina,
recettori
per
la
rianodina
(ryanodine receptor, RYR)
a L’apertura dei recettori per la
rianodina in risposta a variazioni
del potenziale di membrana,
provoca il rilascio di Ca2+ dai
depositi intracellulari.
Copyright (c) by W. H. Freeman and Company
L’aumento del Ca2+ indotto dagli IP3 attiva diverse
risposte in cellule differenti
Copyright (c) by W. H. Freeman and Company
Il complesso Ca2+-calmodulina media molti degli
effetti cellulari del Ca2+
Uno
dei 4
Copyright (c) by W. H. Freeman and
Company
siti di legame del Ca2+ della calmodulina
Il complesso Ca2+-calmodulina
a L’attivazione
allosterica
della
calmodulina è analoga all’attivazione
allosterica della chinasi A da parte del
cAMP
a La Ca2+/calmodulina non ha attività
enzimatica di per sè ma il legame del
Ca2+
provoca
una
variazione
conformazionale della molecola di
calmodulina
che
permette
al
2+
complesso
Ca -calmodulina
di
legarsi a molti enzimi attivandoli.
a Il complesso Ca2+-calmodulina si lega
ed attiva la cAMP fosfodiesterasi, che
degrada il cAMP ponendo termine ai
2+
Quando la Ca /calmodulina si lega alla proteina
suoi effetti, ed anche diverse proteine
bersaglio può subire un ulteriore e più drastico
chinasi (proteine chinasi dipendenti
da Ca2+/calmodulina, chinasi CaM).
cambiamento di conformazione
Copyright (c) by W. H. Freeman and Company
Il DAG attiva la proteina chinasi C
a Dopo essere stato generato dall’idrolisi del PIP2 o di altri fosfoinositidi
ad opera della fosfolipasi C, il DAG rimane associato alla membrana.
a La principale funzione del DAG è quella di attivare una famiglia di
proteine di membrana chiamate proteine chinasi C.
a In assenza di una stimolazione ormonale, la proteina chinasi C è una
proteina citosolica solubile, cataliticamente inattiva.
a In seguito ad un aumento della concentrazione citosolica di Ca2+, la
proteina chinasi C si lega al lato citosolico della membrana cellulare,
dove può essere attivata dal DAG associato alla membrana.
a L’attivazione della proteina chinasi C dipende sia dagli ioni Ca2+ che dal
DAG.
Copyright (c) by W. H. Freeman and Company
Il DAG rimane associato alla membrana
Copyright (c) by W. H. Freeman and Company
Il DAG lega ed attiva PKC
PKC
Copyright (c) by W. H. Freeman and Company
Il DAG attiva la proteina chinasi C
Copyright (c) by W. H. Freeman and Company
Per vedere questa immagine
occorre QuickTime™ e un
decompressore Animation.
Copyright (c) by W. H. Freeman and Company
Il cGMP: un secondo messaggero
a Il cGMP controlla l’attività di specifiche chinasi e si lega direttamente ai
canali ionici dei bastoncelli della retina regolandoli.
a La sintesi del cGMP è catalizzata da due tipi di guanilato ciclasi:
una forma citosolica solubile
una forma transmembrana
a La forma transmembrana costituisce una parte del dominio citosolico di
alcuni recettori dotati di attività enzimatica intrinseca. Il legame del
ligando al dominio extracellulare stimola l’attività del dominio catalitico
guanilato ciclasico intracellulare.
a Le guanilato ciclasi solubili sono attivate dal monossido di azoto (NO)
Copyright (c) by W. H. Freeman and Company
Recettori con attività di guanilato ciclasi
Copyright (c) by W. H. Freeman and Company
Il cGMP media la trasmissione locale del segnale
avviata dal monossido di azoto (NO)
cGMP degradato da fosfodiesterasi
Guanilato ciclasi solubile.
Il monossido di azoto si lega al gruppo eme
e provoca una variazione conformazionale
che
stimola
l’attività
catalitica
dell’eterodimero
Regolazione della contrazione dei
muscoli lisci delle arterie da parte
dell’NO e del cGMP.
L’aumento del cGMP provoca la
distensione del muscolo e la vasodilatazione
Copyright (c) by W. H. Freeman and Company
a I GPCR, direttamente accoppiati a Gs, portano
all’attivazione dell’adenilato ciclasi ed alla conseguente
produzione di cAMP
aI
recettori
tirosina
chinasi
(RTK),
associati
indirettamente alla proteina Ras, inducono l’attivazione
della MAP chinasi
Copyright (c) by W. H. Freeman and Company
Interazione e regolazione delle vie di
trasmissione del segnale
a Gli effetti dell’attivazione dei GPCRs e degli RTKs è più complessa
di una semplice cascata di eventi indipendenti
a La stimolazione di ogni classe di recettori porta in genere alla
produzione di molteplici secondi messaggeri, ed entrambe le classi
di recettori possono promuovere od inibire la produzione degli
stessi secondi messaggeri
a La medesima risposta cellulare può essere indotta da varie vie di
trasmissione del segnale
a L’interazione di differenti vie di trasmissione del segnale permette
la perfetta sintonizzazione delle attività cellulari
Copyright (c) by W. H. Freeman and Company
Lo stesso RTK può essere associato a diverse
vie di trasmissione del segnale
a Gli RTK possono avviare la trasmissione del segnale mediante la proteina
Ras e la via della fosforilazione della MAP chinasi.
a Gli RTK possono stimolare anche la via dei fosfatidil inositoli attraverso il
legame con la IP-3 chinasi e la PLCγ, enzimi necessari per formare IP3 e
DAG.
a I domini SH2 della PLCγ si legano a specifici residui di fosfotirosina di
alcuni RTK , in modo da posizionare l’enzima vicino al suo substrato legato
alla membrana.
a Gli RTK fosforilano anche residui di tirosina della PLCγ ad essi legata,
aumentandone l’attività lipasica.
a Gli RTK attivano la PLCγ in due modi: posizionando l’enzima a livello della
membrana e fosforilandolo.
Copyright (c) by W. H. Freeman and Company
Molteplici proteine G trasducono segnali a
proteine effettrici diverse
a Sono state identificate diverse proteine G accoppiate a proteine effettrici
differenti.
a Nei mammiferi sono state identificate 16 subunità Gα, 5 subunità Gβ e 12
subunità Gγ distinte.
a Gli eucarioti sintetizzano molteplici proteine G trimeriche che associano i
GPCR ad una varietà di proteine effettrici, compresi i canali ionici,
l’adenilato ciclasi, la fosfolipasi C e, nei fotorecettori, le fosfodiesterasi
specifiche per il cGMP.
a La presenza di svariate subunità Gα in una singola cellula aumenta la
possibilità che un unico ligando possa dare inizio alla trasmissione del
segnale attraverso più di una proteina effettrice.
a L’attività di alcune proteine effettrici, comprese
Copyright (c) by W. H. Freeman and Company
dell’adenilato ciclasi, è regolata dalla Gγβ.
alcune
isoforme
Molteplici proteine G trasducono segnali a
proteine effettrici diverse
Gs
Gi
Gq
Go
Gt
Gβγ
Copyright (c) by W. H. Freeman and Company
La regolazione di alcuni enzimi effettori da parte di
Gβγ e di diversi complessi Gα ·GTP contribuisce
all’integrazione del metabolismo cellulare
Isoforme diverse di una proteina effettrice (E) (es. adenilato ciclasi), hanno
W. H. Freeman and Company
differenti affinitàCopyright
per(c)ilbycomplesso
Gα-GTP e per Gβγ.
Le vie del cAMP e del Ca2+ interagiscono
a Le vie di segnalazione intracellulari del cAMP e del Ca2+ interagiscono a
parecchi livelli.
a I livelli citosolici di Ca2+ e di cAMP possono influenzarsi a vivenda.
Es.: la cAMP fosfodiesterasi e l’adenilato ciclasi sono regolate da
complessi Ca2+-calmodulina;
La chinasi A può fosforilare alcuni canali e pompe del Ca2+ e alterarne
l’attività
a Gli enzimi regolati direttamente da Ca2+ e da cAMP possono influenzarsi a
vicenda
Es.: Alcune chinasi CaM sono fosforilate dalla chinasi A
a La chinasi A e le chinasi CaM fosforilano spesso siti diversi delle stesse
2+
(c) by W. H.
Freeman
Company che dal Ca
proteine, che sono quindiCopyright
regolate
sia
dalandcAMP
La glicogenolisi viene stimolata da svariati secondi
messaggeri.
Doppia regolazione
Copyright (c) by W. H. Freeman and Company
Glicogeno fosforilasi chinasi
a
La
glicogeno
fosforilasi
chinasi è un enzima con 4
subunità.
a
La subunità γ ha attività
catalitica;
La subunità δ è la calmodulina
ed è responsabile della
dipendenza
dal
Ca2+
dell’enzima;
Le subunità α e β sono
bersagli della regolazione da
cAMP, essendo fosforilate
dalla chinasi A
a
a
a
Copyright (c) by W. H. Freeman and Company
Lo stesso Ca2+ che dà inizio
alla contrazione muscolare
assicura
che
ci
sia
abbastanza
glucosio
per
sostenere la contrazione.
L’azione dell’insulina
a L’insulina è un esempio tipico di un ormone che può stimolare vie di
trasmissione del segnale multiple, producendo risposte cellulari sia
immediate sia a lungo termine.
a Effetti isantanei: aumento dell’assunzione del glucosio dal sangue nelle
fibre muscolari e negli adipociti.
a L’esposizione prolungata provoca effetti di lunga durata: aumento
dell’espressione di enzimi coinvolti nella sintesi del glicogeno (fegato) e
nella sintesi dei trigliceridi (adipociti).
a L’insulina agisce anche come fattore di crescita per molti tipi di cellule
(es.: fibroblasti).
Copyright (c) by W. H. Freeman and Company
La stimolazione da parte dell’insulina attiva la
MAP chinasi e la proteina chinasi B
a Il legame dell’insulina al suo recettore può attivare due distinte vie di
trasmissione del segnale:
una via Ras-dipendente
una via Ras-indipendente
a Gli effetti prodotti dall’insulina sia attraverso la via Ras-dipendente che
attraverso la via Ras-indipendente dipendono da un polipeptide di 130
kDa, il substrato 1 del recettore per l’insulina (IRS1).
a Iniezione di anticorpi per l’IRS1 in cellule in coltura blocca la normale
risposta proliferativa indotta dall’insulina
Copyright (c) by W. H. Freeman and Company
Via di trasduzione del segnale dell’insulina
Ras-dipendente
a L’IRS1 si lega al recettore per l’insulina attivato mediante il suo dominio
PTB e viene fosforilato dall’attività chinasica del recettore;
a L’IRS1 fosforilato, e non il recettore per l’insulina attivato, si lega al
dominio SH2 di GRB2;
a GRB2 lega la proteina SOS;
a La proteina SOS stimola la formazione del complesso Ras-GTP;
a Viene attivata la cascata di chinasi che porta all’attivazione della MAP
chinasi
Copyright (c) by W. H. Freeman and Company
Via di trasduzione del segnale dell’insulina
Ras-indipendente
a L’IRS1 fosforilato si lega anche alla PI-3 chinasi stimolandone l’attività chinasica;
a La proteina chinasi B (protein kinase B, PkB) viene richiamata verso la membrana
grazie alla regione N-terminale che contiene un dominio PH (di omologia alla
Pleckstrina) che si lega ai fosfoinositidi della membrana plasmatica;
a La PKB, posizionata a livello della membrana, viene fosforilata e quindi attivata, da 2
chinasi associate alla membrana;
a La PKB attivata viene rilasciata nel citosol e media molti degli effetti dell’insulina,
compresa la stimolazione dell’assunzione del glucosio e della sintesi del glicogeno.
a La PKB, detta anche Akt, è una componente della via per la trasmissione del segnale
che previene la morte cellulare.
Copyright (c) by W. H. Freeman and Company
La via Ras indipendente attiva la Proteina chinasi B
GSK3 = glicogeno sintetasi chinasi 3
Copyright (c) by W. H. Freeman and Company
L’insulina ed il glucagone collaborano per mantenere un
livello ematico stabile di glucosio
a In condizioni normali, il livello ematico di glucosio è sotto il controllo
dell’insulina e del glucagone, prodotti rispettivamente dalle cellule β e
dalle cellule α delle isole di Langherans nel pancreas.
a L’insulina riduce il livello di glucosio nel sangue
a Il glucagone aumenta il livello di glucosio nel sangue.
a L’adrenalina ha un ruolo fondamentale nell’indurre un aumento di
glucosio nel sangue durante i periodi di stress.
Copyright (c) by W. H. Freeman and Company
L’insulina ed il glucagone collaborano per mantenere un
livello ematico stabile di glucosio
a Il legame dell’insulina ai suoi recettori provoca un rapido aumento
dell’assunzione del glucosio e stimola la sintesi di glicogeno attraverso la via
Ras-indipendente.
Copyright (c) by W. H. Freeman and Company
L’insulina ed il glucagone collaborano per mantenere un
livello ematico stabile di glucosio
a Il recettore per il glucagone è accoppiato alla proteina Gs, come il recettore
per l’adrenalina.
La stimolazione delle cellule del fegato con il glucagone attiva l’adenilato
ciclasi. ↑ cAMP stimola glicogenolisi ed inibisce la sintesi del glicogeno.
Copyright (c) by W. H. Freeman and Company
Regolazione del livello ematico di glucosio attraverso gli
effetti opposti dell’insulina e del glucagone
>80-90 mg/100
<80 mg/100
Copyright (c) by W. H. Freeman and Company
La fosforilazione dei recettori di superficie modula la
loro attività
Spesso il legame di un agonista induce la fosforilazione del dominio citosolico di
un recettore di superficie, modulando il tal modo la sua attività
Copyright (c) by W. H. Freeman and Company
La fosforilazione dei recettori di superficie modula la
loro attività
Tutti i recettori accoppiati aproteine Gs vengono fosforilati dalla proteina chinasi
cAMP-dipendente (cAPK).
Altri residui vengono fosforilati da chinasi specifiche.
Copyright (c) by W. H. Freeman and Company
BARK fosforila
i recettori β-adrenergici
I recettori per l’EGF sono inibiti dalla fosforilazione da
parte della protein chinasi C
1.
Legame dell’EGF al recettore
2.
Attivazione della PLCγ
3.
Formazione del DAG
4.
Attivazione della PKC da parte del DAG
5.
Fosforilazione dei recettori per l’EGF da parte di PKC
6.
Riduzione (downregulazion) dell’attività dei recettori
Copyright (c) by W. H. Freeman and Company
La densità dei recettori per molti ormoni peptidici viene
diminuita mediante endocitosi
a Ad elevate concentrazioni di ligando, alcuni recettori di superficie vengono
internalizzati per endocitosi.
a Questo processo determina una riduzione del numero di recettori presenti
sulla superficie cellulare e rende le cellule meno sensibili al ligando.
a Molti RTK internalizzati vengono degradati nei lisosomi. La
risensibilizzazione in questo caso, richiede la sintesi di nuove molecole di
recettore.
a L’internalizzazione
dei
GPCR
fosforilati
(inattivati)
porta
alla
defosforilazione dei recettori, alla dissociazione dalla β-arrestina che li
collega alla clatrina, ed il riciclaggio dei recettori attivi verso la superficie
della cellula
Copyright (c) by W. H. Freeman and Company
Dalla membrana plasmatica al nucleo
Copyright (c) by W. H. Freeman and Company
Purificazione di fattori di trascrizione
Copyright (c) by W. H. Freeman and Company
Dalla membrana plasmatica al nucleo
a Gli ormoni steroidei, che si legano a recettori
intracellulari, regolano direttamente l’espressione
genica
a Quello degli ormoni steroidei, rappresenta l’esempio
più semplice di regolazione dell’espressione genica da
parte di ormoni extracelllari.
Copyright (c) by W. H. Freeman and Company
Modello dell’attivazione genica dipendente dagli ormoni
mediata dal recettore per i glucocorticoidi (GR)
Copyright (c) by W. H. Freeman and Company
Dalla membrana plasmatica al nucleo
a Molte risposte cellulari indotte da ormoni idrosolubili, fattori di
crescita e neurotrasmettitori sono la conseguenza dei loro effetti
sull’espressione genica
a Nella maggior parte dei casi, il legame di un agonista al suo
recettore stimola proteine chinasi che, direttamente o
indirettamente, fosforilano residui di serina, treonina o tirosina di
specifici fattori di trascrizione.
Copyright (c) by W. H. Freeman and Company
Gli ormoni polipepdidici segnalano la fosforilazione di
alcuni fattori trascrizionali
Modello di attivazione
genica mediata da IFNγ
tramite la fosforilazione e
la
dimerizzazione
di
proteine Stat.
Tyr
Copyright (c) by W. H. Freeman and Company
Gli ormoni polipepdidici segnalano la fosforilazione di
alcuni fattori trascrizionali (b)
Modello di attivazione genica
mediata da IFNγ tramite la
fosforilazione e la dimerizzazione
di Stat1α.
Tyr
Mutagenizzando
la
tirosina
fosforilabile
di
Stat1α
con
fenilalanina, la proteina non è più
in grado di attivare i geni bersaglio
e di trasferirsi nel nucleo.
Copyright (c) by W. H. Freeman and Company
La via di trasmissione del segnale attivata da TGFβ
Copyright (c) by W. H. Freeman and Company
La via di trasmissione del segnale attivata da TGFβ
Copyright (c) by W. H. Freeman and Company
CREB collega i segnali cAMP alla trascrizione
Ser 133
CRE = elemento di risposta al cAMP
CREB = CRE-bining protein
Copyright (c) by W. H. Freeman and Company
Co-attivatore
Per vedere questa immagine
occorre QuickTime™ e un
decompressore Animation.
Copyright (c) by W. H. Freeman and Company
Sequenza SRE, Serum-response element
a L’aggiunta di un fattore di crescita (es.: EGF, PDGF) ad una coltura di cellule di
mammifero nella fase Go provoca un rapido aumento dell’espressione di circa 100
geni diversi, i così detti geni a risposta precoce.
a
Un importante gene a risposta precoce codifica per il fattore trascrizionale c-Fos.
a L’induzione di c-fos e di altri geni a risposta precoce da parte dei fattori di crescita
è mediata da diverse vie di trasmissione del segnale: quelle attivate dal cAMP
(chinasi A), da Ca2+/DAG (chinasi C), e dalla proteina Ras (MAP chinasi).
a La sequenza regolatoria del gene c-fos contiene un elemento di risposta al siero
(SRE) che viene attivato da molti fattori di crescita.
a Le diverse vie di trasmissione del segnale agiscono attraverso sequenze diverse
del SRE
Copyright (c) by W. H. Freeman and Company
La MAP chinasi regola l’attività di molti fattori di
trascrizione
TCF = Fattore del complesso ternario
SRF = Fattore di risposta al siero
Copyright (c) by W. H. Freeman and Company
La processazione e l’attivazione di Notch
mediante taglio proteolitico
Copyright (c) by W. H. Freeman and Company
La degradazione fosforilazione-dipendente di una
proteina regola NF-κB
a La stimolazione della risposta
immunitaria porta all’attivazione del
fattore di trascrizione NF-kB (nuclear
factor k chain transcription in B
cells).
a L’NF-kB è un eterodimero costituito
da 2 subunità correlate di 65 e 50 kDa
(p65 e p50)
Copyright (c) by W. H. Freeman and Company
L’attivazione di NF-kB da parte di TNF-α
Copyright (c) by W. H. Freeman and Company