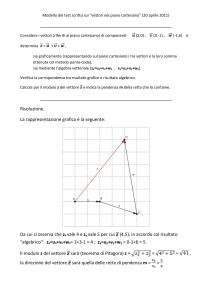
Considerazioni sulla biosicurezza in caso di utilizzo di
costrutti virale per terapia genica
I vettori virali non competenti per la replicazione, devono essere necessariamente prodotti
attraverso l’espressione delle funzioni difettive nel vettore in adatte linee cellulari (packaging cells).
E’ necessario fornire informazioni sull’origine e le caratteristiche delle packaging cells, nonché la
descrizione, caratterizzazione e sequenziamento (quest’ultimo solo nel caso di vettori retrovirali e
lentivirali) di tutti i costrutti molecolari che forniscono le funzioni difettive al vettore virale.
Replication Competent Virus -RCV
Particolare attenzione dovrà essere rivolta a ridurre al minimo la possibilità di eventi di
ricombinazione in grado di generare particelle virali competenti per la replicazione (Replication
Competent Virus -RCV), nonché alle relative metodiche di saggio. In questa prospettiva, andranno
eliminate tutte quelle sequenze virali non necessarie per la produzione/espressione del vettore
virale. Andranno altresì ridotte al minimo tutte quelle sequenze che presentano omologie conosciute
con virus competenti per la replicazione o con virus endogeni umani. In particolare, nel caso di
vettori retrovirali, andrà eliminata ogni omologia di sequenza tra il vettore e i costrutti packaging,
potenzialmente in grado di originare retrovirus competenti per la replicazione attraverso eventi di
ricombinazione. Con lo stesso criterio, sarà anche necessario che le diverse funzioni packaging
vengano espresse il più possibile da vettori indipendenti.
I genomi retro-e lentivirali presentano all’estremità 3’ una sequenza regolatoria/promotrice (3’LTR)
che, una volta inserita nel genoma delle cellule ospite, è potenzialmente in grado di promuovere
l’espressione di geni cellulari adiacenti. Per escludere ragionevolmente questa possibilità, si
raccomanda che i vettori retro-e lentivirali siano costruiti in modo tale che, una volta integrati,
perdano qualsiasi funzione regolatoria/promotrice alla propria estremità 3’.
Possibili conseguenze indesiderate derivanti dall'uso clinico di medicinali sperimentali per
terapia genica da considerare attentamente nella valutazione del protocollo clinico.
Mutagenesi inserzionale
L'integrazione di materiale genetico esogeno nel genoma di cellule bersaglio può dar luogo a una
serie di fenomeni indesiderati quali:
- inattivazione di un gene soppressore di tumori;
- cis - o trans-attivazione di proto-oncogeni o altri geni capaci di promuovere proliferazione
cellulare;
- variazioni nella capacità delle cellule a rispondere ad agenti quali fattori di crescita, citochine o
ormoni, con conseguente acquisizione di potenziale tumorigenicità.
L’insorgenza di eventi di mutagenesi inserzionale è stata osservata in uno studio di terapia genica
facente uso di cellule staminali emopoietiche trasdotte ex vivo con vettori retrovirali.
Nei protocolli che prevedono l’utilizzazione di cellule trasdotte ex vivo con vettori retrovirali o
lentivirali, o comunque potenzialmente capaci di generare eventi di mutagenesi inserzionale, le
condizioni di trasduzione e le dosi dovranno essere giustificate in rapporto ai dati di integrazione
già disponibili e i pazienti dovranno essere sottoposti a monitoraggio per verificare l’inserzione del
vettore. Negli altri tipi di protocollo, la necessità di monitorare i pazienti per l’integrazione del
vettore verrà valutata caso per caso. In tutti i casi, tale monitoraggio non deve essere considerato un
surrogato del controllo di effetti avversi del trattamento.
Riattivazione di virus latenti - Il protocollo clinico dovrà prendere in considerazione la possibile
riattivazione nel paziente di virus latenti (quali herpes virus, Epstein-Barr, Citomegalovirus) e
prevedere relativi adeguati controlli sia nella selezione dei pazienti che nel periodo di osservazione
successivo alla terapia. Altrettanto vale per la possibilità di complementazione nel paziente di
vettori virali deficienti per la replicazione a causa della presenza di virus endogeni.
Effetti immunitari - La sovra-espressione del gene terapeutico e/o di qualsiasi costituente del
vettore genico, in particolare in organi o tessuti non-bersaglio, può portare ad una attivazione
indesiderata del sistema immune (ad esempio, risposte infiammatorie croniche, induzione di
fenomeni di auto-immunità). Dovrà essere presa in considerazione l'immunogenicità del prodotto
del gene introdotto, indipendentemente dal fatto che il meccanismo d'azione previsto sia mediato o
meno dalla risposta immune.
Mobilizzazione del materiale genetico - Come è stato già evidenziato, la competenza alla
replicazione virale recuperata in vivo in seguito a eventi di co- o super-infezione del paziente con
virus correlati, oppure a seguito di eventi di ricombinazione con sequenze virali endogene, può
portare alla mobilizzazione del materiale genetico verso cellule non-bersaglio (ad esempio, cellule
della linea germinale) o alla sua diffusione verso il personale medico o para-medico, verso i
familiari del paziente o ad altri. Nel protocollo clinico dovranno essere descritte le procedure atte a
riconoscere e minimizzare questi rischi.
Considerazioni in termini di salute pubblica - Dovranno essere considerati:
• quali sono le possibilità che il vettore contenente il materiale genetico possa propagarsi oltre il
bersaglio previsto (ad esempio, diffusione di vettori competenti per la replicazione, ricombinazione
con virus helper, ecc.);
• le misure preventive intese a minimizzare o eliminare il rischio di diffusione del prodotto ad altri
individui come il personale medico infermieristico o nell'ambiente;
• quali saggi sono previsti per controllare un’eventuale diffusione del medicinale sperimentale al di
fuori del soggetto della sperimentazione;
• se e per quanto tempo il paziente dovrà essere mantenuto in isolamento e in base a quali criteri
potrà uscirne;
• i criteri di selezione del personale medico e paramedico che può venire in contatto col paziente e
con suo materiale biologico;
• come tale personale viene informato sul protocollo sperimentale.
• eventuali accertamenti da eseguirsi sul personale.
Esempio di valutazione del rischio: impiego confinato di MOGM di classe 2
Descrizione del MOGM
Vettori adenovirali ricombinanti contenenti una proteina terapeutica, VEGF (Vascular endothelial
growth factor) che promuove la crescita del tessuto endoteliale vascolare.
Scopo dell’uso confinato
Produzione di vettori adenovirali contenenti il gene che codifica per il fattore di crescita endoteliale
vascolare umano. Questa proteina ha una potenzialità terapeutica efficace nel trattamento delle
malattie coronariche e vascolari.
PROCEDURA 1
Identificazione dei pericoli potenziali derivanti dall’uso del MOGM
Organismo ricevente
L’organismo ricevente è l’adenovirus type 5. Virus ubiquitario, causa una blanda malattia
respiratoria che non richiede specifico trattamento terapeutico, non è associato ad effetti tossici o
allergenici. La regione E1 e parte della E3 del genoma sono state rimosse per rendere il vettore
virale deficiente per la replicazione.
Organismo ospite
La cellula ospite è la linea cellulare PERC6 derivata da retinoblasti di embrioni umani trasformati
con la regione E1 di adenovirus type 5. Dal momento che il vettore adenovirale è replicazione
deficiente, gli adenovirus ricombinanti possono crescere solo in cellule di complementazione come
le PERC6 che contengono le appropriate sequenze E1.
Le cellule PERC6 non sono in grado di sopravvivere al di fuori delle opportune condizioni di
laboratorio, è, quindi, poco probabile che le cellule ricombinanti PERC6 proliferino o sopravvivano
nell’ambiente e possano determinare rischi per gli animali, le piante o l’ambiente.
Inserto
Il gene per la proteina VEGF è un gene umano e non pone rischi per la salute umana e per
l’ambiente.
Il vettore
La costruzione dell’adenovirus ricombinante è un processo realizzato in due fasi in cui la cassetta di
espressione desiderata è prima assemblata in un vettore pUC e successivamente trasferita nel
genoma adenovirale per ricombinazione omologa.
Il vettore pUC ha una storia di sicurezza d’uso. Il vettore adenovirale è difettivo per la replicazione
in seguito alle delezioni delle regioni E1 ed E3.
Il MOGM
L’adenovirus ricombinate contiene il gene per una proteina terapeutica VEGF che promuove la
crescita dei tessuti endoteliali vascolari. E’ replicazione deficiente e può replicare solo in cellule di
complementazione che portano il gene E1. Non può replicare in vivo o in cellule in vitro. Visto che
è deficiente per la replicazione tale virus è meno patogeno del wild type, ed è minima la sua
capacità di colonizzazione.
L’eventuale reversione alla competenza per la replicazione di un adenovirus deve prevedere la
realizzazione di due eventi di ricombinazione non omologa (uno per la regione E1 e l’altro per la
regione E3). Nel caso in cui si verificasse una ricombinazione con la regione E1 delle PERC6,
l’adenovirus risultante non conterrà la regione E3 dal momento che le cellule PERC6 non la
contengono. L’assenza della regione E3 riduce la fitness del virus come agente infettivo.
Considerazioni sulla salute umana
L’ adenovirus type 5 wild type è ubiquitario e causa leggere infezioni del tratto respiratorio. Se il
ceppo di adenovirus type 5 non competente per la replicazione riacquistasse tale capacità, il rischio
associato sarebbe basso dal momento che le infezioni adenovirali umane sono molto comuni e la
maggior parte degli adulti ne è stato infettato.
Considerazioni ambientali
È possibile che l’adenovirus modificato possa mimare alcune delle principali caratteristiche del
wild-type. Comunque gli adenovirus possono replicare solo in presenza di cellule di
complementazione (PERC6) e conseguentemente pongono bassi rischi per la salute di animali,
piante e
ambiente.
Iniziale classificazione del MOGM
Adenovirus type 5 wild type è ubiquitario e causa leggere infezioni del tratto respiratorio. La
regione E1 e maggior parte della E3 del genoma sono state rimosse per rendere il vettore virale
deficiente per la replicazione. VEGF è una proteina umana e non pone rischi per la salute umana e
per l’ambiente. Il vettore pUC ha una storia di sicurezza d’uso.
È possibile che l’adenovirus modificato possa mimare alcune delle principali caratteristiche del
wild-type o porre un rischio in individui immunocompromessi.
È’ quindi assegnata la classe 2, per attività con MOGM a basso rischio per cui un livello di
contenimento 2 è appropriato a proteggere la salute umana e l’ambiente.
Valutazione della possibilità che si verifichino effetti pericolosi
Natura delle attività
Gli esperimenti riguardano tecniche standard della biologia molecolare che non comportano speciali
rischi e tutte sono condotte in accordo con le procedure operative di sicurezza standard.
Concentrazione e scala
Una tipica preparazione consiste nell’utilizzo di 30 flasks contenenti 30 ml di medium di coltura. Il
pellet è raccolto dalle flasks e il virus è rilasciato in seguito a ripetuti congelamenti- scongelamenti.
Il virus è isolato a una tipica resa di 1 X10 10 PFU/ml.
Condizioni di coltura
Vettori adenovirali sono propagati in cellule PERC6. Le condizioni di coltura sono descritte sopra.
Il MOGM è incubato a 32°C per 36-48 ore.
Ambiente potenzialmente esposto
Solo l’ambiente laboratorio è esposto e una particolare cura viene presa per assicurare che il
MOGM sia contenuto e che le aree e le persone fuori del laboratorio non siano esposte al MOGM.
Inoltre ci si aspetta che il MOGM non sopravviva per un periodo significativo fuori dalle condizioni
di laboratorio.
Presenza di specie suscettibili
Ne’ uomo, ne’ animali, ne’ piante sono suscettibili all’adenovirus type 5. Le persone
immunocompromesse costituiscono il rischio più rilevante.
Se l’ambiente può favorire la sopravvivenza del MOGM
L’adenovirus ricombinate è deficiente per la replicazione, può replicare solo in cellule PERC6.
Effetti sull’ambiente fisico
Poiché è incapace di sopravvivere nessun effetto è atteso.
PROCEDURA 2
Determinazione della classificazione finale e delle misure di contenimento
Adenovirus type 5 wild type è classificato in classe 2. E’ubiquitario e causa leggere infezioni del
tratto respiratorio.
La regione E1 e maggior parte della E3 del genoma sono state rimosse per rendere il vettore virale
deficiente per la replicazione.
VEGF è umana e non pone rischi per la salute umana e per l’ambiente.
Il vettore pUC ha una storia di sicurezza d’uso.
È possibile che l’adenovirus modificato possa mimare alcune delle principali caratteristiche del
wild-type o porre un rischio in individui immunocompromessi.
È’ quindi assegnata la classe 2, per attività con MOGM a basso rischio per cui un livello di
contenimento 2 è appropriato a proteggere la salute umana e l’ambiente.
L’impiego di tale MOGM è quindi classificato come Classe d’impiego 2