Patogenesi delle infezioni batteriche
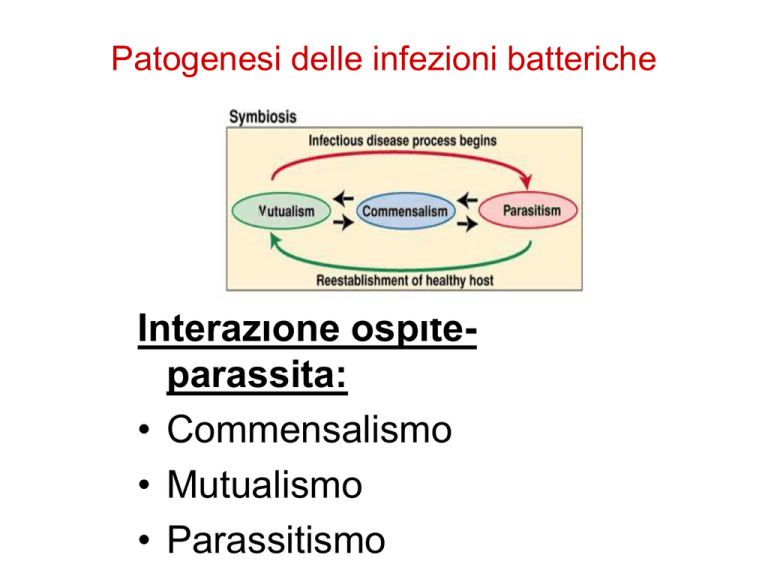
Interazione ospiteparassita:
• Commensalismo
• Mutualismo
• Parassitismo
COMMENSALISMO
Relazione simbiotica in cui un organismo,il
commensale, trae da essa beneficio, mentre
l’altro, l’ospite non ne viene né danneggiato
né favorito. Es. E.coli (Colon)
MUTUALISMO
Particolare tipo di relazione dalla quale
derivano benefici reciproci per entrambi i
partner e dove i membri sono
metabolicamente dipendenti l’uno dall’altro.
Mechanisms by which the normal flora competes with invading pathogens.
Studies with antibiotic treated animals suggest that the flora protects individuals from pathogens.
Investigators have used streptomycin to reduce the normal flora and have then infected animals
with streptomycin-resistant Salmonella. Normally, about 106 organisms are needed to establish a
gastrointestinal infection, but in streptomycin-treated animals whose flora is altered, fewer than 10
organisms were needed to cause infectious disease.
.
PARASSITISMO
• parassita = organismo che danneggia o vive a
spese di un altro organismo (ospite) di specie
diversa.
• Parassitismo = relazione tra parassita e ospite
• Nella patogenesi il termine parassita è sostituito
con il termine patogeno
1 commensalismo:
Escherichia Coli vive nel colon
Candida albicans può trovarsi sulla cute
2 mutualismo:
microflora dell’intestino
(Lactobacillus, Enterococchi, Bacteroides)
3 parassitismo:
Virus
Patogeno: microrganismo capace di produrre malattia in una
certa percentuale di individui sani e non immuni.
Patogenicità : capacità di un microrganismo di
causare la malattia.
Patogeno opportunista = microrganismo che non causa
malattia in un ospite sano, ma solo in individui
immunocompromessi (ustionati , trapiantati, malati
d’AIDS, donne in gravidanza, etc.)
Infezione: moltiplicazione dei microrganismi nell’ospite
senza danno.
Malattia: moltiplicazione dei microrganismi nell’ospite e
danno.
Azione patogena dei batteri
• Un batterio è considerato patogeno quando è in grado
di invadere i tessuti di un organismo umano e di
moltiplicarvisi, danneggiando il normale funzionamento
dell’organismo ospite con la produzione di una o più
sostanze tossiche.
• Le due componenti fondamentali del potere patogeno
sono:
– a) moltiplicazione in vivo
– b) tossinogenicità
Queste dipendono dalla virulenza del batterio
• Virulenza: capacità dei batteri di
instaurare ed estendere una infezione,
moltiplicandosi nei tessuti dell’ospite.
Virulenza:
Viene determinata con la:
DL50: n° dei microrganismi (o tossine) richiesti per
uccidere il 50% degli animali testati
sperimentalmente.
ID50: n° di microrganismi richiesti per produrre una
infezione nel 50% degli animali testati.
Tossigenicità : proprietà che ha il patogeno di produrre
tossine, sostanze in grado di danneggiare l’ospite e di
causare malattia.
Virulenza dei batteri
Penetrazione
Colonizzazione
Competizione con i batteri commensali
Contrasto dei meccanismi di detersione delle superfici
mucose dell’ospite (movimento del contenuto del lume
intestinale o del muco convogliato dagli epiteli vibratili
delle mucose respiratorie).
Competition between host cells and bacterial pathogens
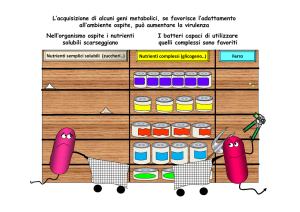
for iron, illustrating the importance of siderophores.
Since free iron is scarce in tissue fluids and blood, bacterial
siderophores compete effectively for Fe3+ bound to
lactoferrin and transferrin.
Chronic pulmonary infections with Pseudomonas aeruginosa are a
debilitating component of the genetic disease cystic fibrosis (CF). The
persistence of these infections is partly due to iron uptake
as this contributes to bacterial growth and the formation of resilient biofilms
.
• La fibrosi cistica (FC),, è una malattia genetica
•
La patologia è causata da una mutazione del gene CFTCR (Cystic
Fibrosis Transmembrane Conductance Regulator) che codifica una
proteina di 1480 aminoacidi situata sulla membrana cellulare delle
cellule epiteliali, la cui funzione, normalmente, è quella di
trasportare il cloro attraverso le membrane cellulari delle vie
aeree ,dell’intestino , del pancreas causando squilibrio ionico
•
(
Manifestazioni cliniche della Fibrosi cistica.[35]
I segni distintivi della fibrosi
Patogenesi dei batteri
I fattori di virulenza dei batteri sono
principalmente 4:
• Adesine
• Capsula
• Esoenzimi
• Tossine (esotossine, endotossine).
Fattori di virulenza
toxin
Adesività batterica
• Capacità del batterio di aderire in maniera
specifica e selettiva alla superficie delle
cellule di vari epiteli mucosi.
• Si deve all’interazione di strutture superficiali
del batterio (adesine) con la porzione
glicidica di glicoproteine e glicolipidi
presenti alla superficie delle cellule che dei
diversi epiteli mucosi.
Fattori di adesione
• Adesine sulla superficie della cellula
batterica che interagiscono con un
recettore sulla superficie delle cellule
dell’ospite
Fattori di virulenza: adesine
Fattori di virulenza: adesione
Altri fattori di adesione
• Glicocalice: strato di fibre eso-polisaccaridiche all’esterno della cellula
batterica.
• Acidi teicoici e lipoteicoici (gram+; LTA
streptococchi)
Streptococchi: Proteina M
N terminal region
The coiled-coil dimeric nature of M protein and its relationship to
the bacterial cell surface is shown. The N-terminal region of the
M protein, distal to the cell surface, varies among different M
types, thereby providing the molecular basis of Dr. Lancefield's
method of serotyping group A streptococci.
In contrast, the C-terminal region of M protein, commencing at
the pepsin susceptible site, is more conserved. The physical
relationship between the cell membrane, cell wall, the group A
specific carbohydrate and M protein are also indicated.
C terminal region
Un biofilm o biopellicola, è una aggregazione
complessa di microorganismi contraddistinta dalla
secrezione di una matrice adesiva e protettiva,
Costituito da oligosaccaridi, piccoli peptidi, proteine
Favorisce il legame del batterio ai corpi estranei (CVC)
Un biofilm è una comunità strutturata di
cellule batteriche racchiuse in una matrice
polimerica autoprodotta ed adesa ad una
superficie inerte o vivente.
Fig. 1: The biofilm life cycle,
1. individual cells populate the surface.
2.extracellular polymeric substances is produced and attachment becomes irreversible.
3.4. biofilm architecture develops and matures.
5: single cells are released from the biofilm
In ospedale, ma talora anche a domicilio, può accadere che un paziente non sia in
grado di alimentarsi per via naturale
Il catetere venoso centrale (CVC) è un
presidio medico utilizzato soprattutto nei
reparti di terapia intensiva per l'infusione di
liquidi la somministrazione di farmaci
endovena, ma anche di nutrizione
parenterale.
CDC
controllo sulla sanità pubblica degli
Stati Uniti d’America che ha il compito
di monitorare, prevenire e suggerire gli
interventi più appropriati in caso di
contagio diffuso ed epidemie
Per infezione acquisita in Ospedale si
definisce un’infezione contratta durante il
ricovero in ospedale, che non era manifesta
clinicamente né in incubazione al momento
dell’ammissione, ma che compare durante o
dopo il ricovero
Si manifestano in genere dopo 48 dal ricovero
durante la degenza stessa o dopo le dimissioni
Capsula
• I polimeri capsulari
Possono inibire la
fagocitosi da parte
delle cellule fagocitarie.
Esoenzimi batterici
I batteri producono enzimi che, favorendo
l’apertura di varchi nei tessuti, consentono la
diffusione dei batteri attraverso i tessuti dell’ospite
• Ialuronidasi
• Stafilochinasi( dissolve la fibrina) e Streptochinasi(
trasforma il plasminogeno in plasmina)
• Collagenasi
• Proteasi
• DNAsi
• Lipasi
• Coagulasi ( stafilococchi)
Coagulasi (solubile)
reagisce con un fattore presente
nel plasma (CRF- coagulase
reacting factor ) per formare
stafilotrombina, che trasforma il
fibrinogeno in fibrina
Protegge il batterio dalla fagocitosi
Clumping factor (coagulasi legata alla cellula)
lega il fibrinogeno trasformandolo in fibrina,
causando l’aggregazione degli stafilococchi (clump)
Coagulasi: è un enzima che coagula il plasma e provoca il
deposito di uno strato protettivo di fibrina intorno alla cellula
batterica, ostacolando così la fagocitosi da parte
dell’organismo ospite o la loro distruzione all'interno di tali
cellule.
Quindi la produzione di coagulasi è sinonimo di potenziale
patogeno
Tossine
Definizione: veleni batterici responsabili del
danno all’organismo ospite e della sintomatologia
morbosa
esotossine
endotossine
ESOTOSSINE
•Sono prodotte sia dai Gram+ che Gram -.
•Sono liberate dal batterio nell’ambiente esterno.
•Si possono separare dai batteri che le producono per
filtrazione o centrifugazione.
•Sono di natura proteica.
•Sono termolabili (tranne alcune eccezioni-toss eritrogenica , enterotossina
stafilococcica, streptolisina S )
•Distrutte dai succhi gastrici
(tranne enterotossina stafilococcica e botulinica).
•Sono ottimi antigeni.
•Il loro potere tossico è neutralizzato dall’anticorpo specifico.
•Alcune possono essere trasformate in anatossine
(molecole derivate da tossine che mantengono il potere antigenico, ma hanno
perduto il potere tossico) .
ENDOTOSSINE
• Sono prodotte dai soli Gram • Gruppo di veleni contenuti nella cellula batterica.
• Non si liberano nell’ambiente se non dopo la lisi dei
batteri che le contengono
• Sono di natura lipopolisaccaridica.
• Il loro potere tossico non è neutralizzato dall’anticorpo
specifico.
• Resistono all’azione dei succhi gastrici.
• Sono termostabili.
• Non possono essere detossificate.
•
•
•
•
ESOTOSSINE: struttura molecolare
Sono di natura proteica.
tossine monomeriche = costituite da una sola
molecola proteica (alcune).
tossine dimeriche = formate da due diverse subunità
peptidiche (tenute insieme da legami disolfuro): A e
B. Il peptide B è il peptide che è in grado di
interagire con recettori presenti alla superficie della
cellula bersaglio, provocando nella membrana
cellulare una serie di alterazioni che consentono la
traslocazione intracellulare del peptide A che è
quello dotato della azione tossica specifica (maggior
parte delle tossine).
Tossine multimeriche = il componente B è un oligomero
formato da un certo n° di peptidi identici o diversi.
Struttura delle esotossine
Tossine A-B
Supeficie cellulare
Attiva (tossica)
A
Binding
B
ESOTOSSINE
classificazione in base alle cellule bersaglio
Tossine citolitiche = in grado di ledere le membrane delle cellule
bersaglio provocandone la morte. Dette anche emolisine per il
fatto che le emazie rappresentano il tipo di cellule più facilmente
utilizzabili in vitro per dimostrarne l’azione.
Tossine neurotrope = le cui cellule bersaglio sono localizzate nel
SNC o periferico.
Enterotossine = attive a livello delle cellule della mucosa
intestinale e la cui azione tossica si traduce nella comparsa di
diarrea.
Tossine pantrope = in grado di danneggiare qualsiasi cellula in
possesso di recettori idonei a fissare la tossina.
ESOTOSSINE
classificazione in base al meccanismo d’azione
• tossine che agiscono a livello extracellulare
( Es. tossina epidermolitica di S. aureus).
• tossine che agiscono a livello della membrana cellulare
(Es. tossine emolitiche -leucocidine di S. aureus )
• tossine che penetrano nella cellula modificandone la
fisiologia(tossina colerica, tossina della pertosse)
• tossine che penetrano nella cellula uccidendola
(tossina difterica).
Tossine che agiscono a livello extracellulare
• La principale è la tossina esfoliativa o tossina
epidermolitica prodotta da alcuni stipiti di S. aureus,
responsabile della sindrome della cute ustionata o
malattia di Ritter.
• La malattia è conseguente alla colonizzazione
dell’epidermide ad opera di stafilococchi produttori della
tossina, la quale si diffonde nell’epidermide, provoca la
rottura dei desmosomi dello strato granuloso, con il
conseguente scollamento spontaneo di ampie zone degli
strati superficiali di epidermide necrotica.
La tossina è una serino-proteasi ed ha la proprietà del
superantigene.
Tossina esfoliativa
Esistono 2 forme della tossina:
ETA termostabile, cromosomica
ETB termolabile, plasmidica
Agisce sui desmosomi(giunzioni cellulari ,mantengono la forma e la consistenza
dei tessuti,
Rompe i ponti cellulari dello strato granuloso dell’epidermide
Tossina esfoliativa
Sindrome della cute ustionata
(SSSS, Staphylococcal Scalded Skin Syndrome,
Sindrome di Ritter)
La tossina induce la
produzione di
anticorpi neutralizzanti
proteggenti che
portano alla risoluzione
del processo tossico (7-10 gg)
Colpisce i bambini di 1-3 anni
Tossine che agiscono a livello della membrana cellulare
(citolisine, emolisine)
• Le tossine citolitiche hanno come bersaglio la
membrana cellulare di cui modificano l’integrità
fisiologica e strutturale provocando al lisi e la
morte della cellula bersaglio. Es. tossina gamma
di S. aureus
Queste tossine possono essere riconducibili a 2
meccanismi principali:
1) formazione di pori o di canali attraverso la
membrana e
2) distruzione enzimatica di componenti lipidici
della membrana.
A) Formazione di pori o canali transmembranari:
• Alcune tossine citolitiche
si inseriscono nel doppio
strato lipidico della
membrana formando dei pori
o canali che mettono in
comunicazione diretta il
citosol con l’ambiente
esterno, alterando la
funzionalità della membrana.
•
Es. emolisine alfa di S. aureus,
streptolisina O di Streptococcus
pyogenes = EMOLISI
B) Azione enzimatica su lipidi di membrana:
• Leucocidine di S. aureus e P.
aeruginosa, citotossiche per i fagociti.
• L’azione tossica sulla membrana
lisosomiale causa la liberazione
degli enzimi lisosomiali e la necrosi
della cellula.
Tossine ADP-ribosilanti
• agiscono sul NAD, staccando la molecola di
nicotinamide e trasferendo il resto della
molecola (adenosina-difosfato-riboso) su una
molecola proteica bersaglio.
• Questi enzimi hanno come bersaglio alcune
proteine della cellula eucariotica.
• Es. tossina difterica, tossina A di P.
aeruginosa, tossina colerica, tossina della
pertosse,
Tossina difterica
•Tossina pantropa ( colpisce in particolare: Cuore e Sistema
nervoso)
•Inibisce la sintesi proteica cellulare
•E’ costituita da una catena polipeptidica di 62.000 daltons, che
per l’azione di proteasi dà origine a 2 frammenti detti “A” (
21.500 daltons) e “B” (40.500 daltons) che rimangono uniti
tramite un ponte disolfuro.
Tossina difterica
• Il frammento B si lega sulla membrana cellulare e tale
legame determina l’ingresso nella cellula del frammento
A
• Il frammento A agisce sul NAD staccando la
nicotinamide e catalizzando il legame della porzione
residua della molecola (ADP-riboso) con il fattore EF2
che nelle cellule eucariotiche , interviene nella biosintesi
della catena polipeptidica a livello della traslocazione sul
ribosoma
• BLOCCO DELLA SINTESI PROTEICA CELLULARE
Electron micrograph of corynebacteriophage ß,
which carries tox. Following lysogenic conversion
with corynebacteriophage ß, or closely related
corynebacteriophages, nontoxigenic strains of C
diphtheriae become toxigenic.
Ribbon diagram of the X-ray crystal
structure of monomeric native
diphtheria toxin
Diphtheria Toxin
•
Dominio
catalitico
•
•
•
•
The Diphtheria Toxin (DT)
Monomer
A (red) is the catalytic domain;
B (yellow) is the binding domain
which displays the receptor for
cell attachment;
T (blue) is the hydrophobic
domain responsible for
insertion into the endosome
membrane to secure the release
of A. The protein is illustrated in
its "closed" configuration.
Dominio
transmembrana
Dominio
per il binding
Recettore per EPGF
eparin binding
Schematic diagram of the diphtherial intoxication of a sensitive eukaryotic
cell. The toxin binds to its cell surface receptor and is internalized by receptormediated endocytosis; upon acidification of the endosome the transmembrane
domain inserts into the vesicle membrane; the catalytic domain is delivered to
the cytosol, resulting in inhibition of protein synthesis and death of the cell.
Il RECETTORE per la tossina è il fattore dincrescita epidermica presente in molte cellule cardiache e
nervose
• Una volta nel citoplasma della cellula bersaglio, il
peptide A interrompe la sintesi proteica per inattivazione
della trasfearsi -2 (Elongating Factor-2, EF2) cioè
l’enzima che provvede al trasferimento dell’aminoaciltRNA dal sito accettore al sito donatore del ribosoma
delle cellule eucariotiche.
• NAD + EF2 + tossina (A) —————————→ ADPREF2
• La tossina stacca dal NAD la frazione adenosina difosfato-ribosile (ADPR) e la unisce all’EF2,
inattivandolo. La sintesi proteica è bloccata e la cellula
muore.
• EF2 è la sola proteina ADP-ribosilata dalla tossina
difterica
Tossina difterica
Uptake and activity of the diphtheria toxin in Eukaryotic cells
The figure above was redrawn from the Diphtheria Toxin Homepage at UCLA. A
represents the A/B toxin's A (catalytic) domain; B is the B (receptor) domain: T is
the hydrophobic domain that inserts into the cell membrane.
Corynebacterium
•
Corynebacteria are Gram-positive, aerobic, nonmotile, rod-shaped bacteria
Stained cells. The "barred" appearance is due to the presence of polyphosphate
inclusions called metachromatic granules. Note also the characteristic
"Chinese-letter" arrangement of cells.
Presenta Granuli metacromatici o granuli di Babes-Ernst accumulo di sostanze
nutritizie evidenziabili con colorazione di Gins-Albert al blu di metilene
Tossina colerica
• Grossa molecola proteica (P.M. = 80.000 Da)
• Oligomero formato dall’unione non covalente da 1 subunità A
e di 5-6 subunità B che circondano come una corona la
subunità A. La subunità A è formata da 2 catene
polipeptidiche dette A1 e A2 tenute insieme da un ponte
disolfuro.
•La catena A1 è la vera responsabile dell’azione tossica,
mentre la A2 è importante per unire la subunità A alle
varie subunità B.
Tossina colerica
•Le subunità B sono le responsabili dell’interazione e del
legame tra la molecola tossica ed i recettori specifici di
membrana delle cellule bersaglio (recettori di natura
gangliosidica).
•La subunità A attraversa la membrana penetrando nel
citosol cellulare.Viene liberata la subunità A1,
•.Viene attivata l’adenilato-ciclasi con conseguente
iperproduzione di AMP-ciclico.
•Effetti della tossina: alterazione del passaggio di acqua
ed elettroliti attraverso la membrana dell’enterocita
perdita di acqua nel lume intestinale conseguente
diarrea e disidratazione dell’organismo.
Tossina colerica
• catalizza l'ADP-ribosilazione di una proteina
G. Ciò ha come risultato, un continuo stato di
attivazione della proteina G che va a
stimolare l'attività di una adenilato ciclasi che
stimola cAMP
• L'elevata presenza di cAMP risultante, ha sui
villi l'effetto di bloccare l'ingresso di sodio ,
cloro ed acqua
Vibrio cholerae
Enterotossina: coleragene
- Consta di una frazione tossica A (suddivisa in A1 e A2)
e di 5 frazioni B (carrier e legame con il recettore)
- Recettore: ganglioside GM1 presente sulle cellule
epiteliali dell’intestino tenue
Provoca:
- aumento di AMPc
- liberazione di ioni sodio, potassio, bicarbonato
(effetto: eliminazione di acqua)
Il microrganismo è poco invasivo: la patogenicità è
legata alla tossina.
tossina colerica
Vibrio cholerae
Patogenesi ed Immunità
Meccanismo d’azione della tossina colerica.
La subunità B si lega al ganglioside GM1 delle cellule epiteliali permettendo la
successiva internalizzazione nell’enterocita delle subunità A tramite un canale
idrofobico.
1
All’interno della cellula, la subunità si dissocia in A1 e A2.
A1catalizza
catalizzalal'ADP-ribosilazione
di una proteina
G(la
proteina Gregolatorio
controlla
A1
ADP-ribosilazione sull’arginina
di un
complesso
l’adenilato ciclasi ) Ciò ha come risultato, un continuo stato di attivazione della
(Proteina
cheva
a sua
volta attiva
l’adenilato
presente
proteina G)
G che
a stimolare
l'attività
di unaciclasi
adenilato
ciclasisulle
con membrane
conseguente
aumento
di AMP
–c
cellulari
a livello
dell’epitelio
intestinale.
2
3
A1 catalizza l'ADP-ribosilazione di una proteina Ciò ha come risultato, un
continuo stato di attivazione della proteina G che va a stimolare l'attività di
l'attività
GTPasica
proteina
G è bloccata.
una adenilato
ciclasidella
che stimola
cAMP
Ne consegue iperproduzione di cAMP che stimola massiva secrezione di
ioni sodio, potassio, bicarbonato con rilascio di acqua nel lumen,
disidratazione e morte (in assenza trattamento).
Vibrio cholerae
Patogenesi ed Immunità
Accumulo di cAMP
cAMP provoca
secrezione attiva di
Na+, Cl-, HCO3K + e H2 O
V. cholerae non invade l’intestino, ma si attacca all’epitelio
intestinale tramite i pili e l’azione della tossina rende le
cellule altamente permeabili ai liquidi (si
può perdere
1 litro d’acqua in 1 ora, fino a 20 litri in 1 giorno).
L’epitelio intestinale è danneggiato ed i sintomi sono:
dolore addominale, diarrea aquosa e vomito.
Per la presenza di muco, le feci diarroiche vengono
definite “ad acqua di riso”.
Attacco e colonizzazione
di Vibrio cholerae
Tossina della pertosse
• P.M = 105 kDa
• formata da 5 differenti
subunità (S1 - S5) a differente
mobilità elettroforetica.
• La porzione attiva A della
molecola è formata dal
monomero S1, mentre la
porzione B è un oligomero
formato da due dimeri ( S2+S4
ed S3+S4) ed un monomero
S5.
• La proteina bersaglio è la
proteina G, regolatrice
dell’adenilato ciclasi presente
nella membrana cellulare.
Le cellule rispondono in modo anomalo agli stimoli
provenienti dall'esterno e l'aumento dell‘AMP ciclico porta ad
un aumento delle secrezioni respiratorie e della
produzione di muco.
Principali gruppi di esotossine-4
(classificate per meccanismo d’azione)
Tossine (neurotrope) che
interferiscono con il rilascio di
neurotrasmettitori:
* tossina tetanica
* tossina botulinica
Tossina tetanica
• Agisce a livello del sistema nervoso
centrale bloccando l’impulso nervoso
inibitore del riflesso da stiramento
muscolare (GABA), per cui ad ogni
contrazione muscolare segue la
contrazione dei muscoli antagonisti con
una contrattura spastica di tutta la
muscolatura che si traduce nell’incapacità
funzionale della stessa muscolatura
(paralisi spastica)
Neurotrasmettitori eccitatori
STIMOLAZIONE
CONTINUA
Neuro–trasmettitori inibitori
BLOCCATI:
Diffonde lungo i
cilindrassi dei nervi
motori e raggiunge il
midollo spinale dove
blocca la trasmissione
a livello delle sinapsi
inibitorie (dando luogo
ad impulsi eccitatori
(paralisi spastica)
Tale blocco da via libera agli impulsi eccitatori.
il blocco degli impulsi inibitori provoca una serie di
spasmi generalizzati che interessano i m. estensori e flessori PARALISI
SPASTICA
Le neuro-tossine
Botulismo
• Sono state identificate 7 diverse varianti
antigeniche delle neurotossine
botuliniche (A-G).
• La A,B,E e raramente la F producono
botulismo nell’uomo.
• La neurotossina viene sintetizzata
all’interno della cellula batterica durante
la crescita anaerobica , dopo la
germinazione delle spore.
• Rilasciata all’esterno, associata ad altri
componenti proteici non tossici, grazie
a questi è protetta dalla denaturazione
dovuta ai succhi gastrici.
• Botulismo :
• I pazienti affetti da Botulismo manifestano
debolezza e stato confusionale dopo 1-2gg
dal consumo dell’alimento contaminato con
la tossina.
• I segni iniziali sono:
• Vista offuscata e pupille dilatate e fisse,
bocca secca ( indicativa degli effetti
anticolinergici della tossina),costipazione e
dolori addominali.
• Paralisi flaccida, debolezza discendente
bilaterale a carico dei muscoli periferici che
può portare alla morte per paralisi dei
muscoli respiratori.
• Mortalità oggi è del 10%, grazie alla terapia
di supporto, nel trattamento delle
complicanze respiratorie.
Il botulismo infantile è una malattia rara,
riconosciuta per la prima volta in California nel
1976, che colpisce
i neonati al di sotto dell’anno di età.
Il miele è il solo veicolo alimentare sicuramente
correlato, da evidenze epidemiologiche e di
laboratorio,al botulismo infantile
Endotossine
Un gruppo di veleni contenuti nella cellula
batterica, che non si liberano nell’ambiente se
non dopo la lisi dei batteri stessi.
• Sono prodotte dai soli Gram-.
• Sono di natura Lipopolisaccaridica.
• Il loro potere tossico non è neutralizzato
dall’anticorpo specifico.
• Termostabili.
• Resistono all’azione dei succhi gastrici.
• Non possono essere detossificata.
Meccanismi d’azione dell’endotossine:
Liberazione massiccia di alcune citochine infiammatorie .
Interazione con gli endoteli vascolari.
Attivazione del complemento per via alternativa.
Attivazione della cascata di eventi legati alla coagulazione
del sangue.
Aumento della permeabilità vascolare
Coagulazione intravasale disseminata (CID)