XXIV Incontro di Strabologia e Neuroftalmologia
Bosisio Parini (LC), 11 marzo 2017
Compromissioni
neuro-oftalmologiche
pupillari
Stefano Pensiero
Paola Michieletto
SC Oculistica e Strabologia
IRCCS Burlo Garofolo di Trieste
IRCCS Eugenio Medea
Pieve di Soligo (TV)
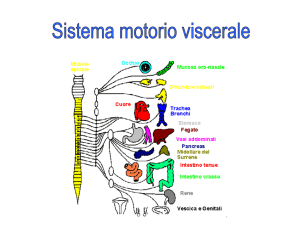
Sistema Nervoso Autonomo
• Involontario.
• L’informazione sensoriale è trasmessa a Centri di
controllo omeostatico localizzati principalmente
nell’ipotalamo o nel tronco encefalico.
• L’elaborazione a livello di questi Centri produce
segnali nervosi che modificano l’attività dei neuroni
autonomi pregangliari.
• L’attività dei Centri può anche essere influenzata da
aree cerebrali superiori, corteccia e sistema limbico,
coinvolte nelle risposte emozionali
Via efferente
• Consiste di 2 neuroni
1. neurone pregangliare: il suo corpo cellulare è localizzato nel
corno laterale della sostanza grigia della midolla spinale o nel
tronco dell’encefalo, a livello dei nuclei dei nervi cranici. Il suo
assone termina a livello di un ganglio autonomo ed ha sinapsi
con un
2. neurone postgangliare, che innerva il tessuto effettore.
• La sinapsi tra neurone postgangliare e tessuto effettore
(neuroeffector junction) è particolare: il neurone, entrato nel
tessuto effettore, presenta dilatazioni multiple, dette varicosità,
che rilasciano il neurotrasmettitore in un’ampia area; questo si
diffonde ulteriormente attraverso il liquido interstiziale ed in
alcuni tessuti ha un effetto globale per la presenza di gap
junctions (cuore).
Corno laterale
Divisioni del Sistema Autonomo
• Due divisioni anatomicamente e funzionalmente distinte:
– Sistema Simpatico
– Sistema Parasimpatico
• Entrambi costituiti da neuroni tonici (a potenziale graduato)
che possono perciò sia incrementare che ridurre la loro
frequenza di scarica: ciò permette una regolazione precisa
delle funzioni tissutali.
• La maggior parte dei tessuti sono innervati da entrambi i
Sistemi (all’aumento dell’attività dell’uno corrisponde una
simultanea riduzione dell’altro), ciò permette una regolazione
più precisa.
Principali caratteristiche dei Sistemi
Simpatico e Parasimpatico
Sistema Simpatico
catena gangliare simpatica paravertebrale
Sistema Parasimpatico
• I neuroni pregangliari escono dal SNC attraverso i
nervi cranici per raggiungere il ganglio localizzato in
prossimità del tessuto effettore:
– III (oculomotore comune): innervazione
dell’occhio, ganglio ciliare.
– VII (faciale): ghiandola lacrimale, ghiandole
salivari, mucusa nasale.
– IX (glossofaringeo): ghiandola parotide (salivare).
– X (vago): cuore, polmone, stomaco pancreas,
intestino, fegato.
Neurotrasmettitori
• Acetilcolina: tutti i neuroni pregangliari; tutti i
neuroni postgangliari del Sistema Parasimpatico.
Recettori colinergici:
– Nicotinici
– Muscarinici
• Norepinefrina (adrenalina): la maggior parte dei
neuroni postgangliari del Sistema Simpatico.
Recettori adrenergici:
– α1
– β1
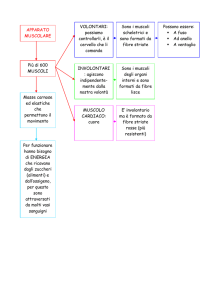
Muscoli involontari dell’occhio
• Muscolo ciliare: accomodazione.
– Rilassamento per visione a distanza: simpatico β2.
– Contrazione per visione per vicino: parasimpatico.
• Muscolo sfintere dell’iride: miosi.
– Contrazione per miosi: parasimpatico.
• Muscolo dilatatore dell’iride: midriasi.
– Contrazione per midriasi: simpatico α1.
Alla contrazione di un muscolo irideo si
associa il rilasciamento dell’altro.
A. Via parasimpatica
Via parasimpatica
• Il muscolo sfintere
dell’iride è innervato dai
nervi ciliari brevi
(colinergici), i cui corpi
cellulari formano il
ganglio ciliare. Questo
si trova nell’orbita, tra il
nervo ottico e il
muscolo retto laterale,
ed ha un diametro di
1.5 mm.
Ganglio ciliare
• Nel ganglio ciliare non ci
sono solo i corpi cellulari
delle cellule ciliari brevi, ma
anche fibre afferenti
sensoriali dell’occhio e fibre
efferenti adrenergiche (del
sistema simpatico, per
dilatazione della pupilla e
accomodazione).
• La maggior parte delle fibre
parasimpatiche riguardano
l’accomodazione, solo il 3%
giungono allo sfintere
dell’iride.
• I nervi ciliari brevi
penetrano la sclera
assieme alle arterie
ciliari brevi, quindi
proseguono nello spazio
sottocoroideale (tra
sclera e coroide) per
raggiungere la parte
anteriore dell’occhio.
Nucleo di Edinger-Westphal
• Al ganglio ciliare giungono fibre provenienti dall’area
del nucleo del III nervo cranico, nucleo
mesencefalico.
Nucleo di Edinger-Westphal
• In realtà, non dal nucleo di
Edinger-Westphal, ma
subito rostralmente ad esso
originano i neuroni
pregangliari per il muscolo
sfintere, mentre,
diversamente dalla scimmia,
non è sicuro che i neuroni
per l’accomodazione
provengano dal nucleo
mediano anteriore (di
Perlia).
Nuclei pretettali
• Nella regione mesencefalica
pretettale, rostralmente ai
collicoli superiori e
posteriormente al talamo,
sono stati individuati più
nuclei, ma solo il nucleo
olivare pretettale sembra in
rapporto alla motilità
pupillare.
• Le fibre del nucleo olivare
raggiungono le due aree
rostrali al nucleo di EdingerWestphal con fibre dirette e
crociate.
La corteccia occipitale
• Fibre dalla corteccia
occipitale raggiungono
direttamente (saltando il
pretetto) la regione
pupillare del nucleo di
Edinger-Westphal. Queste
fibre, che sono in rapporto
al processo accomodativo,
raggiungono il nucleo (di
Perlia ?) passando
superiormente alle fibre
pupillari.
• Altre fibre dalla
corteccia occipitale
raggiungono il pretetto.
Queste collaborano alla
risposta pupillare alla
luce.
L’input visivo (via afferente)
• Lo schema classico
dell’input visivo che giunge
direttamente al pretetto è il
più semplice dal punto di
vista clinico.
• Vi sono cellule ganglionari
contenenti melanopsina
(poche migliaia) che
raggiungono solo il pretetto
(e non il Corpo
GenicolatoLaterale)
• Fibre che provengono
dalla corteccia.
Inibizione del nucleo di
Edinger-Westphal
• Esiste a questo livello
un’inibizione simpatica
centrale che influisce
sull’innervazione
parasimpatica della
pupilla.
• Questa inibizione
spiega, ad esempio, la
midriasi al buio, la miosi
durante il sonno o
l’anestesia.
• L’entità dell’inibizione
dipende dall’entità del
funzionamento del
sistema simpatico
periferico.
Inibizione del nucleo di
Edinger-Westphal
• L’inibizione avviene
attraverso due vie:
– Locus Ceruleus (nucleo
simpatico per la
regolazione del sonno)
con terminazioni
GABAergiche sulla
regione dorsale al
Nucleo di EdingerWestphal.
• L’inibizione avviene
attraverso due vie:
– Tronco encefalico: le
fibre che originano lì
raggiungono il Nucleo di
Edinger-Westphal
attraversando
l’ipotalamo.
Entrambe le vie non passano per i nuclei pretettali.
B. Via Simpatica
Via simpatica
• Costituita da 3 neuroni:
– Il primo origina nella
regione ipotalamica dorsolaterale e raggiunge
ipsilateralmente il Centro
ciliospinale di Budge (C8T2).
– Vi sono infatti numerosi
centri nel SNC, il più in alto
e quello di Karpus-Kreidl, a
livello del pavimento del III
ventricolo.
Via simpatica
• Costituita da 3 neuroni:
– Il secondo lascia la
midolla spinale a
livello T1, passa
attraverso i gangli
stellato, cervicale
inferiore e medio per
raggiungere il ganglio
cervicale superiore.
Ganglio cervicale superiore
• Il più grande ganglio cervicale, lungo 2 cm,
posto tra vena giugulare e arteria carotide.
• Manda l’innervazione simpatica a numerose
strutture.
• E’ colinergico.
Via simpatica
• Costituita da 3 neuroni:
– Il terzo lascia il ganglio
cervicale superiore e
segue entrambe le
carotidi: con l’esterna
viaggiano fibre per le
ghiandole sudoripare,
attorno all’interna si
forma un plesso che
penetra nel cranio.
Via simpatica
Il terzo neurone lascia il plesso
carotideo per raggiungere il
nervo glossofaringeo ed il
petroso profondo, le ultime
dopo un breve tratto con il
nervo abducente (a livello
del seno cavernoso)
raggiungono la prima branca
del trigemino, passano il
ganglio ciliare (nervi ciliari
lunghi) e terminano
principalmente al muscolo
dilatatore ed al Mueller.
Vie pupillari
Pretetto
• L’area pretettale deve essere
considerata un integratore delle
informazioni necessarie
all’adattamento del diametro
pupillare alle condizioni di luce.
• Come per la via visiva
principale, il pretetto riceve
l’informazione visiva
dall’emicampo controlaterale,
con una predominanza delle
fibre nasali rispetto alle
temporali.
Valutazione della pupilla
1. Valutare il riflesso alla luce
2. Valutare la presenza di anisocoria (sia in
condizioni di luce fioca che intensa)
3. Eseguire il “swinging-flashlight test”
Tutti e tre devono essere normali.
Riflesso alla luce
• Dopo una latenza da 200 a 450 ms la
pupilla inizia a costringersi: tale
latenza dipende dall’intensità
luminosa.
• Il tempo per raggiungere il diametro
pupillare minimo è circa lo stesso
della latenza.
• Quindi la pupilla inizia a dilatarsi con
una velocità che si riduce nel tempo.
• IL riflesso è presente dalla 33°
settimana di gestazione.
• I neonati hanno pupille piccole, poi
c’è un incremento fino a 15 anni, poi
nuovamente una riduzione.
Anisocoria
• Se è presente ptosi o paresi dei muscoli
extraoculari, la pupilla anomala è quella
dell’occhio paretico.
• Se la differenza tra le pupille è maggiore alla
luce, la pupilla alterata è quella più ampia
(difetto del parasimpatico).
• Se la differenza è maggiore al buio, la pupilla
alterata è la più piccola (difetto del simpatico).
Anisocoria algorithm
3. “Swinging-flashlight test”
RAPD: relative afferent pupillary defect
• Il test valuta se ci sono differenze nell’input visivo dai due occhi.
• Per poter effettuare questa valutazione occorre che il sistema efferente sia
normale e simmetrico, non devono essere perciò presenti anisocoria o pupille
fisse o poco reagenti alla luce.
• Il test viene eseguito in un ambiente più buio possibile per avere il massimo di
midriasi.
• Il paziente fissa un bersaglio a distanza.
• Una luce brillante è diretta alla retina superiore con un angolo di circa 45°
rispetto all’asse visivo.
• Si varia la distanza in modo che la pupilla si riduca di circa 1/3.
• Si alterna rapidamente l’occhio illuminato e si mantiene per 2-4 secondi.
• Quando un occhio è illuminato, l’altro comincia ad adattarsi al buio ed
aumenta la sua sensibilità alla luce.
• Perciò, come nel caso della neurite ottica, la pupilla dell’occhio affetto si
dilaterà quando la luce ritornerà.
Cause di RAPR
Lesioni unilaterali del nervo ottico
2. Anisocoria
con normale riflesso alla luce
• Dilation test: valuta un deficit del simpatico.
Il paziente guarda lontano in una stanza buia: la pupilla si
dilata al massimo. Una forte luce viene accesa ad
illuminare entrambi gli occhi per qualche secondo e poi
viene spenta. Se le pupille si dilatano ugualmente si tratta
di anisocoria fisiologia, se c’è differenza: Horner sospetta.
• Quindi test del collirio simpaticomimetico (apraclonidina):
instillazione una goccia in entrambi gli occhi allo 0.5%,
Valutare dopo 45’: inversione dell’anisocoria (per
ipersensibilità simpatica da denervazione).
Sindrome di Horner
•
•
•
•
Miosi
Ptosi (da paralisi del Mueller)
Enoftalmo apparente
Anidrosi:
Se la lesione giace centralmente rispetto alla
biforcazione dell’arteria carotide, le ghiandole
sudoripare della faccia possono essere coinvolte
ipsilateralmente e la innervazione vasomotoria
può essere alterata: un lato della faccia rimane
pallido con il bordo esattamente a metà
(sindrome di Arlecchino).
Cause di Horner
Cause di Horner:
Trigeminal autonomic cephalalgias
• Cefalee primarie (oltre ad emicrania e cefalea
tensiva) di breve durata associate ad eccessiva
attività parasimpatica.
• Si distinguono, per la durata e frequenza degli
attacchi, in:
–
–
–
–
Cluster headhache
Paroxysmal hemicrania
Hemicrania continua (diversamente dalle altre)
Short-lasting unilateral neuralgiform headache with
conjunctival injection and tearing (SUNCT) or with cranial
autonomic features (SUNA).
Cefalea a grappolo (più frequente)
• Cefalea severa, attorno agli occhi e alle tempie, descritta
come una coltellata.
• Il dolore ha accessi di breve durata (45-90 minuti)
• Lacrimazione e secrezione nasale dallo stesso lato del dolore
• Gonfiore della faccia e della palpebra dallo stesso lato del
dolore
• Arrossamento o sudorazione facciale
• Irrequietezza
• Sintomi emicranici (nausea, aura, sensibilità alla luce, ai
suoni).
Cause di Horner:
Autoimmune autonomic ganglionopathy
• Nuova entità, caratterizzata da autoanticorpi contro i gangli
autonomi, sia del simpatico che parasimpatico, ma più
frequentemente di quest’ultimo nelle alterazioni pupillari.
• Gli autoanticorpi vengono oggi rilevati nel sangue: ganglionic
acetylcholine receptor antibody (gAChR-Ab)
• I pazienti possono presentare qualsiasi sintomo di
disautonomia, ma i più frequenti sono l’ipotensione
ortostatica e l’anidrosi.
• E’ caratterizzata da prematura re-dilatazione dopo stimolo
luminoso di 2 secondi, dove la pupilla inizia a dilatare quasi un
secondo prima che la luce venga spenta.
1. Alterazione del riflesso alla luce
• Con o senza anisocoria.
• Forme bilaterali più spesso
asimmetriche.
• Pupille dilatate poco reattive possono
essere causate dall’ansietà del paziente.
Anisocoria con alterazione del riflesso alla luce
a. Tonic pupil (Adie)
• Sempre inizialmente unilaterale, non reagisce o
reagisce poco alla luce, ma si costringe lentamente
fissando un oggetto a distanza ravvicinata o tramite
farmaci parasimpaticomimetici.
• La tonic pupil è la diagnosi più frequente in caso di
pupilla dilatata non reattiva alla luce.
• Con l’aumento dell’età diventa più spesso bilaterale e
può scomparire il riflesso per vicino. Deficit di
accomodazione.
• E’ dovuta a lesioni del ganglio ciliare o dei nervi
ciliari brevi.
Alterazione del riflesso alla luce
a. Tonic pupil
• Valutare sempre con
lampada a fessura
• Alla lampada a fessura si
notano paralisi iridee
settoriali (con pupilla
irregolare) e tipici
movimenti vermiformi.
Test del collirio parasimpaticomimetico
• Pilocarpina diluita (0.125%).
• Ipersensibilità da denervazione dello sfintere
irideo (presente anche nella midriasi da
denervazione pregangliare, paralisi III).
• Si instillano due gocce di collirio in entrambi
gli occhi e si valuta dopo 45’.
• Il test è positivo se la pupilla midriatica si
costringe più di quella normale.
Riflesso pupillare per vicino
•
•
•
•
•
•
Molto meno vigoroso di quello
alla luce.
Si testa quando una o entrambe
le pupille non reagiscono bene
alla luce.
Il paziente fissa un bersaglio a
distanza.
L’ambiente è oscurato, ma da
permettere l’osservazione delle
pupille.
Un bersaglio per vicino (non
luminoso) viene avvicinato
rapidamente chiedendo di
metterlo a fuoco (anche il dito
del paziente).
Nel giovane non si ha miosi per
distanze superiori a 10 cm !
Se la reazione per vicino è migliore di quella alla
luce è presente una “light-near dissociation”.
La triade per vicino
Sfocamento dell’immagine
Disparità retinica
Origine corticale
• Accomodazione:
– Fibre dalla corteccia
occipitale raggiungono
direttamente (saltando il
pretetto) la regione
pupillare del nucleo di
Edinger-Westphal.
Queste fibre, che sono in
rapporto al processo
accomodativo,
raggiungono il nucleo (di
Perlia ?) passando
superiormente alle fibre
pupillari.
• Convergenza:
– I FEF (frontal eye fields)
comandano un nucleo
premotore a ridosso della
MRF (mesencephalic
reticular formation) che
contiene neuroni tonici e
fasici che si connettono ai
nuclei del III e del VI nervo
cranico (solo alcune
particolari fibre nervose e
muscolari sono utilizzate
per la vergenza)
Cause di pupillotonia
Diabete
Virus
Poliradicoloneuropatie
demielinizzanti
ereditarie e
post-infettive
SIFILIDE
Pupilla di Argill Robertson
Alterazione del riflesso alla luce
b. Argyll Robertson pupil
• Pupille piccole, non reattive alla luce (non si stringono alla luce né dilatano al
buio), ma reattive alla visione per vicino, con sierologia positiva per sifilide. Di
solito bilaterale e simmetrica, con pupilla irregolare ed atrofia iridea
variabile. Anche il diabete, la neurosarcoidosi e la Charcot-Marie possono
dare questo quadro, perciò non è più segno patognomonico di neurosifilide.
• E’ stato attribuito a lesioni dell’area pretettale, ciò ne spiegherebbe la
bilateralità. Ma non sono mai state evidenziate localizzazioni in quell’area in
corso di sifilide. La presenza di paralisi segmentarie dell’iride fa invece
pensare ad una localizzazione più periferica, a livello del ganglio ciliare o dei
nervi ciliari brevi, come nella pupillotonia.
• Con l’età le pupille toniche diventano più spesso bilaterali e la pupilla tonica
tende a diventare più piccola dopo alcuni anni, anche molto stretta.
• In alcuni casi di pupille toniche bilaterali è stato isolato il treponema.
• Perciò Helmut Wilhelm non considera l’Argill Robertson un’entità distinta,
bensì una long-standing tonic pupil.
Argyll Robertson
(Edimburgo 1837- Gondar 1908)
•
•
•
•
•
•
Medico nato a Edimburgo da padre chirurgo, interessatosi di chirurgia dell’occhio.
Nel 1869, dopo l’osservazione di alcuni casi in corso di sifilide, ne pubblicava le
evidenze pupillari per cui il segno che porta il suo nome in pochi anni diventa
patognomonico di neurosifilide.
Già alla fine dell’800 Fournier e Hutchinson pongono in dubbio che siano tutti casi
di sifilide.
Dopo l’isolamento del treponema pallido nel 1905 da parte di Schaudinn e
Hoffmann, e la messa a punto del test sierologico (nel 1906) da parte di von
Wassermann, questo diventa più evidente.
Ora (2016) Helmut Wilhelm da’ un colpo definitivo al segno di Argill Robertson,
non considerandolo più un’entità distinta, bensì una variante della pupillotonia.
Forse non si ricorderà più Robertson per il suo segno, ma per fortuna gli studi da
lui effettuati sul glaucoma resteranno nella storia dell’oculistica, con la scoperta nel
1863 dell’effetto della fisostigmina (o eserina, inibitore della acetilcolinesterasi),
alcaloide ottenuto dai semi della fava del Calabar (Nigeria), che si instillò in un
occhio notandone l’effetto miotico. Inoltre eseguì i primi interventi di trapanazione
in alcuni casi di glaucoma.
Alterazione del riflesso alla luce
c. Paralisi del III nervo cranico
• Le fibre pupillari sono superficiali perciò
sensibili alla compressione.
• In teoria se è presente una paralisi del III senza
compromissione pupillare non è necessaria la
RMN.
• In caso di pupilla dilatata non reattiva è
sempre necessario valutare la motilità oculare.
Paralisi del III
•
•
•
•
•
•
•
•
La paralisi completa del III si estrinseca in ptosi per la paralisi dell’elevatore della palpebra, abduzione
per prevalere del tono del muscolo retto laterale innervato dal VI, lieve depressione ed intorsione per
l’azione peraltro minima essendo l’occhio abdotto del muscolo GO innervato dal IV. La limitazione di
movimenti è tanto marcata tanto da non permettere al bulbo di superare la linea mediana nei tentativi
di adduzione . Impossibili i movimenti di elevazione e depressione.
Paralisi muscolatura oculare intrinseca provoca midriasi fissa e paralisi dell’accomodazione.
All’esame con lo schermo di Hess è conservata soltanto l’abduzione dell’occhio paretico mentre i
movimenti dell’occhio sano sono aumentati.
Diplopia crociata al test del vetro rosso (sollevando la palpebra dell’occhio paralizzato): falsa immagine
in alto e all’esterno.
PAC ruotata verso l’occhio sano
Paralisi del retto superiore: deficit di elevazione in abduzione nell’occhio colpito. In pp ipotropia ed
exciclotorsione per iperfunzione del retto inferiore omolaterale. Ipotropia che auments nel tentativo di
portare l’occhio in alto e in abduzione e in questa posizione si può evidenziare l’iperfunzione del piccolo
obliquo controlaterale (sinergista). PAC ruotata verso il lato paretico . Per la mancata elevazione del
globo oculare può essere presente anche una lieve debolezza del muscolo elevatore della palpebra:
psudoptosi che si evidenzia durante la fissazione dell’occhio non paretico.
Test del vetro rosso: diplopia verticale che si accentua in alto e all’esterno e presenata una componente
torsionale.
Allo schermo di Hess si evidenzia iperfunzione del retto inferioe omolaterale (antagonista), iperfunzione
poiccolo obliquo controlaterale (sinergista), ipofunzione del sinergista dell’antagonista cioeè GO
controlaterale.
Paralisi del III
• La disposizione del nucleo del III spiega la rarità di una paralisi nucleare
completa e la maggior frequenza di forme incomplete (paralisi nucleari
parziali o fascicolari mesencefaliche). Si tratta di una struttura compatta a
lato della linea mediana a livello della porzione rostrale del mesencefalo.
Questa struttura contiene i nuclei motori e neurovegetativi del III nc. Le fibre
che originano dalle colonne cellulari costituiscono la porzione fascicolare del
nervo che attraversa il mesencefalo, il nucleo rosso, la substantia nigra,
emergendo dalla fossa interpeduncolare prosegue in avanti al di sotto
dell’arteria cerebrale posteriore e lateralmente alla comunicante posteriore,
perfora la dura ed entra nel seno cavernoso. Le fibre pupillari decorrono
superficialmente nella porzione dorso-mediale del nervo. A livello della
fessura orbitaria superiore entra nell’orbita con una branca superiore (MRS)
e inferiore (MRM, MRI, MPO, fibre pupillomotrici).
• Paralisi intrinseche: Lesioni del tratto del nervo tra l’emergenza nel tronco
cerebrale e l’ingresso nel seno cavernoso: le fibre autonome sono disposte
più superficialmente. Accade l’inverso per il tratto dopo il seno cavernoso.
Il 3° nervo cranico
Il seno cavernoso
Esempio: caduta da cavallo
• Contusione temporo• Paresi parziale del III n.c.
destro: exo-ipotropia OD,
polare destra, edema
deficit di elevazione OD.
cerebrale, ictus ischemico
• Anisocoria, pupilla destra in
ACM dx da occlusione
midriasi, non reagente al
della arteria carotide
fotostimolo
• Variazione dell’ampiezza della
interna destra, frattura
rima palpebrale nello sguardo
osso mascellare e ponte
orizzontale probabilmente per
zigomatico destro, trauma
rigenerazione aberrante.
toracico.
• SAod: disepitelizzazione
corneale centrale ed inferiore
• Emiplegia sinistra (S di
• Vod: visus spento; Vos: 10/10
Weber il III è leso nel
cc
punto in cui attraversa il
• Fod: atrofia ottica
peduncolo cerebrale)
• Pev pattern non registrabili a
destra.
• Deficit VII n.c. destro
Caduta da cavallo: esiti
Emicrania oftalmoplegica
• Forma particolare di emicrania con aura nel
bambino.
Si caratterizza per:
• età precoce di esordio (prima dei 12 anni)
• paralisi di uno o più nervi cranici (per lo più il III, ma anche IV o VI) in
assenza di lesioni intracraniche dimostrabili
• ptosi palpebrale, midriasi
• dolore localizzato all’occhio, intorno ad esso o alle tempie, omolaterale alla
ptosi, nausea, vomito
• Dolore che si risolve appena inizia l’oftalmoplegia
• durata dell’oftalmoplegia variabile da ore a settimane
• frequenza variabile
• spesso sostituita da emicrania senz’aura
• Raramente pupillotonia durante l’attacco o residua.
Alterazione del riflesso alla luce
d. Dorsal midbrain lesions
• Pinealoma (giovani maschi) e idrocefalo (bambino) le cause più frequenti.
• Lesione dell’area pretettale.
• Bilaterale. Pupilla in media midriasi, con riflesso alla luce assente (o quasi) e
normale riflesso per vicino.
• Parinaud syndrome: inoltre, paralisi sopranucleare dello sguardo verso
l’alto o dei saccadici verticali (lesione del nucleo interstiziale di Cajal e MRF),
retrazione palpebrale (segno di Collier), deficit di convergenza e nistagmo
retrattivo o in convergenza nei tentativi di sguardo verso l’alto, in alcuni casi
paresi dell’accomodazione e spasmo accomodativo (incapacità di rilasciare
l’accomodazione dopo un periodo di visione per vicino).
• In situazioni lievi, il paziente può presentare solo visione sfocata e diplopia
per vicino, accompagnate da difficoltà nel rivolgere lo sguardo verso l’alto.
Sistema oculomotore
• SRM=Sostanza Reticolare
Mesencefalica
• TQS=Tubercolo
quadrigemino superiore
• FLM=Fascicolo longitudinale
mediale
• nD=Nucleo di Darkshewitz
• CP=Commissura posteriore
• irFLM=Nucleo interstiziale
rostrale FLM
• iC=Nucleo interstiziale di
Cajal
MRF
• Il nucleo interstiziale di
Cajal (subito sotto la
MRF e sopra il III) è
sede dell’integratore
neurale per movimenti
verticali e torsionali. La
sua lesione determina
nistagmo.
• La sostanza reticolare
mesencefalica (MRF) è
la sede del sistema
premotore dei
movimenti saccadici
verticali. La sua lesione
darà impossibilità ad
effettuare saccadi
verticali o paralisi dello
sguardo, di solito verso
l’alto.
Sindrome di Parinaud
(dorsal midbrain syndrome; Sylvian aqueduct syndrome)
•
•
Malattia neurologica associata ad una
lesione del tetto del mesencefalo. Si
riscontra in pazienti giovani con
tumori (della ghiandola pineale),
nelle donne di 20-30 anni con SM,
negli anziani per infarti (ischemici o
emorragici) del tronco.
La sintomatologia oculare migliora
lentamente con la risoluzione del
problema scatenante: nel bambino è
spesso l’idrocefalo la causa della
compressione; se viene derivato
precocemente la sintomatologia può
scomparire, se permane oltre i 6 mesi
la sintomatologia permarrà.
Sindrome di Parinaud
(dorsal midbrain syndrome; Sylvian aqueduct syndrome)
•
Poiché la lesione che determina la
paralisi dei movimenti oculari verticali
volontari è adiacente alle vie pupillari,
vi possono essere vari gradi di
compromissione della convergenza,
della funzionalità pupillare e
dell’accomodazione.
Caratterizzata da:
– Paralisi dello sguardo coniugato
verso l’alto (talora anche o verso il
basso): 100% dei casi
– Light-near dissociation delle pupille:
65%
– Convergence-retraction nystagmus
nei tentativi di saccadi verso l’alto:
88%
Inoltre:
– Retrazione palpebrale (segno di
Collier per lesione sostanza grigia
mesencefalica), anche in posizione
primaria, evidente nello sguardo in
basso: 20%
– Paralisi del III, IV o VI n.c: 15%.
Primo sintomo: diplopia (68%) o visione
sfocata (25%).
Sindrome di Parinaud
(dorsal midbrain syndrome; Sylvian aqueduct syndrome)
•
•
Nei casi di Sindrome con permanenza
della paralisi dello sguardo verticale
(caratterizzati da una chin-up PAC),
sono stati proposti interventi
chirurgici con lo scopo di ruotare
meccanicamente il bulbo oculare
verso l’alto: la trasposizione bilaterale
verso l’alto dei muscoli retto mediale
e laterale, la recessione del retto
inferiore, la resezione del retto
superiore (anche associata alla
recessione dell’inferiore).
Tutti si sono dimostrati utili non solo
per il miglioramento della PAC, ma
soprattutto per la netta riduzione del
nistagmo in convergenza e/o
retrattivo.
Conclusione
• Le alterazioni della
motilità pupillare si
associano spesso ad
alterazioni
oculomotorie
(strabismo, deficit di
convergenza) che
determinano diplopia,
talvolta solo per vicino.
• Più raramente vengono
coinvolte le capacità
accomodative con
conseguente
sfocamento delle
immagini per vicino.
Conclusione
• Una corretta diagnosi, riguardante tutti gli aspetti
coinvolti, permette di intervenire in modo incisivo,
tramite l’applicazione di prismi, la prescrizione di
occhiali bifocali, l’esecuzione di interventi chirurgici,
sulla qualità della vita di questi pazienti che, anche in
giovane età, possono essere interessati da più o
meno gravi danni neurologici permanenti.
RINGRAZIO DELL’ATTENZIONE
XXIV Incontro di Strabologia e Neuroftalmologia
Bosisio Parini (LC), 11 marzo 2017