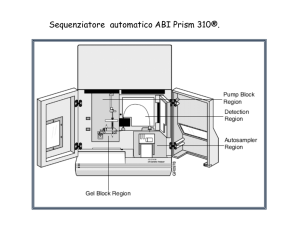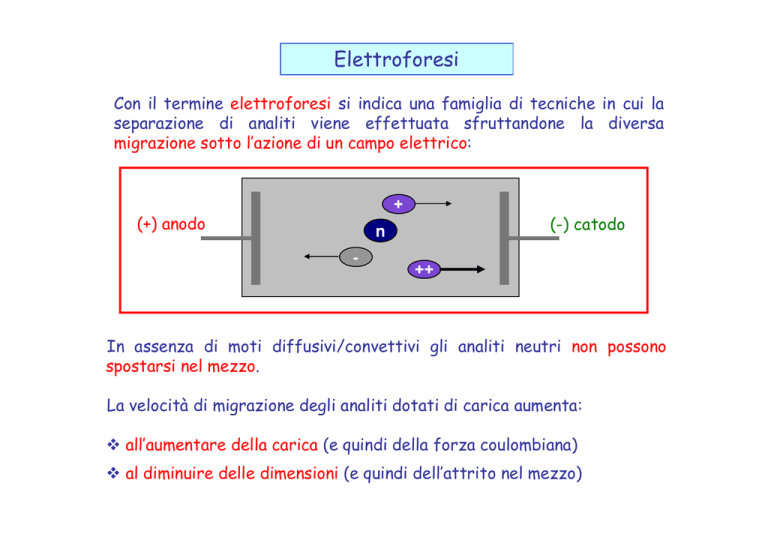
Elettroforesi
Con il termine elettroforesi si indica una famiglia di tecniche in cui la
separazione di analiti viene effettuata sfruttandone la diversa
migrazione sotto l’azione di un campo elettrico:
+
(+) anodo
(-) catodo
n
-
++
In assenza di moti diffusivi/convettivi gli analiti neutri non possono
spostarsi nel mezzo.
La velocità di migrazione degli analiti dotati di carica aumenta:
all’aumentare della carica (e quindi della forza coulombiana)
al diminuire delle dimensioni (e quindi dell’attrito nel mezzo)
L’elettroforesi venne sviluppata dal
chimico svedese Tiselius (Premio
Nobel per la Chimica nel 1948) negli
anni ’30:
Introducendo una miscela di proteine
del siero umano in un tubo a U
riempito con un elettrolita, nel quale
erano immersi, alle estremità del
tubo, due elettrodi sottoposti ad una
differenza di potenziale, egli notò che
le proteine migravano diversamente a
seconda della carica e del pH del
mezzo, risultandone separate.
Le diverse bande dovute alle proteine
erano osservate con un opportuno
apparato ottico.
In parallelo alla tecnica in
soluzione
venne
sviluppata
l’elettroforesi su carta (Konig
1937):
Venivano
eliminati
gli
inconvenienti dovuti a diffusione
e convezione degli analiti ma se
ne introducevano altri:
evaporazione
dalla carta;
del
solvente
limitazioni nell’intensità di
corrente correlata alla migrazione;
instabilità chimica.
Gli inconvenienti dovuti alla carta furono superati con l’introduzione
dell’elettroforesi su gel, sviluppata a partire dalla fine degli anni ’50 e
diventata poi la tecnica dominante per la separazione elettroforetica di
proteine:
In questo caso il mezzo di migrazione è un gel (inizialmente costituito da
amido, oggi quasi unicamente da poliacrilammide) schiacciato fra lastre di
vetro e posto in contatto, alle due estremità, con due riserve di elettrolita,
nelle quali sono immersi i due elettrodi.
Un gel di poli-acrilammide
può
essere
realizzato
mediante polimerizzazione
radicalica del monomero
(acrilammide) in presenza
di un agente reticolante
(metilen-bis-acrilammide):
Elettroforesi su gel di poliacrilammide in presenza di
sodio dodecil solfato (SDS-PAGE)
Il sodio-dodecil-solfato (SDS, Na+ -O3S-O-(CH2)11CH3) agisce sulla
struttura secondaria delle proteine, facilitandone lo “srotolamento”:
SDS
Ditiotreitolo (DTT)
Il ditiotreitolo (DTT) mantiene aperta la struttura della proteina
rompendo i ponti disolfuro (R-S-S-R) fra residui di cisteina presenti in
punti diversi della catena e mantenendoli nella forma tiolica (R-SH).
La modificazione della struttura
secondaria permette di ricondurre
la diversa mobilità elettroforetica
delle proteine unicamente alla loro
massa molecolare, mentre gli
effetti dovuti al ripiegamento
tridimensionale
vengono
resi
trascurabili.
E’ possibile, quindi, costruire una
retta di calibrazione che correli la
massa molecolare alla mobilità
elettroforetica:
Dopo la separazione le proteine possono essere individuate sfruttando
diversi metodi di colorazione:
Coomassie
Blue
Focalizzazione isoelettrica (IEF)
La focalizzazione isoelettrica, sviluppata da Vesterberg e Svensson nel
1966, è una tecnica di separazione elettroforetica che sfrutta la presenza
di un gradiente di pH nel mezzo di migrazione:
Il gel è realizzato in modo che il suo pH cambi in modo regolare lungo la
distanza: le proteine migreranno in direzioni diverse, a seconda della loro
carica, finché non avranno raggiunto la regione del gel in cui il pH eguaglia
il loro punto isoelettrico. In tale regione esse non avranno più una carica
netta e quindi non potranno migrare ulteriormente.
Elettroforesi bidimensionale su gel di poliacrilammide (2D-PAGE)
Le proteine separate in una
prima corsa elettroforetica
mediante
focalizzazione
isoelettrica possono essere
caricate su un gel con SDS:
Si
realizza
così
una
separazione elettroforetica
bidimensionale
(O’Farrell,
1975),
una
tecnica
potentissima
per
la
separazione
di
miscele
estremamente complesse di
proteine (fino a qualche
migliaio!)
Esempio di gel elettroforetico bidimensionale caratterizzato da centinaia di
macchie:
Elettroforesi capillare (CE)
L’elettroforesi capillare è la
variante
di
elettroforesi
sviluppata
più
recentemente
(1980).
Accoppiata ad opportuni rivelatori
rappresenta una delle tecniche di
separazione/analisi a più alta
risoluzione e più sensibili in
assoluto (LOD dell’ordine di 10-21
moli!).
La strumentazione di base per CE è costituita da:
un capillare in silice fusa
un generatore di differenze di potenziale elevate, fino a 30 kV (HV)
due riserve di elettrolita, rappresentato da una soluzione tampone (buffer)
due elettrodi
un rivelatore montato sul capillare (on-column)
Flusso elettrosmotico (EOF)
Il flusso elettrosmotico è uno spostamento del liquido contenuto nel
capillare per elettroforesi capillare innescato dall’applicazione del campo
elettrico.
20-50 cm
Il capillare è simile a quelli impiegati come colonne in GC (ma molto più corto,
naturalmente): il diametro totale è di circa 300 m, quello della cavità
interna di 25-75 m, il rivestimento esterno in polimmide ha uno spessore di
circa 15 m.
In assenza di elettrolita le pareti interne del capillare presentano una serie
di gruppi silanolici non deprotonati (Si-OH).
Quando viene introdotto il tampone-elettrolita, tipicamente avente pH > 2,
i gruppi silanolici si deprotonano e la loro carica negativa viene bilanciata
da cationi dell’elettrolita, che formano un doppio strato di carica sulla
superficie interna del capillare:
S = Stern Layer
(strato immobile)
+
+
+
+
+
+
+
+
+
+
+
+
+
+
S
D = strato diffuso (mobile)
+
+
+
+
+
+
+
D
- +
+
+
+ +
+
- + ++ + - + + + + - + + + - + +
+ + +
+
-+ - + - +- - +- +-+ +
+
+ -
Parete interna del capillare
- +
+
+
+ +
+
- + ++ + - + + + + - + + + - + +
+ + +
+
-+ - + - +- - +- +-+ +
+
+ -
Parete interna del capillare
Flusso netto
Catodo
Anodo
L’applicazione di una differenza di potenziale provocherà lo spostamento dei
cationi presenti sulla superficie interna del capillare:
Il movimento delle cariche positive trascina con sé soluzione vincendo
l’attrito fra il liquido e le pareti del capillare.
In questa situazione il profilo delle velocità del liquido all’interno del
capillare è piatto, mentre in un sistema in cui il flusso è legato ad un
gradiente di pressione la velocità del liquido è inferiore in prossimità delle
pareti del capillare (a causa dell’attrito) e il profilo delle velocità è
parabolico:
flusso elettrosmotico dovuto ad
un campo elettrico
flusso idrodinamico dovuto ad un
gradiente di pressione
Il flusso elettrosmotico ha quindi il vantaggio di non provocare un
allargamento di banda come invece quello idrodinamico (tipico di sistemi
HPLC).
Il flusso elettrosmotico si compone con il flusso elettroforetico che
caratterizza le specie cariche presenti all’interno del capillare:
A
N
O
D
E
EOF
+ ions
- ions
C
A
T
H
O
D
E
A
Net flow (+ ions)
N
O
D
E
EOF
neutrals
Net flow (- ions)
C
A
T
H
O
D
E
i cationi saranno spinti verso il catodo da un flusso dato dalla somma del
flusso elettroforetico e di quello elettrosmotico;
le specie neutre viaggeranno unicamente sotto la spinta del flusso
elettrosmotico;
gli anioni si sposteranno comunque nella stessa direzione delle altre
specie perché il flusso elettrosmotico è normalmente superiore a quello
elettroforetico.
Rappresentazione schematica di una
separazione elettroforetica capillare
Gli anioni più piccoli si sposteranno meno velocemente dei più grandi nella
direzione del catodo perché il loro flusso elettroforetico (diretto verso
l’anodo) è maggiore; l’opposto si verificherà per i cationi.
Equazioni fondamentali: elettroforesi
La forza FE che agisce su una particella di carica q
sottoposta al campo elettrico E è data da:
La forza Ff con cui il mezzo circostante si oppone
al moto della particella, detti vep la velocità di
questa e f il coefficiente di attrito del mezzo, è
data da:
Quando le due forze diventano uguali:
l’accelerazione della particella si annulla ed essa
assume una velocità costante, data da:
Il termine ep si definisce mobilità elettroforetica.
Assumendo che la particella si possa considerare equivalente ad una sfera
di raggio r e detta la viscosità del mezzo il suo coefficiente di attrito f
sarà dato da:
A parità di tutte le altre condizioni (campo elettrico, mezzo di migrazione,
carica) le particelle di raggio maggiore avranno una mobilità
elettroforetica inferiore.
Equazioni fondamentali: elettrosmosi
La velocità assunta da una particella a causa del
flusso elettrosmotico si può esprimere in modo
formalmente analogo a quello usato per la velocità
elettroforetica:
La mobilità elettrosmotica, eo, dipende dalla
costante dielettrica del mezzo () e dal potenziale
zeta (), a sua volta legato alla differenza di
potenziale che si crea alla superficie interna del
capillare a causa del gradiente di carica elettrica.
La mobilità elettrosmotica non dipende, quindi, dalle caratteristiche dei
singoli analiti e viene favorita da un aumento della quantità di carica
presente alla superficie del capillare (e quindi di ) e da una diminuzione
della viscosità del mezzo.
Equazioni fondamentali: elettroforesi + elettrosmosi
La composizione (vettoriale) delle mobilità
elettroforetica ed elettrosmotica si definisce
mobilità apparente, app:
La
velocità
apparente
corrispondente mobilità:
vapp
deriva
dalla
Poiché le mobilità elettroforetiche hanno lo stesso segno della carica delle
specie a cui si riferiscono, mentre la mobilità elettrosmotica è sempre
positiva, nel caso degli anioni la mobilità apparente diventa negativa se ep
è, in valore assoluto, maggiore di eo.
Ciò avviene se si opera a pH < 3, perché in tali condizioni diminuisce
moltissimo il numero di cariche negative dei gruppi Si-OH del capillare e
con esso il valore di eo.
In tal caso gli anioni non potranno mai raggiungere il rivelatore se esso è
posto in prossimità del catodo.
La mobilità apparente può essere espressa anche in termini di altri
parametri strumentali tipici di un apparato per elettroforesi capillare:
μ
app
dove:
v
L t
LL
E
VL
Vt
app
d
m
t
d
t
m
Ld è la lunghezza del capillare dal punto di iniezione al rivelatore;
tm è il tempo di migrazione (l’analogo del tempo di ritenzione in
cromatografia);
V è la differenza di potenziale applicata agli elettrodi;
Lt è la lunghezza totale del capillare, pressoché pari alla distanza fra
gli elettrodi (perciò il campo elettrico è dato da V/Lt)
Fissate tutte le condizioni strumentali, il tempo di migrazione sarà
caratteristico di una particolare specie, come quello di ritenzione in
cromatografia.
Efficienza separativa in CE
L’efficienza di una separazione elettroforetica
capillare può essere espressa in termini di altezza di
piatto teorico H, come in cromatografia, ma va
utilizzata un’equazione di Van Deemter modificata:
H
B
u
x
In questo caso, infatti, sono assenti i termini correlati: 1) ai
trasferimenti di massa fra fasi diverse (termini contenenti il
coefficiente C), non essendoci una fase stazionaria; 2) ai cammini multipli
(parametro A o C modificato), non essendoci un impaccamento.
Il numero dei piatti teorici può essere
calcolato a partire dalle relazioni:
L
N
σ
2
2
σ 2Dt
12
m
in cui D è il coefficiente di diffusione dell’analita e tm il suo tempo di
migrazione.
D’altra parte il tempo di migrazione può
essere espresso con la relazione:
L
L
t
v
μ E
m
app
app
Il numero di piatti teorici per una separazione elettroforetica capillare si
può dunque esprimere con la relazione:
L μ E Lμ E μ V
L
N
2Dt
2DL
2D
2D
L
2
2
2
app
app
app
2
m
N dipende quindi da una serie di fattori strumentali nonché da un
parametro specifico per ciascun analita, il coefficiente di diffusione D.
Poiché le macromolecole hanno valori di D piccoli, nelle separazioni CE di
proteine o acidi nucleici si possono raggiungere valori di N dell’ordine di
500000-1000000, ossia superiori per uno-due ordini di grandezza a quelli
tipici dei metodi HPLC.
Risoluzione in CE
La
risoluzione
in
CE
viene
definita
operativamente in modo analogo a quanto accade
nelle tecniche cromatografiche:
2(tm)B (tm)A
R
WA WB
In questo caso WA e WB sono le larghezze alla base dei due picchi
elettroforetici.
L’espressione matematica della risoluzione elettroforetica ricorda in parte,
almeno formalmente, quella della risoluzione cromatografica:
Il termine centrale, in cui compaiono la differenza (app) e la media (avg)
delle mobilità apparenti delle due specie dalle quali si valuta R, rappresenta
la selettività elettroforetica.
Effetto Joule in elettroforesi capillare
Poiché l’applicazione di una differenza di potenziale alle estremità del
capillare genera un passaggio di corrente (dell’ordine dei mA), la
soluzione elettrolitica in esso contenuta si riscalda per effetto Joule.
L’energia dissipata sotto forma di calore è data dalla relazione:
Energiaterm = V I t
L’aumento del potenziale applicato
alle estremità del capillare
determina, quindi:
un incremento dell’efficienza e
della risoluzione
ma anche:
un aumento della temperatura
dell’elettrolita e, con essa, della
diffusione longitudinale.
A parità di campo elettrico
applicato e di carica (+1 nel
caso del grafico) l’impiego di
capillari di raggio interno
crescente fa innalzare la
temperatura della parete
interna.
L’effetto
è
tanto
più
marcato quanto maggiore è
il campo elettrico (C > B >
A).
L’aumento della temperatura favorisce la diffusione
conseguentemente, incrementa l’altezza di piatto teorico.
longitudinale
e,
In figura le linee descritte da punti e trattini mostrano che H non varierebbe
con il raggio del capillare se non vi fosse l’effetto Joule.
L’aumento del campo elettrico determina inizialmente un aumento di
efficienza, ossia una diminuzione di H, ma a valori elevati provoca un effetto
Joule così significativo da invertire la tendenza (le linee punteggiate indicano
la situazione che si avrebbe se l’effetto Joule fosse assente).
Effetto del pH sulle separazioni CE
L’effetto del pH su una separazione CE deriva principalmente dalla sua
influenza sulla mobilità elettroosmotica.
Si consideri un caso specifico in cui:
eo = 1.3 × 10-8 m2/V s a pH 2 e
8.1 × 10-8 m2/V s a pH 12;
Ld = 52 cm, Lt = 62 cm
Per un campo elettrico pari a circa 4.3 × 104 V/m è possibile calcolare i
tempi di migrazione di un analita neutro (per il quale la mobilità è
puramente elettrosmotica):
pH 2
v eo μeoE 5.66 x 10
m/s
tm 9.2 102 s
pH 12
v eo μeoE 3.53 x 10-3 m/s
tm 1.5 102 s
-4
Il pH può influenzare anche la distribuzione delle forme cariche e neutre
dell’analita e quindi la mobilità totale osservata:
L’aumento del pH porterà inevitabilmente ad un aumento della carica
negativa media nel caso di acidi deboli, con conseguente aumento della
loro mobilità elettroforetica (che in questo caso è opposta a quella
elettrosmotica).
Scelta del tampone per una separazione CE
La scelta del tampone è determinante per la qualità di una separazione
elettroforetica capillare.
Le caratteristiche fondamentali di un tampone per CE sono:
elevata
concentrazione
(25-200 mM)
per migliorare la
focalizzazione
delle bande
elevato potere tampone, per evitare fluttuazioni di pH nel mezzo di
migrazione;
basso assorbimento UV, essendo l’assorbimento della radiazione UV (o
visibile) il metodo di rivelazione più usato per gli analiti;
basso adsorbimento delle specie costituenti il tampone sulle pareti
interne del capillare;
basso costo ed elevata disponibilità
Anche la conducibilità
elettrica del tampone va
adeguatamente
controllata per evitare
effetti sulla forma dei
picchi
elettroforetici
(elettrodispersione):
tempo
fronting
tempo
tempo
tailing
Se la conducibilità del campione è superiore a quella del tampone (pannelli a in
figura) il campo elettrico E sarà inferiore in corrispondenza della banda del
campione e la discontinuità del potenziale V creerà un accumulo transitorio
delle cariche migranti sul confine posteriore della banda (fronting). L’inverso
(tailing) avverrà se la conducibilità del campione è inferiore (pannelli c).
Poiché specie aventi un’elevata mobilità elettroforetica dovrebbero anche
garantire alla propria banda una conducibilità elettrica elevata è tipico
osservare il fenomeno del fronting sulle prime bande dell’elettroferogramma e
quello del tailing sulle bande che arrivano al detector più tardi:
tailing
fronting