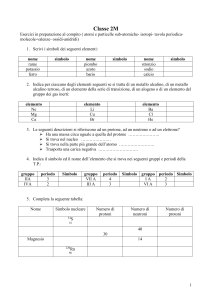
Corso di
CHIMICA INORGANICA
Lezione Seconda
• La teoria atomica
• La massa atomica e il concetto di
Isotopi
• Dentro l’atomo, le particelle
subatomiche
• La Tavola Periodica degli Elementi
2 Gli atomi di un certo elemento
mostrano proprietà comuni
Durante la prima lezione abbiamo affermato che la materia
è costituita da atomi;
ora approfondiamo questo argomento
Il concetto di atomo fu formulato circa 2500 anni fa e
non ha avuto alcuna ricaduta scientifica fino alla
formulazione di due importanti leggi:
• la legge della conservazione della massa
• la legge delle proporzioni definite.
Queste leggi riassumono i risultati ottenuti da
osservazioni sperimentali compiute da parecchi scienziati
nel diciottesimo secolo e nella prima parte del
diciannovesimo secolo.
ELFO-2012/13 --- Chimica_Lezione-2
2
2
2.1 Leggi fondamentali della Chimica
Legge della conservazione della massa:
nelle reazioni chimiche non si osserva né acquisto né perdita di
massa; la massa si conserva.
Vuol dire che in una reazione chimica, ad esempio:
A + B AB
la massa di A più la massa di B devono essere uguali alla massa di AB
Questo deve valere per tutte le reazioni chimiche
Legge delle proporzioni definite e costanti:
in un dato composto chimico, gli elementi si trovano sempre
combinati nello stesso rapporto di massa.
Vuol dire che, considerando ad esempio il composto CuS
Cu (Rame)
S (Zolfo)
2grammi
1gr
4gr
2gr
1gr
0,5gr
Rapporto tra atomi 1 : 1
Rapporto tra masse 2 : 1
ELFO-2012/13 --- Chimica_Lezione-2
3
3
Legge delle proporzioni multiple:
quando due elementi formano più di un composto, le diverse masse di
uno che si combinano con la medesima massa dell'altro sono in un
rapporto di numeri piccoli interi.
Esempio:
ogni molecola di entrambi i composti ha un
atomo di zolfo, quindi la stessa massa si zolfo.
Diverso è il numero di atomi di ossigeno,
quindi il rapporto tra le masse e tra gli atomi
di ossigeno è 3:2
ELFO-2012/13 --- Chimica_Lezione-2
4
4
2.2 La Teoria atomica di Dalton
Le leggi della conservazione della massa e delle proporzioni definite
forniscono la base teorica per la teoria atomica.
La teoria atomica di Dalton:
La materia è costituita da minuscole particelle chiamate atomi.
Gli atomi sono indivisibili, nelle reazioni chimiche essi si
trasformano ma non si rompono in frazioni più piccole.
Tutti gli atomi di un elemento puro sono identici tra loro sia per
la massa sia per le altre proprietà.
Gli atomi di elementi diversi hanno massa e proprietà diverse.
Gli atomi che costituiscono i composti sono sempre combinati
in un rapporto numerico definito.
ELFO-2012/13 --- Chimica_Lezione-2
5
5
2.3 Il concetto di Massa Atomica
In base alla teoria di Dalton gli atomi di un elemento hanno una
massa atomica costante**.
** Per quanto microscopico possa essere un
atomo, esso ha sempre e comunque una massa
Per esempio, per qualsiasi campione di fluoruro di idrogeno (HF):
• rapporto tra atomi F-H: 1 a 1
• rapporto di massa: 19,0 a 1,00
Ciò è vero perché l’atomo di fluoro è 19,0 volte più pesante di quello di idrogeno.
Quando parliamo della massa degli atomi ci riferiamo:
• non alla loro massa reale e assoluta (che è infinitesimamente
piccola 0,0000000000…..)
• ma alle loro masse relative, cioè quanto un atomo è più grande o più
piccolo di un altro atomo.
Ovviamente per fare questo ci occorre la massa di un atomo da prendere
come riferimento e a cui dare il valore unitario (valore = 1 u)
ELFO-2012/13 --- Chimica_Lezione-2
6
6
In realtà quasi tutti gli elementi si trovano in natura come
miscele uniformi di due o più tipi di atomi con masse
leggermente differenti.
Gli atomi dello stesso elemento con masse differenti
vengono chiamati
isotopi.
Tutti gli isotopi di un certo elemento possiedono
stesse proprietà chimiche.
I rapporti relativi tra isotopi diversi dello stesso
elemento sono costanti.
Isotopi dei primi 15
elementi
Isotopi dell’Idrogeno
ELFO-2012/13 --- Chimica_Lezione-2
7
7
Una scala uniforme della masse atomiche relative richiede quindi
una massa di riferimento.
Per l’unità di massa atomica (simbolo u) il riferimento è l’atomo di
carbonio (isotopo12):
• 1 atomo di carbonio (isotopo12) = 12 u (esatte)
• 1 u = 1/12 della massa di un atomo di carbonio (isotopo12)
(In base a questa definizione, l’atomo più leggero è l’atomo di idrogeno con massa di circa 1u, circa
uguale alla dodicesima parte della massa del Carbonio(isotopo 12))
Esempio: Il cloro è presente in natura come miscela di due isotopi.
In ogni campione di questo elemento, il 75,77 % degli atomi è rappresentato da 35Cl e
il 24,23 % da 37Cl.
La misura accurata della massa atomica del cloro dà 34,9689 u per 35Cl e 36,9659 u
per 37Cl. La massa atomica media del cloro risulta pertanto:
ELFO-2012/13 --- Chimica_Lezione-2
8
8
Le masse atomiche relative di tutti gli elementi possono essere
agevolmente trovate sulla Tavola Periodica
Masse atomiche
relative degli
elementi chimici
ELFO-2012/13 --- Chimica_Lezione-2
9
9
2.4 Gli atomi sono costituiti da particelle più
piccole (particelle subatomiche)
Tra la fine dell’Ottocento e l’inizio del Novecento una serie di esperimenti
dimostrò che l’atomo è costituito da particelle subatomiche.
Le principali particelle subatomiche sono:
• protoni: hanno una carica positiva e si trovano nel nucleo
• neutroni: non hanno carica, si trovano nel nucleo
• elettroni: hanno una carica negativa, si trovano al di fuori del
nucleo (la massa di un elettrone è circa 2000 volte più piccola di
quella di protoni e neutroni)
L’atomo è quindi costituito da:
• una parte centrale piena
(nucleo) con carica positiva
(protoni + neutroni);
• una parte esterna “semivuota”
con carica negativa (elettroni)10
ELFO-2012/13 --- Chimica_Lezione-2
10
I PROTONI NON SI TOCCANO, SE CAMBIA IL NUMERO DI
PROTONI CAMBIA L’ELEMENTO CHIMICO
b) Gli isotopi hanno invece diverso numero di massa (A),
perché pur restando costante il numero di protoni varia il numero di
neutroni
• numero atomico, Z = numero di protoni
• numero di massa, A = (numero di protoni) +(numero di neutroni)
c) Un atomo allo stato naturale è un atomo neutro, dove cioè il numero
dei protoni è uguale al numero degli elettroni.
ELFO-2012/13 --- Chimica_Lezione-2
11
11
Numero Atomico = numero di PROTONI
Numero di Massa = PROTONI + NEUTRONI
ISOTOPI con relativa abbondanza % in natura
Esempio 1: carbonio (isotopo-13)
• numero dei protoni = 6 ( = numero degli elettroni)
• numero dei neutroni = 7
• numero atomico (Z) = 6
• numero di massa (A) = 6 + 7 = 13
• simbolo chimico = C
Esempio 2: uranio (isotopo-235)
• numero dei protoni = 92 ( = numero degli elettroni)
• numero dei neutroni = 143
• numero atomico (Z) = 92
• numero di massa (A) = 92 + 143 = 235
• simbolo chimico = U
ELFO-2012/13 --- Chimica_Lezione-2
12
12
Riassumendo:
ALL’INTERNO DEL NUCLEO SI TROVANO LE SEGUENTI
PARTICELLE SUBATOMICHE
• PROTONI: --- nel nucleo
--- carica positiva
--- il loro numero indica il tipo di elemento
--- il loro numero è Z (numero atomico)
• NEUTRONI:
--- nel nucleo
--- nessuna carica
--- il loro numero può essere variabile (ISOTOPI)
--- definiscono numero A (numero di massa = protoni
+ neutroni)
• ELETTRONI:
--- esterni al nucleo
--- carica negativa
ELFO-2012/13 ----- in numero uguale
aiChimica_Lezione-2
protoni
13
13
2.5 La tavola periodica è utilizzata per
organizzare e correlare le proprietà diverse degli
elementi chimici
La tavola periodica riassume le proprietà chimiche e fisiche
degli elementi.
Nella moderna tavola periodica gli elementi sono disposti
secondo un ordine crescente di numero atomico:
(cioè secondo numero crescente di protoni)
• gli elementi sono disposti in righe chiamati periodi
• le colonne verticali sono chiamate gruppi o famiglie
ELFO-2012/13 --- Chimica_Lezione-2
14
14
Tavola periodica moderna
ELFO-2012/13 --- Chimica_Lezione-2
15
15
Terminologia della tavola periodica moderna
Gruppi A = elementi rappresentativi o elementi dei gruppi principali
(i principali elementi chimici)
•
•
•
•
•
•
•
I A = metalli alcalini
II A = metalli alcalino-terrosi
IV A =
VA =
VI A =
VII A = alogeni
VIII = gas nobili
(IDROGENO – SODIO – POTASSIO)
(MAGNESIO – CALCIO)
(CARBONIO – SILICIO)
(AZOTO – FOSFORO)
(OSSIGENO – ZOLFO)
(FLUORO – CLORO)
(ELIO – NEON – ARGO)
Gruppi B = elementi di transizione
(molti dei principali metalli, possono realizzare numerosi legami)
• (FERRO – CROMO – ZINCO – ARGENTO – ORO)
ELFO-2012/13 --- Chimica_Lezione-2
16
16
Tavola periodica e carattere metallico degli elementi
Metalli
• Sono lucenti
• Possono essere lavorati, in lamine sottili (malleabilità) o in fili (duttilità)
• Solidi a temperatura ambiente (tranne Hg), conducono la corrente elettrica
Non-metalli
• Non presentano le proprietà dei metalli
• Reagiscono con i metalli per formare composti (ionici)
Metalloidi
• Hanno proprietà intermedie tra quelle dei metalli e quelle dei non-metalli
ELFO-2012/13 --- Chimica_Lezione-2
17
17