Cenni di anatomia e fisiologia di interesse clinico
1
Capitolo 1
Cenni di anatomia e fisiologia
di interesse clinico
Cesidio Giuliani, Fabrizio Monaco
I. Embriogenesi
Nell’embrione umano la tiroide origina, alla 3-4ª settimana di vita, da un diverticolo
dell’entoderma lungo la linea mediana della superficie ventrale dell’intestino branchiale o
faringeo, fra la prima e la seconda tasca branchiale (6). Tale regione corrisponde, a sviluppo terminato, alla base della lingua. Il diverticolo si allunga e si canalizza discendendo
caudalmente, nel sottostante mesoderma, verso la parte anteriore del collo e costituisce
il dotto tireoglosso, Fig. 1.1. L’estremità caudale del dotto cresce ed assume un aspetto bilobato dando origine ai due lobi tiroidei connessi dall’istmo, mentre la sua porzione
prossimale si trasforma in un peduncolo solido che a partire dalla 6ª settimana comincia
ad atrofizzarsi e scompare (6). Verso la 7-8ª settimana la tiroide è costituita già da due
lobi laterali connessi da un sottile strato di parenchima, l’istmo. Alla 8ª settimana comincia
la funzione delle cellule tiroidee che
dapprima acquistano la capacità di
timpano
sintetizzare la tireoglobulina, quindi
e tuba
di eustachio
quella di organizzarsi in follicoli, successivamente di concentrare lo iodio
dotto
ed infine di sintetizzare gli ormoni
tireo-glosso
tiroidei (6). Al terzo mese si riscontra
tonsilla
la colloide nei follicoli. La tireotropina
(TSH) è prodotta dall’ipofisi fin dalla
paratiroide
7-8ª settimana (6).
inferiore
Intorno alla 12 a settimana si
tiroide
identificano all’interno della tiroide le
timo
cellule C o parafollicolari che derivaparatiroide
superiore
no da cellule della cresta neurale mitrachea
grate nella V tasca branchiale (corpo
ultimobranchiale); intorno alla 7 a
settimana il corpo ultimobranchiale
Fig. 1.1 – Visione ventrale di un modello di entoderma faringeo
si fonde medialmente con l’abbozzo
di embrione umano alla 7-8° settimana di vita.
tiroideo (6, 25).
01.indd 1
04/05/2007 8.13.02
2
Malattie della tiroide
La conoscenza dello sviluppo della ghiandola tiroidea fornisce importanti informazioni
su alcune particolarità anatomiche e malformazioni congenite. Come già detto il dotto
tireoglosso scompare e, normalmente, l’unica
vestigia presente dopo la nascita è il suo
punto d’origine: il forame cieco, al limite tra la
radice e il corpo della lingua, Fig. 1.2; in circa il
40% delle persone permane anche un residuo
della porzione inferiore del dotto a costituire
il lobo piramidale (o del Morgagni), struttura
impari situata medialmente, che si estende
Fig. 1.2 – Superficie ventrale della lingua con
dall’istmo verso l’alto (32). Talora permane,
indicazione del forame cieco.
come residuo del dotto, un cordoncino fibroso
che si estende, lungo la linea mediana del
collo, dal forame cieco fino all’istmo tiroideo;
più raramente lungo questo decorso possono residuare nidi cellulari che costituiscono
delle tiroidi accessorie o si trasformano in cisti (le cisti mediane congenite del collo
o cisti tireoglosse) (13).
Anomalie del processo di migrazione dell’abbozzo tiroideo possono dar luogo ad
ectopie tiroidee (3, 6, 26). Il tessuto ectopico può essere riscontrato in ogni punto tra
il forame cieco e la sede normale della ghiandola, le localizzazioni più comuni sono
sopraioidee: alla base della lingua (tiroide linguale), o immediatamente al di sotto di essa
(tiroide sublinguale), Fig. 1.3. Se l’ectopia
ghiandolare è un evenienza rara, il riscontro
di residui microscopici di tessuto tiroideo alla
base della lingua è invece relativamente frequente e si è osservato nel 10% delle lingue
esaminate nel corso di autopsie (25). Talora si
può avere una migrazione eccessiva del dotto
tireoglosso con localizzazione della tiroide in
sede retrosternale, Fig. 1.3.
Gli stretti rapporti che si hanno nel corso dello sviluppo tra il dotto tireoglosso,
l’abbozzo del condotto laringotracheale, gli
archi branchiali e il mesoderma circostante spiegano il riscontro di tessuto tiroideo
ectopico in altre sedi quali: laringe, trachea,
arco dell’aorta, pericardio, cuore, esofago,
Fig. 1.3 – Sedi ectopiche della tiroide.
mediastino (25, 26).
01.indd 2
04/05/2007 8.13.05
Cenni di anatomia e fisiologia di interesse clinico
3
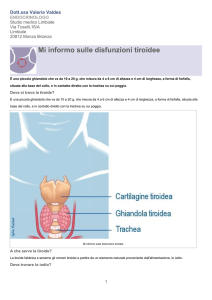
II. Anatomia macroscopica
La tiroide, nell’adulto e in condizioni di ottimale apporto iodico, pesa circa 20±5 g, ha
la forma di una farfalla ed è situata nella regione anteriore del collo davanti e lateralmente
alla laringe e ai primi 2 anelli della trachea, Fig. 1.4. Presenta due lobi laterali connessi
medialmente dall’istmo; in circa il 40% dei soggetti è inoltre presente un lobo piramidale
che si estende medialmente dall’istmo verso l’alto. L’istmo è localizzato immediatamente
al di sotto della cartilagine cricoide, al davanti del 10 e 20 anello tracheale, e la cartilagine
cricoide può essere utilizzata come punto di repere nell’esame obiettivo della tiroide.
Ogni lobo, in media, è lungo 4-5 cm, largo 1,5-2 cm e ha uno spessore di 1-1,5 cm. Il
lobo destro è generalmente maggiore di quello sinistro; ogni lobo ha un volume medio
di 4-8 mL e un peso medio di 5-10 g (19, 25).
La tiroide è accolta in uno sdoppiamento della fascia pretracheale (detta anche fascia
cervicale media) che prende il nome di guaina peritiroidea e tramite essa è adesa all’asse laringo-tracheale. Va segnalata la presenza di un legamento mediano (di Gruber)
che fissa la guaina peritiroidea alla cartilagine tiroidea e di due legamenti laterali che
connettono la suddetta guaina alla cartilagine cricoide e ai primi anelli tracheali (32).
La connessione tra guaina peritiroidea e asse laringo-tracheale permette alla tiroide di
seguire i movimenti della deglutizione.
La tiroide è ricoperta anteriormente dai muscoli sottoioidei (sternoioideo, sternotiroideo
ed omoioideo) e dalla fascia cervicale media, lateralmente dai muscoli sternocleidomastoidei e posteriormente contrae rapporto con il fascio vascolonervoso del collo (arteria
carotide comune, vena giugulare interna e nervo vago) e con il condotto laringotracheale.
Posteriormente a ognuno dei due lobi tiroidei, in corrispondenza del limite tra 1/3 superiore
e 1/3 medio e tra 1/3 inferiore e 1/3 medio rispettivamente, aderiscono due paratiroidi: le
superiori in prossimità del punto di penetrazione del nervo laringeo superiore nella larin-
Fig. 1.4 – Tiroide: visione anteriore.
01.indd 3
04/05/2007 8.13.05
4
Malattie della tiroide
ge, e le inferiori in prossimità
dell’arteria tiroidea inferiore,
Fig. 1.5 (32). Entrambe le
paratiroidi, sia superiore che
inferiore, sono vascolarizzate
dall’arteria tiroidea inferiore e
pertanto, nel corso di interventi chirurgici sulla tiroide,
bisogna sezionare questa
arteria a valle delle diramazioni dirette alle paratiroidi
in modo da salvaguardare
la loro vascolarizzazione.
Alla vascolarizzazione delle
paratiroidi superiori contriFig. 1.5 – Tiroide: visione posteriore.
buisce, in modo meno costante, anche l’arteria tiroidea superiore. Di particolare interesse clinico sono i rapporti
che la tiroide contrae con il nervo laringeo superiore e con il nervo laringeo inferiore
(o ricorrente). Il nervo laringeo superiore nella maggior parte dei casi decorre sulla
superficie del muscolo cricotiroideo, Fig. 1.4, ma in un 15% dei soggetti esso decorre
con i vasi tiroidei del peduncolo superiore (arteria e vena tiroidee superiori) formando
un’ansa sulla superficie superiore del lobo tiroideo. Tale peculiarità anatomica deve essere
conosciuta per individuare il nervo nel corso di interventi chirurgici ed evitare una sua
lesione responsabile della sindrome del laringeo superiore caratterizzata da paralisi
del muscolo cricotiroideo con abbassamento del tono della voce, facile affaticabilità e
limitazione all’emissione dei suoni acuti (15). Il nervo laringeo inferiore o ricorrente
decorre bilateralmente, lungo il canale tracheoesofageo medialmente all’arteria carotide
e contrae rapporti con l’arteria tiroidea inferiore (decorrendo in genere anteriormente o
posteriormente ad essa rispettivamente nel lato destro o sinistro) e con la parte postero-mediale del lobo tiroideo, Fig. 1.5. Una lesione del nervo ricorrente causa paralisi
della corda vocale che assume una posizione paramediana: se la lesione è unilaterale
si ha emiplegia laringea con disfonia, mentre se la lesione è bilaterale si ha diplegia
laringea con afonia e dispnea.
La vascolarizzazione della tiroide è fornita dalle arterie tiroidee superiori e inferiori
rami rispettivamente delle arterie carotidi esterne e delle succlavie. Con meno frequenza
è presente un’arteria tiroidea ima che deriva dal tronco brachiocefalico o dalla carotide
comune (32, 33). Esse forniscono, nel soggetto adulto, circa 5-6 mL/g/min di sangue, flusso
ematico maggiore di qualsiasi altro tessuto in assoluto, in rapporto al peso. Il drenaggio
venoso è effettuato dalle vene tiroidee superiori e inferiori, tributarie rispettivamente
delle vene giugulari interne e brachiocefaliche. Il drenaggio linfatico è garantito da una
estesa rete di capillari intratiroidei che confluisce in rami collettori subcapsulari, questi si
distaccano dalla ghiandola seguendo il decorso dei vasi venosi e si riversano in 5 diversi
01.indd 4
04/05/2007 8.13.06
Cenni di anatomia e fisiologia di interesse clinico
5
gruppi di linfonodi regionali (25): 1) i linfonodi pericapsulari, 2) il gruppo dei linfonodi
pretracheali, paratracheali e prelaringei (da segnalare il linfonodo Delfiano localizzato in
prossimità dell’istmo tiroideo), 3) i linfonodi della catena giugulare interna, 4) i linfonodi
della catena del nervo ricorrente, 5) il gruppo dei linfonodi retrofaringei e retroesofagei. I
diversi gruppi di linfonodi hanno un elevato grado di anastomosi per cui ognuno di essi può
essere sede di metastasi indipendentemente dalla sede del tumore nella tiroide (25).
L’innervazione della ghiandola è effettuata da fibre del sistema nervoso autonomo
simpatico e parasimpatico. Le fibre simpatiche derivano dai gangli cervicali, quelle parasimpatiche da rami dei nervi laringei (25, 32). Il ruolo principale dell’innervazione autonoma è quello di regolare il tono vasale e quindi il flusso ematico, ma si ritiene possibile
anche un effetto diretto sulla funzione tiroidea data la presenza di recettori colinergici e
adrenergici sulla membrana del tireocita (11).
III. Anatomia microscopica
L’unità anatomo-funzionale della tiroide è rappresentata dal follicolo, struttura grossolanamente sferica, costituita da un singolo strato di cellule epiteliali, dette appunto cellule
follicolari o tireociti, che delimitano una cavità centrale, il lume follicolare, in cui è depositata
la tireoglobulina (Tg) sotto forma di colloide. La colloide è una miscela proteica costituita in
massima parte dalla Tg e in minor quantità da altre iodoproteine con minor peso molecolare
e da albumina. Le cellule follicolari hanno un polo basale che è a contatto con lo stroma
e un polo apicale che delimita il lume follicolare. I follicoli tiroidei sono strettamente adesi
gli uni agli altri ed hanno dimensioni variabili (0,05-0,5 mm di diametro) (32). Esiste una
correlazione tra volume dei follicoli, spessore dell’epitelio e funzione del follicolo: i follicoli
di maggiore dimensione hanno un epitelio piatto e sono ipofunzionanti, mentre i follicoli
di dimensioni ridotte hanno un epitelio cubico o cilindrico e sono iperfunzionanti (11). Le
dimensioni follicolari sono influenzate dai livelli di TSH. Infatti sotto stimolo del TSH le cellule
si ingrandiscono e da piatte diventano cuboidali o colonnari, mentre il lume follicolare si
riduce; inoltre il TSH induce anche varie modificazioni morfologiche dei tireociti di cui la più
evidente è costituita dalla formazione di pseudopodi sulla membrana apicale, responsabile
del riassorbimento della tireoglobulina mediante il processo di macropinocitosi (11). Studi
sperimentali hanno evidenziato una eterogeneità funzionale e di crescita sia tra i diversi
follicoli di una stessa ghiandola che fra i tireociti costituenti un unico follicolo (7). Tale
eterogeneità è probabilmente conseguente a una diversa sensibilità delle cellule ai vari
stimoli. Lo stroma tiroideo è molto ricco di vasi che formano un esteso plesso di capillari
interfollicolari adiacenti alla membrana basale delle cellule follicolari. Esso inoltre presenta
un’abbondante rete di terminazioni nervose adrenergiche e colinergiche che circondano
i follicoli. Nella tiroide si trovano anche le cellule parafollicolari (“cellule C”), secernenti
la calcitonina. Queste cellule, voluminose e rotondeggianti con grosso nucleo centrale,
sono localizzate sia nel contesto della parete follicolare senza però raggiungere il lume del
follicolo, sia nello stroma interfollicolare organizzate in piccoli raggruppamenti (25, 32).
01.indd 5
04/05/2007 8.13.06
6
Malattie della tiroide
IV. Fisiologia
A. Sintesi e secrezione degli ormoni tiroidei
La tiroide umana produce due ormoni metabolicamente attivi: la T4, tiroxina o tetraiodotironina, e la T3, triiodotironina, Fig. 1.6. La sintesi degli ormoni tiroidei avviene
attraverso sette principali passaggi: 1) sintesi della tireoglobulina e sua immissione nel
lume follicolare; 2) captazione dello ioduro attraverso la membrana basale della cellula
tiroidea; 3) ossidazione dello ioduro in iodio molecolare; 4) iodazione dei residui tirosinici
della tireoglobulina; 5) accoppiamento delle iodotirosine con formazione di T3 e T4; 6)
riassorbimento della colloide; 7) proteolisi intracellulare della tireoglobulina con: liberazione
in circolo della T4 e T3, liberazione intracellulare di aminoacidi
che vengono riutilizzati per la
sintesi proteica e desiodazione
intracellulare delle iodotirosine
(MIT e DIT) con riutilizzazione
Fig. 1.6 – Struttura degli ormoni tiroidei.
dello iodio.
1. Sintesi della tireoglobulina.
La Tireoglobulina (Tg) è una glicoproteina, con peso molecolare di 660.000 daltons
(Da), che contiene circa il 10% di carboidrati, Tab. 1.1 (10, 17). Essa costituisce circa
il 75% delle proteine contenute nella tiroide ed è per la quasi totalità immagazzinata
nel lume follicolare. La Tg è prodotta solo dalle cellule follicolari tiroidee ed è costituita
da 2 subunità identiche, ciascuna con peso molecolare di 330.000 Da, legate fra loro
mediante legami non covalenti (10, 17). Il gene per la Tg è localizzato, nell’uomo, nel
braccio lungo del cromosoma 8 (8q24) e codifica per un polipeptide di 2768 aminoacidi
(incluso il peptide segnale di 19 aminoacidi) che corrisponde alla singola subunità di
Tg. Il polipeptide dopo essere stato sintetizzato subisce i processi di glicosilazione e
fosforilazione nel reticolo endoplasmatico rugoso e nell’apparato di Golgi e quindi viene
secreto nel lume follicolare. La Tg contiene 132 residui di tirosina di cui circa 1/3 sono
iodati e 8-10 residui sono implicati nella ormonogenesi: infatti per ogni subunità sono
stati descritti nell’uomo 4 siti ormonogenetici principali (designati A, B, C e D) e un sito
minore (N), la cui utilizzazione varia in base all’apporto iodico e al grado di glicosilazione
della Tg, Tab. 1.2 (10, 17, 35).
Tabella 1.1 – Caratteristiche fisico-chimiche della Tg umana.
01.indd 6
Peso molecolare
660.000 Da
Coefficiente di sedimentazione
19S
Contenuto in carboidrati
~10% del peso
Contenuto di iodio
~0,1-1% del peso
Punto isoelettrico
4,3-4,7
04/05/2007 8.13.06
Cenni di anatomia e fisiologia di interesse clinico
7
Tabella 1.2 – Siti ormonogenetici della Tg umana.
Sito
Residuo aminoacidico
Ormone prodotto
A
5
T4
B
2554
T4
C
2747
T3
D
1291
T4
N
685
T3 o T4
Le alterazioni della formazione di Tg (deficit di sintesi o di glicosilazione, alterata conformazione molecolare) rappresentano le cause più comuni di gozzo disormonogenetico.
2. Captazione dello ioduro.
Funzione primaria della tiroide è l’organificazione dello iodio, processo necessario per
la sintesi degli ormoni tiroidei. Lo iodio, introdotto con la dieta, viene ridotto nello stomaco a ione ioduro e rapidamente assorbito. Lo ioduro è trasportato dal sangue all’interno
della cellula tiroidea da una proteina sita sulla membrana basale del tireocita detta NIS,
Na+/I- symporter (cotrasportatore del Na+/I-) il cui gene è localizzato sul cromosoma 19,
Fig. 1.7 (8, 17). Il NIS è una glicoproteina di 613 aminoacidi e p.m. di circa 85.000 Da,
che appartiene alla famiglia delle proteine di trasporto sodio/glucosio, che trasporta 2
molecole Na+ e una di I- dall’esterno all’interno della cellula. La captazione dello ioduro
mediata da NIS è un trasporto attivo che utilizza l’energia del sistema Na+/K+-ATPasi e
permette un gradiente di iodio 40-100 volte maggiore all’interno della tiroide rispetto alla
Fig. 1.7 – Rappresentazione schematica della cellula tiroidea in cui si attua la ormonogenesi tiroidea.
01.indd 7
04/05/2007 8.13.06
8
Malattie della tiroide
concentrazione nel sangue, determinando una concentrazione intratiroidea maggiore di
oltre 10.000 volte rispetto alla quantità introdotta con la dieta (lo iodio costituisce quindi
il maggiore elemento presente nella tiroide: 0,02-0,2% del peso secco) (8). Il NIS non è
espresso solo dalle cellule follicolari tiroidee ma è presente anche in altri organi e tessuti:
le ghiandole salivari, la mucosa gastrica, la ghiandola mammaria durante l’allattamento,
il plesso coroideo, dove media in varia misura la captazione di ioduro (8, 28). Di importanza clinica è la proprietà di NIS di trasportare anche altri anioni oltre lo ioduro con
diversa selettività come riportato nella Tab. 1.3 (8, 38, 39). Il pertecnetato e il perclorato
sono gli anioni a più alta competizione per NIS, il primo è utilizzato in sostituzione dello
iodio nelle scintigrafie (ma misura solo la captazione poichè non viene organificato), il
secondo è utilizzato nel test di “discharge” e nella terapia delle tireotossicosi iodoindotte
poichè è un potente inibitore del trasporto di I- e ne favorisce l’efflusso dalla cellula (39).
L’espressione di NIS nella tiroide è stimolata dal TSH e dagli anticorpi antirecettore del
TSH, mentre è inibita dallo ioduro e dal TGF-β (8). Un’aumentata espressione di NIS si
osserva nella malattia di Basedow-Graves e nei noduli autonomi iperfunzionanti, mentre
un’espressione ridotta o assente si riscontra in adenomi e carcinomi tiroidei caratterizzati da una ridotta o assente captazione del radioiodio (8, 28). Inoltre alcune forme di
gozzo disormonogenetico sono conseguenti ad un deficit della captazione di ioduro per
mutazioni di NIS (8).
Il trasporto dello ioduro dal citoplasma cellulare al lume follicolare viene effettuato
da 2 sistemi di trasporto localizzati sulla membrana apicale del tireocita: la pendrina
e il Trasportatore Apicale dello Ioduro (AIT), Fig. 1.7. La pendrina è una glicoproteina transmembrana di 780 aminoacidi che costituisce il prodotto del gene PDS
(della sindrome di Pendred) e appartiene alla famiglia delle proteine di trasporto per
gli anioni. Essa media il trasporto I-/Cl- e la sua espressione è sotto il controllo della
Tg presente nel lume follicolare (29, 37). Mutazioni del gene PDS sono responsabili
della sindrome di Pendred dove è presente un deficit parziale del processo di organificazione dello iodio.
AIT è una proteina di 610 aminoacidi appartenente alla stessa famiglia di NIS con
cui ha un omologia di circa il 45%. Le informazioni sul ruolo di AIT sono al momento
limitate, si ritiene che medi il trasporto passivo dello ioduro attraverso la membrana
apicale (24).
Tabella 1.3 – Selettività di NIS per gli anioni.
TcO4- ≥ ClO4- > ReO4- > SCN- > BF4- > I- > NO3- > Br- > ClTcO4-: pertecnetato
ClO4-: perclorato
ReO4-: perrenato
SCN-: tiocianato
BF4-: tetrafluoruro di boro
01.indd 8
I-: ioduro
NO3-: nitrato
Br-: bromuro
Cl-: cloruro
04/05/2007 8.13.06
Cenni di anatomia e fisiologia di interesse clinico
9
3. Ossidazione dello ioduro in iodio molecolare.
Il processo di organificazione dello iodio, cioè la sintesi delle iodotironine a partire dagli
ioduri e dai residui tirosinici della Tg, è un processo molto rapido che richiede l’ossidazione dello ione ioduro. L’ossidazione è catalizzata dalla tireoperossidasi (TPO), enzima
presente sulla membrana apicale del tireocita, Fig. 1.7, che media anche il processo di
organificazione dello iodio (9, 17). La TPO è una glicoproteina con un gruppo eme il cui
gene è localizzato sul cromosoma 2; la sua sintesi ed attività è regolata principalmente
dal TSH (9). L’attività della TPO necessita di H2O2, la cui produzione avviene a livello
della membrana apicale ad opera di un sistema di ossidasi NADPH-dipendenti (THOX-1
e THOX-2) (9). Non è ancora del tutto nota la forma chimica che lo iodio deve avere al
momento della sua incorporazione; sono state ipotizzate varie forme di ossidazione quali
lo ione iodinio (I+), il radicale libero I0 o forme intermedie quali l’ipoiodito (OI-) (9, 17).
Le mutazioni della TPO costituiscono una causa importante di ipotiroidismo congenito
e gozzo disormonogenetico e recentemente è stato individuato un caso di mutazione
di THOX-2 responsabile di gozzo disormonogenetico con ipotiroidismo (23). Inoltre il
riscontro di difetti del sistema di ossidazione è molto frequente nei carcinomi tiroidei.
4. Iodazione dei residui tirosinici della tireoglobulina.
L’incorporazione dello iodio nei residui tirosinici della Tg avviene nell’interfaccia membrana apicale/colloide ed è mediata dalla TPO. Si formano così nella Tg i precursori degli
ormoni tiroidei: monoiodotirosina (MIT) e diiodotirosina (DIT), Fig. 1.8, a seconda che
siano legati al residuo tirosinico uno o due atomi di iodio rispettivamente (11). Non tutti i
residui tirosinici presenti nella Tg sono suscettibili di iodazione in modo simile, infatti alcuni
residui dapprima non disponibili per la iodazione lo diventano successivamente quando
con il processo di iodazione la molecola subisce un cambiamento della conformazione.
Inoltre l’apporto iodico influenza anche la formazione relativa delle iodotirosine: a bassi
livelli di iodazione predomina
la formazione di MIT mentre a
livelli elevati predomina quella
di DIT (9, 10, 17). È importante
sottolineare che il processo
di organificazione previene la
diffusione dello iodio dalla cel- Fig. 1.8 – Struttura delle iodotirosine: MIT= monoiodotirosina; DIT=
lula tiroidea al compartimento diiodotirosina.
plasmatico.
5. Accoppiamento delle iodotirosine con formazione di T3 e T4.
I residui di MIT e DIT interagiscono poi tra loro nella tireoglobulina dando luogo alla
formazione di iodotironine. Nella reazione di accoppiamento una delle molecole di iodotirosina dona l’anello iodofenolico all’altra generando un residuo di deidroalanina che
rimane incorporato nella catena tireoglobulinica, i due anelli iodofenolici sono uniti tra
01.indd 9
04/05/2007 8.13.07
10
Malattie della tiroide
loro mediante legame covalente tipo etere. Queste reazioni sono catalizzate dalla TPO
e richiedono H2O2 (17).
L’interazione fra due residui di DIT dà luogo alla formazione di T4 (o tetraiodotironina
o tiroxina) mentre quella di un residuo di DIT e uno di MIT porta alla formazione di T3 (o
triiodotironina). I residui di DIT e di MIT possono quindi essere considerati come i precursori degli ormoni tiroidei attivi. L’accoppiamento può avvenire sia fra iodotirosine presenti
sulla stessa molecola di Tg che su molecole contigue. L’apporto iodico è determinante
nell’influenzare le proporzioni relative degli ormoni tiroidei: in caso di elevata iodazione
l’alto rapporto DIT/MIT favorisce la formazione di T4, mentre una ridotta iodazione determina una maggiore formazione di MIT con prevalente produzione di T3 (17).
6. Riassorbimento della colloide.
La Tg iodata e accumulata nel lume follicolare come colloide viene riassorbita e
idrolizzata dal tireocita sotto lo stimolo del TSH. Il processo di riassorbimento avviene sia mediante fagocitosi (o macropinocitosi) con formazione di pseudopodi nella
membrana apicale che incorporano gocciole di colloide, sia mediante micropinocitosi
con formazione sulla membrana apicale di vescicole rivestite di clatrina che inglobano
microgocciole di colloide, Fig. 1.7 (9, 17). Entrambi i processi sono stimolati dal TSH
e sono variamente prevalenti nelle diverse specie, nell’uomo il processo più utilizzato
è quello della micropinocitosi. Sia i fagosomi che le vescicole di endocitosi una volta
penetrate nel citoplasma si fondono con i lisosomi a formare fagolisosomi dove la Tg
viene degradata (9, 17).
Si ritiene che la Tg presente nel siero possa derivare da vescicole che non si fondono
con i lisosomi e che raggiungono la membrana basale della cellula (transocitosi) dove la
Tg viene secreta (20). Alcuni Autori però contestano questa ipotesi e ritengono che la Tg
sierica sia conseguenza di una diretta secrezione di proteina neosintetizzata da parte
del tireocita quale retaggio filogenetico del tessuto tiroideo non ancora organizzato per
formare i follicoli (22).
La secrezione della Tg presenta una notevole importanza clinica in quanto la sua
determinazione sierica è utilizzata per la diagnosi differenziale di alcune tireopatie (ipotiroidismo congenito, tireotossicosi) e per il follow-up del carcinoma tiroideo differenziato.
7. Proteolisi della tireoglobulina.
All’interno dei fagolisosomi la Tg è degradata da enzimi proteolitici quali endo- ed esopeptidasi liberando T3, T4, MIT, DIT e i vari aminoacidi. Gli ormoni tiroidei che si liberano
nel processo di proteolisi migrano verso il polo basale della cellula ed entrano in circolo;
non è attualmente noto se esiste uno specifico meccanismo di trasporto intracellulare
o se c’è una semplice diffusione (9, 11, 17). Va ricordato che all’interno del tireocita si
forma una piccola quota di T3 a partire dalla T4 per la presenza degli enzimi 5’-desiodasi
di tipo I (D1) e II (D2): si ritiene che circa il 10% della T4 intratiroidea è convertita in T3.
Le molecole di MIT e DIT che si liberano dal processo proteolitico vengono desiodate
da specifiche iodotirosine-desiodasi intratiroidee NADPH-dipendenti; lo ioduro liberato
01.indd 10
04/05/2007 8.13.07
Cenni di anatomia e fisiologia di interesse clinico
11
rientra in gran parte nel pool intratiroideo dello iodio per essere riutilizzato dalla stessa
cellula e solo in piccola parte viene immesso in circolo (9, 11, 17). L’importanza che la
desiodazione intratiroidea di MIT e DIT ha nel recupero dello ioduro è dimostrata dal fatto
che deficit congeniti di tale processo causano gozzo disormonogenetico.
La maggior parte degli aminoacidi che derivano dalla proteolisi della Tg sono riutilizzati
dalla cellula per la sintesi proteica.
La proteolisi della Tg e la secrezione di ormoni tiroidei sono inibite dall’eccesso di
iodio e dal litio con meccanismi d’azione non ancora conosciuti (12).
B. Metabolismo dello iodio
Lo iodio, un oligoelemento solubile in acqua ma relativamente scarso in natura, viene
assunto con l’acqua e/o con il cibo e convertito nello stomaco in ioduro. La concentrazione
di ioduro nel sangue è bassa (0,1-2,0 µg/dL) e varia a seconda del suo introito alimentare
(che può oscillare da <50 a >500 µg/die). L’Organizzazione mondiale della Sanità ritiene
ottimale un apporto di iodio di 150 µg per tutte le persone con età >12 anni, 200 µg per
le donne in gravidanza e durante l’allattamento, 120 µg per i ragazzi in età scolare (6-12
anni) e 90 µg per i bambini con età inferiore ai 6 anni, Tab. 1.4 (36).
Il pool extracellulare scambiabile di ioduro dipendente dall’apporto alimentare, in condizioni ottimali (apporto iodico di 150 µg) è di circa 250 µg, Fig. 1.9. Approssimativamente
Tabella 1.4 – Apporto dietetico di iodio raccomandato (WHO, UNICEF, ICCIDD 2001).
Bambini con età < 6 anni
90 µg
Bambini con età scolare (6-12 anni)
120 µg
Persone con età >12 anni
150 µg
Donne in gravidanza o allattamento
200 µg
Fig. 1.9 – Pool dello iodio.
01.indd 11
04/05/2007 8.13.07
12
Malattie della tiroide
la tiroide capta 115 µg di iodio/24 ore di cui 75 µg vengono utilizzati per la sintesi degli
ormoni tiroidei e il rimanente 40 µg entra nel pool extracellulare. Il pool dello iodio organificato intratiroideo è di 8-10 mg e rappresenta una forma di deposito sia degli ormoni
che dei precursori ormonali; da questo pool circa 75 µg vengono immessi in circolo ogni
giorno nella forma organificata e corrispondono alla quota utilizzata e metabolizzata dai
tessuti periferici. La quantità di ioduro che si genera dai processi di desiodazione epatica e renale ammonta a circa 60 µg/die che ritornano nel pool dello ioduro, mentre 15
µg/die sono escreti con la bile ed eliminati nelle feci, come conseguenza dei processi di
glucuronazione e solfatazione degli ormoni tiroidei che avvengono nel fegato. Il pool dello
ioduro extracellulare è quindi costituito dalla quota alimentare (150 µg) cui va sommata
la quota immessa come tale dalla tiroide (40 µg) a cui va aggiunta la quota derivante
dal metabolismo periferico (60 µg) per una quantità totale pari a 250 µg. La maggior
parte dello ioduro alimentare viene invece eliminato nelle urine; la sua determinazione
rappresenta pertanto un indice attendibile dell’apporto iodico alimentare. In circolo è
inoltre presente iodio organificato circolante (T3 e T4) legato alle proteine plasmatiche la
cui quota ammonta a circa 600 µg (9, 11, 21).
C. Trasporto degli ormoni tiroidei nel sangue.
Gli ormoni tiroidei sono secreti all’esterno della cellula e circolano nel sangue quasi
completamente sotto forma legata alle proteine sieriche. Solo lo 0,03% della T4 e lo 0,3%
della T3 circolano libere e costituiscono gli ormoni metabolicamente attivi. La maggior
parte della T4 totale ematica (99,97%) e della T3 totale ematica (99,7%) circola legata
alla Thyroxine-binding globulin (TBG) e, in minor misura, alla Thyroxin-binding prealbumin (TBPA), all’albumina e alle lipoproteine. La TBG è la proteina che possiede
maggiore affinità per gli ormoni tiroidei, mentre TBPA e l’albumina hanno un’affinità molto
minore anche se una capacità maggiore, Tab. 1.5 (1).
Tabella 1.5 - Caratteristiche delle proteine di trasporto degli ormoni tiroidei.
TBG
Peso molecolare (Da)
Struttura
Contenuto in carboidrati (%)
Albumina
54.000
55.000
66.000
Monomero
Tetramero
Monomero
23
0
0
1,5-2
15-25
3,5-4,5
Emivita plasmatica (giorni)
5
2
15
Numero di siti leganti
1
2
>5
Concentrazione plasmatica (mg/dL)
Capacità di legame per la T4 (µg/dL)
Frazione dei siti occupata dalla T4
% degli ormoni legati alle singole forme di proteine sieriche
T4
T3
01.indd 12
TBPA
20
4
0,8
0,33
0,02
<0,001
70-75
75-80
10-15
5-9
15-20
5-11
04/05/2007 8.13.07
Cenni di anatomia e fisiologia di interesse clinico
13
La TBG è una glicoproteina con il 23% di carboidrati, ha un peso molecolare di 54.000
Da, è sintetizzata dal fegato ed è presente nel siero alla concentrazione di 1,5-2 mg/dL.
La TBG, grazie alla sua elevata affinità per la T4 e la T3, trasporta circa il 75% degli ormoni tiroidei circolanti. Ogni molecola di TBG ha un sito legante per gli ormoni tiroidei;
il legame con la T4 presenta un’affinità 10-20 volte maggiore rispetto a quello con la T3.
In condizioni fisiologiche circa un terzo della TBG circolante lega gli ormoni tiroidei e
prevalentemente la T4, in caso di completa saturazione la capacità della proteina è di 20
µg di T4/dL di siero. La TBG è un membro della famiglia degli inibitori delle serin-proteasi
(SERPIN), cui appartengono l’α1antichimotripsina, l’α1antitripsina e la proteina di trasporto
del cortisolo (CBG). Sia gli estrogeni che la gravidanza aumentano il contenuo in acido
sialico della molecola con conseguente diminuzione della sua clearance metabolica e
aumento dei livelli sierici; gli androgeni e i glucocorticoidi invece diminuiscono i livelli di
TBG. Alcuni farmaci come i salicilati e la difenilidantoina competono per il legame fra
ormoni tiroidei e TBG aumentando i livelli delle frazioni libere.
La TBPA nota anche come transtiretina è una proteina costituita da 4 subunità identiche
ciascuna contenente 127 aminoacidi. La proteina è sintetizzata dal fegato, ha un peso molecolare di 55.000 Da e circola nel siero alla concentrazione di 15-25 mg/dL. La TBPA lega
circa il 10-15% della T4 circolante ed ha una affinità per la T4 10 volte maggiore rispetto alla
T3. Sebbene la TBPA trasporti una minore quantità di ormoni tiroidei per molecola, rispetto
alla TBG, il suo contributo alla quota di ormone libero rilasciato a livello tessutale è pari a
quello della TBG poichè la costante di dissociazione del legame ormone-proteina è 5 volte
maggiore. La TBPA ha un ruolo specifico nel facilitare il passaggio di T4 attraverso il plesso
corioideo, costituisce il 25% delle proteine presenti nel liquido cerebrospinale dove lega l’80%
della T4. La TBPA inoltre ha un ruolo nel trasporto del retinolo e dell’acido transretinoico.
L’Albumina è anch’essa sintetizzata dal fegato e possiede un peso molecolare di circa
66.000 Da. Essa possiede un sito di legame forte per la T4 e la T3 e più siti di legame
debole. L’affinità della proteina per gli ormoni tiroidei è bassa ma in conseguenza della
sua elevata capacità (la concentrazione sierica è di 3,5-4,5 mg/dL) essa trasporta circa
il 15-20% di tutta la T4 e T3 circolanti. Il legame dell’albumina agli ormoni tiroidei presenta
inoltre una elevata costante di dissociazione e questo associato alla elevata capacità fa
si che l’albumina sia la principale fonte degli ormoni tiroidei liberi.
Le lipoproteine e in maniera significativa le HDL legano una piccola quota di ormoni
tiroidei (3% di T4 e 6% di T3).
Le funzioni delle proteine di trasporto sono essenzialmente cinque:
1) costituiscono un deposito extracellulare degli ormoni tiroidei;
2) possiedono un’azione “tampone” che mantiene una concentrazione costante delle
frazioni libere nonostante eventuali fluttuazioni della secrezione ormonale;
3) sono responsabili della ottimale e omogenea distribuzione ormonale a livello
tessutale;
4) consentono un rilascio delle frazioni libere metabolicamente attive in relazione alle
esigenze tessutali;
5) aumentano significativamente l’emivita plasmatica degli ormoni tiroidei.
01.indd 13
04/05/2007 8.13.07
14
Malattie della tiroide
Nonostante la molteplicità delle funzioni descritte, le proteine di trasporto non sono
indispensabili per la funzione tiroidea; infatti una marcata riduzione della loro concentrazione o addirittura la completa mancanza, come si osserva in alcune condizioni con
deficit congeniti di ciascuna delle proteine, non alterano la funzione tiroidea. È pur vero
che non esiste una condizione clinica in cui tutte le proteine di trasporto siano contemporaneamente carenti e che altre proteine sieriche (SHBG, immunoglobuline, ecc.)
contribuiscono al trasporto degli ormoni tiroidei (1).
D. Metabolismo degli ormoni tiroidei.
La produzione media giornaliera di ormoni tiroidei è illustrata nella Fig. 1.10 (11).
In condizioni fisiologiche la tiroide produce in modo predominante T4 e solo in piccola
quantità T3, quest’ultima infatti è prodotta soprattutto a livello tessutale periferico mediante
desiodazione dell’anello fenolico esterno della T4. Nel siero la T3 ha un’emivita di circa 1
giorno mentre la T4 di 7-8 giorni, Tab. 1.6. Circa un terzo della T4 viene convertita in T3
che rappresenta l’ormone biologicamente attivo essendo 3-8 volte più potente della T4,
mentre il 45% è trasformato in reverse-T3 (rT3) che è invece un metabolita privo di attività
biologica con emivita relativamente breve (~0,5 h).
Gli ormoni tiroidei sono metabolizzati mediante desiodazione nei tessuti periferici
(principalmente fegato, rene, cervello) attraverso tre differenti enzimi: la desiodasi tipo I
(D1), la desiodasi tipo II (D2) e la desiodasi tipo III (D3), Fig. 1.11. Questi enzimi sono
delle selenio-proteine che contengono nel loro sito catalitico un residuo di seleniocisteina
Fig. 1.10 – Produzione giornaliera degli ormoni tiroidei.
01.indd 14
04/05/2007 8.13.07
Cenni di anatomia e fisiologia di interesse clinico
15
la cui presenza è essenziale per l’attività enzimatica. Le tre forme di desiodasi differiscono
per la diversa localizzazione tessutale e attività enzimatica Tab. 1.7 (2, 11).
Tabella 1.6 - Caratteristiche degli ormoni tiroidei.
T4
T3
5-11
0,07-0,2
0,8-1,8 ng/dL
2,5-4,5 pg/mL
Concentrazione totale (µg/dL)
Frazione libera
Frazioni libere (% del totale)
0,03
0,3
Produzione giornaliera (µg)
80-100
30-40
Emivita plasmatica (giorni)
8
1
Fig. 1.11 – Metabolismo degli ormoni tiroidei
ad opera delle desiodasi.
Tabella 1.7 - Caratteristiche delle desiodasi umane.
01.indd 15
D1
D2
Peso molecolare (Da)
27.000
30.000
D3
32.000
Attività desiodasica
5’, 5, 3’, 3
5’
5
Localizzazione tessutale
Fegato, rene, tiroide
Ipofisi, tiroide, tessuto
adiposo bruno, cuore,
SNC, muscolo, placenta
Placenta, SNC, cute
Inibizione da parte del PTU
Elevata
Assente
Assente
Fattori stimolanti l’attività
T4
?
T4
Fattori inibenti l’attività
Citochine
acido iopanoico
Acido iopanoico, T4
Acido iopanoico
04/05/2007 8.13.07
16
Malattie della tiroide
La D1 rappresenta l’enzima con maggiore distribuzione nell’organismo, e si trova
principamente nel fegato, nel rene e nella tiroide. Essa agisce sulla T4 desiodandola in
posizione 5’ con formazione della T3. L’attività enzimatica di D1 costituisce la principale
fonte di T3 circolante. La D1 possiede inoltre anche l’attività 5-desiodasica e catalizza
la trasformazione della T4 in rT3. Una caratteristica distintiva della D1 rispetto alle altre
desiodasi è la sua inibizione da parte del propiltiouracile (PTU). L’attività enzimatica è
stimolata dagli ormoni tiroidei e pertanto è ridotta nell’ipotiroidismo e aumentata nell’ipertiroidismo. La D1 è inoltre ridotta da varie citochine quali IL-1, IL-6, TNF-α.
La D1 catalizza anche la 3’ e 3 desiodazione, reazioni importanti nel catabolismo
degli ormoni tiroidei.
L’enzima D2 è localizzato soprattutto a livello ipofisario, del sistema nervoso centrale
(SNC), del tessuto adiposo bruno e del muscolo scheletrico. Possiede solo l’attività 5’desiodasica ed è insensibile all’azione del PTU.
La D3 è presente principalmente nel SNC, nella placenta e nella cute. Possiede solo
attività 5-desiodasica e costituisce la principale fonte della rT3 circolante.
Riassumendo, in condizioni fisiologiche circa il 35% della T4 è desiodato in T3 per
azione della D1 o della D2, il 45% è desiodato in rT3 per azione della D1 o della D3 e
circa il 10% è secreto nella bile come metabolita glucuronato o solfato ed escreto con le
feci. Il processo di solfatazione è molto importante per il catabolismo degli ormoni tiroidei
poichè aumenta l’affinità del substrato con le desiodasi e di conseguenza l’efficienza dei
processi di desiodazione a livello epatico. Le frazioni della T4 che vengono desiodate
in T3 o in rT3 dipendono dalle condizioni dell’organismo e sono influenzate dallo stato
nutrizionale (iper o ipoalimentazione) e dalle condizioni di salute (benessere, febbre o
malattie), infatti si osserva una riduzione dell’attività della D1 nel corso di malattie e nel
digiuno. La funzione della rT3 nell’uomo non è nota anche se sperimentalmente essa
inibisce l’attività 5’-desiodasica, suggerendo così un suo effetto nella regolazione della
produzione degli ormoni tiroidei (2).
La funzione delle desiodasi è quella di modulare a livello locale, nell’organo bersaglio,
l’attività degli ormoni tiroidei regolando la quantità di ormone attivo (T3) che viene prodotta
in relazione alle necessità dell’organismo.
Le concentrazioni ematiche di MIT e DIT sono molto basse, meno di 0,1 ng/mL, e
rappresentano soprattutto il prodotto catabolico della rottura del legame etere fra i due
residui iodofenolici delle iodotironine. Le iodotirosine hanno emivita biologica breve, di
circa 4-5 ore, sono prive di attività biologica, vengono desiodate principalmente a livello
epatico e lo iodio entra nel pool circolante dello ioduro (2, 34).
Un’ulteriore tappa metabolica cui vanno incontro gli ormoni tiroidei è la reazione di
desaminazione della catena laterale alaninica con formazione di acido tetraiodotiroacetico
(TETRAC) e 3,3’,5’-triiodotiroacetico (TRIAC) rispettivamente dalla T4 e dalla T3. Questo
processo è di minore importanza dal punto di vista quantitativo e i metaboliti prodotti sono
successivamente desiodati. TETRAC e TRIAC sono privi di attività biologica ma il TRIAC
è in grado di legarsi con buona affinità ai recettori per gli ormoni tiroidei e competere con
la T3 per il legame a livello nucleare (2, 34).
01.indd 16
04/05/2007 8.13.07
Cenni di anatomia e fisiologia di interesse clinico
17
E. Meccanismo d’azione degli ormoni tiroidei.
La maggior parte delle azioni degli ormoni tiroidei sono conseguenti all’interazione
con specifici recettori nucleari; entrambi gli ormoni si legano ai recettori ma la T3 presenta
un’affinità 10-15 volte maggiore e pertanto costituisce il ligando d’elezione (40, 41, 42). La
modulazione della trascrizione genica è il principale meccanismo d’azione degli ormoni
tiroidei tramite il legame al recettore nucleare. Gli ormoni tiroidei circolanti liberi sono
trasportati all’interno della cellula sia per diffusione passiva che mediante un trasporto
attivo attraverso la membrana cellulare; la T4 viene convertita in T3 all’interno della cellula e
quest’ultima migra nel nucleo dove si lega al recettore nucleare specifico, (11, 40, 41, 42). I
recettori per gli ormoni tiroidei (TR) appartengono alla superfamiglia dei recettori nucleari
per gli ormoni steroidei/tiroidei, comprendenti i recettori per gli ormoni steroidei, la vitamina
D, l’acido retinoico e il recettore attivante la proliferazione dei perossisomi (PPAR) (11, 40,
41, 42). I recettori membri della superfamiglia presentano un’alta omologia strutturale tra
loro e derivano da un gene precursore comune nel corso dell’evoluzione; essi agiscono tutti
come fattori di trascrizione e modulano l’espressione genica. I TR costituiscono l’omologo
cellulare dell’oncogene virale v-erbA responsabile della eritroleucemia aviaria. Si distinguono due tipi di recettori, α e β, i cui geni sono localizzati rispettivamente sul cromosoma
17 e 3, Fig. 1.12 (40, 41, 42). Il gene α codifica per 2 isoforme recettoriali distinte α1 e
c-erbAα2. Il TRα1 è espresso in quasi tutti i tessuti, è particolarmente abbondante nel
sistema nervoso centrale, nel muscolo scheletrico, nel grasso bruno, nel tessuto adiposo e
nel cuore, e agisce come un classico recettore legando la T3 e modificando la trascrizione
genica. Il c-erbAα2, presente soprattutto nel testicolo, nel SNC e nell’ipotalamo, non è in
grado di legare l’ormone e agisce come un repressore dell’attività mediata dagli altri TR.
Il gene β codifica anch’esso per 2 isoforme: TRβ1 e TRβ2, Fig. 1.12. ll TRβ1, presente in
molti tessuti, è particolarmente espresso nel fegato e nel rene, mentre il TRβ2 è presente
quasi esclusivamente nell’ipofisi e nell’ipotalamo, Tab. 1.8. Le tre isoforme TRα1, TRβ1 e
TRβ2 legano tutte la T3 con alta affinità (la T3 si lega con un’affinità 10-15 volte maggiore
rispetto alla T4) e modulano
la trascrizione di geni specifici svolgendo un ruolo nella
funzione, differenziazione e
divisione cellulare. Il recettore
si lega a specifiche sequenze
nucleotidiche, denominate
“thyroid hormone response
element” (TRE), sotto forma
di dimeri. Il TRE è costituito
generalmente da una coppia
di esameri (sequenza di 6
basi nucleotidiche) disposti in
Fig. 1.12 – Struttura schematica dei recettori degli ormoni tiroidei.
modo palindromico a diretto
01.indd 17
04/05/2007 8.13.07
18
Malattie della tiroide
Tabella 1.8 - Distribuzione tessutale dei recettori per la T3.
Recettore
Tessuto
TRα1
Muscolo scheletrico, SNC, cuore, fegato, tessuto adiposo
c-erbAα2
Testicolo, SNC, ipotalamo
TRβ1
Fegato, rene, SNC, muscolo
TRβ2
Ipofisi, ipotalamo
contatto o separati da una sequenza
di DNA di lunghezza variabile, Fig.
1.13 (40, 41, 42). I recettori leganti
la T3 si legano al DNA formando
degli eterodimeri con i recettori per
il retinoide X (RXR) o per l’acido
retinoico (RAR), mentre i TR senza
T3 si legano al DNA sia come eterodimeri che come omodimeri. Infatti
una caratteristica peculiare dei TR
è quella di legarsi al DNA e modulare la trascrizione genica anche in
assenza di ligando. Il legame della
Fig. 1.13 – Sequenza Consensus del TRE.
T3 al recettore induce, a seconda del
gene, un aumento o una riduzione
della trascrizione, quindi nei geni
regolati positivamente dagli ormoni tiroidei i TR privi di ligando esercitano una inibizione
della trascrizione e il legame con la T3 inverte il processo determinando una stimolazione
di essa; il processo inverso si verifica nei geni regolati negativamente. Come già accennato
l’isoforma c-erbAα2 del recettore non è in grado di legare la T3 ma è in grado di legare il
TRE sul DNA.
Oltre agli effetti trascrizionali, sono state descritte anche delle azioni non genomiche
degli ormoni tiroidei, Tab. 1.9, mediate, probabilmente, da recettori non nucleari diversi
dai TR, localizzati sulla superficie della membrana cellulare e a livello mitocondriale (5,
40, 41, 42). Studi “in vitro” hanno identificato varie proteine, sia a livello mitocondriale
(ADP/ATP translocasi) che della membrana plasmatica (integrina αVβ3), leganti gli ormoni
Tabella 1.9 – Azioni non genomiche degli ormoni tiroidei.
– Stimolo dell’attività Ca++-ATPasi di membrana
– Stimolo del trasporto transmembrana del glucosio
– Inibizione dell’attività desiodasica di D2
– Azione sulla adenina-nucleotide translocasi mitocondriale (enzima chiave dello scambio ATP/ADP)
– Polimerizzazione dell’actina costituente il citoscheletro
01.indd 18
04/05/2007 8.13.08
Cenni di anatomia e fisiologia di interesse clinico
19
tiroidei, ma il loro ruolo è ancora in discussione (5). Studi recenti hanno evidenziato che
l’interazione degli ormoni con l’integrina αVβ3 è correlata all’attivazione del segnale di
trasduzione di MAP-chinasi e con il rimodellamento del citoscheletro (5).
F. Effetti degli ormoni tiroidei.
Gli ormoni tiroidei hanno molteplici effetti e intervengono nella regolazione dei processi
di crescita e metabolici di quasi tutti gli organi ed apparati, Tab. 1.10 (11, 21, 42). Alcuni
effetti, quali l’attivazione del trasporto intracellulare di glucosio e degli aminoacidi, sono
precoci, cioè si manifestano nell’arco di minuti e sono di natura non genomica; la maggior
parte degli effetti invece sono tardivi e richiedono un periodo di latenza di alcune ore; questi
effetti sono genomici e mediati dai TR. Gli ormoni tiroidei sono fondamentali per lo sviluppo
fetale e per i processi di accrescimento postnatale, e il loro ruolo per lo sviluppo del SNC
e dell’apparato muscolo-scheletrico è particolarmente importante. Essi inoltre sono importanti regolatori delle funzioni metaboliche: in quasi tutti i tessuti aumentano il consumo di
O2, la produzione di calore e la sintesi proteica; intervengono nel metabolismo glucidico
aumentando la gluconeogenesi e la glicogenolisi epatica e stimolando l’assorbimento
intestinale di glucosio; influenzano il metabolismo lipidico aumentando la sintesi epatica
dei recettori per le LDL, l’attività della lipoproteinlipasi e la lipolisi nel tessuto adiposo.
Gli ormoni tiroidei sono necessari per la conversione epatica del carotene in vitamina A;
infatti nell’ipotiroidismo si ha un accumulo di carotene nel plasma responsabile dal colorito
giallastro della cute. Altri importanti effetti degli ormoni tiroidei si riscontrano nell’apparato
cardiovascolare dove esercitano un effetto inotropo e cronotropo positivo conseguenti alla
stimolazione della sintesi nelle cellule miocardiche delle catene α di miosina, dell’enzima
Ca++-ATPasi e dei recettori β-adrenergici (16). La sintesi di questi ultimi è stimolata anche
in altri tessuti quali il muscolo scheletrico e il tessuto adiposo.
Tabella 1.10 – Principali effetti degli ormoni tiroidei.
01.indd 19
Organo/tessuto
Effetti
Cuore
Aumentano il numero dei recettori β adrenergici e la sintesi della catena
pesante α della miosina
Tessuto adiposo
Stimolano la lipolisi
Muscolo
Aumentano il catabolismo proteico
Osso
Promuovono la crescita e lo sviluppo
Sistema Nervoso
Promuovono lo sviluppo
Intestino
Stimolano l’assorbimento di glucosio
Fegato
Aumentano la sintesi del recettore per le LDL, stimolano la conversione
del carotene in vitamina A
Tutti (eccetto testicolo, utero,
tessuto linfatico e adenoipofisi)
Aumentano il consumo di O2 e la produzione di calore
04/05/2007 8.13.08
20
Malattie della tiroide
G. Controllo della funzione tiroidea.
1. Asse ipotalamo-ipofisi-tiroide.
La sintesi e secrezione degli ormoni tiroidei è regolata primariamente dalla tropina
ipofisaria Thyroid Stimulating Hormone (TSH) o tireotropina, che a sua volta è regolata
dal fattore ipotalamico Thyrotropin-Releasing Hormone (TRH) (34).
Il TRH è un tripeptide sintetizzato nei nuclei sopraottico e paraventricolare dell’ipotalamo, il cui gene si trova sul cromosoma 3. Esso stimola la sintesi e la secrezione del TSH
legandosi a specifici recettori di membrana delle cellule tireotrope. La risposta dell’ipofisi
al TRH è bimodale liberando inizialmente il TSH già sintetizzato e presente nell’ipofisi e
quindi inducendone la sintesi. Il TRH stimola anche la sintesi e il rilascio della prolattina.
Esso è prodotto anche in altre parti del SNC e nell’apparato gastroenterico (14).
Il TRH viene metabolizzato rapidamente con una emivita ematica di circa 5 minuti, i livelli
sierici sono di 25-100 pg/mL. La sua secrezione è stimolata dagli agonisti α-adrenergici
mentre gli ormoni tiroidei esercitano un feed-back negativo sulla sua produzione (14).
Il TSH è una glicoproteina del p.m. di 28.000 Dalton costituita da due subunità, α e β.
La subunità α, di 92 aminoacidi, è comune agli altri ormoni glicoproteici ipofisari (FSH,
LH) e all’hCG, mentre la subunità β, di 112 aminoacidi, è specifica per ciascun ormone.
Il TSH ha una concentrazione ematica di 0,4-4,0 µU/mL e un’emivita di circa 60 min.
Costituisce il principale regolatore della crescita e della funzione tiroidea intervenendo
su tutte le tappe dell’ormonogenesi ed agisce legandosi ad uno specifico recettore di
membrana (TSHR) appartenente alla famiglia dei recettori accoppiati alle G-proteins (31).
Il legame del TSH al recettore attiva diversi sistemi di trasduzione del segnale; il principale
è rappresentato dal sistema adenilatociclasi/AMPc, ma un ruolo importante è svolto anche
dai sistemi della fosfolipasi C (PLC) e della fosfolipasi A2 (PLA2) (27). Lo studio del TSHR
si è rivelato molto utile per la comprensione della patogenesi delle tireopatie autoimmuni
e del meccanismo d’azione degli autoanticorpi stimolanti e bloccanti il recettore. Inoltre
studi molecolari hanno evidenziato mutazioni attivanti del TSHR responsabili di alcune
forme di ipertiroidismo (ipertiroidismo familiare non autoimmune, adenoma autonomo
iperfunzionante) e di ipotiroidismo (sindrome da resistenza al TSH) (31).
La produzione di TSH è inversamente regolata dalla concentrazione degli ormoni
tiroidei presenti nell’ipofisi anteriore, dove la 5’-desiodasi tipo II converte rapidamente la
T4 in T3. Pertanto, la regolazione ipofisaria della secrezione del TSH è influenzata soprattutto dalla concentrazione della T4 sierica piuttosto che da quella della T3. Inoltre, l’attività
della desiodasi specifica dell’ipofisi e del cervello è aumentata dalla riduzione dei livelli
di T4 sierica; in questi organi anche la conversione della T4 in T3 aumenta non appena
la T4 sierica si riduce. Il sistema di desiodazione ipofisaria rappresenta il meccanismo
regolatore principale della produzione di TSH da parte dell’ipofisi (2, 11).
2. Autoregolazione da parte dello iodio.
Lo iodio non è solo un costituente indispensabile per la formazione degli ormoni tiroidei,
ma è anche un regolatore della funzione tiroidea. Un rapido aumento della concentrazio-
01.indd 20
04/05/2007 8.13.08
Cenni di anatomia e fisiologia di interesse clinico
21
ne di ioduro sierico, maggiore di 20-30 µg/dL, determina un blocco dell’organificazione
dello iodio e quindi dell’ormonogenesi. Tale fenomeno è definito effetto Wolff-Chaikoff
e generalmente è transitorio (~48 ore). Infatti se permane l’elevata concentrazione di
ioduro l’inibizione scompare e l’ormonogenesi tiroidea viene ripristinata (fenomeno
chiamato “escape” dall’effetto Wolff-Chaikoff) (4). Non è tuttora noto come l’eccesso di
ioduro agisca a livello molecolare, studi “in vitro” hanno dimostrato che esso interferisce
con la trasduzione del segnale indotta dal TSH e che modifica a livello trascrizionale
l’espressione di vari geni tiroidei fra i quali NIS. Lo ioduro esercita inoltre un effetto inibitorio sulla crescita del tireocita (4).
3. Altri fattori.
Altri ormoni, fattori di crescita e neurotrasmettitori partecipano alla regolazione della
crescita e funzione tiroidea. Sebbene i loro effetti sono stati ben descritti in studi sperimentali “in vitro”, il loro ruolo nella fisiologia e fisiopatologia umana non è ancora chiaro.
Alcuni tra i fattori meglio studiati sono riportati in Tab. 1.11, molte delle loro azioni sono
strettamente integrate a quelle del TSH modulandone l’effetto finale sul tireocita (18).
Recentemente è stato osservato che la Tg presente nel lume follicolare agisce in
modo autocrino sulla regolazione dell’espressione di geni tiroide specifici quali il TSHR,
TPO, NIS e PDS (29, 30).
Tabella 1.11 – Fattori che intervengono nella regolazione della crescita e funzione tiroidea.
Crescita
Funzione
TSH
S
S
LH, hCG (alte concentrazioni)
S
S
FGF
S
?
Ioduro
I
I
TGF-β
I
I
Noradrenalina
?
S
Insulina/IGF-I
S
S
Acetilcolina
?
I
Citochine (IL-1, TNF-α, IFN-γ)
I
I
Tireoglobulina
?
I
-S = stimolazione
- I = inibizione
Gli studi sul meccanismo d’azione degli ormoni tiroidei e in modo particolare sulle loro azioni
trascrizionali, mediate dai recettori nucleari, hanno consentito la sintesi di ligandi selettivi dei
TR denominati STORMs (selective thyroid hormone receptor modulators). Tali ligandi sono in
grado di esercitare una stimolazione dei TR tessuto-specifica che si ritiene possa essere di
grande utilità in clinica. Sono in atto studi per confermare un loro utilizzo terapeutico (Flamant
F, Gauthier K, Samarut J, Thyroid hormones signaling is getting more complex: STORMs are
coming, Mol Endocrinol, 2007, 21, 321).
01.indd 21
04/05/2007 8.13.08
22
Malattie della tiroide
Bibliografia
1. Benvenga S, Thyroid hormone transport proteins and the physiology of hormone binding, in
Werner and Ingbar’s The Thyroid: a Fundamental and Clinical Text, 9th Ed, Braverman LE,
Utiger RD Eds, Lippincott Williams and Wilkins, Philadelphia, 2005, 97.
2. Bianco AC, Reed Larsen P, Intracellular pathways of iodothyronine metabolism, in Werner
and Ingbar’s The Thyroid: a Fundamental and Clinical Text, 9th Ed, Braverman LE, Utiger RD
Eds, Lippincott Williams and Wilkins, Philadelphia, 2005, 109.
3. Bowen-Wright HE, Jonklaas J, Ectopic intratracheal thyroid: an illustrative case report and
literature review, Thyroid, 2005, 15, 478.
4. Burman KD, Wartofsky L, Iodine effects on the thyroid gland: biochemical and clinical aspects,
Rev Endocr Metab Disord, 2000, 1, 19.
5. Davis PJ, Davis FB, Cody V, Membrane receptors mediating thyroid hormone action, Trends
Endocrinol Metab, 2005, 16, 429.
6. De Felice M, Di Lauro R, Thyroid development and its disorders: genetics and molecular
mechanisms, Endocr Rev, 2004, 25, 722.
7. Derwahl M, Studer H, Hyperplasia versus adenoma in endocrine tissues: are they different?,
Trends Endocrinol Metab, 2002, 13, 23.
8. Dohán O, De La Vieja A, Paroder V, Riedel C, Artani M, Reed M, Ginter CS, Carrasco N, The
sodium/iodide symporter (NIS): characterization, regulation, and medical significance, Endocr
Rev, 2003, 24, 48.
9. Dunn JT, Dunn AD, Update on intrathyroidal iodine metabolism, Thyroid, 2001, 5, 407.
10. Dunn JT, Dunn AD, The importance of thyroglobulin structure for thyroid hormone biosynthesis,
Biochimie, 1999, 81, 505.
11. Ganong WF, The Thyroid gland, in Review of Medical Physiology, 22nd Ed, McGraw-Hill, New
York, 2005, 317.
12. Giuliani C, Monaco F, Malattie della tiroide, in Prontuario di Terapia Endocrina e Metabolica,
Monaco F Ed, SEU, Roma, 2006, 131.
13. Grosfeld JL, Chirurgia pediatrica, in Trattato di Chirurgia: le basi biologiche della moderna
pratica chirurgica, I Ed italiana, Sabiston DC Jr Ed, Antonio Delfino Editore, Roma, 1999,
1234.
14. Guillemin R, Hypothalamic hormones a.k.a. hypothalamic releasing factors, J Endocrinol,
2005, 184, 11.
15. Hurtado-Lopez LM, Pacheco-Alvarez MI, De la Luz Montes-Castillo M, Zaldivar-Ramirez FR,
Importance of the intraoperative identification of the external branch of the superior laryngeal
nerve during thyroidectomy: electromyographic evaluation, Thyroid, 2005, 15, 449.
16. Kahaly GJ, Dillmann WH, Thyroid Hormone Action in the Heart, Endocr Rev, 2005, 26, 704.
17. Kim P, Thyroid hormones formation, in Endocrinology, 5th Ed, DeGroot LJ, Jameson JL Eds,
Elsevier Saunders, Philadelphia, 2006, 1823.
18 Kimura T, Van Keymeulen A, Golstein J, Fusco A, Dumont JE, Roger PP, Regulation of thyroid
cell proliferation by TSH and others factors: a critical evaluation of in vitro models, Endocr Rev
2001, 22, 631.
19. Osti V, Solbiati L, Semeiotica ecografica normale, in Tiroide: diagnostica per immagini e
approccio clinico ragionato, Lagalla R, Latteri MA, Attard M, Midiri M Eds, Idelson-Gnocchi,
Napoli, 2004, 115.
20. Marinò M, Pinchera A, McCluskey RT, Chiovato L, Megalin in thyroid physiology and pathology, Thyroid, 2001, 11, 47.
21. Monaco F, La tiroide, in Endocrinologia Clinica, III Ed, Monaco F Ed, SEU, Roma, 2005,
225.
01.indd 22
04/05/2007 8.13.08
Cenni di anatomia e fisiologia di interesse clinico
23
22. Monaco F, Napolitano G, Lio S, Roche J, Existet il une double vie de secretion de la Thyroglobuline: un “circuit courte” faiblement glycosylo-iodè et un “circuit-long” fortment glycosyloiodè?, CR Seances Soc Biol Fil, 1989, 183, 108.
23. Moreno JC, Bikker H, Kempers MJE, van Trotsenburg P, Baas F, De Vijlder JJM, Vulsma T,
Ris-Stalpers C, Inactivating mutations in the gene for thyroid oxidase 2 (THOX2) and congenital
hypothyroidism, N Engl J Med, 2002, 347, 95.
24. Rodriguez AM, Perron Lacroix L, Caillou B, Leblanc G, Schlumberger M, Bidart JM, Pourcher
T, Identification and characterization of a putative human iodide transporter located at the
apical membrane of thyrocytes, J Clin Endocrinol Metab, 2002, 87, 3500.
25. Rosai J, Carcangiu ML, DeLellis RA, The normal thyroid gland, in Atlas of tumor pathology:
Tumors of the thyroid gland, Rosai J, Carcangiu ML, DeLellis RA Eds, Armed Forces Institute
of Pathology, Washington DC, 1992, 1.
26. Soscia A, Guerra G, Cinelli MP, Testa D, Galli V, Macchi V, De Caro R, Parapharingeal ectopic
thyroid: the possible persistence of the lateral thyroid anlage. Clinical case report, Surg Radiol
Anat, 2004, 26, 338.
27. Spaulding SW, Biological actions of thyrotropin, in Werner and Ingbar’s The Thyroid: a Fundamental and Clinical Text, 9th Ed, Braverman LE, Utiger RD Eds, Lippincott Williams and
Wilkins, Philadelphia, 2005, 183.
28. Spitzweg C, Morris JC, The sodium iodide symporter: its pathophysiological and therapeutic
implications, Clin Endocrinol, 2002, 57, 559.
29. Suzuki K, Kohn LD, Differential regulation of apical and basal iodide transporters in the thyroid
by thyroglobulin, J Endocrinol, 2006, 189, 247.
30. Suzuki K, Nakazato M, Ulianich L, Mori-Aoki A, Moriyama E, Chung HK, Pietrarelli M, Grassadonia A, Matoba H, Kohn LD, Thyroglobulin autoregulation of thyroid-specific gene expression and follicular function, Rev Endocr Metab Disord, 2000, 1, 217.
31. Szkudlinski MW, Fremont V, Ronin C, Weintraub BD, Thyroid-stimulating hormone and thyroidstimulating hormone receptor structure-function relationships, Physiol Rev, 2002, 82, 473.
32. Testut L, Latarjet A, Sistema nervoso centrale-Ghiandole a secrezione interna, in Trattato di
Anatomia umana, vol. III, UTET, Torino, 1977, 750.
33. Toni R, Della Casa C, Mosca S, Malaguti A, Castorina S, Roti E, Anthropological variations
in the anatomy of the human thyroid arteries, Thyroid, 2003, 13, 183.
34. Utiger RD, The thyroid: physiology, thyrotoxicosis, hypothyroidism, and the painful thyroid, in
Endocrinology and Metabolism, 4th Ed, Felig P, Frohman LA Eds, McGraw Hill Inc, New York,
2001, 261.
35. van de Graaf SAR, Ris-Stalpers C, Pauws E, Mendive FM, Targovnik HM, de Vijlder JJM, Up
to date with human thyroglobulin, J Endocrinol, 2001, 170, 307.
36. WHO Global Database on Iodine deficiency, Iodine status worldwide, World Health Organization, Geneva, 2004.
37. Wollf J, What is the role of Pendrin?, Thyroid, 2005, 15, 346.
38. Wollf J, A miss for NIS?, Thyroid, 2002, 12, 295.
39. Wollf J, Perchlorate and the thyroid gland, Pharmacol Rev, 1998, 50, 89.
40. Yen PM, Genomic and non-genomic actions of thyroid hormones, in Werner and Ingbar’s The
Thyroid: a Fundamental and Clinical Text, 9th Ed, Braverman LE, Utiger RD Eds, Lippincott
Williams and Wilkins, Philadelphia, 2005, 135.
41. Yen PM, Ando S, Feng X, Liu Y, Maruvada P, Xia X, Thyroid hormone action at cellular, genomic and target gene levels, Mol Cell Endocrinol, 2006, 246, 121.
42. Yen PM, Physiological and molecular basis of thyroid hormone action, Physiol Rev, 2001, 81,
1097.
01.indd 23
04/05/2007 8.13.08