AZOTO
•
•
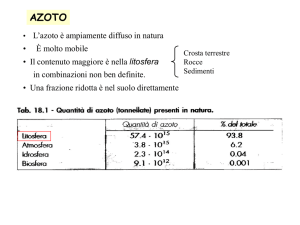
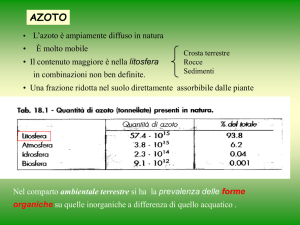
L’azoto è ampiamente diffuso in natura
È molto mobile
• Il contenuto maggiore è nella litosfera
in combinazioni non ben definite.
Crosta terrestre
Rocce
Sedimenti
• Una frazione ridotta è nel suolo direttamente
assorbibile dalle piante
Il comparto ambientale terrestre si differenzia da quello acquatico per la
prevalenza delle forme organiche su quelle inorganiche
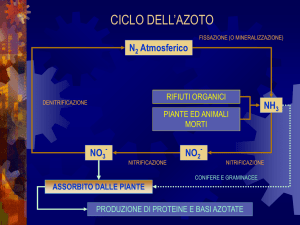
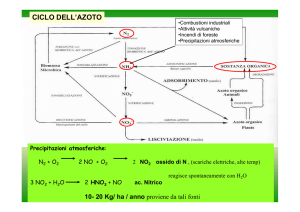
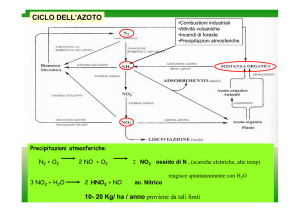
CICLO DELL’AZOTO
•Combustioni industriali
•Attività vulcaniche
•Incendi di foreste
•Precipitazioni atmosferiche
Precipitazioni atmosferiche:
N2 + O2
3 NO2 + H2O
2 NO + O2
2 HNO3 + NO
2 NO2 ossido di N , (scariche elettriche, alte temp)
ac. Nitrico reagisce spontaneamente con H2O
10- 20 Kg/ ha / anno proviene da tali fonti
AZOTO ORGANICO
Humus : mol organiche complesse
Mineralizzazione
N proteico derivante da spoglie
animali e vegetali
NO3– e NH4+
processo che avviene in 3 stadi :
1. PROTEOLISI
Proteine
Acidi nucleici
operata da microrganismi
amminoacidi
amminoacidi
nucleotidi
apertura anelli
2. AMMONIFICAZIONE (microrganismi eterotrofi)
AMMONIFICAZIONE
deamminazione
rilascio di NH3
amminoacidi
rilascio di
Ac. Organici
R
CO2+ H20
H-C-NH2
COOH
3. NITRIFICAZIONE
(batteri autotrofi)
conversione di
NH3
NO2- e NO3–
NH3 è un gas a temp ambiente
+
NH3 + H2O
NH4 +
OH-
•
sono 2 forme molto solubili
•
entrambe direttamente
assorbibili dalle piante
A pH ~ 7 la
NH3
è trascurabile
NH4 +
Assorbimento
(Piante)
Immobilizzazione
nella S.O.
(microrganismi)
Fissazione
sui colloidi del suolo
Nitrificazione
Conversione in NO2- e NO3-
NITRIFICAZIONE: 2 stadi
a) 2NH3 + 3O2
2NO2- + 2H+ + 2H2O
Batteri nitrosanti: Nitrosococcus, Nitrosomonas,Nitrosovibrio
b) 2NO2- + O2
2NO3-
Batteri nitricanti: Nitrobacter, Nitrococcus,Nitrospina
Entrambe le reazioni sono esoergoniche : I batteri usano l’energia liberata
dall’ossidazione di NH3 per ridurre
la CO2 ed utilizzarla per la
produzione di sostanza organica.
Per questo sono detti autotrofi chemiosintetici.
NITRIFICAZIONE
NH3
(-3)
NO2-
NO3–
nitrito
nitrato
6 e-
2 e-
(+3)
operata da Nitrosomonas
1. Nitrosazione
NH4+ + 3 O2
Perdita di 8 e-
(+5)
2 NO2- + 4 H+ + 2 H2O ∆G= - 65 Kcal/mole
Perdita di 6 e- per ogni N:
3 fasi distinte di reazione con scambio di 2 e- per fase :
1.
NH3 + ½ O2
2.
NH2OH + ½ O2
NH2OH idrossilammina
HNO
nitrossile
La formazione di tali
composti non è
evidenziabile perché
restano ancorati
3.
HNO2 + ½ O2
NO2- + H + Ac. Nitroso
all’E. che li sintetizza
solo il prodotto finale è rilasciato nell’ambiente
•
Il passaggio di e- all’O2 non è diretto ma avviene tramite
Trasportatori costituiti da coenzimi contenenti Cu
•
•
I batteri tollerano elevata concentrazione di NH4+
range di pH : 8,6-8,8
2. Nitricazione
NO2- + ½ O2
NO3-
∆G = -17,8 Kcal/mole
2 e- arrivano all’O2 tramite catena di citocromi
• La nitrificazione comporta acidificazione
• La nitricazione è molto + veloce della nitrosazione
non si ha accumulo di nitriti
• La presenza ubiquitaria dei batteri nitrificanti garantisce
il processo di nitrificazione, ma
• Le condizioni ambientali possono influire:
pH :
optimum da neutralità a leggera acidità
Temperatura :
26°C è optimum
A pH > 7
l’ NH4+ assorbito risulta fitotossico
Aumento rapido della NH3
A pH neutro-acido molte specie tollerano elevate concentrazioni di NH4+
NH3 + H+
NH4+
Tossicità dell ‘ammoniaca:
Facilità di attraversamento della membrana
Nei cloroplasti azione ossidativa a livello dei
tilacoidi
Inibizione della germinazione
Inibizione della respirazione
Danneggiamento delle radici
ASSORBIMENTO NELLE PIANTE DELLE FORME AZOTATE
- Per il NITRATO, NO3- , 2 sistemi:
1.
Sistema ad alta affinità,dovuto a un carrier inducibile
efficiente a basse concentrazioni (< 1 mM) , con flusso basso
Attività dell’ATPasi
Gradiente protonico
Cotrasporto 2H+ / NO3-
2.
Sistema a bassa affinità, di tipo costitutivo (canale anionico?)
attivo a concentrazioni elevate (> 1mM) ma con flusso maggiore.
- Per lo ione AMMONIO, NH4+
È assorbito in relazione all’efflusso di H+
Tramite un Carrier definito ad alta affinità
- Assorbimento dell’ AMMONIACA, NH3:
Diffusione attraverso lo strato lipidico
Favorita da elevati pH all’esterno della radice
La fonte di N influisce sul pH della soluzione esterna:
• L’ NH4+
diminuzione pH soluzione esterna
• L’NO3- è assorbito di preferenza a
pH inferiori della rizosfera
•
NH4+ + NO3-
aumento pH soluzione esterna
iniziale diminuzione di pH (assorbimento di NH4+)
aumento di pH (assorbimento di NO3- )
rappresenta la situazione
migliore per la pianta:
•
•
la produzione di H+ ~ produzione di OH –
La regolazione del pH non richiede elevati
costi energetici
DENITRIFICAZIONE = perdita di N dal suolo sottoforma gassosa :
NO2
ossido nitroso
N2
N molecolare
è una
Riduzione dissimilatoria del nitrato
23 specie di batteri denitrificanti :
Pseudomonas, Rhizobium, Azospirillum eterotrofi e aerobi facoltativi
Il processo generale si riassume con le reazioni:
2 NO3- + 10 e- + 12 H+
N2 + 6 H2O
2 NO3- + 8 e- + 10 H+
N2O + 5 H20
La riduzione è graduale con
l’acquisto di 2 e- per tappa
Denitrificazione
NO3-
N2
N2O
riduttasi
anaerobi facoltativi
N2O
NO
NO
riduttasi
NO2-
Nitrito
riduttasi
Nitrato
riduttasi
Enzima diverso da quello
coinvolto nell’assimilazione
Questi quattro enzimi contengono: Mo, Cu and Fe.
Batteri denitrificanti, in assenza di ossigeno come
accettore di elettroni, riducono ossidi di azoto.
Il substrato ossidato è S.O.
Utilizzano
l’energia
ottenuta
dalla
riduzione
per
trasferire elettroni e immagazzinare energia (ATP).
Parametri che favoriscono
il processo di denitrificazione:
• Assenza di O2
• Alte concentrazioni di nitrati
• 5.5< pH <8.6
•Temperature > 5°C,
anche se avviene anche fino a 0°C
La denitrificazione riveste importanza:
•
Terreni con alternanza nel tempo di
Fasi aerobiche
formazione di NO3-
Fasi anaerobiche
denitrificazione
(risaie)
•
Elevata presenza di radici vive nel suolo: elevata produzione di essudati
radicali
•
stimolazione attività batterica denitrificante
Sottrazione di O2
condizioni di anaerobiosi
Lo svolgersi del processo di denitrificazione
negli orizzonti profondi del suolo
diminuzione del contenuto di NO3-
diminuzione dell’inquinamento
delle falde acquifere
ASSIMILAZIONE
RIDUZIONE DEL NITRATO
NO3- + 8 H+ + 8 e-
NH3 + 2 H2O + OH -
2 Enzimi lavorano in serie:
- La Nitrato reduttasi
NR
NO3- + NAD(P)H + 2e- + 2H+
- Nitrito reduttasi NiR
NO2- + NAD(P)+ + H2O
NO2- + 6 e- + 6 H+
NH3 + OH- + H2O
Nitrato reduttasi (NR)
3 gr. Prostetici : FAD, Citocromo , Cofattore molibdeno
È citoplasmatica
2 isoforme della NR:
È costituita da 2 subunità identiche e autonome
Fogliare utilizza NADPH
Radicale utilizza NADH
Nitrito reduttasi (NiR)
E’ un monomero
gr. Siro-eme come gr. prostetico
NR
1.
NO3- + NADH+ H+ + 2e-
NO2- + NAD+ + H2O
NiR
2.
NO2- + 6e- + 6H+
In Totale:
NH3 + OH- + H2O
NO3- + 8 H+ + 8 e-
NH3 + 2 H2O + OH-
Nelle foglie i 6 e- per la riduzione dei nitriti provengono alla Fd dall’acqua, tramite il
trasporto non ciclico degli e- nella fase luminosa della fotosintesi.
Nelle radici è una proteina simile alla Fd che viene ridotta dal NADH
La Nitrato reduttasi
•
È un E. substrato-inducibile (regolazione trascrizionale):
La presenza di NO3- nel citosol
aumento della sintesi dell’E.
Incremento di attività dell’E.
La presenza di prodotti di assimilazione azotati (a.a., amidi..)
Inibizione dell’attività dell’E (feed-back negativo)
•
•
Ha un veloce turn-over :
continua sintesi e degradazione
La sua attività è modulata da alcuni effettori:
1. Nitrato
agiscono da segnali che influenzano
2. Luce
la ripartizione del C fotosintetico nelle foglie fra
sintesi di saccarosio e
Sintesi di a.a.
due vie competono per gli scheletri C
Il flusso di C è regolato da una proteina chinasi citosolica
buio
Proteina chinasi
Inattiva
Proteina chinasi
Attiva
luce
opera una fosforilazione
e modula l’attività dei 2 E chiave:
FOSFORILAZIONE
Sacc-Sintasi P
(inattiva)
PEPc –P
(attiva)
Saccarosio
Malato
3. Fitormoni :
Le citochinine :
aumento della trascrizione di mRNA per NR
aumento della sintesi di NR
ABA
inibizione della NR
Nelle piante C4 le cellule di mesofillo e guaina del fascio si differenziano anche
per l’assimilazione dei nitrati:
NR e NiR sono localizzate solo
nelle cellule del mesofillo
•
Nelle cell. del mesofillo l’energia prodotta nella fase luminosa viene
utilizzata per la
riduzione del nitrato
e la sua assimilazione
•
Nelle cell. della guaina del fascio viene utilizzata per
la riduzione della CO2 (Rubisco)
La riduzione del nitrato è
sia nelle foglie che nelle
radici
Dipende da: specie
vegetale, età della pianta,
concentrazione di NO3- esterno
In generale:
• Quando il rifornimento esterno di nitrato è basso
Un’elevata quantità è organicato nelle radici
Elevata concentrazione di a.a. nel succo xilematico
•
All’aumentare della concentrazione esterna di nitrato:
Una proporzione crescente di NO3viene traslocato alle foglie nello xilema
ASSIMILAZIONE del NITRATO
Avviene
prevalentemente nelle
foglie
La produzione di OHrichiede la sintesi di
acidi organici che
dissociando con gli H+
tamponano il pH
intracellulare e vengono
accumulati nel vacuolo
Meccanismi di osmoregolazione:
• Ritraslocazione nel floema verso aree in crescita dell’N ridotto (a.a, amidi) + cationi
mobili (K e Mg)
• Ritraslocazione verso le radici di anioni di acidi organici (malato) + K+ successiva
decarbossilazione e rilascio di HCO3• Uptake di NO3 - :
Il K+ agisce da contro-ione nel trasporto in salita del NO3 -
assorbito a livello radicale
Assimilazione dell’ NH4+
Se il nitrato può essere
accumulato nei vacuoli senza
danno L’NH4+ e soprattutto
l’NH3 sono tossici a basse
concentrazioni: Nel citoplasma
NH4+ < 15 µM
Nel vacuolo anche
conc + elevate in quanto il
basso pH previene la
formazione di NH3
L’assorbimento di NH4+ nella radice comporta il rilascio di H+ per la
compensazione di cariche: antiporto NH4+ / H+
• Quasi tutto l’NH4+ è assimilato nelle radici: 3 NH4+
3 NH2-R + 4 H+
Detossificazione
rapida formazione di a.a. e amidi
Produzione di H+
Acidificazione del citoplasma
e aumento dell’invio di H+ all’esterno
•
L’elevata richiesta di scheletri C per la sintesi di a.a. viene garantita dal
ciclo degli ac.tricarbossilici
Processi di ORGANICAZIONE
Proteine
Ac. Nucleici
Clorofilla
GS
GOGAT
La conversione dell’ammonio in azoto organico è il risultato della
Attività di 2 Enzimi:
1.
GS
= glutammina sintetasi
2. GOGAT = glutammato sintetasi
L’asparagina è la 2a ammide importante per le piante in particolare
nelle leguminose originarie dei climi temperati
È ottenuta mediante idrolisi dell’ATP
L’N dell’aspartato può derivare dal glutammato
I 4 C derivano dall’ossalacetato
L’asparagina ha le stesse funzioni della glutammina
RADICE
Frazioni azotate nelle piante Il turnover dell’N ha 3 tappe principali:
NO3-, NH4+
N2
1
Aminoacidi, Ammine
Ammidi
2
Proteine
Acidi nucleici
3
L’azoto che viene organicato nella pianta resta come tale
È un processo irreversibile
Le 3 frazioni azotate sono influenzate dalla nutrizione:
Aumentando il livello di nutrizione azotata
Incremento di tutte la frazioni
ma con intensità differente
• In questa situazione il contenuto proteico varia in modo modesto
• L’ac glutammico e la glutammina sono i 2 primi a.a. sintetizzati:
L’ac glutammico è sensibile agli incrementi azotati
•L’N inorganico in questo caso è assimilata a una vel > vel con cui
sono utilizzati gli a.a nella sintesi proteica:
aumento notevole degli a.a. solubili e non delle proteine
NO 3-
NO 3-
La carenza di K comporta:
A.A. SOLUBILI
• Alterazione della sintesi proteica
A.A. SOLUBILI
PROTEINE
PROTEINE
•
Il K è cofattore in molte
attività enzimatiche
Aumento nel contenuto degli a.a. solubili
Rallentamento della velocità di crescita
Il contenuto di N ottimale per la pianta varia a seconda
della specie, dello stadio di sviluppo, dell’organo considerato
In genere è compreso fra il 2- 5 % espresso in sostanza secca
I sintomi di carenza si manifestano
• nelle foglie con clorosi:
L’N presente nelle foglie più vecchie viene traslocato
in forma di a.a. alle parti giovani
La proteolisi provoca collassamento dei cloroplasti:
Calo del contenuto di clorofilla
Sbiancamento delle foglie
In mais e pomodoro:
accumulo di antociani in fusto, piccioli,nervature
colorazione rossastra
• Compromissione
dell’apparato radicale
soprattutto la ramificazione
Modesta velocità di
crescita
Piante piccole, steli
sottili, foglie piccole
Il rapporto germogli/radici è
abbassato dalla carenza di N
All’aumentare della disponibilità di N:
• Incremento del contenuto di N nelle sue forme organiche
• Diminuzione del contenuto di carboidrati di riserva
• Aumenta il rapporto germogli/radici . Le radici sono corte
situazione + sfavorevole per acquisizione di H2O e nutrienti nella
pianta adulta
In riso
Cambi nella morfologia fogliare
la disponibilità di N
•
Aumento lunghezza, larghezza e area fogliare
•
Diminuzione dello spessore
foglie flosce e curve
interferenza con l’intercettazione della luce
Nei cereali
l’eccessivo N
interferenze nel bilanciamento dei fitormoni
aumento della lunghezza dello stelo
Aumento rischio allettamento
MOVIMENTO DEI COMPOSTI AZOTATI
•Durante la germinazione
Idrolisi delle proteine accumulate nei corpi proteici
formazione di a.a. e ammidi
produzione di nuove proteine
e acidi nucleici
Traslocazione alle cellule in accrescimento
di radici e germogli
Durante la fase vegetativa e riproduttiva
Ampia ricircolazione dell’N verso i sink + importanti:
•
Le foglie perdono N e i semi lo accumulano
•
Idrolisi della Rubisco ad opera di proteinasi
(nelle foglie circa la metà delle proteine si trovano nei cloroplasti)
L’attività fotosintetica diminuisce
In carenza di N durante la fase riproduttiva:
•
Autodistruzione delle proteine nelle foglie per garantire il giusto apporto di N
ai semi
(anche le molecole di clorofilla)
• All’inizio della fase riproduttiva il massiccio trasferimento di N è accompagnato
da una diminuzione dell’assorbimento dell’N dal suolo
arancio
Clorosi delle foglie
adulte
limone
arancio
vite
mais
riso
frumento
tabacco
patata
pomodoro
cucurbitacee
ulivo
cicas
garofano
cavolo
eccesso di
N
Cavolo cappuccio:
Eccesso di N
Anomala distribuzione
del Ca