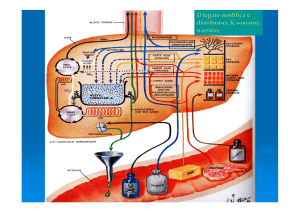
Università degli Studi Kore di Enna
Facoltà di Scienze dell’Uomo e della Società
CdL in “Scienze delle attività motorie e sportive”
Biochimica
Domenico Ciavardelli - Ph.D.
email: [email protected]
AA 2013-2014
Biochimica-Lezione 5
Domenico Ciavardelli
La glicogenosintesi è un processo anabolico
Principali vie anaboliche
proteine
sintesi proteine
polisaccaridi
glicogenosintesi
aminoacidi
citosol
lipidi
sintesi
glucosio
gluconeogenesi
lipidi
acidi grassi
sintesi
acidi grassi
piruvato, lattato, AA
corpi
chetonici
chetogenesi
acetil-CoA
mitocondrio
ciclo di
Krebs
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Il glucosio viene conservato sotto forma di GLICOGENO localizzato
prevalentemente nel fegato e nel muscolo.
GLICOGENOSINTESI
Legame (16)
Legame (14)
•Catalizzata dalla glicogenosintasi
•Richiede l’attivazione del glucosio
•Quali sono le possibili configurazioni del legame glicosidico di di- e polisaccaridi?
•Come si chiama il derivato di aldeidi e chetoni che dà origine al legame glicosidico?
•Qual è la principale differenza tra amido e cellulosa? E tra maltosio e lattosio?
•La presenza di ramificazioni nel glicogeno rende la molecola più solubile in acqua e più suscettibile all’azione di enzimi grazie
alla maggiore esposizione dei legami glicosidici. Perché?
AA 2013-2014
•La cellulosa è ramificata o lineare?
Biochimica-Lezione 4
Domenico Ciavardelli
Glicogeno + UDP
Legame fosfoanidridico
Pirofosfato scisso
da pirofosfatasi
inorganica
glicogeno
sintetasi
Uridina
UDP-glucosio + PPi
UDP-glucosio
UDP-glucosio pirofosforilasi
Uridina
glucosio 1-P
UTP
2Pi
UTP
+
glucosio 1-P
•Che ruolo ha ai fini della
glicogenosintesi l’idrolisi del pirofosfato?
Ricordare il principio di Le Chatelier.
•Perché l’attivazione del glucosio avviene
in posizione 1? Qual è l’etremità reattiva
del glicogeno in cresita?
fosfoglucomutasi (isomerasi)
glucosio 6-P
glucosio 6-P
(intermedio della glicolisi)
•Complessivamente l’allungamento del polisaccaride di un’unità richiede il
consumo di una molecola di UTP
•Formazione delle ramificazioni Glicosiltransferasi: enzima ramificante
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Il glicogeno è una fonte di glucosio che può essere rilasciato dal fegato nel
sangue mediante il processo di GLICOGENOLISI: degradazione enzimatica del
glicogeno a glucosio
•Catalizzata dalla GLICOGENO FOSFORILASI
Glicogeno fosforilasi
•Fosfoglucomutasi catalizza
l’isomerizzazione di G-1P a G-6P
•G-6P può entrare nella glicolisi o
essere defosforilato da glucosio
6-fosfatasi epatica e trasportato
ad altri tessuti.
•Solo gli epatociti esprimono la
glucosio 6-fosfato fosfatasi e
quindi solo il fegato può utilizzare
il glicogeno come fonte di glucosio
per tessuti diversi (sistema
nervoso centrale, eritrociti)
•I miociti utilizzano il proprio
glicogeno per la produzione di
energia in situ.
Glucosio 1-fosfato
•Qual è l’enzima che trasforma il glucosio 1-fosfato in glucosio 6-fosfato? Di che reazione
si tratta?
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
La regolazione di glicogenolisi e glicogenosintesi è fondamentale per il
mantenimento di:
•OSMOLARITA’ CELLULARE (lo spazio extracellulare deve essere
mantenuto alla stessa pressione del citoplasma).
•GLICEMIA (concentrazione ematica di glucosio).
Regolazione coordinata della glicogeno sintasi e della glicogeno fosforilasi
La glicogeno sintasi (glicogenosintesi)
glicogenosintesi) e la glicogeno fosforilasi (glicogenolisi)
glicogenolisi) possono
esistere in due forme:
- a attiva ;
- b inattiva.
La glicogeno sintasi è nella forma attiva a quando è defosforilata, mentre la glicogeno
fosforilasi è nella forma a attiva quando è fosforilata.
fosforilata
viceversa
La glicogeno sintasi è nella forma b inattiva quando è fosforilata, mentre la glicogeno
fosforilasi è nella forma b inattiva quando è defosforilata.
Gli enzimi coinvolti vengono regolati mediante MODIFICAZIONE COVALENTE, un
ulteriore meccanismo di regolazione dell’attività enzimatica oltre a quelli trattai
nelle diapositive 47 e 48 della lezione 3.
AA 2013-2014
Biochimica-Lezione 4
•Quali sono i principali meccanismi di regolazione dell’attività enzimatica?
Domenico Ciavardelli
La fosforilazione reversibile delle proteine spesso interessa residui di serina (il gruppo
ossidrilico viene trasformato in fosfoestere e viceversa). Gli enzimi che catalizzano la
fosforilazione sono le Chinasi e Fosforilasi mentre le Fosfatasi catalizzano la defosforilazione.
AA1
Ser
•In figura è mostrata la
fosforilazione reversibile della
O
R
serina (in rosso) in un tripeptide
costituito dagli amminoacidi AA1,
NH
H2N
Ser e AA2 legati mediante un
legame ammidico.
H2C
O
•L’inserimento di un gruppo
OH
fosofoestereo carico negativamente
influenza la struttura della proteina
Chinasi
e quindi la sua funzione.
•Qual è la differenza tra CHINASI e
FOSFATASI? Quale delle due classi di
enzimi catalizza reazioni che coinvolgono il
fosfato inorganico? Quali tra tali enzimi
richiedono ATP?
•Quale altro amminoacido ossidrilato è
frequentemente fosforilato in modo
reversibile?
•A quale classe di AA appartiene la serina?
AA2
R
OH
NH
O
Fosfatasi
O
R
R
OH
NH
NH
H2N
H2C
O
O
O
O
P O
O
-
-
Gruppo
fosfoestereo
(condensazione di
un alcol e di acido
fosforico)
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Fosfoproteina fosforilasi (defosforila la sintasi e attiva la glicogenosintesi)
Fosforilasi a fosfatasi (defosforila la fosforilasi e disattiva la glicogenolisi)
H2O
CH2-OH
CH2-OH
Gl
i co
(d gen
ef o
os sin
fo ta
ril si
at
at e
a a
tiv
a)
HO-H2C
Glicogeno fosforilasi b
(defosforilata
e
inattiva)
CH2-O-Pi
CH2-O-Pi
CH2-O-Pi
Gl
ico
g
(fo eno
sf sin
or
i ta
ina e lata si b
tt
iva
)
Pi-O-H2C
Glicogeno fosforilasi a
(fosforilata
e
attiva)
Glicogenosintesi inibita
Glicogenolisi favorita
•Perché tale tipo di modificazione è reversibile o meglio, perché deve esserlo?
Proteina chinasi A (fosforila la sintasi e disattiva la glicogenosintesi)
Fosforilasi b chinasi (fosforila la fosforilasi attivando la glicogenolisi)
Pi
CH2-OH
Glicogenosintesi favorita
Glicogenolisi inibita
ATP
ADP
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
•La stessa modificazione ha effetti opposti sui due enzimi che regolano
sintesi e demolizione del glicogeno.
•Nel fegato la glicogeno fosforilasi è regolata dall’ormone GLUCAGONE che,
quando i livelli di glucosio ematico sono troppo bassi, attiva l’enzima
fosforilasi b chinasi che converte la fosforilasi b inattiva nella forma a
attiva mediante fosforilazione glicogenolisi
•Livelli ematici di glucosio elevati determinano invece un’inibizione allosterica
della fosforilasi a attiva mediante agevolazione della defosforilazione
esposizione dei residui di serina.
•In generale:
•Adrenalina e glucagone promuovono la fosforilazione favoriscono la
glicogenolisi
•L’insulina inibisce la fosforilazione glicogenosintesi
•Qual è il principale tessuto bersaglio dell’adrenalina?
•Il glicogneo epatico può essere utilizzato completamente?
•Che cos’è la glicogenina?
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Il glucosio è la principale fonte di energia per molti tipi di cellule e deve
essere sempre disponibile.
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
La glicogenolisi è una fonte di glucosio che può rifornire
attraverso l’apparato cardiocircolatorio i tessuti periferici di
glucosio. Le riserve di glicogeno sono però limitate
La cellula può ottenere glucosio mediante il processo
alternativo di
GLUCONEOGENESI: biosintesi di
glucosio da molecole non glucidiche.
La gluconeogenesi non è il processo inverso della glicolisi
alcune reazioni della prima fase della respirazione sono infatti
irreversibili e devono essere aggirate.
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Glicolisi
Gluconeogenesi
Reazione 1
(irreversibile
G=-33Kj mol-1)
Reazione 2
(reversibile,
può essere usata
nella gluconeogenesi)
Glucosio
Glucosio 6-fosfato
Fosfogluco
Isomerasi
Fruttosio 6-fosfato
Reazione 3
(irreversibile Fosfofruttochinasi 1
G=-22Kj mol-1)
Reazione 4
(reversibile,
Glucosio 6-fosfatasi
(solo negli epatociti)
Esochinasi
Fruttosio 1,6-difosfatasi
Fruttosio 1,6-difosfato
Aldolasi
può essere usata
nella gluconeogenesi)
Diidrossiacetone fosfato
Reazione 5
(reversibile)
Gliceraldeide 3-fosfato
•Quale fonte di carbonio è utilizzata dalla piruvato carbossilasi?
•Dove viene prodotta GTP utilizzata nella sintesi di PEP
dall’ossalacetato?
•Perché la sintesi di 1,3-difosfoglicerato da 3-fosfoglicerato
richiede energia?
Reazione 10
(irreversibile
G=-17Kj mol-1)
Piruvato
Chinasi
Piruvato
ATP
Piruvato Carbossilasi
Reazione 6
Gliceraldeide fosfato (reversibile,
Deidrogenasi
può essere usata
Triosofosfato
Isomerasi
nella gluconeogenesi)
1,3-difosfoglicerato
ATP
3-fosfoglicerato
Fosfoglicerato
Chinasi
Fosfoglicerato
Mutasi
Enolasi
Ossalacetato
GTP
può essere usata
nella gluconeogenesi)
Reazione 8
(reversibile,
può essere usata
nella gluconeogenesi)
2-fosfoglicerato
Fosfoenolpiruvato
Reazione 7
(reversibile,
Reazione 9
(reversibile,
può essere usata
nella gluconeogenesi)
Fosfoenolpiruvato (PEP)
Carbossichinasi
Nella gluconeogenesi le reazioni irreversibili 1, 3 e 10 sono evitate mediante:
Conversione del piruvato in fosfoenolpiruvato attrverso la formazione
dell’ossalacetato (consumo di energia):
Piruvato+CO2+ATP+H2O ossalacetato+ADP+Pi+2H+ (Piruvato Carbossilasi)
Ossalacetato+GTP fosfoenolpiruvato+GDP+CO2
(Fosfoenolpiruvato carbossichinasi)
OSS.1: la formazione dell’ossalacetato avviene nel mitocondrio (piruvato
carbossilasi è espressa nei mitocondri). L’ossalacetato viene trasformato in
malato (riduzione) che una volta trasportato nel citoplasma viene ossidato
nuovamente ad ossalacetato e convertito in PEP.
OSS.2: complessivamente la reazione è una carbossilazione –decarbossilazione.
La decarbossilazione rende possibile la sintesi dell’enolo instabile reso stabile
dalla fosforilazione.
Formazione del fruttosio 6-fosfato per idrolisi del gruppo fosfoestereo sul C1
del fruttosio 1,6-bifosfato:
Fruttosio 1,6-bifosfato+H2O fruttosio 6-fosfato+Pi
(Fruttosio 1,6-bifosfatasi)
Il glucosio è ottenuto per idrolisi del legame fosfoestereo del glucosio 6fosfato
AA 2013-2014
Biochimica-Lezione 4
Glucosio 6-fosfato + H2O glucosio + Pi (glucosio 6-fosfatasi) Domenico Ciavardelli
Ricordare le Reazioni anaplerotiche del ciclo di Krebs:
reazioni che rispristinano le concentrazioni degli intermedi del ciclo e che
permettono la sua prosecuzione la reazioni catalizzate dalla piruvato
carbossilasi e da PEP carbossichinasi ne sono un esempio.
Reazioni anaplerotiche in rosso
•L’enzima malico è mitocondriale o citosolico?
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Stechiometria della gluconeogenesi:
2Piruvato+4ATP+2GTP+2NADH+6H2O
Glucosio+4ADP+2GDP+6Pi+2NAD++2H+
G=-38kJ mol-1
Il processo inverso alla glicolisi dal piruvato sarebbe al contrario
endoergonico:
2Piruvato+2ATP+2NADH+2H2O
Glucosio+2ADP+2Pi+2NAD+
G=84kj mol-1
La gluconeogenesi richiede idrolisi di 6 molecole di nucleoside
trifosfato (nella glicolisi ne vengono prodotte solo 2, insufficienti
alla realizzazione del processo inverso)accoppiamento di reazioni.
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
La glicolisi e la gluconeogenesi sono regolate reciprocamente
Glucosio
Fruttosio
2,6-difosfato +
AMP
ATP
Citrato
H+
-
Fruttosio
+
1,6-difosfato
ATP
Alanina
-
Fruttosio 6-fosfato
Fosfofruttochinasi
Fruttosio
1,6-bifosfatasi
Fruttosio
2,6-difosfato
AMP
-
Citrato
+
ADP
-
Fruttosio 1,6-difosfato
Fosfoenolpiruvato
PEP
Carbossichiansi
Piruvato
chinasi
Ossalacetato
Piruvato
Carbossilasi
Piruvato
•Che tipo di regolazione esercitano ATP, ADP e AMP?
•In quali condizioni viene prodotto H+ con inibizione di PFK1? Da dove vengono questi
protoni? Ricordare il prodotto della fermentazione omolattica
•Spiegare l’azione di citrato, acetil-CoA e alanina.
ADP
-
Acetil-CoA +
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
La fosfofruttochinasi e la fruttosio 1,6-bifosfatasi sono regolate
reciprocamente dal fruttosio 2,6-difosfato che attiva la fosfofruttochinasi
(attivatore allosterico) e disattiva la fruttosio 1,6-bifosfatasi.
La sintesi di fruttosio 2,6-difosfato dal fruttosio 6-fosfato è catalizzata dalla
fosfofruttochinasi 2 (PFK-2).
L’attività di PFK-2 epatica è regolata dal GLUCAGONE che determina la
fosforilazione dell’enzima la forma fosforilata è inibita riduzione della
concentrazione di fruttosio 2,6-difosfato riduzione del metabolismo epatico
del glucosio.
In condizioni di digiuno le basse concentrazioni di fruttosio 2,3-difosfato la
fruttosio 1,6-bifosfatasi è attivata e prevale la gluconeogenesi il glucosio
formato dal fegato in tali condizioni è essenziale per cervello e muscolo.
•Il ciclo di Krebs viene regolato dalle variazioni del rapporto NAD+/NADH. A quali vaori di tale rapporto il ciclo è
rispettivamente attivato o inibito? Di che tipo di regolazione si tratta? Quali sono le reazioni regolate? Ricordare le reazioni
irreversibili del ciclo e ricordare che la citrato sintasi è inibita dal citrato stesso.
•La succinato deidrogenasi è inibita dall’acido malonico, intermedio della biosintesi degli acidi grassi. Il nome IUPAC
dell’acido malonico è acido propandioico. Che meccanismo di regolazione induce?
AA 2013-2014
•La fermentazione omolattica è regolata dalle concentrazioni di NAD+/NADH. In che modo? Biochimica-Lezione 4
Domenico Ciavardelli
Lattato e alanina sono una fonte di piruvato composti gluconeogenici.
•Alla fine della lezione precedente è stata sottolineata la possibilità di convertire il
lattato in glucosio. Il lattato prodotto nel muscolo può infatti essere convertito in
piruvato nel fegato dalla lattato deidrogenasi ed entrare nella gluconeogenesi CICLO
DI CORI mediante il quale il fegato ripristina glucosio dal lattato prodotto dall’intenso
catabolismo anaerobico nel muscolo.
•Nel muscolo l’alanina si forma per transamminazione dal piruvato e da amminoacidi (vedi
catabolismo degli amminoacidi). La reazione inversa avviene nel fegato ciclo GlucosioAlanina (la figura mostra sia il ciclo di Cori che quello glucosio-alanina).
Sangue
Fegato
Glucosio 6-P
Muscolo
Glucosio
Glucosio
Glicolisi
NA
DH
Gluconeogenesi
Piruvato
Lattato
Lattato
i
cid
oa
et
Ch
-
NA
D+
idi
ac
Piruvato
no
mi
Am
i
•I diversi isoenzimi di
LDH hanno stessa Km
per piruvato?
•Qual è l’isoenzima
prevalente a livello
epatico in condizioni di
elevato fabbisogno
energetico?
Alanina
•La lattato deidrogenasi (LDH) è un enzima tetramerico costituito da combinazioni variabili di
sub-unità H (heart) e M (muscle) codificate rispettivamente da due geni diversi:, LDHB e
LDHA, la cui espressione è condizionata dalla disponibilità di glucosio e ossigeno. Le
combinazioni di catene H e M genera 5 isoenzimi diversi nella capacità di convertire
piruvatolattato o lattatopiruvato. L’isoenzima M4 catalizza la reazione diretta mentre
l’isoenzima H4 catalizza la reazione inversa.
Alanina
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
•Cosa si intende per biodisponibilità di un nutriente?
•Cosa si intende per indice glicemico?
•Cos’è l’ipoglicemia reattiva?
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
+
Attivazione
-
Inibizione
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Catabolismo e Anabolismo
degli acidi grassi
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Assorbimento e trasporto ematico dei lipidi
Dieta
Acidi biliari
Intestino
VLDL
54% TG, 19% Col
LDL
45% Col, 22% PL
Fegato
•Qual è il precursore degli acidi
biliari?
•Cosa s’intende per molecola anfifilica?
•Quale gruppo funzionale differenzia i
triglicerdi dai fosfolipidi?
Chilomicroni
84% TG
Tessuti
extra-epatici
HDL
24% PL, 22% Col
Residui dei chilomicroni
80% TG, 11% PL
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Membrana
Dieta
Cellula della
mucosa
intestinale
TG
Col
PL
Acidi biliari
Emulsificazione
Micella
TG
Lipasi
Col
Idrolasi
Membrana
basolaterale
Circolazione
portale
FFA+
albumina
• FFA
• monogliceridi
• Col
Fosfolipasi
PL
FFA
C8-C10
• Glicerolo
Glicerol
FFA
o
C8-C10
• Ac.fosfatidico
TG= trigliceridi
Col=colesterolo
PL=fosfolipidi
FFA=acidi grassi liberi
Col
+Proteine
PL
Globulo
I chilomicroni, complessi lipoproteici a densità più bassa, vengono
sintetizzati negli enterociti e successivamente esocitati.
•In quale organulo subcellulare avviene la sintesi dei chilomicroni?
TG
Esocitosi
TG
Col
PL
Chilomicrone
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Trasporto ematico dei lipidi
• Acidi grassi liberi (piccola %): trasportati dall’albumina e
metabolizzati molto rapidamente
• Altri lipidi come i trigliceridi: trasportati sotto forma di
lipoproteine (5 classi) complessi lipoproteici.
•Per quale motivo la riduzione del contenuto lipidico determina l’aumento della densità?
AA 2013-2014
•Ricordare la definizione di densità?
•Quale proprietà rende l’albumina capace di trasportare molecole apolari nel flusso ematico? Biochimica-Lezione 4
Domenico Ciavardelli
Destino dei chilomicroni generano lipoproteine a densità più
alta (VLDL, IDL e LDL) che riforniscono di grassi i tessuti.
Dotto toracico
Capillare
Cellula epiteliale
intestinale
Tessuto adiposo
FEGATO
FFA: acidi grassi liberi
Tessuti periferici
MG: monogliceridi
CM: chilomicroni
CMR: residui di chilomicroni ottenuti dall’azione della lipoproteina lipasi (LPL)
IDL: lipoproteine a densità intermedia.
•Che ruolo hanno le HDL?
Muscolo
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Adipociti trigliceridi: lipidi di deposito
Controllo ormonale di accumulo (Insulina) e rilascio (glucagone e
ormone adrenocorticotrofico, ACTH)
Glut4
(tessuto isulino-dipendente)
Adipocita
Glucosio
VLDL
TG
GLUT1,4
Lipoproteina
Lipasi
•La gliceraldeide 3-fosfato ottenuta dal
glucosio viene convertita in glicerolo che
entra nella sintesi dei trigliceridi. Come?
Ricordare lo shuttle del glicerolo 3fosfato.
Gliceraldeide
3-P
TG
FFA
TG
Lipasi
Glicerolo
FFA
Fegato
Sangue
(Albumina)
Triacilglicerolo lipasi
ormone sensibile
(attivata da glucagone e adrenalina)
GluT: Glucose Transporter; VLDL: Very Low Density Lipoprotein; TG: Trigliceridi; FFA: Free Fatty
Acids (acidi grassi liberi, non esterificati)
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Catabolismo degli acidi grassi
-ossidazione:
dopo la trasformazione dei lipidi (trigliceridi) in
acidi grassi, monoacilgliceridi e glicerolo da parte delle lipasi
1. Il glicerolo viene trasformato in gliceraldeide 3-fosfato ed entra
nella glicolisi o nella gluconeogenesi
2. Gli acidi grassi vengono
•In quali condizioni fisiologiche? Quali sono gli ormoni
coinvolti?
attivati mediante la formazione di acil-CoA
La sintesi di acil-CoA richiede energia:
Acido grasso + ATP +CoA Acil-CoA + AMP + PPi
L’adenosina monofosfato formata è convertita in ADP dalla miochinasi
con consumo di una seconda molecola di ATP:
AMP + ATP ADP + ADP
•Che ruolo ha ai fini della attivazione dell’acido grasso l’idrolisi del pirofosfato? Ricordare il principio di Le Chatelier.
Qual è il destino del pirofosfato?
•In quale altro processo è coinvolto?
AA 2013-2014
•Il glicerolo può essere convertito direttamente in gliceraldeide 3-fosfato o no?
Biochimica-Lezione 4
Ricordare lo shuttle del glicerolo 3-fosfato.
Domenico Ciavardelli
Gli acil-CoA ottenuti devono essere trasportati nella matrice
mitocondriale, sede della -ossidazione. Sono quindi trasformati
in acil carnitina dalla carnitina acil transferasi I. Le acil
carnitine ottenute sono trasportate nel mitocondrio mediante
Translocasi dove vengono nuovamente convertite in acil-CoA dalla
carnitina aciltransferasi II generando carnitina libera.
Spazio
Intermembrana
carnitina acil
transferasi II
Carnitina
Carnitina
Carnitina
Carnitina
carnitina acil
transferasi I
Matrice
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Gli acil-CoA nella matrice mitocondriale vengono degratati a
unità di Acetil-CoA che entrano nel ciclo di Krebs
H
Ossidazione
O
H
H
CoA
S
H
FAD
FADH2
H2O Idratazione
OH O
H
H
O
NAD+
NADH +
+
Tiolisi
O
R
C
CH2
CoA
S
Acil-CoA (due atomi di C in meno)
HS-CoA
(il C è ossidato a chetone)
H+
O
R
H
Ossidazione
CoA
S
H
S
C
CH2
Acetil-CoA
CoA
C
R
H
S
H
Acil-CoA
HC
CoA
C
C
CH2
R
C
C
CH2
R
O
H
O
C
C
CH2
H
CoA
S
H
3-Chetoacil-CoA
•Cosa indicano le lettere alfa e beta? La lettera omega? Ricordare la nomenclatura degli acidi AA 2013-2014
grassi. Calcolare il numero di ossidazione degli atomi di carbonio degli intermedi del processo. Biochimica-Lezione 4
•Quale altro processo è dipendente da FAD?
Domenico Ciavardelli
La degradazione ossidativa del palmitato
richiede sette cicli di β-ossidazione e genera:
8 molecole di acetil-CoA;
7 molecole di FADH2;
7 molecole di NADH.
La reazione complessiva è:
Palmitoil-CoA+7FAD+7NAD++7CoA+7H2O8Acetil-CoA+7FADH2+7NADH+7H+
•L’acetil-CoA ottenuto degli acidi grassi non può essere usato per produrre glucosio. Infatti la reazione
catalizzata da piruvato deidrogenasi che porta da privato ad acetil-CoA è irreversibile e non può essere
aggirata.
•La beta ossidazione richiede sempre che il ciclo di Krebs sia attivato da adeguate concentrazioni di
ossalacetato. Tale composto può essere rifornito dalla reazione catalizzata dalla piruvato carbossilasi “i
grassi bruciano nel fuoco degli zuccheri”.
•Dalla beta ossidazione dell’acido pentanoico e degli altri acidi grassi a catena dispari si ottengono acetilCoA e propionil-CoA. Il propionil-CoA può essere convertito in succinato che mediante il ciclo di Krebs può
fornire ossalacetato e quindi glucosio Gli acidi grassi a catena dispari sono gluconeogenici e
contribuiscono all’anaplerosi.
AA 2013-2014
•Calcolare la resa della beta ossidazione dell’acido butanoico, esanoico e decanoico. Quanti
cicli di beta ossidazione prevedono, rispettivamente?
Biochimica-Lezione 4
Domenico Ciavardelli
•L’acetil-CoA prodotto nella -ossidazione entra nel ciclo di Krebs solo
se la degradazione dei grassi e dei carboidrati sono bilanciate.
•L’entrata dell’acetil-CoA nel ciclo dipende dalla disponibilità di
ossalacetato che si forma dal piruvato mediante la reazione anaplerotica
catalizzata dalla piruvato carbossilasi. “I grassi bruciano nel fuoco
degli zuccheri”
•Se i carboidrati non sono disponibili la concentrazione dell’ossalacetato
si abbassa in quanto reclutato nella gluconeogenesi e l’acetil-CoA si
accumula
•Es.:
Digiuno e diabete aumento della concentrazione di Acetil-CoA
prevale una reazione di condensazione Corpi chetonici
H3C
O
S
CoA
O
O
CoA
S
H3C
S
CoA
O
C
CH2
CH3
Acetoacetil-CoA
H3C
H3C
O
O
Acetone
C
CH2
O
•I corpi chetonici sono più solubili in acqua rispetto agli acidi grassi. Perché? Qual è la
parte delle molecole di acido grasso che inibisce la solubilità in acqua?
O
HO
Acetoacetato
O
CH3
H3C
CH2
O
-
3-idrossi-butirrato
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
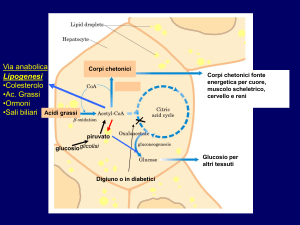
Formazione e consumo dei corpi chetonici
fegato
sangue
acidi grassi
cuore, muscoli e
cervello
ciclo di Krebs
-ossidazione
acetil-CoA
2 acetil-CoA
Tale reazione avviene
solo nei tessuti periferici
acetoacetato
-idrossibutirrato
•In quale processo abbiamo parlato della tiolasi? Che reazione catalizza? Ricordare che il
substrato è un beta-chetoacil-CoA. L’acetoacetato contiene questo gruppo funzionale?
Tiolasi
acetoacetato
-idrossibutirrato
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Malonil-CoA
Acetil-CoA
Acido grasso
sintasi
Condensazione
Disidratazione
Riduzione
Riduzione
Acil-CoA saturo
(aumento della lunghezza
della catena di 2 atomi di
carbonio)
ELONGASI
Acido Stearico (C18:0)
15
13
11
12
16
14
9
10
7
8
5
3
6
Acido Palmitico (C16:0)
4
2
1
•Chi è il precursore •La BIOSINTESI degli
dell’acetil-CoA utilizzato acidi grassi ad opera del complesso
enzimatico
dell’
ACIDO
GRASSO
nella biosintesi degli acidi SINTASI che catalizza l’allungamento della
catena a due atomi di carbonio proveniente
grassi?
dal malonil coenzima A di due atomi di
•L’acido propandioico carbonio
•Nell’uomo i cicli di condensazione, prima
riduzione,
disidratazione
e
seconda
viene ottenuto dalla
riduzione portano alla sintesi dell’acido
carbossilazione dell’acetil palmitico mediante 7 cicli. Tale acido grasso
saturo costituito da 16 atomi di carbonio e
CoA. La reazione è endo- non contenente alcun doppio legame (C16:0)
•L’azione dell’enzima ELONGASI permette
o esoergonica?
di ottenere da C16:0 prima l’acido stearico
(C18:0; 18 atomi di carbonio e nessun doppio
legame o INSATURAZIONE) mentre
l’enzima DESATURASI è capace di
catalizzare la ossidazione (deidrogenazione)
del legame semplice C9-C8 dell’acido C18:0
DESATURASI
generando l’acido oleico costituito da 18
atomi di carbonio e contenente un doppio
legame a 9 atomi di carbonio dalla fine della
catena (C18:1 n-9).
•L’uomo non ha enzimi capaci di creare doppi
legami a meno di 9 atomi di carboni dalla
fine non può quindi sintetizzare acidi
grassi n-3 (ω3) o n-6 (ω6) Tali acidi
Acido Oleico (C18:1 n-9) grassi sono essenziali VITAMINA F
•La biosintesi degli acidi grassi avviene nel citoplasma ma l’acetil-CoA è prodotto nel
mitocondrio.Attraverso il ciclo di Krebs l’acetil-CoA viene convertito in citrato che può essere trasportato AA 2013-2014
nel citoplasma. Che tipo di trasporto viene impiegato? Ricordare che il citrato è carico negativamente. Biochimica-Lezione 4
Domenico Ciavardelli
Quante cariche negative ha a pH fisiologico?
Regolazione di sintesi e catabolismo degli acidi grassi.
Ruolo chiave della Acetil-CoA carbossilasi (catalizza la sintesi di malonilCoA da acetil CoA e bicarbonato):
Acetil-CoA+ATP+HCO3- malonil-CoA +ADP+Pi+ H+
Controllo ormonale:
•L’insulina attiva la carbossilasi stimolando la biosintesi.
•Il glucagone e l’adrenalina inibiscono la carbossilasi e quindi la biosintesi
attivando il catabolismo degli acidi grassi.
Il citrato stimola la biosintesi elevate concentrazioni di citrato
dipendono da elevate concentrazioni di ossalacetato e acetil-CoA.
AMP e palmitoil-CoA inibiscono la biosintesi.
Il malonil-CoA inibisce la carnitina aciltransferasi I bloccando il
catabolismo degli acidi grassi.
AA 2013-2014
Ricordare che l’acido malonico inibisce il complesso II della ETC. Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Catabolismo delle proteine e
degli amminoacidi
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
La digestione delle proteine
Stomaco
HCl
Denaturazione delle proteine
Pepsinogeno
Intestino
Tenue
Pancreas
Pepsina
pH acido
Secretina
Tripsinogeno
Tripsina
Chimotripsinogeno
Chimotripsina
pH neutro
Peptidi
•Che cosa si intende per modificazione post-traduzionale delle proteine? E’ una modificazione
dipendente da mutazioni del gene?
•Che tipo di modificazione è implicata nella trasformazione di tripsinogeno e chimotripsinogeno
AA
AA 2013-2014
nella forma attiva?
Biochimica-Lezione 4
Domenico Ciavardelli
•Disegnare le curve dell’attività di tripsina e pepsina in funzione del pH.
Il destino metabolico degli AA nel fegato
N.B.: Gli AA
introdotti con la dieta
sono utilizzati anche
nella sintesi delle
proteine
dell’organismo!
Corpi
Chetonici
e
Acidi grassi
PROTEINE
Sintesi
Proteica
•In quali condizioni prevale la sintesi
proteica rispetto al catabolismo
ossidativo?
Proteolisi
Gluconoegenesi
Chetogenesi*
Glucosio
20 AA ORDINARI
Decarbossilazione
Transaminazione
Glutammato
Ammine
Biogene
Deamminazione
chetoglutarato + NH3
Ciclo dell’urea
*Trasformazione in piruvato, acetil-CoA e
acetoacetil-CoA
Urea
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Catabolismo degli amminoacidi.
1. Mediante reazioni di trasferimento
di gruppo amminico catalizzate dalle
transaminasi gli AA sono convertiti
in intermedi del ciclo di Krebs
(alfa-cheto acidi)
2. Transaminazione dell’ chetoglutarato: accettore finale di
gruppi amminici provenienti da altri
AA con contemporanea sintesi di
glutammato e -chetoacidi
OH
O
Glutammico
Deidrogenasi
NAD
H2N
NADH
H
HO
O
Glutammato
C
CH2
CH2
CH2
OH
O
O
H2O
NH3
Ciclo di Krebs
CH2
HO
O
-chetoglutarato
3. Il glutammato ottenuto subisce la
deamminazione ossidativa NADdipendente catalizzata dall’enzima
glutammico deidrogenasi con
produzione di ammoniaca (ione
ammonio) e nuova sintesi di chetoglutarato
•Come vengono definite le reazioni che riforniscono di intermedi il ciclo di Krebs?
•Il catabolismo ossidativo degli AA è mitocondriale o citosolico? Aerobico o anaerobico?
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
-aminoacido
-chetoacido
1. Transaminazione
(Transaminasi)
Un generico -AA trasferisce il
gruppo amminico all’chetoglutarato che si trasforma
in glutammato. L’AA è convertito
in -chetoacido
glutammato
-chetoglutarato
Ricordare che l’ammoniaca,
base debole, si dissocia in
acqua generando lo ione
ammonio
2. Deaminazione
(Glutammato Deidrogenasi)
Il glutammato viene trasformato
nuovamente in -chetoglutarato
per deaminazione ossidativa e
formazione di ammoniaca (vedi
reazione nella pagina precedente).
NH3 (NH4+)
CO2 (HCO3-)
Ricordare che l’anidride
carbonica è convertita in
bicarbonato dall’anidrasi
carbonica
Urea
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
•ALT=Alanina Transaminasi trasferimento di gruppo amminico da vari AA nel
muscolo (sforzo prolungato o digiuno) prima all’-chetoglutarato. Il glutammato
formato trasferisce il gruppo amminico al piruvato con formazione di alanina nel
muscolo. L’alanina viene inviata al fegato dove viene nuovamente transaminata
con alfa-chetoglutarato generando piruvato che entra nella gluconeogenesi e
glutammato che viene deamminato producendo ammoniaca che entra nel ciclo
dell’urea CICLO GLUCOSIO-ALANINA.
•Ricordare che il ciclo dell’urea avviene solo nel fegato. Quindi l’alanina può
essre considerata sia un composto gluconeogenico capace di rifornire di glucosio
il fegato e quindi i tessuti periferici sia un trasportatore dei gruppi amminci
ottenuti dala catabolismo ossidativo degli amminoacidi nel muscolo nel tentativo
di compensare l’abbassamento delle concentrazioni degli intermedi del ciclo di
Krebs in condizioni di scarsa disponibilità di glucosio ed elevato fabbisogno
energetico.
•Un altro importante trasportatore di gruppi amminici è la glutammina ottenuta
dal glutammato mediante l’azione della gluatmmina sintasi nel muscolo e
trasferita al fegato attraverso il flusso ematico. La glutammina viene
nuovamente convertita grazie alla catalisi realizzata da glutaminasi in
glutammato che verrà deamminato ossidativamente.
AA 2013-2014
•Qual è il gruppo funzionale tipico della catena laterale della glutammina?
Biochimica-Lezione 4
•Quale ormone attiva il catabolismo ossidativo muscolare degli AA? Quale la sintesi proteica? Domenico Ciavardelli
3. L’ammoniaca ottenuta dalle reazioni
di deamminazione ossidativa del
glutammato viene trasformata in
carbamil fosfato per reazione con
l’idrogenocarbonato.
O
NH3 + CO2+2ATP
NH3
O
P
+2ADP + Pi
Carbamil fosfato
4. Il carbamil fosfato viene convertito in urea CICLO DELL’UREA
Il fumarato connette il
ciclo dell’urea al ciclo di
Krebs e permette di
recuperare l’energia
spesa nell’attivazione
dell’ammoniaca mediante
la sintesi di coenzimi
ridotti e le successive
ETC e fosforilazione
ossidativa.
•Il carbamil fosfato è una molecola ad alta o bassa energia? La sua sintesi può essere
definita un processo di attivazione?
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Il destino dello scheletro carbonioso di alcuni AA
AA glucogenici e chetogenici
triptofano, tirosina,
leucina, lisina,
fenilalanina
piruvato
acetil-CoA
ossalacetato
citrato
Ciclo di Krebs
succinato
alanina, aspartato, glutamato
-chetoglutarato
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Oss.: L’integrazione con AA ramificati non è priva di controindicazione.
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli
Glucosio
Glucidi
Glucosio
ATP
Gluconeogenesi
Ac. Lattico
Glucosio-6-P
Glicolisi
Ribulosio-5-P
Pentoso Fosfato
Pi
Gli c
ogen
osin
tesi
Glucosio-1-P
Gli c
og
enol
isi
Glicogeno
Ac. Piruvico
AA
Biosintesi degli acidi grassi
Acil-CoA
Acetil-CoA
-ossidazione
Corpi
chetonici
Acetoacetil-CoA
Acidi grassi
Ac. Ossalacetico
Ac. Fumarico
Trigliceridi
Ciclo
di
Krebs
Acidi grassi
AA
Ac. -Chetoglutarico
AA
Succinil-CoA
Lipidi
Protidi
Spero sia tutto più chiaro!
AA 2013-2014
Biochimica-Lezione 4
Domenico Ciavardelli