Eosin Methylene Blue Agar
(LEVINE)
Hektoen enteric agar
McConkey Sorbitolo
Simmons Citrate
Lysine Iron Agar (LIA)
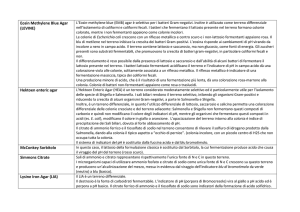
L’Eosin-methylene blue (EMB) agar è selettivo per i batteri Gram-negativi. Inoltre è utilizzato come terreno differenziale
nell’isolamento di coliformi e coliformi fecali. I batteri che fermentano il lattosio presente nel terreno formano colonie
colorate, mentre i non fermentanti appaiono come colonie incolori.
Le colonie di Escherichia coli crescono con un riflesso metallico e centro scuro e i non-lattosio fermentanti appaiono rosa. Il
blu di metilene nel terreno inibisce la crescita dei batteri Gram-positivi. L’eosina risponde ai cambiamenti di pH virando da
incolore a nero in campo acido. Il terreno contiene lattosio e saccarosio, ma non glucosio, come fonti di energia. Gli zuccheri
presenti sono substrati fermentabili, che promuovono la crescita di batteri gram-negativi, in particolare coliformi fecali e
non.
Il differenziamento è reso possibile dalla presenza di lattosio e saccarosio e dall’abilità di alcuni batteri di fermentare il
lattosio presente nel terreno. I batteri lattosio fermentanti acidificano il terreno e l’indicatore di pH in campo acido dà una
colorazione viola alle colonie, solitamente associata a un riflesso metallico. Il riflesso metallico è indicatore di una
fermentazione massiccia, tipica dei coliformi fecali.
Una produzione minore di acido, che è il risultatoi di una fermentazione più lenta, dà una colorazione rosa-marrone alla
colonia. Colonie di batteri non-fermentanti appaiono come rosa o traslucidi.
L'Hektoen Enteric Agar (HEA) è un terreno considerato moderatamente selettivo ed è particolarmente utile per l'isolamento
delle specie di Shigella e Salmonella. I sali biliari rendono il terreno selettivo, inibendo gli organismi Gram-positivi e
riducendo la crescita di alcuni organismi Gram-negativi, a parte le Salmonella e Shigella.
Inoltre, è un terreno differenziale, in quanto l’utilizzo differenziale di lattosio, saccarosio e salicina permette una colorazione
differenziale delle colonie cresciute e del terreno adiacente: Salmonella e Shigella non fermentano questi composti di
carbonio e quindi non modificano il colore degli indicatori di pH, mentre gli organismi che fermentano questi composti in
acidi (es. E. coli), modificano il colore in giallo o arancione. L’opacizzazione del terreno intorno alla colonia è indice di
precipitazione dei Sali biliari, dovuta al forte abbassamento di pH.
Il citrato di ammonio ferrico e il tiosolfato di sodio nel terreno consentono di rilevare il solfuro di idrogeno prodotto dalla
Salmonella, dando alla colonia il tipico aspetto a “occhio di pernice”. (colonia incolore, con un piccolo centro di H2S che non
occupa tutta la colonia.
Il sistema di indicatori del pH è costituito dalla fucsina acida e dal blu bromotimolo.
In questo caso, il lattosio della formulazione classica è sostituito dal Sorbitolo, la cui fermentazione produce acido che causa
il viraggio del pH del terreno (rosso scuro).
Sali di ammonio e citrato rappresentano rispettivamente l’unica fonte di N e C in questo terreno.
I microrganismi capaci di utilizzare ammonio fosfato e citrato di sodio come unica fonte di N e C crescono su questo terreno
e producono un’alcalinizzazione del mezzo, messa in evidenza dal viraggio dell’indicatore blu di bromotimolo da verde
(neutro) a blu (basico).
Il LIA è un terreno differenziale.
Il destrosio è la fonte di carboidrati fermentabile. L’indicatore di pH (porpora di Bromocresolo) vira al giallo a pH acido ed è
porpora a pH basico. Il citrato ferrico di ammonio e il tiosolfato di sodio sono indicatori della formazione di acido solfidrico.
Voges-Proskauer (VP)
Indolo (IND)
Phenylalanine-deaminase
Agar (PDA)
Phenol Red Glucose Broth
con CAMPANELLE (Durham
tubes)
Riduzione dei Nitrati
La lisina è il substrato usato nella rilevazione degli enzimi lisina decarbossilasi e lisina deaminasi.
I batteri che producono acido solfidrico provocano l’annerimento del terreno a causa della formazione di solfuri ferrosi.
I microorganismi che producono lisina decarbossilasi sviluppano una reazione alcalina (color porpora) o neutra nel fondo del
terreno, mentre quelli che deamminano la lisina causano lo sviluppo di una colorazione rossa nello slant su fondo acido.
E’possibile che vi sia sviluppo di gas, sebbene tale fenomeno sia spesso irregolare o soppresso.
Il colore nero indica la produzione di FeS.
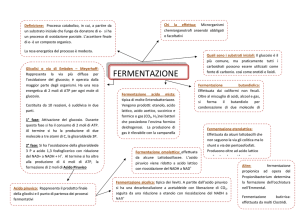
La prova rileva la produzione di acetil-metil-carbinolo (acetoina), un composto intermedio della fermentazione
butanediolica del glucosio, i cui prodotti finali sono etanolo e butanediolo, composti neutri.
L’acetil-metil-carbinolo può ossidarsi spontaneamente a diacetile a pH alcalino. Pertanto, aggiungendo in ogni provetta con
il terreno inoculato 1 goccia di KOH 40%, che alza il pH, e 3 gocce di α-naftolo 5% in etanolo puro, è possibile rilevare la
presenza di acetil-metil-carbinolo. La reazione positiva si manifesta entro 10-20 minuti con l’apparire di un colore rosa
intenso.
Il test rileva la presenza dell’enzima triptofanasi. L’indolo è uno dei prodotti della degradazione metabolica dell’aminoacido
triptofano. I batteri che possiedono l’enzima triptofanasi sono in grado di idrolizzare e deaminare il triptofano con
produzione di indolo, acido piruvico ed ammoniaca.
Aggiungendo qualche goccia di reattivo di Kovacs (p-dimetilamino-benzaldeide in HCl e alcool isoamilico), se l’indolo è
presente, viene estratto dall’alcool isoamilico e passa nella fase alcolica, stratificata su quella acquosa, dove reagisce con la
p-dimetilamino-benzaldeide, provocando la comparsa di un colore rosso-porpora, dovuto alla reazione dell’indolo con il
gruppo aldeidico della p-dimetilamino-benzaldeide.
Questo tipo di terreno serve per verificare la capacità di un microrganismo di produrre l'enzima fenilalanina-deaminasi, che
rimuove il gruppo aminico della fenilalanina e rilascia il gruppo amminico come ammoniaca libera. Come risultato di questa
reazione, è prodotto anche l’acido fenilpiruvico.
Dopo l’incubazione, viene aggiunto cloruro ferrico al 10% (FeCl3); se è stato prodotto acido fenilpiruvico, esso reagirà con il
cloruro ferrico e diventa verde scuro. Se il mezzo rimane un colore paglierino, l'organismo è negativo per la produzione di
fenilalanina deaminasi.
È utilizzato per differenziare i membri dei generi Proteus, Morganella e Providencia dalle altre Enterobacteriaceae.
Se l’organismo è capace di fermentare il Glucosio, produce un composto acido che fa virare il terreno al giallo.
Può anche venir prodotto del gas dalla fermentazione; in questo caso, una bolla d’aria sarà presente all’interno della
campanella.
La capacità di usare NO3 come accettore finale di elettroni può essere rivelata mostrando il prodotto della riduzione (NO2)
mediante l’acido α-naftilamino-sulfanilico, che sviluppa un colore rosso intenso.
Tuttavia, le reazioni negative vanno ulteriormente interpretate, perché possono risultare da un’effettiva incapacità di ridurre
i nitrati, o dalla ulteriore riduzione da NO2 a N2. Aggiungendo Zinco in polvere (un forte riducente), i nitrati non ridotti si
trasformano in nitriti e reagiscono con l’acido α-naftiloamino-sulfanilico, mentre, se la reazione resta negativa, se ne deduce
che la denitrificazione è stata completa.
Klieger Iron Agar (KIA)
Ureasi (FERGUSON)
Ossidasi
Catalasi
Contiene lattosio e destrosio che consentono la differenziazione dei batteri facendo virare l’indicatore di pH (rosso fenolo) in
risposta all’acidificazione prodotta dalla loro fermentazione. La combinazione di citrato ferrico di ammonio con tiosolfato di
sodio consente la rilevazione della produzione di acido solfidrico.
a) I microrganismi non fermentanti lattosio, producono inizialmente uno slant giallo dovuto alla fermentazione del
destrosio; una volta esaurito l’apporto di destrosio in ambiente aerobico, la reazione diventa alcalina a causa
dell’ossidazione degli acidi (slant rosso). Tale inversione non si verifica in ambiente anaerobico, che resta acido (fondo
giallo).
b) i microrganismi fermentanti lattosio producono slant (pH acido in aerobiosi) e fondo giallo .
c) i microrganismi che non fermentano lattosio né destrosio, producono sia lo slant che il fondo rosso.
La produzione di acido solfidrico è messa in luce dalla colorazione nera del fondo.
La produzione di gas, è evidenziata dalla formazione di bolle nel terreno.
L’enzima ureasi catalizza l’idrolisi dell’urea in ioni bicarbonato e ammonio. L’Urea fornisce una fonte di N per gli organismi
che producono l’enzima ureasi. La scissione dell’urea produce ammoniaca, indicata da un viraggio al rosa-rosso
dell’indicatore nel terreno.
Il test della citocromo C-ossidasi, grazie alla reazione con la tetra-metil-p-fenilendiammina, che viene utilizzata come
substrato della reazione, ci permette di distinguere microorganismi che possiedono la citocromo C-ossidasi. Il test si esegue
preparando una soluzione di tetrametil-fenilendiammina allo 0.4%, distribuendone una goccia su carta assorbente e
strisciando sulla carta un’aliquota di crescita batterica, prelevata con uno stecchino sterile. Nel caso in cui la citocromo Cossidasi sia presente nel campione, la carta assorbente su cui sono stati strisciati i batteri vira in pochi secondi al blu intenso
perché il substrato viene ossidato dall’azione della citocromo-ossidasi. Se la carta resta bianca, la reazione viene considerata
negativa.
La catalasi trasforma il perossido di idrogeno in acqua e ossigeno.
Aggiungendo una goccia di H2O2, la rapida formazione di bolle di gas, indica la presenza dell’enzima catalasi.
d