SISTEMA NERVOSO
Questo capitolo è necessario per avere una idea di massima delle strutture nervose, ai fini della
comprensione del danno che si instaura nelle diverse patologie trattate, è chiaramente un livello di base
per un pubblico di non addetti, ma può tornare utile anche agli addetti ai lavori. Come si evince dalla
citazione fu Ippocrate (460-379 a.C.) ad avanzare le prime ipotesi sul funzionamento del cervello, in un
epoca dove il centro dell’intelletto era considerato il cuore, ma fu Galeno nel secondo secolo d.C. a
riprendere le concezioni di Ippocrate. Aveva molta esperienza perché curava i gladiatori, e avanzo l’ipotesi
che il cervello fosse la sede delle sensazioni e il cervelletto il centro che sovraintendeva al controllo dei
muscoli. Le congetture di Galeno sono rimaste in piedi per circa 1.500 anni fino al Rinascimento, quando
furono aggiunte nuove scoperte da grandi scienziati del calibro di Andrea Vesalio, Cartesio e altri che si
discostarono dalla visione di Galeno che
incentrava tutto sui ventricoli; ma si iniziò a
Ippocrate, sul male sacro - IV secolo a. C.
valutare la sostanza bianca e la sostanza grigia.
Gli uomini dovrebbero sapere che da nient’altro, se
Nel XIX secolo si sa qualcosa in più sulla
non dal cervello, derivano la gioia, i pensieri, il riso
traumatologia del cervello, sulla connessione
e gli sport, i piaceri e i dolori, l’angoscia, lo
attraverso i nervi, fu Franklin nel 1751 a scrivere
sconforto e il lamento. Ed è mediante il cervello,
Esperimenti e osservazioni sull’elettricità, sulla
soprattutto, che noi acquisiamo saggezza e
funzione delle diverse aree cerebrali grazie
conoscenza, e che possiamo vedere e sentire e
a scienziati del calibro di Charles Bell, Francois
riconoscere ciò che è illecito e ciò che è giusto, ciò
Magendie, Franz Gall, Paul Broca. La storia
che è cattivo e ciò che è buono, quello che è dolce e
insegna che la comprensione del SNC è una
quello che è insipido… ed è sempre a causa dello
grande sfida, attualmente siamo di fronte a quella
stesso organo che noi diventiamo pazzi e deliranti,
del XXI secolo. Da quando Golgi e Cajal
e che ci viene paura e ci assale il panico... tutte
condivisero il Nobel nel 1906 per il lavoro sul
queste cose dobbiamo sopportare da parete del
neurone, sono stati fatti passi da gigante e siamo
nostro cervello quando questo non è in salute... in
in piena era post-genomica, conosciamo i geni
questo senso, sono del parere che sia il cervello a
espressi nelle nostre diverse cellule e questo è
esercitare sull’uomo il più grande potere.
utile per comprendere le basi biologiche delle
malattie, anche in ambito neurologico e
psichiatrico.
Il razionale è il seguente, se il SNC è il prodotto dei geni
in esso espressi, le differenze nell’espressione genica tra un cervello sano e uno malato possono essere
utilizzate per evidenziare le basi molecolari che stanno alla base della patologia. Il livello di espressione
genica è definito dal numero dei trascritti di mRNA sintetizzato dalle cellule,
in questo caso da quelle nervose, per ottimizzare la sintesi di specifiche
Il cervello è il pezzo di
proteine, comprese quelle che costellano a membrana neuronale.
materia più complesso
dell’universo
CENNI DI ANATOMIA
Comprendere il funzionamento della membrana neuronale e delle proteine ad essa associate, è
fondamentale perché il neurone ha delle peculiarità nel trasferimento dei segnali elettrici. Immaginiamo la
membrana neuronale come il telo disteso su un ombrellone, i cui sostegni sono equiparabili al
citoscheletro, che è l’impalcatura del neurone insieme ai microtubuli, microfilamenti e neurofilamenti, il
citoscheletro non è una struttura statica. La membrana cellulare è una struttura fondamentale, è
importante anche il tipo e la distribuzione delle proteine sulla sua superficie che differenziano il neurone da
altri tipi di cellule, per esempio i recettori per i neurotrasmettitori, i canali sono anch’essi strutture
proteiche.
1
I canali e le pompe ioniche da cui dipende il funzionamento del neurone, sono importanti strutture
proteiche che attraversano la membrana, un canale è costituito da 4 a 6 molecole proteiche che formano
una specie di cilindro che in base al diametro e alla natura dei gruppi R viene definita la selettività ionica.
I canali hanno selettività specifica, in altre parole alcuni di essi sono selettivamente permeabili agli ioni K+,
altri agli ioni Ca2+, dai canali ionici dipende la neurofisiologia cellulare, senza addentrarsi nella fisiologia
cellulare ricordo solo che il potenziale di membrana (Vm) nel neurone è di estrema importanza.
Il potenziale di riposo di un neurone è all’incirca -65 millivolt, 1 millivolt corrisponde a 0.001 volt, questo
potenziale negativo all’interno del neurone a riposo è necessario per il suo funzionamento e di
conseguenza per quello del sistema nervoso, il tutto è regolato dalla regolazione del potassio al di fuori
della cellula. La membrana a riposo è permeabile al potassio con potenziale prossimo a E K, il potenziale è
molto sensibile ai cambiamenti di concentrazione del potassio extracellulare, se ad esempio tale
concentrazione aumentasse di 10 volte (da 5 a 50 mM), il potenziale aumenterebbe da -65 millivolt a -17
millivolt; in altre parole l’incremento di potassio extracellulare depolarizza i neuroni. Sono le pompe sodio
– potassio che mantengono alto il gradiente extracellulare di K+ attraverso la membrana, giocano un ruolo
chiave gli astrociti, che operano quando la concentrazione di potassio nel cervello aumenta in alcune aree a
causa dell’attività neurale, facendo entrare il potassio al loro interno attraverso i canali di membrana; il
tutto rapportato all’estesa rete formata dagli astrociti possiamo comprendere l’importanza che hanno su
tutto il SNC. Da quanto su esposto è fondamentale preservare la membrana da qualsiasi tipo di insulto.
Potenziale d’azione
La depolarizzazione del neurone è causata dall’ingresso di ioni sodio attraverso la membrana, la
ripolarizzazione dall’uscita degli ioni potassio, quindi il potenziale d’azione può essere definito una
redistribuzione della carica elettrica lungo la membrana. Una volta generatosi il potenziale d’azione si
propaga lungo l’assone e porta l’informazione da un punto all’altro del sistema nervoso, quando l’assone è
depolarizzato al punto di raggiungere il livello di soglia, c’è l’apertura dei canali per il sodio e il potenziale
d’azione ha inizio. Un importante fattore che influenza la velocità di conduzione è il diametro
dell’assone, maggiore è il diametro maggiore sarà la velocità di conduzione del potenziale d’azione, le
dimensioni dell’assone e il numero dei canali voltaggio dipendenti della membrana ne influenzano
l’eccitabilità.
NEURONI
Sappiamo che i neuroni che contribuiscono a formare il SNC sono miliardi, la sfida ancora aperta è quella di
capire come ognuno di essi contribuisce alla fisiologia cerebrale, in un certo qual modo possiamo
suddividerli in gruppi e ogni gruppo ha le sue peculiarità. In base al numero dei neuriti, la somma di dendriti
e assoni, se ha un solo neurite è un neurone unipolare, se ne ha due è bipolare, se ne possiede almeno tre è
un neurone multipolare che rappresenta la maggior parte dei neuroni. In base al numero dei dendriti, gli
alberi dendritici variano molto per esempio le cellule piramidali e le cellule stellate, che ritroviamo nella
corteccia cerebrale che si trova subito al di sotto la superficie esterna del proencefalo. Si possono
classificare anche in base alla presenza di spine, avremo così gli spinosi e non spinosi; possiamo basarci sulle
connessioni per esempio i neuroni sensitivi primari che sono quelli che fanno afferire lo stimolo al SNC dalla
cute e dalla retina. Si possono differenziare anche in base al tipo di neurotrasmettitore; per completezza
citiamo anche i motoneuroni, gli interneuroni, e i neuroni di tipo I e II del Golgi.
Una ulteriore differenziazione va fatta in base alla attività elettrica, infatti da questo punto di vista i neuroni
non sono tutti uguali, ad esempio la corteccia cerebrale ha due tipi di neuroni:
2
Cellule stellate senza spine, rispondono con una scarica di potenziali d’azione a una frequenza più o
meno costante, durante tutto il periodo in cui sono stimolate.
Cellule piramidali con le spine, non possono sostenere il ritmo delle stellate, rispondono
rapidamente nella fase iniziale, ma poi rallentano anche se lo stimolo è costante, l’ultima fase
descritta va sotto il nome di adattamento ed è comune nei neuroni.
Altri neuroni compresi i grandi neuroni piramidali della corteccia rispondono con un pattern di scarica detto
burst, se lo stimolo è continuo i piramidali rispondono con burst ripetitivi e ritmici; la fisiologia dei neuroni
è determinata dalle proprietà e dal numero dei canali ionici di membrana. L’esame autoptico nei pazienti
con depressione, ha evidenziato che nelle aree corticali prefrontali c’è un’anormale densità di neuroni
piramidali, neuroni GABAergici e cellule gliali; i neuroni piramidali di medie e grandi dimensioni hanno
minori dimensioni del soma e bassa densità nell’area studiata. Anche la densità delle cellule gliali è ridotta
in questi pazienti. Distinguiamo i neuroni colinergici, i neuroni catecolaminergici , catecolamine sono la
dopamina, la noradrenalina e l’adrenalina, i neuroni serotoninergici il neurotrasmettitore è la serotonina
che gioca un ruolo importante nella regolazione del tono dell’umore e del sonno. Ci sono inoltre i neuroni
aminoacidici, i neurotrasmettitori sono il glutammato, la glicina e il GABA, glutammato e glicina vengono
sintetizzati a partire dal glucosio, ci sono altri presumibili neurotrasmettitori e messaggeri intercellulari,
degno di essere menzionato è il monossido di azoto (NO)
Tirosina
tirosin
idrossilasi
(TH)
L-Diidrossi
fenilalanina
(dopa)
Dopa
decarbos
silasi
Dopamina
Dopamina
Β- idrossilasi
Noradrenalina
Fentolamina
Nmetiltransferasi
Adrenalina
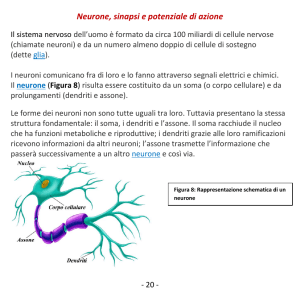
DENDRITI (dal greco “ albero”)
ASSONE
Lunghi da 1 millimetro a 1 metro, largo da 1 μm a 25 μm, spesso si
ramificano in assoni collaterali e in, qualche più raro, collaterale
ricorrente; la larghezza dell’assone è importante per la velocità di
trasmissione elettrica, infatti, l’impulso nervoso viaggia più
velocemente in un assone più largo. L’assone è una parte importante
del neurone inizia con il cono d’integrazione, non contiene Reticolo
Endoplasmatico rugoso, la membrana dell’assone è diversa da quella
somatica, queste diversità strutturali si ripercuotono a livello
funzionale. La parte finale dell’assone è detta terminale dell’assone o
bottone terminale, tramite questa formazione l’assone viene in
contatto con altre cellule e si ha la formazione della sinapsi, dal greco
“legare insieme”. Quando l’impulso arriva all’assone terminale
presinaptico, vengono rilasciate le molecole del neurotramettitore,
che vanno dalle vescicole sinaptiche allo spazio intersinaptico, si lega
ai recettori e innescano il segnale nella cellula postsinaptica. Gli assoni
possono avere parecchie ramificazioni nella parte finale, formando le
cosiddette arborizzazioni dendritiche, che hanno una notevole
importanza a livello funzionale per l’innesco dei potenziali d’azione.
I dendriti di un neurone sono detti
albero dendritico, e ogni ramo di
questo “albero” si chiama ramo
dendritico, ne esistono di diversa
forma e grandezza e caratterizzano il
tipo di neurone, permettendone la
classificazione.
Possiamo considerare i dendriti
come le antenne del neurone, hanno
migliaia di sinapsi, in alcuni neuroni i
dendriti sono ricoperti dalle spine
dendritiche, che sono strutture
specializzate, e sono proprio le spine
dendritiche che vanno incontro a
modificazioni nel cervello di individui
con danni cognitivi. I dendriti hanno
il citoplasma simile a quello
dell’assone, contiene elementi del
citoscheletro e mitocondri, ma con
la differenza che i ribosomi sono
situati, a volte, appena sotto la spina
e questo ci autorizza a pensare che
3
la trasmissione sinaptica in alcuni neuroni dirige la sintesi proteica localmente; sappiamo che la sintesi
proteica è fondamentale per memorizzare l’informazione. Le spine dendritiche sono molto sensibili e il loro
numero dipende dall’ambiente in cui si sviluppano, lo conferma con i suoi studi William Greenough che ha
rilevato la presenza di poliribosomi in corrispondenza delle sinapsi nelle spine dendritiche. Greenough si è
chiesto il perché di questa presenza al di fuori del soma e dove l’mRNA è tradotto, probabilmente per
sintetizzare particolari proteine coinvolte nel rimodellamento delle sinapsi. Dal rilevamento di qualche
mRNA associato ai poliribosomi che indicava che c’era sintesi proteica, si osservava un forte aumento della
stessa in presenza di glutammato, questo neurotrasmettitore è in grado di stimolare i sinaptoneurosomi,
quindi è chiaro che c’è il coinvolgimento del suo recettore. Gli sforzi dei ricercatori oggi sono incentrati a
comprendere i meccanismi che sono alla base del rimodellamento sinaptico, si è partiti dall’individuazione
della FMRP (fragile X-mental retardation protein) che è legata al ritardo mentale della sindrome dell’X
fragile; ma la FMRP non può essere considerata proteina della memoria perché non è strutturale, lega solo
l’mRNA. La funzionalità cerebrale dipende dall’architettura dell’albero dendritico e dalle loro connessioni
che si sviluppano e modellano nel periodo fetale (fetal programming), nel periodo neonatale e nella prima
infanzia, questo processo è molto sensibile ad alterazioni indotte dall’ambiente. Marin –Padilla e Purpura
studiando il cervello dei bambini con ritardo mentale hanno evidenziato importanti modificazioni della
struttura dendritica, i dendriti di questi bambini presentavano un numero notevolmente inferiore di spine
dendritiche ed erano più sottili e lunghe. La corposa documentazione di questi ultimi decenni evidenzia che
il normale sviluppo sinaptico, comprendente la maturazione delle spine dendritiche è strettamente
correlato dall’ambiente nella vita uterina, nella fase perinatale e nella prima infanzia.
A
B
A: dendrite di un bambino normale; B: dendrite di un bambino con ritardo mentale. (disegno)
LE SINAPSI
Le sinapsi sono importanti perché sono il punto di contatto tra le cellule nervose, ma anche altri tipi di
cellule, è una giunzione specializzata, esistono diversi tipi di sinapsi: chimiche ed elettriche.
Sinapsi elettricheSemplici come struttura, permettono il trasferimento di correnti ioniche direttamente da
una cellula all’altra, si ritrovano in siti specializzati e formano le giunzioni comunicanti, la distanza tra le due
cellule è di 3 nanometri e in questo spazio che le connessine formano il connessone, canale formato da 6
connessine.
4
Ogni cellula mette in comune un connessone per formare il canale della giunzione comunicante, che
permette il passaggio agli ioni che vanno direttamente da una cellula all’altra, il poro della giunzione
comunicante ha un diametro di 1 o 2 nanometri, in grado di garantire il passaggio a ioni e macromolecole.
Sono sinapsi bidirezionali, la trasmissione dell’impulso è velocissima, queste sinapsi si ritrovano ovunque
nel SNC dei mammiferi, ma la funzione di questo tipo di sinapsi varia da regione a regione, per lo più si
trovano in aree dove è richiesta una elevata sincronizzazione dell’attività di neuroni vicini.
Sinapsi elettrica
Sinapsi chimiche
Rappresentano la maggior parte delle sinapsi del SNC umano maturo, quindi sono molto importanti, la
membrana presinaptica e postsinaptica delimitano lo spazio intersinaptico o fessura sinaptica, tale spazio
misura dai 20 ai 50 nanometri. La membrana presinaptica in genere è la parte terminale di un assone, che
contiene sferette di 50 nanometri di diametro, le vescicole sinaptiche, che contengono il
neurotrasmettitore. Ci sono diversi tipi di sinapsi nel SNC : assodendritica, assosomatica, assoassonica e
dendrodendritiche sono chiamate così in dipendenza della parte del neurone che va a costituire la parte
postsinaptica e il contatto con la postsinaptica, solo per citarle ricordo le sinapsi del I e II tipo di Gray.
NEUROTRASMETTITORI
Possiamo far rientrare i neurotrasmettitori in tre categorie:
Aminoacidi
Amine
Peptidi
in dipendenza del tipo di neurone viene rilasciato un neurotrasmettitore diverso, nella trasmissione
sinaptica veloce sono coinvolti il glutammato, il GABA e la glicina; l’acetilcolina media la trasmissioni
sinaptiche veloci delle giunzioni neuromuscolari. Tutti le altre classi di neurotrasmettitori mediano le forme
di trasmissione più lente.
5
AMINOACIDI
AMINE
GABA (acido gamma-amino butirrico) Acetilcolina
Glutammato
Dopamina
Glicina
Adrenalina
Istamina
Noradrenalina
Serotonina
PEPTIDI
Colecistochinina
Dinorfina
Encefaline
Ormone per il rilascio della tireotropina
NAAG (N-acetilaspartilglutammato)
Neuropeptide Y
PVI (Polipetide vasoattivo intestinale)
Sostanza P
Un importante meccanismo per il rilascio del neurotrasmettitore è la fusione della vescicola che li contiene
con la membrana del terminale postsinaptico, fusione possibile grazie alla famiglia delle proteine integrali
di membrana SNARE. I peptidi SNARE hanno un terminale lipofilo che si ancora nella membrana e l’altro
più lungo che penetra nel citoplasma, in questo modo “agganciano” l’altra membrana; le vescicole hanno le
v-SNARE, mentre la membrana a cui si va ad ancorare ha le t-SNARE (t= target). Ancora non è del tutto
chiarito il meccanismo della connessione-SNARE e di tutte le proteine che sono coinvolte, ma sembra che
una proteina vescicolare, la sinaptotagmina sia il sensore in grado di attivare la fusione delle vescicole, in
questo meccanismo c’è il coinvolgimento degli ioni Ca 2+.
I neurotrasmettitori estrinsecano la loro azione grazie ai recettori, ce ne sono oltre cento tipi ma si possono
racchiudere in due categorie:
1. i canali ionici trasmettitore dipendenti
2. i recettori accoppiati alla proteina G
In parole povere lo stesso neurotrasmettitore può avere un differente effetto su recettori diversi, è un
esempio l’effetto che ha l’acetilcolina sul cuore e sul muscolo scheletrico, nel primo caso provoca una lenta
iperpolarizzazione delle cellule cardiache, facendo rallentare la frequenza; nel secondo caso induce una
depolarizzazione delle fibre muscolari e il muscolo si contrae. I neurotrasmettitori sono il trait d’union tra i
neuroni e anche con altri tipi di cellule come le muscolari, epiteli ghiandolari etc, e contribuiscono al
funzionamento del network neuronale.
IMPORTANZA DELLA MIELINA
Abbiamo avuto modo di vedere che più è grande il diametro dell’assone, maggiore sarà la velocità di
conduzione dei potenziali d’azione, ma se fossero grandi come quelli del calamaro (usato per molti
esperimenti in ambito neurologico) avremmo una testa enorme, per questo la natura per i vertebrati ha
previsto un altro tipo di evoluzione per aumentare la velocità di conduzione dei potenziali. La guaina di
mielina che riveste l’assone e lo isola elettricamente favorisce la velocità di conduzione dei potenziali
d’azione da un nodo di Ranvier all’altro, dove sono concentrati nella membrana assonica i canali voltaggiodipendenti per il sodio; in corrispondenza dei nodi di Ranvier la guaina si interrompe. Per avere un idea
dell’ordine di grandezza, la distanza tra i nodi di Ranvier va da 0.2 a 2 mm, in dipendenza della grandezza
dell’assone, pertanto la distanza tra i nodi è direttamente proporzionale al diametro dell’assone.
La Sclerosi Multipla (SM) è un esempio di patologia dove è coinvolta la mielina, non ancora tutto è chiarito
per quanto concerne l’eziologia, ma di certo sappiamo che ci sono lesioni a carico della guaina mielinica
degli assoni del cervello, del midollo spinale e dei nervi ottici, altra malattia che manifesta lesioni a carico
della mielina è la Guillain Barré. In entrambe le patologie c’è un marcato rallentamento dei tempi di
risposta perché la conduzione saltatoria viene impedita, inoltre è da ricordare che sono malattie
autoimmunitarie, e da più parti si invoca la causa virale.
6
IL SISTEMA NERVOSO PERIFERICO (SNP)
Si distingue in sistema nervoso periferico somatico e viscerale.
SNP somatico, vi fanno parte i nervi spinali che innervano la cute, le articolazioni e i muscoli
sottoposti al controllo volontario. La contrazione muscolare è sotto il controllo degli assoni motori
somatici dei motoneuroni del midollo spinale, mentre gli assoni somato-sensitivi provenienti dalla
cute articolazioni e formazioni muscolo-tendinee entrano nel midollo attraverso le radici dorsali
SNP viscerale, detto anche sistema nervoso autonomo (SNA) o involontario, o vegetativo
comprende i neuroni deputati all’innervazione degli organi interni, gli assoni sensitivi viscerali
informano il SNC; le fibre viscerali motorie controllano la contrazione.
Il SISTEMA NERVOSO CENTRALE (SNC)
L’encefalo è la parte più rostrale (posta più avanti) del cervello si suddivide in due emisferi, il cervelletto è
posto caudalmente ( posteriormente), il tronco encefalico situato tra encefalo e midollo allungato, che
prosegue con il midollo spinale. L’emisfero cerebrale destro controlla il lato sinistro del corpo, viceversa il
sinistro, scambiano informazioni anche tra di loro. Il cervelletto può essere considerato un centro di
controllo del movimento, ha numerose connessioni con l’encefalo e il midollo, contrariamente all’encefalo
la parte sinistra del cervelletto controlla la parte sinistra del corpo e la destra l’omolaterale. Il tronco
encefalico può essere considerato un centro di smistamento delle informazioni che vanno dall’encefalo al
cervelletto, al midollo spinale e viceversa, nel tronco avviene la regolazione delle funzioni vitali, la
regolazione della temperatura corporea ed è fondamentale per la vita. Dal tronco encefalico si dipartono i
12 paia di nervi cranici, che sono deputati principalmente all’innervazione della testa, ogni paio è numerato
e conservano la numerazione romana attribuita da Galeno quasi due millenni fa. Alcuni appartengono al
SNC, altri al SNP somatico e altri al SNP viscerale, alcuni sono composti da tipi diversi di neuroni che hanno
funzioni diverse.
I cervello è protetto da tre tipi di membrane dette meningi:
dura madre, è la parte più esterna è robusta e anelastica
aracnoide, si trova subito al di sotto della dura madre adesa ad essa, si chiama aracnoide perché ha
l’aspetto di una tela di ragno, è la zona dove si formano gli ematomi subdurali
pia madre, è aderente al cervello, è una membrana sottile separata dall’aracnoide dallo spazio
subaracnoideo dove è contenuto il liquido cerebrospinale (LCS)
Il liquido cerebrospinale (liquor) è prodotto da una formazione particolare, il plesso coroideo situato nei
ventricoli cerebrali che sono cavità che con i canali costituiscono il sistema ventricolare dove scorre il
liquor, lo stesso che ritroviamo nello spazio subaracnoideo dove viene assorbito dai villi aracnoidei.
7
SOSTANZA GRIGIA
È l’insieme dei corpi cellulari dei
neuroni nel sistema nervoso
centrale.
CORTECCIA
È il sottile strato della superficie
cerebrale compost dai neuroni.
NUCLEO
Appartengono al sistema ventricolare cerebrale, i ventricoli laterali, il
Area di neuroni raggruppati in una
terzo ventricolo, l’acquedotto cerebrale e il quarto ventricolo, le
parte più in profondità, per
strutture ad essi correlate sono rispettivamente:
Il cervello: la più
esempio tronco encefalico.
telencefalo basale; talamo e ipotalamo;
alta conquista
tegmento del mesencefalo; cervelletto, ponte e
dell’evoluzione
midollo allungato. Il cervello umano si
caratterizza per le dimensioni e per la grande quantità di circonvoluzioni, separate
dai solchi, le protuberanze sono chiamate circonvoluzioni o giri; il sottile strato di neuroni sotto la superficie
è la corteccia cerebrale. Solchi e circonvoluzioni si formano durante lo sviluppo embrionale e alla luce delle
più attuali conoscenze è la risultante di giochi di forze di trazione.
La cervello sviluppa una superficie di circa 1.100 cm2 e per essere contenuta all’interno del cranio deve
ripiegarsi più volte su se stessa, nonostante la crescita sproporzionata il cervello umano conserva ancora la
sua organizzazione arcaica e i ventricoli sono la chiave di lettura, nonostante che il sistema ventricolare si è
modificato a causa della crescita dei lobi temporali. In parole semplici il rapporto tra ventricoli e cervello
restano.
CARATTERISTICHE DELLA CORTECCIA CEREBRALE
La corteccia cerebrale può essere considerata la parte più importante del sistema nervoso dell’uomo, da
essa dipendono le sensazioni, il movimento, il linguaggio, il pensiero e molto altro. I corpi cellulari sono
organizzati in strati .
IL GIGANTE ADDORMENTATO DELLE NEUROSCIENZE: LA GLIA
La glia (dal greco clèa, «colla») contribuisce al funzionamento del SNC più di quanto pensassimo fino a
qualche tempo fa, contribuisce ai processi di analisi dell’informazione e a sostenere i neuroni nella loro
fisiologica funzione cerebrale e il cervello non sarebbe in grado di funzionare se non ci fosse. Gli astrociti
sono le cellule più rappresentate tra le gliali, sovraintendono alla crescita e al mantenimento funzionale del
neurite, quest’ultimo potrebbe degenerare nel caso l’astrocita non dovesse attendere in maniera ottimale
alla sua funzione. Il compito dell’astrocita è quello di avvolgere le giunzioni sinaptiche per il controllo della
diffusione dei neurotrasmettitori, della loro rimozione e della regolazione biochimica dello spazio
extracellulare, in particolare la regolazione della concentrazione degli ioni K+. Recentemente sono stati
scoperti recettori sulla superficie di queste particolari cellule. Nevroglia o neuroglia o glia, termini che
8
indicano lo stroma interstiziale del cervello e del midollo spinale sono cellule del sistema nervoso molto più
numerose dei neuroni, hanno funzione trofica, di difesa e di riparazione; ma oggi ci sono evidenze che
indicano un ruolo più importante, infatti, sono coinvolte in funzioni neurologiche più specifiche. Esistono
due tipologie di glia:
macroglia, di origine neuro ectodermica con elementi cellulari più grandi rispetto alla
microglia, vi fanno parte gli astrociti, gli oligodendrociti, gli ependimociti e le cellule di
Schwann.
microglia, circa il 10% delle cellule del sistema nervoso, di derivazione mesodermica, è una
popolazione di cellule immunocompetenti del sistema nervoso centrale, composta da
macrofagi di derivazione monocitaria, con compito di proteggere i neuroni nel SNC. Deriva
da precursori mieloidi che migrano nel SNC nelle prime settimane di crescita fetale che si
differenzieranno nella vita adulta in microglia parenchimale e perivascolare, la prima è
stabile la seconda va incontro a turnover, entrano in azione in caso di lesioni cerebrali. La
morfologia della microglia nelle prime fasi di vita extrauterina è di tipo ameboide, per poi
cambiare col passare dei mesi fino ad assumere la classica forma ramificata tipica del
fenotipo funzionale in quiescenza (resting). È importante il ruolo della barriera
ematoencefalica che mette al riparo il sistema nervoso centrale da insulti di vario genere,
garantendo la quiescienza delle suddette cellule che interagiscono con gli astrociti e i
neuroni, anche questi ultimi elementi cellulari interagendo con la microglia ne garantiscono
la stabilità. Questa condizione di quiescenza non deve indurci a pensare alla sua totale
inattività, perché conserva il suo importante ruolo di “sorveglianza” mediante i suoi processi
citoplasmatici, e in caso di necessità reagisce riacquistando la forma ameboide e le funzioni
macrofagiche, passa allo stato attivato, tipico delle patologie neurologiche, anche se i
meccanismi non sono del tutto chiariti. Le cellule della microglia sono maggiormente
rappresentate nella substantia nigra, nell’ippocampo e nei gangli basali,
Microglia ramifica
MICROGLIA E SNC
Il “Sistema Immunitario” è un “Organo Diffuso” che si integra con l’organismo e in particolare, con il
Sistema Nervoso con il quale condivide i mediatori chimici, le cellule del Sistema Immunitario costituiscono
il tessuto di sostegno di molti organi e tessuti, come le:
cellule di Kupfer nel fegato
glia nel cervello
osteoblasti/osteoclasti nel tessuto osseo
sono tutti Macrofagi “specializzati”.
9
Nell’autismo sono di comune riscontro le modifiche della struttura e della funzione delle sinapsi e dei
dendriti, perché sembra che i fattori ambientali possano interagire con il profilo genetico e favorire
l'eterogeneità clinica di comune osservazione nei disturbi dello spettro autistico. Molti sono stati gli studi che
hanno cercato di far luce sulla pathway molecolare che caratterizza la malattia, in particolar modo molecole
di segnalazione quali: neurotrofina, reelin, fattori di crescita, neurotrasmettitori come la serotonina e
glutammato e altre proteine sinaptiche. Morgan nel 2010 ha rilevato in bambini autistici una precoce
attivazione della microglia, che può essere importante nella patogenesi dell'autismo, tale fenomeno può
rappresentare una risposta del sistema innato neuroimmune ai disturbi della rete sinaptica, neuronale, o
del network neuronale. L’attivazione della microglia, in risposta ad alcuni tossici ambientali e
proteine endogene, contribuisce al danno neuronale nelle malattie neurodegenerative, perché è
sovrattivata e avvia il rilascio di radicali liberi; svolgono un ruolo chiave i pattern recognition
receptors (PRRs) espressi sulle cellule della microglia che sono coinvolti nella trasduzione del
segnale, indotto dalle tossine. La microglia non attivata non esprime citochine, CD45, molecole MHC di
classe I, MHC di classe II e altri recettori necessari per presentare l'antigene ai linfociti che sono espressi
normalmente sui macrofagi.
Astroglia: costituita dagli astrociti, che sono cellule di 10 µm di diametro con forma stellata, da cui
deriva il nome, sono le cellule più rappresentate della neuroglia dal 25 al 50% del volume
complessivo del SNC, hanno estroflessioni che ne consentono la connessione con i neuroni.
Esistono due tipi astrociti:
protoplasmatici, maggiormente rappresentati nella materia grigia, hanno estroflessioni corte
e ramificate, sottili che permettono loro di circondare i neuroni, gli assoni, i dendriti e le
sinapsi, regolando l’ambiente chimico extracellulare rimuovendo i neurotrasmettitori
rilasciati nell’attività di trasmissione dell’impulso, tra i quali il glutammato ad opera di
trasportatori ad alta affinità, facendone cessare l’azione preservando i neuroni da una
eccessiva stimolazione recettoriale e quindi dall’eccitotossicità.
fibrosi, maggiormente rappresentati nella materia bianca, devono il loro nome per la
presenza della proteina gliale fibrillare acida (GFAP - Glial Fibrillary Acidic Protein), che le
caratterizza, infatti i protoplasmatici ne hanno meno.
Gli “end feet” astrocitari (estremità di alcuni di questi prolungamenti), si estendono e si “adagiano”
sulla superficie del cervello proteggendolo, questa specie di guscio protettivo è noto come “glia
limitans”; altri prolungamenti prendono contatto con i vasi cerebrali interconnettendosi e
interagendo con l’endotelio contribuiscono a formare la barriera ematoencefalica. Gli astrociti sono
dislocati nel parenchima cerebrale in maniera strategica, affinché possano prendere contatto con i
neuroni, con gli altri elementi costitutivi della glia e con i vasi sanguigni. Gli astrociti comunicano
tra di loro utilizzando il calcio, sono in grado di controllare il flusso ematico nel cervello, facilitano
il neurone nell’assorbimento del glucosio, mantengono concentrazioni ottimali di K+ durante
l’attività di firing, e sembra essere sempre più chiaro il loro ruolo di terzo elemento della
trasmissione sinaptica: sinapsi tripartita
Astrociti quali fornitori di energia dei neuroni.
All’incirca l’80 % dell’energia necessaria al sistema nervoso è utilizzata per la trasmissione eccitatoria
glutammatergica, la fonte energetica è rappresentata dal glucosio che utilizza il suo trasportatore GLUT1 per
essere infine utilizzato dalla cellula. Il GLUT1 è presente anche sugli end feet astrocitari che rivestono i vasi
sanguigni, questo posizionamento facilita l’assorbimento di glucosio dal torrente circolatorio, negli astrociti
il glucosio avvia il processo di glicolisi o viene trasformato in glicogeno. Il GLUT3 è un altro trasportatore
che permette ai neuroni l’assorbimento del glucosio, che però non sono in grado di formare glicogeno a
differenza degli astrociti che lo utilizzano mobilizzandolo dai depositi per far fronte alle esigenze energetiche
10
dei neuroni. Gli astrociti rimuovono gli ioni K + e il glutammato dallo spazio extracellulare utilizzando ATP
proveniente dalla glicolisi, il glutammato viene convertito in glutammina che viene trasformata di nuovo in
glutammato, questo processo è detto ciclo del glutammato-glutammina. I neuroni e i globuli rossi hanno
come unico substrato nutrizionale il glucosio, diversamente dalle altre cellule che possono utilizzare gli
aminoacidi o gli acidi grassi.
Galattosio
Le cellule nervose si nutrono esclusivamente di glucosio, circa 150 grammi al giorno nell’adulto, per
poterlo metabolizzare c’è bisogno dei recettori per l’insulina, la quantità di glucosio plasmatico libero è di
appena 5 grammi pertanto è importante l’apporto alimentare per poter mantenere un’omeostasi efficiente. Se
a questo aggiungiamo che solo il fegato è in grado di effettuare la neoglucogenesi, comprendiamo
l’importanza di un’alimentazione adeguata e la necessità di avere un fegato e i recettori per l’insulina in
piena efficienza. Il galattosio, anch’esso un monosaccaride, diversamente dal glucosio può entrare
all’interno della cellula nervosa tramite il GLUT3 indipendentemente dai recettori dell’insulina, e viene
trasformato in glucosio, la via di Leloir. Sono necessari adeguati livelli di galattosio nel sangue affinché si
possa creare il giusto gradiente di concentrazione, una parte di galattosio proviene dalla scissione del lattosio,
che ci fornisce anche il glucosio, ma in presenza di una disbiosi o un deficit di lattasi tale processo non è
garantito.
Nei bambini con ASD viene meno la capacità di scindere i disaccaridi in monosaccaridi, è importante quindi,
eliminare dalla dieta i disaccaridi come il saccarosio, alcune diete prevedono anche l’eliminazione dei
polisaccaridi, infatti, uno dei punti più importanti e difficili nella dieta del bambino autistico è proprio l’uso
degli “zuccheri”. Diventa perciò importante la scelta degli “zuccheri “da somministrare senza che si creino
problemi, ecco perché consiglio l’uso del galattosio, del mannosio e del glucosio, in dipendenza della fase
della dieta. Tra i monosaccaridi il più conosciuto è il fruttosio, bisogna però distinguere la provenienza,
quello della frutta, della verdura e del miele sono salutari, a meno che non ci si trovi in presenza di deficit
della fruttosio-1-fosfato-aldolasi, meglio conosciuta come “intolleranza al fruttosio”. Ritengo che non si
debba essere schematici e rigidi, perché non esiste la patologia, esiste il malato e poiché ogni malato è
diverso, va valutato caso per caso il tipo di dieta da applicare; ci sono troppe variabili in gioco che spesso
non coincidono in tutti i pazienti. Ho avuto pazienti che hanno risolto la loro problematica senza grandi
sconvolgimenti alimentari, al contrario pazienti che prima di conseguire qualche risultato hanno dovuto
combattere con la patologia intestinale; mi riferisco soprattutto a disbiosi e permeabilità intestinale.
Premettendo che i carboidrati sono fondamentali nella dieta dobbiamo bilanciarla e non incorrere
nell’errore di spostarla sul versante proteico, soprattutto se ci sono mutazioni, mi riferisco ai polimorfismi
che non lo consentono, perché uno dei problemi potrebbe essere l’elevazione dei livelli di ammoniemia.
È stato dimostrato che la contemporanea somministrazione di enzimi proteolitici e galattosio, hanno
una duplice funzione:
indurre l’espressione genica per la Dipeptidil-peptidasi IV
favorire lo sviluppo di una normale microflora intestinale
Il tutto si traduce in un miglioramento clinico, a cui segue il miglioramento dell’iperattività e una
migliore socializzazione, sono diverse le sostanze usate, una di queste è il PeptizydeTM che è un
mix di enzimi proteolitici derivati da tre piante e permette una dieta più varia nei bambini con ASD.
Il galattosio si rivela un utile monosaccaride perché non ha bisogno dell’intervento degli enzimi
come per i disaccaridi e i polisaccaridi (DPPIV).
11
OLIGODENDROCITI
Gli oligodendrociti originano da precursori derivanti dalle cellule neuroepiteliali del tubo neurale,
che migrano per raggiungere la loro sede finale, dove continuano a proliferare e maturare. Sono
cellule più piccole degli astrociti e hanno meno prolungamenti e sono più sottili, la loro funzione
principale è la mielinizzazione, possono svolgere il loro compito su più assoni contrariamente alle
cellule di Schwann. Nel midollo spinale gli oligodendrociti derivano da cellule progenitrici nella
zona ventrale che proliferando si spostano nella zona dorsale e laterale, giunte nella sede di
destinazione iniziano a differenziarsi e down-regolano alcune proteine come l’NG2 (chondroitin
sulfate proteoglycan) e la PDGFaR (platelet-derived growth factor-a receptor). In questo stadio le
cellule sovraregolano l’espressione dei geni per le proteine della mielina ed iniziano la formazione
della membrana. Se l’oligodendrocita muore la conseguenza è la demielinizzazione dell’assone,
con ripercussioni negative sulla conduzione dello stimolo nervoso, fenomeno osservabile nella
sclerosi multipla. Gli oligodendrociti sono metabolicamente attivi e provvedono anche al supporto
trofico del soma neuronale, oltre a sintetizzare fattori di crescita come il CNTF (ciliary
neurotrophic factor), l’IGF-1 (insulin-like growth factor-1) ed altri fattori neurotrofici con ruolo
neuroprotettivo.Anche nel cervello dell’adulto è conservata una buona riserva di tali precursori, in
grado di migrare, proliferare e rimielinizzazione, ma quest’ultimo aspetto è condizionato da molti
fattori non ancora del tutto conosciuti. Sembra di notevole importanza la compartecipazione della
proteina Notch, espressa dagli oligodendrociti, e del ligando Jagged espresso sulla membrana
dell’assone, nell’attivazione degli oligodendrociti; infatti una sotto-regolazione del ligando Jagged
fa sì che ci sia un ritardo di maturazione dei precursori oligodendrocitari. Funzioni di controllo sono
state attribuite anche al sistema microtubulare oligodendrocitario, che sembra avere funzione di
controllo sulla mielinizzazione. Anche gli astrociti sono coinvolti nel rilascio di fattori di crescita e
differenziazione oligodendrocitaria, contribuendo al processo della mielinizzazione. L’esistenza di
una unica linea di astrociti lungo il decorso dell’assone, che si interpongono a tre o quattro
oligodendrociti in sequenza e la presenza di giunzioni intercellulari, sembra essere un network
funzionale. Inoltre gli alti livelli di glial fibrillar acidic protein (GFAP) durante il processo di
mielinizzazione e la presenza del complesso citoscheletrico GFAP-vimentina all’inizio del
processo, conferma l’importanza degli astrociti nella mielinizzazione.
C’è anche la compartecipazione di altri fattori in questo processo, e sono:
Fattori di crescita, come per es. PDGF
Neurotrasmettirori come per es. GABA
Ormoni Tiroidei
Gap junction fra oligodendrociti e astrociti
Ependimociti
Gli ependimociti sono cellule che rivestono le cavità del sistema nervoso centrale, sono provviste di
ciglia, sono in grado di produrre e riassorbire il liquor cerebrospinale, ne favoriscono la
circolazione. Sono prive di membrana basale e questo permette loro di avere connessioni con gli
astrociti, si pensa che possano avere funzione di cellule staminali neuronali.
12
“ L’attivazione delle cellule della microglia è una reazione di difesa dell’organismo che pu
e che il ripristino dell’omeostasi tissutale dipende dal delicato equilibrio tra le funzioni pro-infiammatorie
potenzialmente dannose e quelle più propriamente neuroprotettive.
alla degenerazione dei motoneuroni, attraverso diversi meccanismi che coinvolgono il rilascio di radicali
liberi e di sostanze neurotossiche.
Inoltre, in questa patologia gli astrociti hanno una ridotta espressione del trasportatore per il glutammato
EAAT-1 e una diminuita capacità di rimuovere glutammato dallo spazio extracellulare, favorendo
l’instaurarsi di fenomeni di eccitotossicità e di morte neuronale.
Infine, il danno e la morte degli oligodendrociti, e la conseguente perdita della guaina mielinica, sono
eventi tipici di importanti patologie demielinizzanti come la sclerosi multipla,
Tuttavia, la perdita di oligodendrociti mielinizzanti o dei loro precursori immaturi sta emergendo come
tratto comune a molte altre patologie, per es. traumi cerebrali o del midollo spinale, malattia di Alzheimer e
corea di Huntington. Oligodendrociti distrofici e alterazioni della guaina mielinica sono stati riscontrati
anche in malattie psichiatriche come la schizofrenia. “ Fonte:Treccani
Neurotrofine e fattori di crescita.
Le neurotrofine sono strutturalmente correlate e legano due classi di recettori: i Trk, della famiglia dei
recettori tirosinchinasi, e i p75, della superfamiglia dei recettori del TNF (Tumor Necrosis Factor o fattore di
necrosi tumorale). Attraverso l’interazione e l’attivazione di questi recettori, le neurotrofine regolano la
crescita e la sopravvivenza di specifiche popolazioni di neuroni durante lo sviluppo e nel cervello adulto. Le
neurotrofine sono inoltre in grado di influenzare importanti funzioni neuronali come eccitabilità e
sinaptogenesi.
La glia è un’abbondante fonte di neurotrofine sia in condizioni fisiologiche sia in seguito a vari tipi di
danno neuronale. In partic., NGF e BDNF sono prodotti da tutti tre i principali tipi di glia (astrociti,
oligodendrociti e microglia) del sistema nervoso centrale e dalle cellule di Schwann nel sistema nervoso
periferico. L’espressione di questi fattori è aumentata in caso di danno neuronale, soprattutto in
astrociti e cellule di Schwann, ed è stato suggerito che l’aumento dei livelli di neurotrofine promuove la
rigenerazione delle fibre nervose. Anche l’NT-3 è ampiamente espressa dalle cellule gliali, mentre la
13
sintesi di NT-4 sembra limitata ad astrociti e cellule di Schwann. Nella microglia, l’espressione di NT-3 è
regolata dallo stato di attivazione e limitata a sottopopolazioni microgliali in determinate aree cerebrali, per
es. la corteccia. Oltre che dagli oligodendrociti maturi, NT-3 è espressa dai loro precursori, sui quali agisce
regolandone proliferazione e sopravvivenza, con un meccanismo autocrino. La glia produce anche altre
sostanze, o fattori di crescita, in grado di promuovere la sopravvivenza dei neuroni, soprattutto in seguito alla
loro attivazione in caso eventi patologici. Tra questi il TGF-B (Transforming Growth Factor B) e il GDNF
(Glial cell line-Derived Neurotrophic Factor). L’espressione di questi fattori aumenta durante la fase di
degenerazione neuronale in seguito a una lesione, per ritornare a livelli di normalità dopo la rigenerazione
dell’assone. Altri fattori importanti sono CNTF (Ciliary NeuroTrophic Factor) e IGF-1 (Insulin-like Growth
Factor-1). Queste proteine potrebbero mediare l’azione neuroprotettiva degli oligodendrociti e di altri tipi
gliali, nei confronti di neuroni corticali e cerebellari.
Le cellule della microglia, sono cellule del sistema immunitario innato molto attive, sono i
macrofagi del sistema nervoso centrale, in movimento costante, interagiscono con le sinapsi e
giocano un ruolo importante nella funzione sinaptica, nell’eliminazione del glutammato
extracellulare in eccesso in modo da ridurre il danno eccitotossico. Ci sono diversi tipi di microglia,
la sua attivazione non implica un fenotipo distruttivo, può esserci soprattutto una funzione
neuroprotettiva che si estrinseca tramite la fagocitosi di residui di neuroni, cellule morenti e dal
rilascio di neurotrofine come fattore di crescita nervosa. Pio del Rio-Hortega nel 1932 descrisse per
la prima volta delle funzioni della microglia con molta precisione, fu anche il primo a dire che
queste cellule possono migrare all'interno del cervello verso aree lesionate, e che potrebbe
proliferare ed effettuare la fagocitosi. Pubblicò le sue scoperte in un testo molto importante:
Cytology and Cellular Pathology of the Nervous system, anticipando di quasi mezzo secolo molte
cose in ambito immunologico; per esempio che la microglia si ritrova nel cervello già nelle fasi
precoci dello sviluppo. La microglia deriva da tessuti di origine mesodermica/mesenchimali,
principalmente da cellule mieloidi del midollo osseo, che migrano nel cervello fetale durante il
primo trimestre e parte del secondo, attraverso i vasi sanguigni e le vie nervose; raggiunte le aree
cerebrali di destinazione si trasformano in fenotipi microgliali quiescenti. Fu il primo a dire che la
microglia se non ha influenze ambientali negative conserva un aspetto ramificato (resting), dopo
stimolo da parte di noxae esterne o di una patologia cerebrale assume un aspetto ameboide, possono
migrare nelle aree cerebrali danneggiate, possono moltiplicarsi e assumere il ruolo di fagociti. La
microglia ha una distribuzione eterogenea, con le più alte concentrazioni nella materia grigia e in
particolare nell’amigdala, corteccia entorinale (giro ippocampale), ippocampo e nella substantia
nigra, in quest’ultima raggiunge la più alta concentrazione rispetto alle altre aree cerebrali. La
microglia sta assumendo un ruolo importante tant’è che negli ultimi anni la ricerca sta concentrando
risorse ed energie per studiarla, per esempio si pensava che il fenotipo a riposo (resting phenotype)
fosse una fase di inattività, mentre con l’avvento di nuove tecniche è stato evidenziato che è molto
attiva, estende e ritrae le sue estensioni intorno alle sinapsi. La microglia è in grado di attivare la
fagocitosi anche nei confronti di sostanze chimiche, questo fa pensare a uno stato di controllo
continuo del microambiente, ha un ruolo importante nel mantenere bassi i livelli di glutammato
extracellulare, evitando il fenomeno dell’eccitotossicità. Sappiamo che è distribuita lungo i vasi
sanguigni cerebrali e si trova spesso in uno stato attivato e forma una particolare barriera
immunologica per il cervello in combinazione con la barriera emato-encefalica. In presenza di
patologia la microglia residente non solo prolifera, ma può anche migrare, e anche a grandi distanze
accumulandosi nel sito della lesione e nei suoi dintorni.
Anche se non è del tutto chiaro il meccanismo, ma sembra che la microglia non si trova mai in uno
“stato di riposo", e che esistono molti stati intermedi di transizione in base alla funzione e alla
morfologia, in dipendenza di trigger che portano al cambiamento da uno a un altro stato.
14
Sembra che in dipendenza del tipo di stimolo ambientale varia lo stato di attivazione della
microglia, in altre parole se cambia il tipo di stimolazione di pari passo cambia lo stato della
microglia. È importante rilevare che la microglia è maggiormente presente dove non c’è la barriera
ematoencefalica, per esempio nelle zone circumventricolari che sono i punti critici da cui possono
entrare sostanze che normalmente non si trovano nel cervello.
Origine cellulare della microglia
Nonostante gli studi intensi non è del tutto chiaro da dove deriva la microglia, infatti a differenza di
questa e dei neuroni, di derivazione neuroectodermica, i progenitori microgliali provengono dal
mesoderma e colonizzano il sistema nervoso, soprattutto durante il periodo embrionale e lo
sviluppo fetale. Ci sono evidenze che la microglia derivi da progenitori mesodermici distinti dai
monociti, inoltre, inizialmente i progenitori microgliali colonizzano il sistema nervoso attraverso
percorsi extra vascolari, pertanto va messo in discussione il concetto che la microglia residente nel
sistema nervoso derivi da monociti circolanti nel sangue.
Il lavoro per stabilire l’origine dei progenitori microgliali di ricerca è ancora in corso
Cellule microgliali ameboidi si osservano durante la fase finale dell'embriogenesi, e sembrano avere
importanza nella “synaptic pruning”, e sullo sviluppo del cervello dell’embrione, in un articolo
del 2011 Paolicelli correla la sorveglianza della microglia alla maturazione
sinaptica, ed evidenzia che deficit funzionali della microglia possono indurre
anomalie sinaptiche che si osservano in alcuni disturbi dello sviluppo
neurologico.
La proteina fractalkine, chemochina CX3CL1 codificata dal gene CX3CL1, modula le
citochine proinfiammatorie che possono attivare la microglia, agendo sul suo recettore
localizzato sulla membrana delle cellule microgliali. Questa proteina è importante perché
modula la “synaptic pruning ” durante lo sviluppo neurale; una sua carenza o quella del suo
recettore porta a un aumento delle connessioni sinaptiche con conseguenti anomalie dello
sviluppo cerebrale. Per esempio nell’epilessia, si ha un eccessiva sensibilità della trasmissione
eccitatoria e quindi si hanno i disturbi correlati a questa condizione.
15
Le vie di segnalazione cellulare e i secondi messaggeri rivestono una importanza particolare nelle
cellule della microglia, sembra che per il gran numero di recettori sulla membrana, queste cellule
non agiscono semplicemente e solamente con un meccanismo di tipo “on” “off”, ma modulano la
risposta all’ambiente.
Esistono molte vie di segnalazione che collegano i recettori di membrana ai geni, ciò è reso
possibile da molecole di origine organica e non, che sovraintendono alla regolazione di pathways
biochimici essenziali per la fisiologia cellulare. Tali sostanze vanno sotto il nome di “secondo
messaggero”, attivate o rilasciate dopo che si è instaurato il legame recettore/ligando.
Le cellule della microglia possono essere attivate dalle citochine pro infiammatorie e dal
glutammato, assumono un ruolo citotossico e iniziano a danneggiare le sinapsi, i dendriti e se
il processo non si arresta portano alla distruzione del neurone. Lo fa attraverso il rilascio di
citochine pro infiammatorie come TNF-α, IL-1β e IL-6; chemochine come MAP-1 e MCP-1;
eccitotossine come aspartato, glutammato e acido quinolinico. La
La chemochina CX3CL1 può riportare le cellule della microglia a uno stato di riposo, e metterle in
condizioni di non portare nocumento al neurone, le citochine anti infiammatorie come il
transforming growth factor beta (TGF-β) e l’IL-10; i fattori neurotrofici come il brain derived
neurotrophic factor (BDNF) e il nerve growth factor (NGF).
Il danno a carico delle sinapsi, dei dendriti ma anche dei neuroni, che si osserva nelle malattie
neurodegenerative, si ha sia per l’attivazione cronica delle componenti del sistema immunitario
innato, sia nel caso che i fattori deputati al ripristino della normale omeostasi non funzionino.
Osserviamo l’attivazione microgliale cronica in patologie dove si ha attivazione immunitaria
sistemica cronica, come nelle malattie autoimmuni e nelle infezioni croniche di tipo virale, malattia
di Lyme etc., anche i metalli pesanti quali alluminio, piombo e mercurio creano le condizioni per un
attivazione cronica delle cellule della microglia.
Anche i metalli pesanti, come i virus, possono fungere da stimoli neurotossici persistenti e poiché
non possono essere rimossi costituiscono una noxa costante sul sistema immunitario, abbiamo visto
come è coinvolta la microglia. L’alluminio è il metallo tossico particolarmente dannoso per la
microglia, perché si accumula in essa raggiungendo concentrazioni importanti, mantenendola in
costante stato di pro-attivazione infiammatoria con conseguente immuno-eccitotossicità cronica che
esiterà in neurodegenerazione.
Ormai c’è una robusta documentazione che l’iperresponsività a certi vaccini è la causa di
complicanze associate alla immunizzazione, tali complicanze sono l’encefalomielite, l’epilessia e
l’autismo.
Sebbene ci siano numerosi studi che indicano quali responsabili dell’accumulo e dell’attivazione
della microglia e la sua attivazione, l’alluminio e il mercurio contenuto nei vaccini, sono del parere
che potrebbero non essere questi metalli a creare il problema, le motivazioni per pensarlo sono
diverse:
16
1. Molti bambini già nei primissimi anni di vita mostrano elevati livelli di mercurio e
alluminio, se fossero i metalli tossici a creare il problema sulla microglia basterebbero quelli
introdotti attraverso la catena alimentare o per inalazione.
2. Il vaccino potrebbe creare attivazione delle cellule della microglia per mimetismo
molecolare e per infezioni concomitanti.
3. Non mi risulta che siano stati effettuati studi che tengano conto della tipizzazione HLA,
vaccinazione e adiuvanti.
Ad ogni buon conto concordo con gli autori (vedi riferimenti bibliografici) che dicono che la pratica
vaccinale debba essere rivista, nel numero e nei modi.
Anche la microglia e i macrofagi sono coinvolti nella cascata del complemento, infatti i patogeni
sovra regolano i recettori Fc, favorendo la fagocitosi attraverso l’opsonizzazione dell’antigene.
Quando si attivano questi processi infiammatori sono da tener presenti i danni che si instaurano a
carico delle cellule nervose, infatti i “detriti” delle cellule danneggiate o morte innescano una
risposta fagocitarie anche senza il rilascio di citochine pro infiammatorie.
Le cellule della microglia riconoscono i microrganismi patogeni virali, batterici, fungini
etc.utilizzando i TLRs 1-9 situati sulla membrana cellulare delle microglia, mostrando similitudine
nella specificità di legame con i macrofagi periferici.
Le cellule microgliali sono in grado di legare i lipopolisaccaridi (LPS), costituenti la parete dei
gram -, che hanno specificità per il TRL4; il TRL2 lega il peptidoglicano dei batteri gram +; il
TRL9 lega le isole CpG virali non metilate (CpG -islands).
Nel legame del TLR4 con i lipopolisaccaridi è coinvolto anche il CD14 con funzione di corecettore, LPS sono stati trovati nei vaccini, sono recettori coinvolti nell’infiammazione cerebrale e
nelle endotossiemie, in questi casi c’è sempre una sovra regolazione dei TRL4.
I damage associated molecular patterns (DAMPs), come dice il nome, sono prodotti in conseguenza
di un danno neuronale e possono interagire con specifici pattern recognition receptors (PRRs) sulla
superficie delle cellule della microglia attivandone le funzioni immunitarie.
17
Riferimenti
Immunology primer for neurosurgeons and neurologists part 2: Innate brain immunity
The multifaceted profile of activated microglia.
Microglial physiology: unique stimuli, specialized responses
The origin and cell lineage of microglia: new concepts
Synaptic pruning by microglia is necessary for normal brain development
Central nervous system disease in patients with macrophagic myofascitis.
A possible central mechanism in autism spectrum disorders, Part I
A possible central mechanism in autism spectrum disorders, Part 2
Macrophagic myofascitis lesions assess long-term persistence of vaccine-derived aluminum
hydroxide in muscle
Aging-related hyperinflammation in endotoxemia is mediated by the α2A-adrenoceptor and CD14/TLR4
pathways
Blaylock RL. Immunoexcitotoxicity as a central mechanism of autism spectrum disorders. In: Strunecka A,
editor. Cellular and Molecular Biology of Autism Spectrum Disorders. Bentham Science Publishers,
ebook; 2012. pp. 47–72.
18