Analisi di pedigree
Cos’è un pedigree?
Un albero genealogico, o pedigree, descrive la storia di una
famiglia rispetto a un carattere genetico e come quest’ultimo viene
ereditato nel corso di numerose generazioni
Il carattere in esame è trasmesso con gli autosomi o è
associato ai cromosomi sessuali?
Autosomico – non ci sono differenze di trasmissione tra i due sessi
Associato ai cromosomi sessuali
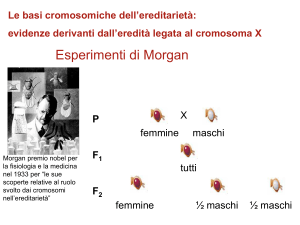
Associato al cromosoma X – i maschi e le femmine ereditano il
carattere in modo differente e dipendente dal sesso del
genitore che lo trasmette
Associato al cromosoma Y – solo i maschi ereditano il carattere
che viene trasmesso dal padre a tutti i figli maschi
Come si esprime questo carattere?
Dominante – il carattere è espresso a ogni generazione
Recessivo – il carattere può saltare una o più generazioni o
comparire all’improvviso
Analisi di pedigree
3
Analisi di pedigree
Simboli utilizzati per costruire un pedigree
Maschio
Individui malati (o che
esprimono il carattere
in esame)
Femmina
Eterozigoti per
caratteri autosomici
recessivi
Accoppiamento
Portatrice di un
carattere recessivo
legato al sesso
Morto/a
Accoppiamento tra
consanguinei
Genitori e figli,
maschio e femmina, in
ordine di nascita
Analisi di pedigree
I
II
1
1
2
2
3
Metodo per identificare i
soggetti di un pedigree. I
numeri romani indicano le
generazioni, quelli arabi i
singoli soggetti di ogni
generazione. Il soggetto II2 esprime il carattere
4
Analisi della segregazione della malattia di Huntington
1
2
I
1
II
III
IV
1
2
1
2
3
2
3
4
5
4
5
6
7
8
9
10
11
3
4
5
6
7
8
9
10
La malattia viene espressa in egual misura
femmine: il carattere è AUTOSOMICO
nei maschi e nelle
La malattia è presente in tutte le generazioni: il carattere è
DOMINANTE
Ereditarietà autosomica-dominante
5
Analisi della segregazione della malattia di Huntington
La malattia di Huntington, anche chiamata Corea di Huntington, è una malattia
neurodegenerativa ereditaria caratterizzata da disturbi del movimento (corea),
modificazioni della personalità e demenza.
La malattia è dovuta a una espansione di un segmento di DNA all’interno della
regione codicante del gene IT-15 formato dalla ripetizione di tre nucleotidi,
CAG, che vengono tradotti, nella proteina huntingtina, in una segmento
poliglutamminico.
Normalmente questo segmento è composto da 10-34 ripetizioni, mentre nei
soggetti malati esso ha subito un allungamento anche di decine di unità ripetute.
Ancora non si conosce il meccanismo patogenetico di questa mutazione, ma è
sicuramente scatenato da una nuova funzione tossica acquisita dalla cellula per la
presenza di questi tratti espansi poliglutamminici.
E’ una malattia a esordio tardivo in quanto la patologia colpisce soprattutto gli
adulti, generalmente compare tra i 30 e i 45 anni di età, ma la comparsa si può
verificare a qualsiasi età, anche molto precocemente, se il tratto espanso è molto
lungo (>80 ripetizioni).
Il modello di trasmissione della malattia è di tipo autosomico dominante, vale a
dire che essa può essere trasmessa da un genitore affetto ai suoi figli con una
probabilità del 50% per ciascun figlio, a prescindere dal sesso.
A tutt’oggi non si conoscono cure per rallentare la progressione della malattia.
Ereditarietà autosomica-dominante
6
Analisi della segregazione della malattia di Huntington
Si indichi con H l’allele che causa la malattia e con h l’allele normale
Essendo il carattere dominate, tutti i soggetti che non presentano la
malattia devono essere omozigoti recessivi hh
1
2
I
hh
1
II
III
IV
2
3
hh
1
2
hh
4
hh
1
hh
3
2
hh
Ereditarietà autosomica-dominante
5
hh
3
4
7
8
6
hh
hh
9
hh
hh
5
hh
5
hh
6
hh
4
7
hh
10
hh
8
hh
9
hh
11
10
hh
7
Analisi della segregazione della malattia di Huntington
I soggetti affetti dovranno possedere almeno un allele H
Inoltre i soggetti affetti figli di un genitore sano, omozigote recessivo,
riceveranno da questo un allele h.
Come pure i genitori affetti con figli normali dovranno possedere un h
1
I
Hh
1
II
III
IV
2
2
Hh
1
2
Hh hh
hh
1
hh
3
2
hh
Ereditarietà autosomica-dominante
4
Hh
3
Hh
hh
3
hh
5
hh
4
Hh
hh
6
7
5
hh
8
hh H h
hh
4
6
hh
Hh
9
hh
7
hh
5
10
hh
8
Hh
hh
hh
9
hh
11
10
hh
8
Analisi della segregazione di un tipo di sordità familiare
1
2
I
1
2
II
III
1
2
IV
3
3
4
4
5
5
6
6
1
7
7
8
9
2
La malattia viene espressa in egual misura
femmine: il carattere è AUTOSOMICO
nei maschi e nelle
La malattia non è presente in tutte le generazioni: il carattere è
RECESSIVO
Ereditarietà autosomica-recessiva
9
Analisi della segregazione di un tipo di sordità familiare
Mutazioni del gene che codifica per la proteina connessina-26 sono
responsabili della maggior parte dei casi di sordità autosomica recessiva in
Italia e Spagna.
Le connessine sono una famiglia di proteine presenti sulla membrana
cellulare, dove formano dei canali necessari per gli scambi e la comunicazione
tra cellule.
Questo gene è coinvolto in due diverse forme di sordità non sindromica:
DFNB1 e DFNA3.
La forma DFNA3 è molto rara, mentre la DFNB1 è la più frequente forma ad
eredità autosomica recessiva.
Questa malattia è congenita (presente già alla nascita) e può dare sordità
moderata o profonda, generalmente non progressiva.
L'analisi molecolare del gene connessina-26 può essere molto utile per
diagnosticare una sordità congenita ereditaria.
La diagnosi precoce e quella prenatale possono essere eseguite solo se la
mutazione responsabile della patologia è già stata identificata nelle persone
affette presenti in famiglia.
Ereditarietà autosomica-recessiva
10
Analisi della segregazione di un tipo di sordità familiare
Si indichi con s l’allele che causa la malattia e con S l’allele normale
Essendo il carattere RECESSIVO, tutti i soggetti che presentano la
malattia devono essere omozigoti recessivi ss
1
2
I
1
2
II
III
3
4
5
6
7
ss
1
2
IV
Ereditarietà autosomica-recessiva
3
4
5
6
1
7
8
9
2
ss
11
Analisi della segregazione di un tipo di sordità familiare
Poiché i genitori della I generazione sono normali ma hanno generato un
figlio affetto, sono eterozigoti per il questo gene
Il ragionamento è uguale per i genitori III-5 e III-6, che sono anche
primi cugini
I
1
2
II
III
3
1
2
Ss
Ss
4
5
6
7
ss
1
2
IV
Ereditarietà autosomica-recessiva
3
4
5
6
Ss
7
8
9
Ss
1
2
ss
12
Analisi della segregazione di un tipo di sordità familiare
Avendo III-5 trasmesso un allele s, verosimilmente lo deve a sua volta
aver ricevuto dal genitore II-2, che lo ha ricevuto da uno dei suoi
genitori. Il ragionamento è uguale per II-6.
Tutti gli altri soggetti sani possiedono sicuramente un allele sano S ma
non è possibile sapere qual è l’allele omologo
I
II
III
1
1
2
3
S?
Ss
S?
2
S? S?
3
S?
IV
Ereditarietà autosomica-recessiva
4
S?
1
2
Ss
Ss
4
ss
5
6
7
S?
Ss
S?
5
Ss
1
S?
6
7
8
Ss
S?
S?
9
S?
2
ss
13
Analisi della segregazione del tipo 2 di condrodisplasia punctata
1
2
I
1
II
III
IV
3
2
1
2
1
2
4
3
5
5
4
3
4
6
6
8
7
7
8
5
6
9
9
10
7
11
8
9
La malattia è presente in tutte le generazioni: il carattere è
DOMINANTE
C’è un forte sbilanciamento del rapporto sessi tra gli affetti a
favore delle femmine: il carattere è ASSOCIATO ALL’X
Ereditarietà associata all’X dominante
14
Analisi della segregazione del tipo 2 di condrodisplasia punctata
1
2
I
1
II
III
IV
3
2
1
2
1
2
4
3
5
5
4
3
4
6
6
8
7
7
8
5
6
9
9
10
7
11
8
9
E’ importante inoltre notare che i maschi affetti generano tutte
femmine affette e tutti i maschi sani.
Al contrario le femmine affette generano un rapporto sessi 1 : 1
Ereditarietà associata all’X dominante
15
Analisi della segregazione del tipo 2 di condrodisplasia punctata
La condrodisplasia punctata di tipo 2, conosciuta anche come sindrome di
Conradi-Hunermann, è contraddistinta dalla presenza di foci multipli di
calcificazioni intorno alla colonna vertebrale, alla pelvi e alle ossa lunghe.
Il fenotipo è variabile nelle femmine affette, comprendendo forme letali
e forme lievi identificate solo nell’età adulta.
Come molte malattie dominanti associate al cromosoma X, i maschi
sviluppano una forma di malattia molto più grave. Di conseguenza, il
rapporto femmine/maschi affetti da questa malattia è 36 : 7, e non 2 :
1 come normalmente dovrebbe essere la segregazione di caratteri
dominanti associati all’X.
Il motivo risiede nel fatto che questa forma di condrodisplasia punctata
è sub-letale nei maschi.
Ereditarietà associata all’X dominante
16
Analisi della segregazione del tipo 2 di condrodisplasia punctata
Analizziamo in primo luogo i cromosomi sessuali dei componenti di questo
pedigree:
• tutte le femmine avranno due cromosomi X
• tutti i maschi avranno un cromosoma X e un cromosoma Y
1
I
XY
1
II
III
IV
2
XY
7
8
XX XX
XY
XX
XX
2
3
2
XX
Ereditarietà associata all’X dominante
5
4
XX XX XX
1
XY
6
4
XY XX XY
1
5
3
2
3
XY
XX
6
XY XY
4
XY
7
XX
5
XY
8
9
XY
9
10
XY XX XY
6
XY
7
XY
11
XX
8
XX
9
XX
17
Analisi della segregazione del tipo 2 di condrodisplasia punctata
Si indichi con C l’allele che causa la malattia e con + l’allele normale
Tutti gli individui maschi affetti possiedono un allele C su sul loro unico
cromosoma X
Tutte le femmine affette possiedono un allele C su un cromosoma X e
un allele + sull’altro X ereditato dal genitore sano
1
I
XY
1
II
III
IV
2
3
2
4
X Y X X XCY
1
XY
3
5
6
7
XX XX
XCY
XX
5
4
6
XCX+ XCX+ XCX+ X Y X Y
1
XY
2
XX
2
XCX+
Ereditarietà associata all’X dominante
3
XY
4
XCY
7
8
9
XCX+
8
XY
9
10
XCX+ X Y X X XCY
5
XCY
6
XY
7
XY
11
XX
8
9
XCX+ XCX+
18
Analisi della segregazione del tipo 2 di condrodisplasia punctata
Tutti i maschi non affetti possiedono l’allele + sul loro cromosoma X
Tutte le femmine non affette sono omozigoti per l’allele +
La donna I-2 possiede sicuramente un allele C e un allele + che ha
trasmesso alle sue figlie sane.
1
I
X+Y
1
II
III
IV
2
3
2
4
X+Y X+X+ XCY
1
X+Y
5
6
3
5
4
6
2
XCX+
Ereditarietà associata all’X dominante
3
X+Y
4
XCY
8
7
X+X+ X+X+ XCY
XCX+ XCX+ XCX+ X+Y X+Y
1
X+Y
2
XCX+
9
X+X+ XCX+
7
8
X+Y
9
10
XCX+ X+Y X+X+ XCY
5
XCY
6
X+Y
7
X+Y
11
X+X+
8
9
XCX+ XCX+
19
Analisi della segregazione del daltonismo
1
2
I
1
II
III
IV
1
2
1
2
2
3
3
5
4
3
4
6
5
4
7
8
5
6
6
9
10
11
7
8
Solo i maschi sono daltonici e nessun maschio lo riceve dal genitore
maschio: il carattere è ASSOCIATO AL CROMOSOMA X
La malattia non è presente in tutte le generazioni: il carattere è
RECESSIVO
Ereditarietà associata all’X recessiva
20
Analisi della segregazione del daltonismo
Il daltonismo è un difetto congenito ereditario del sistema visivo descritto per la
prima volta nel 1798 da John Dalton, scienziato inglese che ne era affetto.
Comporta l'incapacità di distinguere il rosso dal verde. Spesso viene scoperto del
tutto casualmente durante un esame per la patente o sottoponendosi a un test
specifico.
Questo difetto ereditario è molto comune in Europa e ne sono affetti circa l'8% dei
maschi e lo 0,6% delle femmine. La differenza tra maschi e femmine si spiega col
fatto che l'alterazione genetica è localizzata sul cromosoma X: le donne hanno due
cromosomi X e per essere affette devono possedere due X con la mutazione, mentre
gli uomini sono emizigoti per questo cromosoma (hanno un unico cromosoma X) e se in
questo manca il gene necessario alla discriminazione dei colori, l'alterazione si
manifesta senz'altro.
Esempio di test per la verifica della corretta visione dei colori
Le persone dotate di normale capacità di
discriminazione dei colori, nei riquadri leggono
rispettivamente i numeri: 42, 37 e 58
Quelle affette dalla più comune forma di daltonismo
(totale confusione tra rosso e verde) leggono: 2, 7, 58
Ereditarietà associata all’X recessiva
21
Analisi della segregazione del daltonismo
Analizziamo in primo luogo i cromosomi sessuali dei componenti di questo
pedigree:
• tutte le femmine avranno due cromosomi X
• tutti i maschi avranno un cromosoma X e un cromosoma Y
I
X Y
II
III
IV
1
X Y
1
X Y
X X
1
2
3
4
5
6
X Y
X X
X Y
X X
X X
X Y
2
3
5
4
X X X X X Y
6
7
X Y X Y
X X
2
3
4
X X
X Y
X Y
Ereditarietà associata all’X recessiva
5
X Y
8
9
10
X Y X X X Y
6
X Y
7
X Y
11
X X
8
X X
22
Analisi della segregazione del daltonismo
Si indichi con d l’allele che causa la malattia e con D l’allele normale
Tutti gli individui maschi affetti possiedono un allele d sul loro unico
cromosoma X
Al contrario, tutti gli individui maschi non affetti possiedono un allele D
sul loro unico cromosoma X
I
XDY
II
III
IV
1
XDY
1
XDY
X X
1
2
3
4
5
6
XDY
X X
XDY
X X
X X
XDY
2
3
5
4
X X X X XdY
6
7
XdY XDY
X X
2
3
4
X X
Xd Y
Xd Y
Ereditarietà associata all’X recessiva
5
XDY
8
9
10
X dY X X XdY
6
XDY
7
XDY
11
X X
8
X X
23
Analisi della segregazione del daltonismo
Tutte le madri o le figlie di soggetti affetti sono portatrici obbligate,
come lo sono a loro volta le madri delle portatrici obbligate
Tutte le portatrici obbligate possiedono un allele d e, poiché non
esprimono il carattere, anche un D
I
XDY
1
II
III
IV
2
XDY
1
XDY
1
XDY
2
XdX D
3
5
4
XdX DX X XdY
3
4
XDY
X X
6
7
XdY XDY
X X
2
3
4
X X
Xd Y
Xd Y
Ereditarietà associata all’X recessiva
XdXD
5
XDY
5
6
X dX D
8
9
XDY
10
X dY X X XdY
6
XDY
7
XDY
11
X X
8
XdXD
24
Analisi della segregazione del daltonismo
Tutte le altre femmine sane, non portatrici obbligate, possiedono almeno
un allele normale D, ma non si può sapere com’è l’allele omologo.
I
XDY
1
II
III
IV
2
XDY
1
XDY
1
XDY
2
XDX?
Ereditarietà associata all’X recessiva
3
XDY
XdX D
3
5
4
XdX DXDX? XdY
2
XdXD
6
XdY XDY
3
4
Xd Y
Xd Y
5
4
XDX?
7
6
X dX D
8
9
XDY
10
XDX? X dY XDX? XdY
5
XDY
6
XDY
7
XDY
11
XDX?
8
XdXD
25
Analisi della segregazione di una forma di retinite pigmentosa
1
2
3
4
I
1
II
III
IV
1
2
1
2
2
3
5
4
3
4
6
5
7
8
5
6
6
9
10
11
7
8
Solo i maschi sono affetti e tutti ricevono il carattere dal padre
affetto. NB. tutti i maschi di un padre affetto sono affetti:
il carattere è ASSOCIATO AL CROMOSOMA Y
Ereditarietà associata all’Y
26
Analisi della segregazione di una forma di retinite pigmentosa
Con l’eccezione delle azoospermie, assenza di spermatozoi nel liquido
seminale, che rendono i portatori sterili, le malattie ereditarie associate
al cromosoma Y sono rarissime, in accordo con l’estrema scarsità dei geni
presenti.
L’esempio più famoso di ereditarietà associata al cromosoma Y finora
riportato, era l’ipertricosi del padiglione auricolare. Pur non avendo
ancora scoperto il gene responsabile di questo rarissimo carattere, è
stato però recentemente dimostrato con metodi indiretti (analisi
dell’associazione) che non è associato al cromosoma Y.
Esiste un tipo di retinite pigmentosa riportata in una grande famiglia
cinese di 4 generazioni in cui sono ammalati solo e tutti i figli maschi di
padri ammalati. E’ quindi molto probabile che questo tratto sia associato
al cromosoma Y.
La retinite pigmentosa è caratterizzata da depositi di pigmenti sulla
retina, visibili all'esame del fondo dell'occhio. Di solito esordisce con
cecità notturna, seguita da perdita progressiva del campo visivo
periferico durante il giorno e porta a cecità dopo alcuni decenni.
Ereditarietà associata all’Y
27
Analisi della segregazione di una forma di retinite pigmentosa
Anche in questo caso è bene analizzare
sessuali dei componenti di questo pedigree:
in primo luogo i cromosomi
• tutte le femmine avranno due cromosomi X
• tutti i maschi avranno un cromosoma X e un cromosoma Y
I
II
III
IV
1
X Y
X Y
X Y
X X
2
3
4
5
6
X X
X Y
X Y
X X
X Y
X X
3
5
4
X X X X X Y
6
7
X Y X Y
X X
2
3
4
X X
X Y
X Y
Ereditarietà associata all’Y
2
1
2
1
1
5
X X
8
9
10
X Y X X X Y
6
X Y
7
X Y
11
X X
8
X X
28
Analisi della segregazione di una forma di retinite pigmentosa
Si indichi con p l’allele che causa la malattia e con + l’allele normale
• Tutti gli individui maschi affetti possiedono un allele p sul loro
cromosoma Y
• Al contrario, tutti gli individui maschi non affetti possiedono un allele +
sul loro cromosoma Y
1
2
I
X Yp
1
II
III
IV
2
1
2
3
X Yp
X X
3
X X
X Yp
5
4
6
X X
7
X Y + X X X X X Y p X Y pX Y p X X
1
2
X Y+ X X
Ereditarietà associata all’Y
3
4
X Y+ X Y+
5
4
5
X X
6
X Yp
8
9
X X
10
11
X Yp X X X Y + X X
6
X Yp
7
8
X Y+ X X
29
Analisi della segregazione di una forma di retinite pigmentosa
ATTENZIONE
Le femmine naturalmente non ricevono e non trasmettono il carattere
perché non hanno cromosoma Y
1
I
X Yp
1
II
III
IV
2
1
2
3
X X
3
X Yp
X X
2
X Yp
5
4
6
X X
7
X Y + X X X X X Y p X Y pX Y p X X
1
2
X Y+ X X
Ereditarietà associata all’Y
3
4
X Y+ X Y+
5
4
5
X X
6
X Yp
8
9
X X
10
11
X Yp X X X Y + X X
6
X Yp
7
8
X Y+ X X
30
Analisi dell’ereditarietà associata al DNA mitocondriale
Alle quattro modalità di ereditarietà mendeliana descritte in
precedenza va aggiunta l’ereditarietà di malattie dovute a
mutazioni del DNA mitocondriale (mtDNA).
I mitocondri possiedono un
proprio genoma a DNA. Il
mtDNA
è
una
molecola
circolare di circa 16,6 kb e
codifica per 22 molecole di
RNA di trasporto (tRNA), 2
molecole di RNA ribosomiale
(rRNA)
e
13
subunità
proteiche che fanno parte dei
complessi interessati nella via
respiratoria
Ereditarietà associata al DNA mitocondriale
Geni codificanti per
proteine
Geni tRNA
Geni rRNA
31
Analisi dell’ereditarietà associata al DNA mitocondriale
Nell’uomo le malattie associate al mtDNA si ereditano solo per via
materna. Si prenda come esempio la sindrome MELAS.
L’acronimo MELAS deriva dalla dizione inglese della patologia: Encefalomiopatia
Mitocondriale con Acidosi Lattica ed Episodi di Ictus. I sintomi clinici insorgono
durante l'infanzia o nell'adulto prima dei 40 anni.
1
1
II
1
III
IV
1
2
2
3
3
Ereditarietà associata al DNA mitocondriale
4
2
5
4
2
3
4
5
6
7
8
9
10
11
5
6
7
8
9
10
32
Analisi dell’ereditarietà associata al DNA mitocondriale
Il rapporto maschio/femmina tra gli affetti è pari a 1/1, ma tutti
hanno ricevuto il carattere dalla madre.
Inoltre le femmine affette trasmettono il carattere a tutti i figli,
maschi e femmine, mentre i maschi affetti non lo trasmettono a
nessuno.
1
1
II
1
III
IV
1
2
2
3
3
Ereditarietà associata al DNA mitocondriale
4
2
5
4
2
3
4
5
6
7
8
9
10
11
5
6
7
8
9
10
33
Complicazioni nell’analisi di pedigree
Talvolta l’analisi di un pedigree può essere complicata da situazioni
anomale che portano a una interpretazione sbagliata della modalità di
trasmissione.
Tra le più importanti cause fuorvianti vi sono:
Complicazioni nell’analisi di pedigree
34
Complicazioni nell’analisi di pedigree
Mutazione de novo
Se un soggetto è affetto da una malattia ereditaria
autosomica dominante a causa di una nuova mutazione (de novo), non
presenterà come di regola un genitore affetto.
Penetranza incompleta
Alcune malattie ereditarie autosomiche dominanti
non si manifestano nel 100% dei soggetti portatori, presentando di
conseguenza degli occasionali salti di generazione.
Esordio tardivo
Alcune malattie ereditarie si manifestano in età adulta o
anche durante l’invecchiamento. In questo caso si deve tenere conto del
rischio residuo di ammalarsi che dipende dal tipo di patologia.
Espressività variabile
La medesima mutazione può determinare quadri
clinici diversi in quanto l’espressione di un carattere dipende non solo dal
gene in questione, ma anche dal contesto genetico, da quello ambientale e non
ultimo dal caso.
Fenocopie
Presenza di sintomatologia caratteristica di una mutazione in
assenza del difetto molecolare.
Alterazione del rapporto maschi/femmine affetti
La malattia potrebbe
essere letale nei maschi emizigoti che non giungono alla nascita, ma
compatibile con la vita nelle femmine eterozigoti.
Complicazioni nell’analisi di pedigree
35