2°O: Mancini, Mareeandee, Bessi,
Aprile -Maggio 2016
I.T.P: Cortellini
PROTEZIONE DEI METALLI
DALLA CORROSIONE
Scopo: proteggere dalla corrosione un chiodo
immerso nell’acqua di rubinetto.
Cenni teorici: Il termine corrosione (dal latino com- particella indicante insistenza e rodere, per
"consumare" ) indica un processo naturale ed
irreversibile di consumazione lenta e continua di un materiale, che ha come conseguenze il
peggioramento delle caratteristiche o proprietà
fisiche del materiale inizialmente coinvolto. La
corrosione è un fenomeno di natura elettrochimica che determina una interazione chimico-fisica del
materiale metallico con l'ambiente che lo circonda.
Possono essere coinvolti da tale fenomeno molte
tipologie di materiali, sebbene il termine "corrosione"
venga comunemente associato ai materiali metallici
(cioè i metalli e le loro leghe).
La corrosione dei metalli può essere definita come
un processo di degradazione e ricomposizione con
altri elementi presenti nell'ambiente: metalli e leghe
si trovano ad un livello energetico maggiore di
quello a cui stanno i corrispondenti minerali, per cui
sotto determinate condizioni ambientali tendono a
riprendere lo stato più stabile presente in natura,
usualmente quello di ossido, di idrato o di sale.
La corrosione dei materiali metallici può essere
classificata a seconda dell'ambiente in cui ha luogo
la corrosione:
corrosione a umido: se avviene in presenza di acqua o di altro elettrolita,
corrosione a secco: negli altri casi (ad esempio
nell'ossidazione a caldo dei metalli o
nell'ossidazione in atmosfera secca).
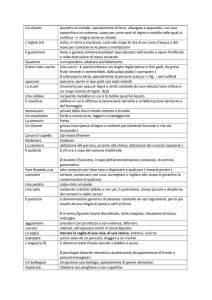
Potenziale standard di ossidazione dei metalli
presi in considerazione (tendenza di una
specie ad ossidarsi):
Metallo
E° (V)
Ferro (Fe → Fe2+ + 2e)
0.44
Magnesio (Mg → Mg2+ + 2e)
2.37
Zinco (Zn → Zn2+ + 2e)
0.76
Rame (Cu → Cu+ + e)
-0.52
Potenziale standard di ossidazione dei metalli
presi in considerazione (tendenza di una
specie ad ossidarsi):
Metallo
E° (V)
Ferro (Fe → Fe2+ + 2e)
0.44
Magnesio (Mg → Mg2+ + 2e)
2.37
Zinco (Zn → Zn2+ + 2e)
0.76
Rame (Cu → Cu+ + e)
-0.52
Materiale utilizzato:
4 becher da 100mL
Ferro (chiodi)
Indicatore (blu Timolo)
un nastro di magnesio, di zinco e rame
Procedimento operativo:
Inserire nei 4 becher 40 mL di H2O
nel becher A inserire il chiodo
nel becher B inserire il chiodo avvolto con il
nastro di magnesio
nel becher C inserire il chiodo avvolto con il
nastro di zinco
nel becher D inserire il chiodo avvolto con il
nastro di rame
In tutti i becher si aggiunge l’indicatore (blu
Timolo).
Si attende qualche giorno e si fanno le
osservazioni.
Il risultato ottenuto è il seguente:
becher A (acqua, chiodo): il chiodo di ferro
si sarà corroso e si avrà un deposito
marrone di ruggine
becher B (acqua,chiodo ricoperto di filo di
magnesio): la soluzione sarà colorata ad
indicare l’ambiente basico causato dal
nastro di magnesio corroso, mentre il
chiodo risulterà intatto.
●
●
becher C (acqua,chiodo ricoperto di filo di
zinco) avremo la corrosione del filo di
zinco che ricopre il chiodo, causata dal
suo potenziale di ossidazione maggiore
becher D (acqua, chiodo ricoperto di
rame) avremo la corrosione del chiodo di
ferro formando ruggine.
Conclusioni:
Con questa esperienza siamo riusciti a
dimostrare che alcuni metalli possono
proteggere il ferro dalla corrosione.
Reazioni di
formazione della
ruggine